一种治疗关节炎的干细胞生物制品及其制备方法与应用与流程
本发明属于干细胞技术领域,具体涉及一种治疗关节炎的干细胞生物制品及其制备方法、应用。
背景技术:
关节炎是指发生在人体关节及其周围组织,由炎症、感染、退化、创伤或其他因素引起的炎性疾病,具体可分为数十种。关节炎临床表现包括关节的红、肿、热、痛、功能障碍,甚至关节畸形,严重者会导致关节残疾,严重影响患者的生活质量和劳动能力。据统计目前我国的关节炎患者有1亿以上,且人数在逐年增加,其中50岁以上人群中半数患骨关节炎,65岁以上人群中90%女性和80%男性患骨关节炎,对于患者、家庭、社会都是沉重的负担。
药物治疗对关节炎,特别是严重关节炎的效果非常有限,关节置换、部分摘除等手术处理适用条件相对苛刻而且后续问题较多。在最近的报导中发现,能自我更新并分化成各种间充质组织的间充质干细胞(mscs)成为临床应用的一个有效的工具。举例而言,可用于成骨不全的细胞治疗与软骨及骨的组织工程。来自健康捐赠者的同种异体mscs可作为“全适捐赠细胞”而用于治疗患有肌肉骨骼疾病的患者。相比之下使用间充质干细胞修复受破坏的关节组织是从根本上治疗关节炎、特别是严重关节炎的有效途径,但是,现有采用间充质干细胞治疗关节炎也存在一定的不足,例如,现有间充质干细胞主要是利用其归巢能力使其能够附着于病灶位置并促进细胞增殖,但间充质干细胞通过静脉注射等回输方式施用时,其归巢能力有限,难以达到修复损伤所需的干细胞数量(有研究认为需要至少10×106个间充质干细胞),同时,采用间充质干细胞治疗关节炎的效果仍有一定提升空间。
技术实现要素:
针对现有间充质干细胞在治疗关节炎领域存在归巢能力弱和治疗效果不足的问题,本发明提供了一种干细胞生物制品及其制备方法、应用。
本发明解决上述技术问题所采用的技术方案如下:
一方面,本发明提供了一种干细胞生物制品,包括间充质干细胞,所述间充质干细胞经转染引入有载体,所述载体上包括cxcr1基因序列。
可选的,所述间充质干细胞包括脐带间充质干细胞、胎盘间充质干细胞、脂肪间充质干细胞、骨髓间充质干细胞和牙髓间充质干细胞中的一种或多种。
可选的,所述间充质干细胞为分离于哺乳动物体外的间充质干细胞。
可选的,所述载体选自质粒载体,所述质粒载体包括pcdna3.1+、pcdna3.1-hisb/c、pcdna3.1-3flag、pcdna6-myc/hisabc中的一种或多种。
可选的,所述cxcr1基因序列包括如seqidno.9所示的序列,转入cxcr1基因序列的载体包括如seqidno.10所示的序列。
另一方面,本发明提供了如上所述的干细胞生物制品的制备方法,其特征在于,包括以下操作:
获取cxcr1目的基因;
构建包括cxcr1基因序列的载体;
获取间充质干细胞;
载体转染间充质干细胞。
可选的,所述“获取cxcr1目的基因”包括以下操作:
收取骨关节腔滑液样本,提取总rna,设计扩增引物,以逆转录-聚合酶链式反应法pcr扩增cxcr1基因全长,电泳,纯化cxcr1目的基因片段。
可选的,所述“构建包括cxcr1基因序列的载体”之后,将包括cxcr1基因序列的载体转染至原核细胞中进行扩充培养,提取包括cxcr1基因序列的载体。
可选的,所述“获取间充质干细胞”的途径包括获取脐带、胎盘、脂肪、骨髓或牙髓,进行培养和分离,得到间充质干细胞。
可选的,所述“载体转染间充质干细胞”的方式包括电击法、磷酸钙法、脂质体介导法和病毒介导法。
另一方面,本发明提供了如上所述的干细胞生物制品在制备治疗关节炎的药物中的应用。
根据本发明提供的干细胞生物制品,通过转染在间充质干细胞中转入带有cxcr1基因序列的载体,从而促进间充质干细胞中受体cxcr1的高表达,由于炎性部位高表达cxcl8,cxcl8与受体cxcr1结合后起到下游信号通路,产生多种生物学功能,包括促炎性细胞趋化、促血管生成、促有丝分裂,诱导细胞增殖等,有效提高间充质干细胞对关节炎的治疗效果,同时当高表达cxcr1的间充质干细胞经过炎症组织部位时,通过cxcl8与受体cxcr1特异性结合,间充质干细胞会被截留在炎症组织部位,提高了间充质干细胞在关节炎病灶部位的富集和特异性归巢能力,提高局部干细胞数量。
附图说明
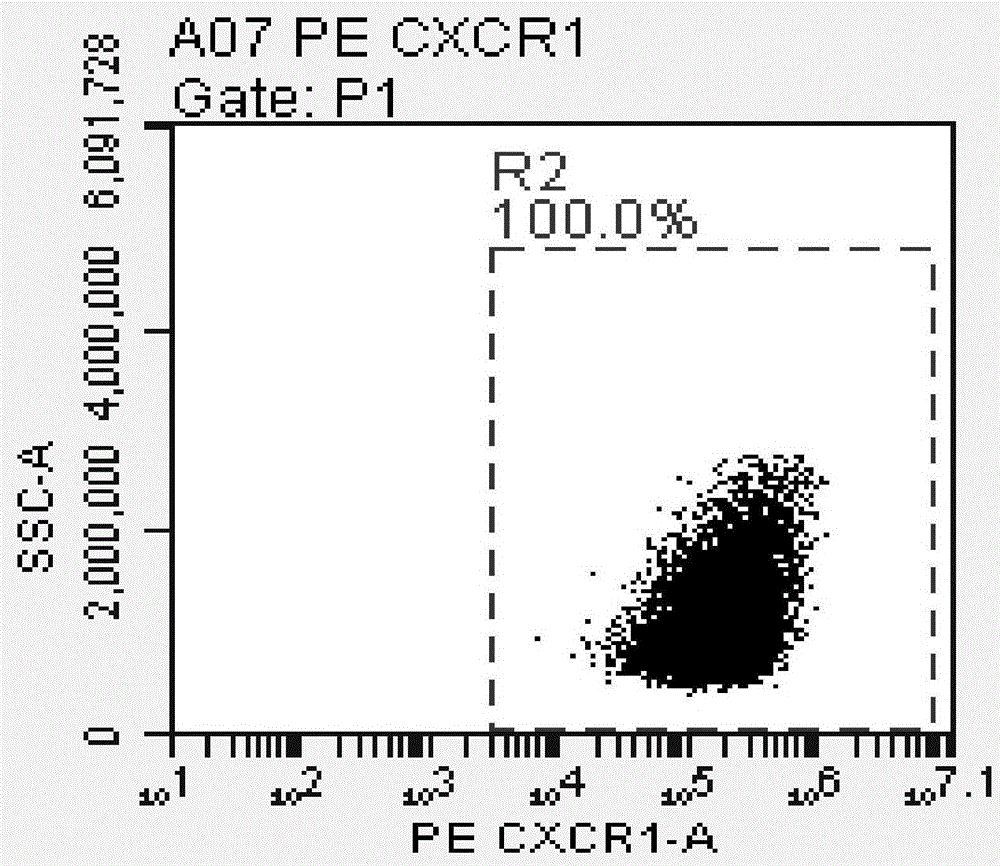
图1为实施例1中脐带间充质干细胞表面cxcr1流式细胞检测结果。
图2为实施例2中脐带间充质干细胞表面cxcr1流式细胞检测结果。
图3为实施例3中脐带间充质干细胞表面cxcr1流式细胞检测结果。
图4为实施例4中脐带间充质干细胞表面cxcr1流式细胞检测结果。
图5为对比例1中脐带间充质干细胞表面cxcr1流式细胞检测结果。
图6为对比例2中脐带间充质干细胞表面cxcr1流式细胞检测结果。
图7为骨关节炎小鼠模型的治疗前关节处成像。
图8为骨关节炎小鼠模型的治疗后关节处成像。
具体实施方式
为了使本发明所解决的技术问题、技术方案及有益效果更加清楚明白,以下结合附图及实施例,对本发明进行进一步详细说明。应当理解,此处所描述的具体实施例仅仅用以解释本发明,并不用于限定本发明。
本发明一实施例提供了一种干细胞生物制品,包括间充质干细胞,所述间充质干细胞经转染引入有载体,所述载体上包括cxcr1基因序列。
研究表明,多种关节炎患者的血清和关节液中cxcl8水平显著升高,提示ra患者的cxcl8参与免疫过程,cxcl8又名il-8或白细胞介素8,属cxc家族,是一个典型的含保守的glu-leu-arg“elr”n端序列的炎性趋化性因子。基因位于人染色体4q12-q21,含有4个外显子和3个内含子。主要由单核巨噬细胞和中性粒细胞产生,其他细胞,如淋巴细胞、滑膜成纤维细胞、血管内皮细胞等也能分泌。cxcr1是cxcl8的受体,cxcr1能够与cxcl8高度特异性结合;cxcl8与受体cxcr1结合后影响游信号通路,产生多种生物学功能,包括促炎性细胞趋化、促血管生成、促有丝分裂,诱导细胞增殖等。
本实施例提供的间充质干细胞通过转染导入包括cxcr1基因序列的载体,能促进受体cxcr1的高表达,从而促进上述治疗效果,促进间充质干细胞在病灶位置归巢。
所述间充质干细胞中载体并非天然存在的物质,而是作为通过基因工程的方法进行人工操作的结果。
在一些实施例中,所述间充质干细胞包括脐带间充质干细胞、胎盘间充质干细胞、脂肪间充质干细胞、骨髓间充质干细胞和牙髓间充质干细胞中的一种或多种。
在优选的实施例中,所述充间质干细胞选自脐带间充质干细胞。
在一些实施例中,所述间充质干细胞为分离于哺乳动物体外的间充质干细胞。
所述哺乳动物包括人及其他哺乳动物。
在一些实施例中,所述载体选自质粒载体,所述质粒载体包括pcdna3.1+、pcdna3.1-hisb/c、pcdna3.1-3flag、pcdna6-myc/hisabc中的一种或多种。
在其他实施例中,所述载体还可采用病毒载体。
在一些实施例中,所述cxcr1基因序列包括如seqidno.9所示的序列。
在一些实施例中,转入cxcr1基因序列的载体包括如seqidno.10所示的序列。
需要说明的是,本发明中的cxcr1基因序列不局限于实施例中所用的seqidno.9所示的序列,载体也不限于如seqidno.10所示的序列,其他cxcr1序列以及可能新发现的cxcr1序列及其变体或是其他载体经过常规验证均可使用,cxcr1基因序列可以将本说明书或后附的序列表所公开的序列信息、公共数据库(例如ddbj/embl/genbank)中登录的序列信息作为参考,使用标准的基因工程方法、分子生物学方法、生化学方法等来制备。采用其他cxcr1序列以及可能新发现的cxcr1序列及其变体或是其他载体,其相应引物和分子生物学实验操作也可以以分子生物学领域常规技术手段(如萨姆布鲁克《分子克隆实验指南》)完成,均应包括在本发明的保护范围之内。
考虑到密码子的简并,只要是编码相同蛋白质(即cxcr1受体)的dna序列,则与seqidno.9所示的dna序列在功能上等价,可以作为本发明中的cxcr1基因使用。另外,一般而言,对某一蛋白质的氨基酸序列的一部分进行改变时,有时改变后的蛋白质与改变前的蛋白质具有同等的功能。即,有时氨基酸序列的改变对蛋白质的功能没有实质性的影响,蛋白质的功能在改变前后维持不变。因此,与seqidno.9所示的dna序列编码的蛋白质具有同源的氨基酸序列、并且作为cxcr1受体作用的蛋白质(以下也称为“同源蛋白质”)的dna序列也可以作为本发明的cxcr1基因使用。此处的“同源的氨基酸序列”是指,与seqidno.9所示的氨基酸序列部分不同、但该不同对蛋白质的功能(该情况下为cxcr1受体活性)没有实质性影响的氨基酸序列。
“氨基酸序列的部分不同”,典型地是指通过构成氨基酸序列的一个至数个氨基酸的缺失、取代、或一个至数个氨基酸的添加、插入、或者它们的组合使氨基酸序列产生突变(变化)。此处的氨基酸序列的不同只要不使cxcr1受体活性大幅下降就是容许的。只要满足该条件则氨基酸序列不同的位置没有特别限制,另外也可以在多个位置产生不同。此处的多个例如为相当于小于全部氨基酸的约30%的个数,优选为相当于小于约20%的个数,进一步优选为相当于小于约10%的个数,更进一步优选为相当于小于约5%的个数,最优选为相当于小于约1%的个数。即,同源蛋白质与序列编号15的氨基酸序列具有例如约70%以上、优选约80%以上、进一步优选约90%以上、更进一步优选约95%以上、最优选约99%以上的同源性。
本发明的另一实施例提供了如上所述的干细胞生物制品的制备方法,包括以下操作:
获取cxcr1目的基因;
构建包括cxcr1基因序列的载体;
获取间充质干细胞;
载体转染间充质干细胞。
在一些实施例中,所述“获取cxcr1目的基因”包括以下操作:
收取患者骨关节腔滑液样本,提取总rna,设计扩增引物,以逆转录-聚合酶链式反应法pcr扩增cxcr1基因全长,电泳,纯化cxcr1目的基因片段。
在一些实施例中,所述cxcr1基因序列的酶切位点为kpn1和ecor1,应用primer6.0软件设计cxcr1基因的扩增引物,引物序列如下:
(1)当载体选自pcdna3.1+时,设计引物序列如下:
cxcr1-kpn1-f1:ggggtaccatgtcaaatattacagatccacagat(seqidno.1)
cxcr1-ecor1-r1:cggaattctcagaggttggaagagacattga(seqidno.2)
(2)当载体选自pcdna3.1-hisb/c时,设计引物序列如下:
cxcr1-kpn1-f2:ggggtaccaatgtcaaatattacagatccacagat(seqidno.3)
cxcr1-ecor1-r1:cggaattctcagaggttggaagagacattga(seqidno.4)
(3)当载体选自pcdna3.1-3flag时,设计引物序列如下:
cxcr1-ecor1-f3:cggaattcatgtcaaatattacagatccacagat(seqidno.5)
cxcr1-kpn1-r3:ggggtacccggaggttggaagagacattgacag(seqidno.6)
(4)当载体选自pcdna6-myc/hisabc时,设计引物序列如下:
cxcr1-kpn1-f1:ggggtaccatgtcaaatattacagatccacagat(seqidno.7)
cxcr1-ecor1-r4:cggaattccggaggttggaagagacattgacag(seqidno.8)。
在一些实施例中,所述“构建包括cxcr1基因序列的载体”包括以下操作:
通过限制性内切酶对载体进行双酶切,加入cxcr1目的基因和连接酶,使cxcr1目的基因转入载体的酶切位点。
在转入cxcr1目的基因时,可在载体中追加功能序列(例如选择标记或增强子)等进一步的改变。
另外,关于构建本发明的表达载体时所需的操作方法、试剂、条件等,可以参考例如分子克隆(molecularcloning)(第三版,冷泉港实验室出版社,纽约)或分子生物学实验方法汇编(frederickm.ausubel等编著,1987)等。
在一些实施例中,所述“构建包括cxcr1基因序列的载体”之后,将包括cxcr1基因序列的载体转染至原核细胞中进行扩充培养,提取包括cxcr1基因序列的载体。
通过原核细胞对包括cxcr1基因序列的载体进行扩充培养,能够有利于后续包括cxcr1基因序列的载体的提纯和检测载体是否表达成功。
所述原核细胞选自于大肠杆菌或其他适合培养载体的原核细菌。
在一些实施例中,所述“获取间充质干细胞”的途径包括获取脐带、胎盘、脂肪、骨髓或牙髓,进行培养和分离,得到间充质干细胞。
在一些实施例中,所述“载体转染间充质干细胞”的方式包括电击法、磷酸钙法、脂质体介导法和病毒介导法。
在优选的实施例中,采用脂质体介导法处理所述间充质干细胞,以使载体成功转染至间充质干细胞中。
本发明的另一实施例提供了如上所述的干细胞生物制品在制备治疗关节炎的药物中的应用。
所述干细胞生物制品可通过静脉注射或骨关节局部注射。
以下通过实施例对本发明进行进一步的说明。
实施例1
本实施例用于说明本发明公开的干细胞生物制品及其制备方法,包括以下操作步骤:
步骤一、载有目的基因cxcr1重组质粒载体的构建
步骤1、获取目的基因。收取患者骨关节腔滑液样本,采用trizol试剂,提取总rna,琼脂糖电泳鉴定总rna有无降解。设计扩增引物为:
cxcr1-kpn1-f1:ggggtaccatgtcaaatattacagatccacagat(seqidno.1)
cxcr1-ecor1-r1:cggaattctcagaggttggaagagacattga(seqidno.2)
取1μg总rna以oligodt(18)逆转录cdna,rt-pcr法扩增cxcr1基因全长。
pcr条件:98℃变性15s,68℃退火及延伸3min,循环35次,末次循环后72℃延长15min。琼脂糖凝胶电泳观察,切胶回收并纯化目的基因片段。
步骤2、载体双酶切。灭菌的ep管,取5ug的质粒载体pcdna3.1+,用kpn1和ecor1双酶切,1.5ulkpn1,1.5ulecor1;用ddh2o补充总体系为50ul,37℃酶切30min,取酶切产物6ul进行1.5%琼脂糖凝胶电泳,30min;将凝胶置于紫外灯下,判定目的片段位置进行割胶回收,将回收的胶放入无菌ep管中,利用微量琼脂糖凝胶dna回收试剂盒回收dna目的片段。
步骤3、目的片段与载体连接。目的片段cxcr1与商用质粒载体pcdna3.1+链接,反应体系:pcdna3.1+100ng,cxcr1100ng,5*ceiibuffer4ul,clonexpressiionestepcloningkit连接酶2ul;ddh2o添加至总体积20ul;37℃连接,30min,冰浴5min。
步骤4、连接产物转化感受态细胞。在冰中解冻感受态细胞150ul,解冻后加入3ul连接产物,摇匀冰浴30min后于42℃水浴中热休克45s,然后迅速冰浴2min.然后放入800ullb培养基,37℃、225r/min震荡培养箱中培养1h,菌液涂布,37℃孵育器过夜培养。挑取单个菌落于amp+lb(100ug/ml)培养基3管(每管约5ml)中培养过夜培养,测定其od值为2~3时提取质粒。
步骤5、质粒提取。取细菌培养液5ml于干净无菌的离心管中,10000r/min离心1.5min,吸干培养基;加入250μlbufferp1/rnasea混合液,使用涡旋振荡器彻底悬浮细菌沉淀;加入250μlbufferp2,立即平和颠倒混匀离心管5~10次,室温静置2~4min;加入350μlbufferp3,出现白色沉淀,立即平和颠倒离心管5~10次混匀,12000r/min离心12min,将上清全部移入吸附柱,10000r/min离心30s,倒掉收集管中的液体;在吸附柱中加入500μlbufferdw1,10000r/min离心30s,倒掉收集管中的液体;在吸附柱中加入500μlwashsolution,10000r/min离心30s,倒掉收集管中的液体;再用500μlwashsolution洗一次,10000r/min离心30s,倒掉收集管中的液体。离心空吸附柱,10000r/min离心1min;将吸附柱放入新的1.5ml离心管中,在吸附膜中央加入65μl已经预热到63℃的elutionbuffer,为提高洗脱率,室温静置5min,10000r/min离心1min,将所得质粒dna溶液置于-20℃保存,用于后续的体外转录实验。
步骤6、质粒酶切鉴定。用限制性内切酶knp1和ecor1进行双酶切,酶切反应体系为:10×buffer5ul;pcdna3.1-cxcr12μg;限制性内切酶knp1和ecor1各1ul;加无酶水补充到总体积20ul;37℃酶切20min。酶切完成后,取6ul15000marker和6ul酶切产物进行1.5%琼脂糖凝胶电泳检测。琼脂糖凝胶电泳鉴定完毕后,送上海生工进行质粒dna序列测定,测序结果与序列seqidno.9对比,证明pcdna3.1-cxcr1真核表达载体构建成功。
步骤二、脐带间充质干细胞的分离培养
步骤1:脐带自手术台取下后,浸入含抗生素的0.9%生理盐水中,4℃保存;
步骤2:在超净台内取出脐带,用生理盐水冲洗净脐动脉和脐静脉内的残余血液,用止血:钳和剪刀剔除上述血管,将脐带剪成1mm^3大小的组织块;
步骤3:加入质量/体积比为0.1%的ii型胶原酶至完全覆盖组织块,置于培养箱内持续消化6h,100目筛网过滤收集细胞;
步骤4:生理盐水冲洗细胞3次,每次2000rpm,8min;
步骤5:用含10%fbs的dmem/f12培养液重悬细胞,调整细胞密度为1x106cells/ml,接种于t.25培养瓶中,置于37℃、饱和湿度、5%c02培养箱内培养;
步骤6:3天后全量换为mesenprorsrmmedium培养液,弃去未贴壁的细胞与杂质,以后根据细胞生长情况,每3天换液一次。
步骤三、脂质体瞬时转染脐带间充质干细胞
载有目的基因cxcr1重组质粒pcdna3.1-cxcr1为ampicillin氨苄抗性,酶切位点为knp1和ecor1,核酸定量仪定量。
取2-5μg质粒pcdna3.1-cxcr1,加200-500μl无血清培养基,混合均匀;取15-30μltransquick(脂质体转染试剂),加200-500μl无血清培养基,混合均匀;合并以上2种溶液,混合均匀,室温孵育5-10min,得到预处理液。
脐带间充质干细胞按每孔2×106个细胞,接种于含2ml完全无血清培养基的六孔板中,培养24h至细胞对数生长期;对数生长的细胞经无血清培养基洗1次,加入800μl无血清培养基;预处理溶液200μl加入实验孔,轻柔振荡混匀;在无血清条件下,37℃,体积分数为5%co2的温箱培养5h后换为完全培养基,继续培养。
实施例2
本实施例用于说明本发明公开的干细胞生物制品及其制备方法,包括实施例1中大部分操作步骤,其不同之处在于:
步骤一中,步骤1设计扩增引物为:
cxcr1-kpn1-f2:ggggtaccaatgtcaaatattacagatccacagat(seqidno.3)
cxcr1-ecor1-r1:cggaattctcagaggttggaagagacattga(seqidno.4);
步骤3目的片段cxcr1与商用质粒载体pcdna3.1-hisb/c链接。
构建pcdna3.1-hisb/c-cxcr1表达载体。
步骤三中,取2-5μg质粒pcdna3.1-hisb/c-cxcr1,加200-500μl无血清培养基,混合均匀;取15-30μltransquick(脂质体转染试剂),加200-500μl无血清培养基,混合均匀;合并以上2种溶液,混合均匀,室温孵育5-10min,得到预处理液。
采用pcdna3.1-hisb/c-cxcr1对脐带间充质干细胞进行转染。
实施例3
本实施例用于说明本发明公开的干细胞生物制品及其制备方法,包括实施例1中大部分操作步骤,其不同之处在于:
步骤一中,步骤1设计扩增引物为:
cxcr1-ecor1-f3:cggaattcatgtcaaatattacagatccacagat(seqidno.5)
cxcr1-kpn1-r3:ggggtacccggaggttggaagagacattgacag(seqidno.6);
步骤3目的片段cxcr1与商用质粒载体pcdna3.1-3flag链接。
构建pcdna3.1-3flag-cxcr1表达载体。
步骤三中,取2-5μg质粒pcdna3.1-3flag-cxcr1,加200-500μl无血清培养基,混合均匀;取15-30μltransquick(脂质体转染试剂),加200-500μl无血清培养基,混合均匀;合并以上2种溶液,混合均匀,室温孵育5-10min,得到预处理液。
采用pcdna3.1-3flag-cxcr1对脐带间充质干细胞进行转染。
实施例4
本实施例用于说明本发明公开的干细胞生物制品及其制备方法,包括实施例1中大部分操作步骤,其不同之处在于:
步骤一中,步骤1设计扩增引物为:
cxcr1-kpn1-f1:ggggtaccatgtcaaatattacagatccacagat(seqidno.7)
cxcr1-ecor1-r4:cggaattccggaggttggaagagacattgacag(seqidno.8);
步骤3目的片段cxcr1与商用质粒载体pcdna6-myc/hisabc链接。
构建pcdna6-myc/hisabc-cxcr1表达载体。
步骤三中,取2-5μg质粒pcdna6-myc/hisabc-cxcr1,加200-500μl无血清培养基,混合均匀;取15-30μltransquick(脂质体转染试剂),加200-500μl无血清培养基,混合均匀;合并以上2种溶液,混合均匀,室温孵育5-10min,得到预处理液。
采用pcdna6-myc/hisabc-cxcr1对脐带间充质干细胞进行转染。
对比例1
本对比例用于对比说明本发明公开的干细胞生物制品及其制备方法,包括实施例1中大部分操作步骤,其不同之处在于:
不进行步骤一载有目的基因cxcr1重组质粒载体的构建;
步骤三中,采用200μl的无血清培养基替换200μl的预处理溶液加入实验孔。
对比例2
本对比例用于对比说明本发明公开的干细胞生物制品及其制备方法,包括实施例1中大部分操作步骤,其不同之处在于:
不进行步骤一载有目的基因cxcr1重组质粒载体的构建;
步骤三中,取2-5μg质粒pcdna3.1+,加200-500μl无血清培养基,混合均匀;取15-30μltransquick(脂质体转染试剂),加200-500μl无血清培养基,混合均匀;合并以上2种溶液,混合均匀,室温孵育5-10min,得到预处理液。
性能测试
一、利用流式细胞法检测细胞培养上清液中cxcr1蛋白的表达情况
利用有pe标记的anti-cxcr1抗体孵育30min,流式细胞仪检测cxcr1的表达情况,得到的测试结果如图1~图6所示。
其中图1为实施例1中脐带间充质干细胞表面cxcr1流式细胞检测结果。
图2为实施例2中脐带间充质干细胞表面cxcr1流式细胞检测结果。
图3为实施例3中脐带间充质干细胞表面cxcr1流式细胞检测结果。
图4为实施例4中脐带间充质干细胞表面cxcr1流式细胞检测结果。
图5为对比例1中脐带间充质干细胞表面cxcr1流式细胞检测结果。
图6为对比例2中脐带间充质干细胞表面cxcr1流式细胞检测结果。
由图1~图6的测试结果可知,相比于对比例1的未转染干细胞对照组和对比例2的空载体转染干细胞对照组,实施例1~4将cxcr1基因通过质粒载体的方式转染至脐带间充质干细胞,能够促进脐带间充质干细胞中cxcr1受体的高表达。
二、小鼠动物模型有效性和安全性检测
步骤1、建立骨关节炎小鼠动物模型,关节内手术诱发模型:①手术切断前后交叉韧带、内侧副韧带,切除内侧半月板,术中避免损伤关节软骨,术后不固定伤肢,动物可自由活动,适当给予抗生素预防感染。由于手术造成关节不稳从而诱发骨关节炎,术后3个月软骨出现裂隙、破坏;②半月板或(和)前交叉韧带切除:当半月板或(和)前交叉韧带切除时,关节稳定性受到破坏而使关节应力发生改变,造成关节的退行性变化,从而诱发骨关节炎。
步骤2、分别采用实施例1方法制备得到的小鼠脐带间充质干细胞,将小鼠脐带间充质干细胞通过骨关节炎局部注射的方式输到小鼠体内,输注量为5*106个干细胞。
步骤3、治疗效果有效性评价。
骨关节炎小鼠动物模型治疗前的骨关节处成像如图7所示,骨关节炎小鼠动物模型治疗8周后的骨关节处成像如图8所示。
由图7和图8的显示结果可以明显看出在采用转染cxcr1的脐带间充质干细胞治疗后,骨关节炎小鼠的骨关节炎症得到明显的缓解,证明转染cxcr1的脐带间充质干细胞对于骨关节炎具有治疗效果。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
序列表
<110>深圳爱生再生医学科技有限公司北京大学深圳医院
<120>一种治疗关节炎的干细胞生物制品及其制备方法与应用
<160>10
<170>siposequencelisting1.0
<210>1
<211>34
<212>dna
<213>人工序列
<400>1
ggggtaccatgtcaaatattacagatccacagat34
<210>2
<211>31
<212>dna
<213>人工序列
<400>2
cggaattctcagaggttggaagagacattga31
<210>3
<211>35
<212>dna
<213>人工序列
<400>3
ggggtaccaatgtcaaatattacagatccacagat35
<210>4
<211>31
<212>dna
<213>人工序列
<400>4
cggaattctcagaggttggaagagacattga31
<210>5
<211>34
<212>dna
<213>人工序列
<400>5
cggaattcatgtcaaatattacagatccacagat34
<210>6
<211>33
<212>dna
<213>人工序列
<400>6
ggggtacccggaggttggaagagacattgacag33
<210>7
<211>34
<212>dna
<213>人工序列
<400>7
ggggtaccatgtcaaatattacagatccacagat34
<210>8
<211>33
<212>dna
<213>人工序列
<400>8
cggaattccggaggttggaagagacattgacag33
<210>9
<211>1053
<212>dna
<213>cxcr1基因
<400>9
atgtcaaatattacagatccacagatgtgggattttgatgatctaaatttcactggcatg60
ccacctgcagatgaagattacagcccctgtatgctagaaactgagacactcaacaagtat120
gttgtgatcatcgcctatgccctagtgttcctgctgagcctgctgggaaactccctggtg180
atgctggtcatcttatacagcagggtcggccgctccgtcactgatgtctacctgctgaac240
ctggccttggccgacctactctttgccctgaccttgcccatctgggccgcctccaaggtg300
aatggctggatttttggcacattcctgtgcaaggtggtctcactcctgaaggaagtcaac360
ttctacagtggcatcctgctgttggcctgcatcagtgtggaccgttacctggccattgtc420
catgccacacgcacactgacccagaagcgtcacttggtcaagtttgtttgtcttggctgc480
tggggactgtctatgaatctgtccctgcccttcttccttttccgccaggcttaccatcca540
aacaattccagtccagtttgctatgaggtcctgggaaatgacacagcaaaatggcggatg600
gtgttgcggatcctgcctcacacctttggcttcatcgtgccgctgtttgtcatgctgttc660
tgctatggattcaccctgcgtacactgtttaaggcccacatggggcagaagcaccgagcc720
atgagggtcatctttgctgtcgtcctcatcttcctgctttgctggctgccctacaacctg780
gtcctgctggcagacaccctcatgaggacccaggtgatccaggagagctgtgagcgccgc840
aacaacatcggccgggccctggatgccactgagattctgggatttctccatagctgcctc900
aaccccatcatctacgccttcatcggccaaaattttcgccatggattcctcaagatcctg960
gctatgcatggcctggtcagcaaggagttcttggcacgtcatcgtgttacctcctacact1020
tcttcgtctgtcaatgtctcttccaacctctga1053
<210>10
<211>1474
<212>dna
<213>人工质粒
<400>10
cattgacgtcaatgggagtttgttttggcaccaaaatcaacgggactttccaaaatgtcg60
taacaactccgccccattgacgcaaatgggcggtaggcgtgtacggtgggaggtctatat120
aagcagagctctctggctaactagagaacccactgcttactggcttatcgaaattaatac180
gactcactatagggagacccaagctggctagcgtttaaacttaagcttggtaccatgtca240
aatattacagatccacagatgtgggattttgatgatctaaatttcactggcatgccacct300
gcagatgaagattacagcccctgtatgctagaaactgagacactcaacaagtatgttgtg360
atcatcgcctatgccctagtgttcctgctgagcctgctgggaaactccctggtgatgctg420
gtcatcttatacagcagggtcggccgctccgtcactgatgtctacctgctgaacctggcc480
ttggccgacctactctttgccctgaccttgcccatctgggccgcctccaaggtgaatggc540
tggatttttggcacattcctgtgcaaggtggtctcactcctgaaggaagtcaacttctac600
agtggcatcctgctgttggcctgcatcagtgtggaccgttacctggccattgtccatgcc660
acacgcacactgacccagaagcgtcacttggtcaagtttgtttgtcttggctgctgggga720
ctgtctatgaatctgtccctgcccttcttccttttccgccaggcttaccatccaaacaat780
tccagtccagtttgctatgaggtcctgggaaatgacacagcaaaatggcggatggtgttg840
cggatcctgcctcacacctttggcttcatcgtgccgctgtttgtcatgctgttctgctat900
ggattcaccctgcgtacactgtttaaggcccacatggggcagaagcaccgagccatgagg960
gtcatctttgctgtcgtcctcatcttcctgctttgctggctgccctacaacctggtcctg1020
ctggcagacaccctcatgaggacccaggtgatccaggagagctgtgagcgccgcaacaac1080
atcggccgggccctggatgccactgagattctgggatttctccatagctgcctcaacccc1140
atcatctacgccttcatcggccaaaattttcgccatggattcctcaagatcctggctatg1200
catggcctggtcagcaaggagttcttggcacgtcatcgtgttacctcctacacttcttcg1260
tctgtcaatgtctcttccaacctctgagaattctgcagatatccagcacagtggcggccg1320
ctcgagtctagagggcccgtttaaacccgctgatcagcctcgactgtgccttctagttgc1380
cagccatctgttgtttgcccctcccccgtgccttccttgaccctggaaggtgccactccc1440
actgtcctttcctaataaaatgaggaaattgcat1474
- 还没有人留言评论。精彩留言会获得点赞!