卟啉封端的纳米级荧光聚轮烷及其制备方法和应用与流程
本发明属于药物制备技术领域,具体涉及一种卟啉封端的纳米级荧光聚轮烷及其制备方法和应用。
背景技术:
肿瘤的检测与肿瘤部位药物的富集是癌症治疗的关键。因此,制备具有示踪功能的荧光纳米载药体系势在必行。目前,临床上使用的抗肿瘤药物没有靶向性,且不能被示踪,在肿瘤的治疗过程中存在着严重的毒副作用。纳米材料由于其在肿瘤中的增强渗透与滞留效应优点,已经成为人们研究的热点。但是,目前多数研究的纳米药物载体存在制备过程复杂、成本高、所用材料生物相容性欠佳以及对药物没有示踪功能等缺陷。
基于以上缺点,本申请发明了一种具有靶向性、药物示踪功能的荧光纳米载药体系。在此体系中,由于卟啉的引入使得制备的纳米载药材料自身具有荧光,避免了在后期使用中的有机染料的荧光标记,此荧光载药材料可作为药物的示踪剂来检测药物到达肿瘤的部位的量。
技术实现要素:
本发明目的在于克服现有技术缺陷,提供一种卟啉封端的纳米级荧光聚轮烷,其是以卟啉、环糊精和聚乙二醇为原料制备而成的纳米载药体系,能够示踪药物,提高药物在肿瘤部位的富集,减少药物对生物体的毒副作用,提高药物对肿瘤的治疗效果。
本发明还提供了上述卟啉封端的纳米级荧光聚轮烷的制备方法和应用
为实现上述目的,本发明采用如下技术方案:
一种卟啉封端的纳米级荧光聚轮烷的制备方法,其具体为:将准轮烷(ppr)、卟啉、pybop(六氟磷酸苯并三唑-1-基-氧基三吡咯烷基磷)、dmap(4-二甲氨基吡啶)和溶剂无水dmf(二甲基甲酰胺)混合后,放置在摇床中于2-8℃反应12-24h,反应结束后加入甲醇以析出固体,固体洗涤后分散在dmso(二甲基亚砜)中,然后加入去离子水,析出淡粉色沉淀,经洗涤、冻干即得卟啉封端的纳米级荧光聚轮烷pr。
进一步的,所述准轮烷、卟啉、pybop和dmap的摩尔比为1:10-12:10-12:1-3。
进一步优选的,所述卟啉经下述步骤制备获得:将吡咯和苯甲醛按摩尔计量比1:1加入到丙酸中,搅拌加热至130-150℃回流反应30-60min,然后经冷却、抽滤、洗涤、干燥即得。
本发明提供了采用上述制备方法制备得到的卟啉封端的纳米级荧光聚轮烷pr。
本发明提供了上述卟啉封端的纳米级荧光聚轮烷作为药物载体或药物示踪剂的应用。
本发明还提供了一种利用上述卟啉封端的纳米级荧光聚轮烷作为药物载体制备得到的负载药物的纳米体系,其将卟啉封端的纳米级荧光聚轮烷pr、琥珀酸酐和dmap溶于dmso中,在室温下反应12-24h,然后将反应溶液在蒸馏水中透析24-48h,透析溶液冷冻干燥,获得浅绿色固体产物羧基化的聚轮烷pr-cooh;再将羧基化的聚轮烷和顺铂溶解于蒸馏水中,室温避光反应24-48h,然后在蒸馏水中透析24-36h,透析溶液经冷冻干燥即得负载药物的纳米体系(即负载药物的聚轮烷,pr-cooh-pt)。
进一步优选的,透析时选用截留分子量为3-5kda的透析袋。
本发明旨在通过示踪抗肿瘤药物在体内的分布,提高药物在肿瘤部分的富集,减少现有抗肿瘤药物的毒副作用,从而克服现有药物载体存在的制备过程复杂、成本高、生物相容性差等缺点。卟啉具有荧光,且在体内能形成生物相容性的血卟啉而被生物体所吸收,制备聚轮烷(pr)所用的主体分子环糊精和和客体分子聚乙二醇生物相容性好。因此,以卟啉、环糊精和聚乙二醇为原料制备的纳米载药体系,能够示踪药物,提高药物在肿瘤部位的富集,减少药物对生物体的毒副作用,提高药物对肿瘤的治疗效果。
本发明中,所用卟啉利用较廉价原料通过简单的合成方法制备而得,并且主客体化学中所用的主体分子环糊精和客体分子聚乙二醇市售价格均不高,所以制备此载药材料的成本较低。从生物相容性考虑,环糊精和聚乙二醇均是fda批准的材料生物相容性好,而卟啉在体内可以与铁结合形成血红素参与蛋白质的合成。本发明通过体外和体内实验来研究纳米药物载体pr-cooh的生物性能。通过体外细胞实验来研究pr-cooh在细胞中的分布,通过细胞毒性实验来研究pr-cooh的生物相容性和所载药物的体外抗肿瘤效果。和现有技术相比,本发明具有以下优点和有益效果:
1)本发明制备pr-cooh所用原料廉价成本低、生物相容性好且自身有荧光,是比较好的药物示踪剂和药物载体;纳米药物载体pr-cooh制备方法简单易操作,制备载药体系成本低且生物相容性好;
2)纳米药物载体pr-cooh自身有荧光,免于有机染料荧光标记且能够对药物示踪;肿瘤对纳米药物载体的epr效应使得肿瘤部位的药物浓度提高、药物对生物体的毒副作用低、肿瘤治疗效果增强。
附图说明
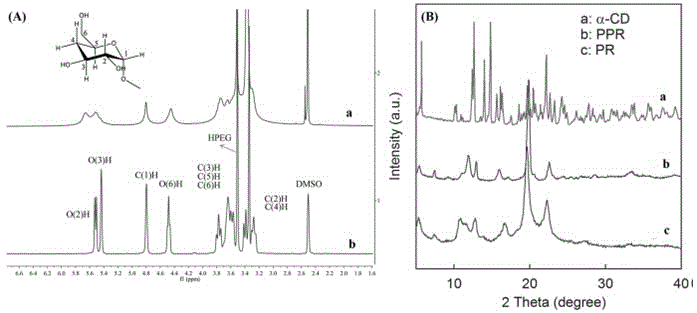
图1中(a)为实施例1中聚轮烷pr和准轮烷ppr的核磁共振氢谱;(b)为环糊精α-cd、准轮烷ppr和聚轮烷pr的xrd谱;
图2中为实施例1中(a)羧基化的聚轮烷pr-cooh的透射电镜图;(b)为羧基化的聚轮烷pr-cooh的粒径分布图;
图3为实施例1中羧基化的聚轮烷pr-cooh在37℃与ct26细胞和hela细胞共培养后的激光共聚焦成像图;
图4为实施例1中羧基化的聚轮烷pr-cooh对(a)hl7702细胞(b)ct26细胞l(c)hela细胞的毒性实验;
图5为顺铂cddp和实施例1载药纳米材料pr-cooh-pt对(a)ct26细胞(b)hela细胞的毒性实验;
图6中(a)为不同实验组荷瘤小鼠肿瘤体积的变化;(b)为不同实验组荷瘤小鼠的体重变化;(c)为不同实验组荷瘤小鼠的生存时间。
具体实施方式
以下结合实施例对本发明的技术方案作进一步地详细介绍,但本发明的保护范围并不局限于此。
本发明中所用原料均可以直接购买普通市售产品,其中,准轮烷(ppr)可参照现有文献制备获得,如yizhang,qiaoqiaozhou,shuxinjia,kunpenglin,guangfangfan,jintaoyuan,shulingyu,*andjiahuashi*,specificmodificationwithtpgsanddrugloadingofcyclodextrinpolyrotaxanesandtheenhancedantitumoractivitystudyinvitroandinvivo,acsappliedmaterials&interfaces,2019,11,50,46427-46436。
实施例1
一种卟啉封端的纳米级荧光聚轮烷的制备方法,其具体为:
将准轮烷(3.0471g,0.1mmol),卟啉(629.24mg,1.0mmol),pybop(520mg,1.0mmol),dmap(122.17g,0.1mmol)依次加入到50ml的圆底中,然后加入20ml无水dmf,放置在摇床中4℃下反应过夜(12h),反应结束后加入20ml甲醇,此时有紫色固体析出。离心收集紫色固体,然后依次用甲醇、二氯甲烷和蒸馏水洗涤,将得到的紫色固体超声分散在10ml的dmso中,静置使残留的准轮烷充分解组装,然后滴加80ml去离子水中,得到淡粉色沉淀,离心收集淡粉色沉淀,然后分别用甲醇、水洗涤,冻干得淡粉色固体产品卟啉封端的纳米级荧光聚轮烷(pr)。
上述卟啉经下述步骤制备获得:将吡咯(6.84ml,0.098mol)和苯甲醛(10.00ml,0.098mol)加入到320ml的丙酸中,搅拌加热至140℃回流反应30min。冷却过夜(12h),抽滤、用甲醇洗涤数次,得到紫色晶体,在真空干燥箱中干燥即得卟啉。
一种利用上述卟啉封端的纳米级荧光聚轮烷作为纳米负载材料通过负载抗肿瘤药物制备得到的负载药物的纳米体系,具体如下:
1)将卟啉封端的纳米级荧光聚轮烷pr(100mg,3.36×10-3mmol),琥珀酸酐(54mg,0.545mmol)和dmap(66mg,0.545mmol)溶于dmso(20ml)中,混合溶液在室温下反应过夜12h,然后将反应溶液装进3.5kda透析袋在蒸馏水中透析24h,最后将透析溶液冷冻干燥,获得浅绿色固体产物(羧基化的聚轮烷pr-cooh),134.5mg;
2)将羧基化的聚轮烷pr-cooh(30mg,7.55×10-4mmol)和顺铂(cddp,4.8mg,0.016mmol)溶解于3ml蒸馏水中,室温避光反应24h,然后将反应溶液装入3.5kda透析袋在蒸馏水中透析24h,最后将透析溶液冷冻干燥得到产物负载药物的纳米体系(pr-cooh-pt)(24.2mg,72%)。
上述实施例1制备所得的产品的结构和形态分别通过核磁共振技术、xrd技术和透射电子显微镜技术进行表征如图1和图2。测试结果证明:聚轮烷(pr)成功合成,并且形貌为粒径约为1.7nm的类球形纳米粒子,如此小粒径的纳米粒子在肿瘤中有较好的渗透与滞留作用,这也决定了其负载药物后使得肿瘤部位的药物浓度较高而提高抗肿瘤效果。
为了更进一步了解聚轮烷pr的载药性能,本申请先将其羧基化获得羧基化的聚轮烷pr-cooh(其目的在于便于载药),然后再负载药物顺铂cddp,从而获得负载药物的纳米体系pr-cooh-pt。当选用的药物不是顺铂时,可以不用羧基化,而是直接将聚轮烷pr负载药物。
应用实验
pr-cooh的封端剂是带有红色荧光的卟啉,因此,本发明所制备的pr-cooh也具有红色荧光。本发明选择人宫颈癌细胞hela和鼠结肠癌细胞ct26来检测pr-cooh在细胞中的分布。
将细胞在含有10%fbs(胎牛血清)、1%青霉素(100u/ml)和链霉素(0.1mg/ml)的rpmi1640培养基中37℃孵育24h。然后将细胞与0.25mg/mlpr-cooh在37℃共同孵育4h。4h后,将细胞用pbs缓冲溶液(ph=7.4)洗涤。然后将细胞用4%多聚甲醛固定在盖玻片上10min,用dapi(4',6-二脒基-2-苯基吲哚)染色细胞核。通过激光扫描共聚焦显微镜观察样品,结果如图3所示。图3的结果显示:药物载体pr-cooh能够通过胞吞作用被两种癌细胞摄取并分布在细胞质中。
通过mtt实验研究了药物载体pr-cooh和负载在纳米材料上的抗肿瘤药物pr-cooh-pt的细胞毒性。将细胞以每孔7000个细胞的密度接种在96孔板中,并在37℃孵育24h。然后将不同浓度(12.5、25、50、100和200μg/ml)的pr-cooh和不同浓度(5、10、20、40、80μg/ml)的pr-cooh-pt、cddp与细胞共在37℃卵育48h。然后,将50μl含5mg/mlmtt的pbs缓冲溶液加入每个孔中,并将细胞再孵育4h。然后除去mtt并加入dmso以溶解活细胞还原mtt所得甲瓒晶体。使用酶标仪在570nm处测量吸光度。未经处理的细胞作为对照组。在本实验中,使用ct26细胞,hl7702细胞和hela细胞评估pr-cooh,pr-cooh-pt和cddp的细胞毒性和抗肿瘤活性。
测试结果见图4和图5中。图4的实验结果显示:本发明所制备的纳米药物载体pr-cooh对正常细胞和各种肿瘤细胞均没有毒性,证明这种材料具有较好的生物相容性。图5的负载抗肿瘤药物的纳米载体pr-cooh-pt毒性实验结果显示:负载在纳米药物载体pr-cooh的药物能够释放并能保持原来的药效,由于负载在纳米药物载体pr-cooh上的药物能够通过纳米药物载体的作用更好地被肿瘤细胞摄取,因此,负载在纳米材料上的抗肿瘤药物与裸药cddp相比具有更好的抗肿瘤效果。
通过体内实验进一步研究纳米药物载体pr-cooh的生物相容性和抗肿瘤效果。通过皮下接种法将鼠肝癌细胞h22(每只小鼠2×106个细胞)接种到6-8周的昆明小鼠腋下建立肿瘤模型。当肿瘤体积长到约90mm3时,将小鼠随机分为四组(每组8只):(i)pr-cooh(浓度与iii组中所用负载药物的材料浓度相同),(ii)裸药cddp(5mg/kg),(iii)pr-cooh-pt(cddp浓度为5mg/kg)和(iv)生理盐水为阴性对照。在第一天、第四天和第七天通过尾静脉向小鼠体内注射200μl相关样品的盐水溶液。每隔一天测量肿瘤大小和体重,直到第十五天。同时观察小鼠的生存数量,直到实验结束。研究结果见图6。图6的实验结果显示:与裸药cddp相比,负载在纳米药物载体pr-cooh中的药物能更好的抑制肿瘤生长,即药物cddp负载在纳米药物载体pr-cooh上具有更好的抗肿瘤作用。经体重实验研究发现:在整个实验过程中,材料pr-cooh和载药材料pr-cooh-pt组的小鼠体重没有明显的下降,证明材料pr-cooh具有较好的生物相容性,药物cddp负载在纳米药物载体pr-cooh上可以减少药物对生物体的毒副作用;经生存率实验研究发现:当研究到45天时,裸药cddp组的小鼠全部死亡,而载药pr-cooh-pt组的小鼠还有四只存活,说明药物负载在纳米药物载体pr-cooh上能够较好地延长小鼠的生存时间。
综上说明:本发明制备的pr所用原料廉价成本低、生物相容性好且自身有荧光,是比较好的药物示踪剂和药物载体。将药物负载到pr-cooh上后,由于肿瘤对纳米药物载体pr-cooh的epr效应使得肿瘤部位的药物浓度提高、药物对生物体的毒副作用低、肿瘤治疗效果显著增强。
- 还没有人留言评论。精彩留言会获得点赞!