一种物理法制备动物源细胞外基质多肽的方法与流程
本发明属于生物活性物质的制备方法技术领域,更具体地,本发明涉及一种物理法制备动物源细胞外基质多肽的方法。
背景技术:
肽是由氨基酸组成的短链,是精准的蛋白质片段,其分子只有纳米般大小,肠胃、血管及肌肤皆容易吸收。小分子多肽具有更高皮肤渗透性,更容易被人体皮肤吸收,同时由于分子量小到一定程度,生物活性就发生了质的飞跃。肽的分子量越小,“氨基酸链”越短,越易被人体吸收和利用。
由于小分子多肽的独特生物个性及突出功能表现,使其在日化美容领域、洗发护发、食品保健品、生物医学、甚至纺织领域等都有着巨大的应用空间。小分子多肽在美容领域应用广泛,引领着中国高端美容市场健康护肤的新趋势。但是目前的小分子多肽多为化学合成,成分单一,单价昂贵,化学添加剂多,未充分利用多种天然复合型多肽的配伍作用等不足。
技术实现要素:
为了解决上述问题,本发明第一个方面提供了物理法制备动物源细胞外基质多肽的方法,包括以下步骤:
(1)将动物源性组织清洗、分割、高温处理,得组织样品;
(2)将上述组织样品进行深冷处理,再用25-35℃的水解冻组织样品,循环3-5次,得到解冻后的组织样品;
(3)将上述解冻后的组织样品进行物理粉碎,得到粉末颗粒;
(4)将上述粉末颗粒溶于水中,高速搅拌乳化得浆液;
(5)将上述浆液加热溶解、抽滤、收集滤液,干燥得粉末半成品;
(6)将上述粉末半成品通过辐照处理得到动物源细胞外基质多肽。
作为一种优选的技术方案,所述动物源组织包括猪、牛、羊等陆地哺乳动物的膀胱粘膜下层基质、小肠粘膜下层基质、腹膜基质及基底膜基质中的一种或多种的组合。
作为一种优选的技术方案,所述步骤(1)中的高温为100-140℃。
作为一种优选的技术方案,所述步骤(2)中的深冷处理具体为在-100~-60℃下处理20-28h。
作为一种优选的技术方案,所述步骤(3)中的物理粉碎具体为在-200~-40℃的低温下粉碎。
作为一种优选的技术方案,所述步骤(4)中粉末颗粒与水的质量比为(1-5):100;所述高速搅拌的转速为18000-24000rpm。
作为一种优选的技术方案,所述步骤(5)中加热溶解具体为在80-120℃下处理一次或多次。
作为一种优选的技术方案,所述步骤(5)中的干燥选自冷冻干燥、喷雾干燥、鼓风干燥中的一种。
本发明第二个方面提供了所述物理法制备动物源细胞外基质多肽的方法制备得到的动物源细胞外基质多肽。
本发明第三个方面提供了所述物理法制备动物源细胞外基质多肽的方法制备得到的动物源细胞外基质多肽在美容护肤、功能饮料及营养辅食添加剂的应用。
有益效果:本发明以天然动物源组织为多肽来源,采用一套组合式的物理制备技术,包括高温处理、反复超低温循环冷冻、物理粉碎、高温溶解、冷冻干燥及射线辐照方法,减少化学试剂的使用,制备出富含iii型胶原蛋白序列的超低分子量无菌复合多肽。实现了分子量不断减小,最终到可以透皮吸收的效果,从而,为供皮肤美白、护理、修复提高生物活性成分。另外,所选的天然动物源组织原料成分包含i型胶原蛋白、iii型胶原蛋白及iv型胶原蛋白等,用其制备的低分子量多肽序列活性成分丰富,代谢周期长,活性维持时间久,且成本较低,可用于美容护肤、功能饮料及营养辅食的添加剂等。
附图说明
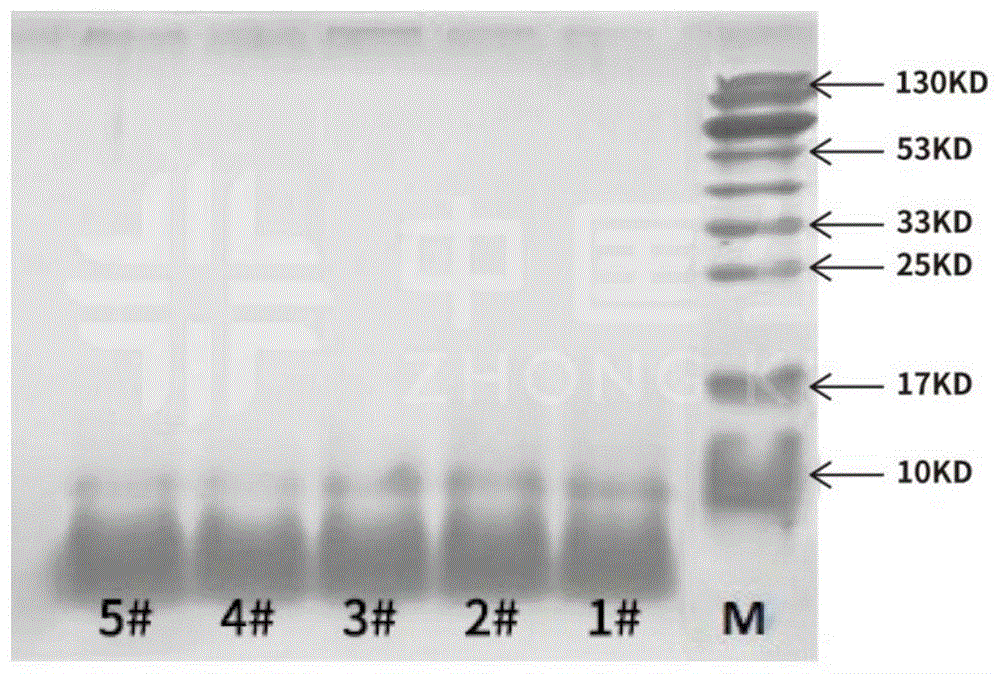
图1为实施例1-5制得的动物源细胞外基质多肽的分子量分布图。
图2为对比例1-4制得的动物源细胞外基质多肽的分子量分布图。
图3为实施例1制得的动物源细胞外基质多肽的扫描电镜图(20kx)。
附图标记:m-标准蛋白marker;1#-实施例1;2#-实施例2;3#-实施例3;4#-实施例4;5#-实施例5;1-对比例1;2-对比例2;3-对比例3;4-对比例4。
具体实施方式
参选以下本发明的优选实施方法的详述以及包括的实施例可更容易地理解本发明的内容。除非另有限定,本文使用的所有技术以及科学术语具有与本发明所属领域普通技术人员通常理解的相同的含义。当存在矛盾时,以本说明书中的定义为准。
如本文所用术语“由…制备”与“包括”同义。本文中所用的术语“包括”、“具有”、“含有”或其任何其它变形,意在覆盖非排它性的包括。例如,包括所列要素的组合物、步骤、方法、制品或装置不必仅限于那些要素,而是可以包括未明确列出的其它要素或此种组合物、步骤、方法、制品或装置所固有的要素。
连接词“由…组成”排除任何未指出的要素、步骤或组分。如果用于权利要求中,此短语将使权利要求为封闭式,使其不包括除那些描述的材料以外的材料,但与其相关的常规杂质除外。当短语“由…组成”出现在权利要求主体的子句中而不是紧接在主题之后时,其仅限定在该子句中描述的要素;其它要素并不被排除在作为整体的所述权利要求之外。
当量、浓度、或者其它值或参数以范围、优选范围、或一系列上限优选值和下限优选值限定的范围表示时,这应当被理解为具体公开了由任何范围上限或优选值与任何范围下限或优选值的任一配对所形成的所有范围,而不论该范围是否单独公开了。例如,当公开了范围“1至5”时,所描述的范围应被解释为包括范围“1至4”、“1至3”、“1至2”、“1至2和4至5”、“1至3和5”等。当数值范围在本文中被描述时,除非另外说明,否则该范围意图包括其端值和在该范围内的所有整数和分数。
单数形式包括复数讨论对象,除非上下文中另外清楚地指明。“任选的”或者“任意一种”是指其后描述的事项或事件可以发生或不发生,而且该描述包括事件发生的情形和事件不发生的情形。
说明书和权利要求书中的近似用语用来修饰数量,表示本发明并不限定于该具体数量,还包括与该数量接近的可接受的而不会导致相关基本功能性的改变的修正的部分。相应的,用“大约”、“约”等修饰一个数值,意为本发明不限于该精确数值。在某些例子中,近似用语可能对应于测量数值的仪器的精度。在本申请说明书和权利要求书中,范围限定可以组合和/或互换,如果没有另外说明这些范围包括其间所含有的所有子范围。
此外,本发明要素或组分前的不定冠词“一种”和“一个”对要素或组分的数量要求(即出现次数)无限制性。因此“一个”或“一种”应被解读为包括一个或至少一个,并且单数形式的要素或组分也包括复数形式,除非所述数量明显旨指单数形式。
针对上述技术问题,本发明第一个方面提供了物理法制备动物源细胞外基质多肽的方法,包括以下步骤:
(1)将动物源性组织清洗、分割、高温处理,得组织样品;
(2)将上述组织样品进行深冷处理,再用25-35℃的温水解冻组织样品,循环3-5次,得到解冻后的组织样品;
(3)将上述解冻后的组织样品进行物理粉碎,得到粉末颗粒;
(4)将上述粉末颗粒溶于水中,高速搅拌乳化得浆液;
(5)将上述浆液加热溶解、抽滤、收集滤液,干燥得粉末半成品;
(6)将上述粉末半成品通过辐照处理得到动物源细胞外基质多肽。
在一种优选的实施方式中,所述动物源组织包括猪、牛、羊等陆地哺乳动物的膀胱粘膜下层基质、小肠粘膜下层基质、腹膜基质及基底膜基质中的一种或多种的组合。
在一种最优选的实施方式中,所述动物源性组织为猪小肠粘膜下层基质。
在一种优选的实施方式中,所述步骤(1)中的高温为100-140℃。
在一种最优选的实施方式中,所述步骤(1)中的高温为120℃。
本发明人经过长时间的研究发现,采用100-140℃下对动物源基质进行处理,不仅可以消除其表面的细菌和病毒,还可以起到脱脂的功效,提高了灭菌的效率。可能的原因是若温度低于100℃,不能杀灭芽孢杆菌,温度高于140℃会破坏蛋白的结构而影响最终产物活性,所以,采用100-140℃下对动物源基质进行处理既可杀灭芽孢杆菌又不会影响产品质量,并缩短了灭菌时间,提高了灭菌效率。
在一种优选的实施方式中,所述步骤(2)中的深冷处理具体为在-100~-60℃下处理20-28h。
在一种最优选的实施方式中,所述步骤(2)中的深冷处理具体为在-80℃下处理24h。
在一种优选的实施方式中,所述步骤(2)中的温水和组织样品的质量比为(8-12):1。
在一种最优选的实施方式中,所述步骤(2)中的温水和组织样品的质量比为10:1。
在一种优选的实施方式中,所述步骤(3)中的物理粉碎具体为在-200~-40℃的低温下粉碎。
在一种最优选的实施方式中,所述步骤(3)中的物理粉碎具体为在-196℃下粉碎。
在一种优选的实施方式中,所述步骤(3)中的粉末颗粒的粒径小于等于200目。
本发明人经过长期研究发现,通过步骤(2)和步骤(3)可以得到粒径均一的粉末颗粒。可能的原因是,当将组织样品放在-100~-60℃下处理20-28h,然后再用25-35℃的水解冻组织样品,重复2-3次后松解了组织纤维与结构,使得组织样品深度破碎;然后将其立即置于-196℃下粉碎,可以粉碎为一定粒度的颗粒,且能够最大限度地水解成小分子的多肽,而又不影响小分子多肽的生物活性。
在一种优选的实施方式中,所述步骤(4)中的水为纯化水。
本发明所述纯化水,是指纯水通过蒸馏法、离子交换法、反渗透法或其他适宜的方法制得的供药用的水,不含任何添加剂。
在一种优选的实施方式中,所述步骤(4)中粉末颗粒与水的质量比为(1-5):100;所述高速搅拌的转速为18000-24000rpm。
在一种最优选的实施方式中,所述步骤(4)中的粉末颗粒与水的质量比为3:100;高速搅拌的转速为21000rpm。
在一种优选的实施方式中,所述步骤(5)中的加热溶解具体为先在80-120℃下处理20-40min一次或多次。
在一种最优选的实施方式中,所述步骤(5)中的加热溶解具体为在100℃下处理30min一次或多次。
在一种优选的实施方式中,所述步骤(5)中的干燥选自冷冻干燥、喷雾干燥、鼓风干燥中的一种。
在一种最优选的实施方式中,所述干燥为冷冻干燥。
在一种优选的实施方式中,所述步骤(5)中的抽滤具体为尼龙纱布抽滤。
在一种优选的实施方式中,所述尼龙纱布的孔径为30-50μm。
在一种最优选的实施方式中,所述尼龙纱布的孔径为37.5μm。
在一种优选的实施方式中,所述步骤(6)中的射线辐照剂量为15-35kgy。
在一种优选的实施方式中,所述步骤(6)中的射线辐照剂量为30kgy。
本发明人经过长期研究发现,溶浆通过孔径为30-50μm尼龙纱布过滤后得到的滤液冷冻干燥,再辐照处理,可以得到品质很好的小分子多肽。可能的原因是所述尼龙纱布的孔径为30-50μm,只允许水及小分子物质通过,所得的滤液再采用冷冻干燥,成分的活性损失较少;且有色泽、形态优异,脱水彻底,复水性好,易于保藏和运输,最后采用辐照处理,再次起到灭菌效果,进而增强了小分子多肽复合物的品质。
在一种最优选的实施方式中,一种物理法制备动物源细胞外基质多肽的方法包括以下步骤:
(1)将动物源性组织清洗,分割为长为10cm,宽为2cm条状,并在120℃下处理30min,得到组织样品;
(2)将上述组织样品立即置于-80℃深冷处理24h,然后用30℃温水按质量比为10:1解冻组织样品,如此循环3次,得到解冻后的组织样品;
(3)将上述解冻后的组织样品在-196℃下进行物理粉碎,制备得到粒径为200目以下的粉末颗粒;
(4)将上述粉末颗粒按质量比为3:100混合于纯水中,在21000rpm下乳化5min后获得浆液;
(5)将上述浆液加热至100℃处理30min随后用孔径为37.5μm尼龙纱布抽滤、收集滤液,冷冻干燥得粉末半成品;
(6)将上述粉末半成品通过30kgy辐照处理得到动物源细胞外基质多肽。
本发明第二个方面提供了所述物理法制备动物源细胞外基质多肽的方法制备得到的动物源细胞外基质多肽。
在一种优选的实施方式中,所述动物源细胞外基质多肽为富含iii型胶原蛋白序列的无菌复合多肽。
所述iii型胶原蛋白呈疏网状,散布于i型胶原周围,其含量越高纤维束越细。是我们人体和其他脊椎动物的一个主要的结构蛋白,起到支撑组织和缔结组织的主要作用,有着骨中之骨,肉中之肉的称呼,iii型胶原蛋白决定着皮肤的弹性和嫩滑度。
在一种优选的实施方式中,所述动物源细胞外基质多肽的分子量为4000-10000da。
在一种更优选的实施方式中,所述动物源细胞外基质多肽的分子量为6000-8000da。
本发明第三个方面提供了所述物理法制备动物源细胞外基质多肽的方法制备得到的动物源细胞外基质多肽在美容护肤、功能饮料及营养辅食添加剂的应用。
实施例
为了更好的理解上述技术方案,下面将结合具体的实施方式对上述技术方案进行详细的说明。有必要在此指出的是,以下实施例只用于对本发明作进一步说明,不能理解为对本发明保护范围的限制,该领域的专业技术人员根据上述本发明的内容做出的一些非本质的改进和调整,仍属于本发明的保护范围。另外,如果没有其它说明,所用原料、植物提取物都是市售的。
实施例1
实施例1提供了一种物理法制备动物源细胞外基质多肽的方法,包括以下步骤:
(1)将猪小肠粘膜下层基质清洗,分割为长为10cm,宽为2cm条状,在120℃高温处理30min,得到组织样品;
(2)将上述组织样品立即置于-80℃深冷处理24h,然后用30℃温水按质量比为10:1解冻组织样品,如此循环3次,得到解冻后的组织样品;
(3)将上述解冻后的组织样品在-196℃下进行物理粉碎,制备得到粒径为200目的粉末颗粒;
(4)将上述粉末颗粒按质量比为3:100混合于纯水中,在21000rpm下乳化5min后获得浆液;
(5)将上述浆液加热至100℃处理30min;随后用孔径为37.5μm尼龙纱布抽滤、收集滤液,冷冻干燥得粉末半成品;
(6)将上述粉末半成品通过30kgy辐照处理得到动物源细胞外基质多肽。
实施例2
实施例2与实施例1基本相同,区别仅在于,所述步骤(1)为将猪腹膜基质清洗,分割为长为10cm,宽为2cm条状,并采用120℃高温处理30min,得到组织样品。
实施例3
实施例3与实施例1基本相同,区别仅在于,所述步骤(1)中的高温为140℃。
实施例4
实施例4与实施例1基本相同,区别仅在于,所述步骤(2)中的深冷处理具体为在-100℃下处理20h。
实施例5
实施例5与实施例1基本相同,区别仅在于,所述步骤(5)中加热溶解具体为先在120℃下处理20min,冷却后补充适量纯化水并加热到120℃再处理20min。
对比例1
对比例1与实施例1基本相同,区别仅在于,包括以下步骤:
(1)将猪小肠粘膜下层基质清洗,分割为长为10cm,宽为2cm条状,在120℃高温处理30min,得到组织样品;
(2)将上述组织样品在-196℃下进行物理粉碎,制备得到粒径为200目的粉末颗粒;
(3)将上述粉末颗粒按质量比为3:100混合于纯水中,在18000rpm下乳化5min后获得浆液;
(4)将上述浆液加热至100℃处理30min;随后用孔径为37.5μm尼龙纱布抽滤、收集滤液,冷冻干燥得粉末半成品;
(5)将上述粉末半成品通过30kgy辐照处理得到动物源细胞外基质多肽。
对比例2
对比例2与实施例1基本相同,区别仅在于,包括以下步骤:
(1)将猪小肠粘膜下层基质清洗,分割为长为10cm,宽为2cm条状,在120℃高温处理30min,得到组织样品;
(2)将上述组织样品立即置于-80℃深冷处理24h,然后用30℃温水按质量比为10:1解冻组织样品,如此循环3次,得到解冻后的组织样品;
(3)将上述解冻组织样品按质量比为3:100混合于纯水中,在23000rpm下乳化5min后获得浆液;
(4)将上述浆液加热至100℃处理30min,随后用孔径为37.5μm尼龙纱布抽滤、收集滤液,冷冻干燥得粉末半成品;
(5)将上述粉末半成品通过30kgy辐照处理得到动物源细胞外基质多肽。
对比例3
对比例3与实施例1基本相同,区别仅在于,包括以下步骤:
(1)将猪小肠粘膜下层基质清洗,分割为长为10cm,宽为2cm条状,在120℃高温处理30min,得到组织样品;
(2)将上述组织样品立即置于-80℃深冷处理24h,然后用30℃温水按质量比为10:1解冻组织样品,如此循环3次,得到解冻后的组织样品;
(3)将上述解冻后的组织样品在-196℃下进行物理粉碎,制备得到粒径为200目的粉末颗粒;
(4)将上述粉末颗粒按质量比为3:100混合于纯水中,在21000rpm下乳化5min后获得浆液;
(5)将浆液用孔径为37.5μm尼龙纱布抽滤、收集滤液,冷冻干燥得粉末半成品;
(6)将上述粉末半成品通过30kgy辐照处理得到动物源细胞外基质多肽。
对比例4
对比例4与实施例1基本相同,区别仅在于,包括以下步骤:
(1)将猪小肠粘膜下层基质清洗,分割为长为10cm,宽为2cm条状,在120℃高温处理30min,得到组织样品;
(2)将上述组织样品立即置于-80℃深冷处理24h,然后用30℃温水按质量比为10:1解冻组织样品,如此循环3次,得到解冻后的组织样品;
(3)将上述解冻后的组织样品在-196℃下进行物理粉碎,制备得到粒径为200目的粉末颗粒;
(4)将上述粉末颗粒按质量比为3:100混合于纯水中,在8000rpm下乳化30min后获得浆液;
(5)将上述浆液加热至100℃处理30min;随后用孔径为37.5μm尼龙纱布抽滤、收集滤液,冷冻干燥得粉末半成品;
(6)将上述粉末半成品通过30kgy辐照处理得到动物源细胞外基质多肽。
性能评价
多肽分子量分布是采用琼脂糖凝胶电泳法测得;其中m为标准蛋白marker;1#为实施例1的制得的动物源细胞外基质多肽;2#为实施例2制得的动物源细胞外基质多肽;3#为实施例3制得的动物源细胞外基质多肽;4#为实施例4制得的动物源细胞外基质多肽;5#为实施例5制得的动物源细胞外基质多肽。1为对比例1制得的动物源细胞外基质多肽;2为对比例2制得的动物源细胞外基质多肽;3为对比例3制得的动物源细胞外基质多肽;4为对比例4制得的动物源细胞外基质多肽。
分子量测试结果如下图:
图1为实施例1-5制得的动物源细胞外基质多肽的分子量分布图。
图2为对比例1-4制得的动物源细胞外基质多肽的分子量分布图。
图3为实施例1所制得的动物源细胞外基质多肽的扫描电镜图(20kx)。
从图1和图2可以看出,通过本发明的方法制备得到的动物源细胞外基质多肽分子量在4000-10000da,集中分布在6000-8000da;而对比例制得的动物源细胞外基质多肽分子量在4600-40000da,集中分布在10000-26000da。从图3可以看出,通过本发明的方法制备得到的动物源细胞外基质多肽分子,其物理尺寸达到了纳米级别。
前述的实例仅是说明性的,用于解释本发明所述方法的一些特征。所附的权利要求旨在要求可以设想的尽可能广的范围,且本文所呈现的实施例仅是根据所有可能的实施例的组合的选择的实施方式的说明。因此,申请人的用意是所附的权利要求不被说明本发明的特征的示例的选择限制。在权利要求中所用的一些数值范围也包括了在其之内的子范围、工艺、特征及原理,这些范围中的等效变化或修饰也应在可能的情况下解释为被所附的权利要求覆盖。
- 还没有人留言评论。精彩留言会获得点赞!