一种从胸腔积液中筛分肿瘤细胞的微流控芯片的制作方法
本发明涉及生物医学工程领域微流控分析检测技术,具体是指一种从胸腔积液中筛分肿瘤细胞的微流控芯片。
背景技术:
通过胸腹水涂片进行脱落细胞学检查是诊断原发或转移癌的关键方法。胸腹水涂片的质量直接关系到诊断的准确性和治疗的适用性。然而现有的胸腔积液细胞学涂片操作流程仅包括离心、涂片、染色等步骤,所制备的涂片包含多种细胞,观察肿瘤细胞时背景干扰很大。可以预见,通过对胸水进行细胞筛分处理,获得仅含待观察肿瘤细胞的涂片,将有效的提高涂片质量和诊疗水平。
微流控细胞分选技术由于其高通量、低成本和操作简单的优点而在细胞筛分中备受关注。sun等人设计了双螺旋微流道,实现了从稀释全血液中分离循环肿瘤细胞;lee等人设计了双入口缩扩微流道,实现了从血液中分离循环肿瘤细胞;yuan等人构建了缩扩流道中的双流体并流体系,使特定尺寸的颗粒从粘弹性流体中迁移到牛顿流体中。但以上装置仍存在一些缺点,主要包括:依据惯性分选原理,不同细胞聚焦于不同位置,当细胞尺寸不均一时,分离纯度低;装置只适用于特定粘度的流体样品,使用前需要对样品进行处理,增加了操作难度和时间;颗粒尺寸小于5μm,不适用于肿瘤细胞;分离距离较小,实际应用中效率较低。简单的将现有的微流控芯片技术应用于胸腔积液中肿瘤细胞的筛分难度较大,不能以简单高效的方法提高涂片速度和质量,不具备实际应用的可操作性。
综上所述,提出一种可从各种粘度胸腔积液中高效分离出肿瘤细胞的微流控芯片,对进一步提高肿瘤细胞涂片质量,缩短诊断时间和提高肿瘤诊断准确性具有重要的现实意义。
技术实现要素:
针对现有技术的不足,本发明的目的在于提供一种从胸腔积液中筛分肿瘤细胞的微流控芯片,从各种粘度的胸腔积液样品中获得高纯度的肿瘤细胞而无须对样品进行预处理,最终得到无背景干扰的细胞涂片,减少样品用量,缩短操作时间,实现对胸腔积液中肿瘤细胞的高效检测。
为了解决现有技术存在的问题,本发明采用如下技术方案予以实施:
所述一种从胸腔积液中筛分肿瘤细胞的微流控芯片,其具体包括:
该微流控芯片的结构:
芯片主体为其上设置的微流体通道结构。所述微流体通道结构包含3个流体入口和2个流体出口,三入口通过支流通道与主流道连接。主流道分为两个部分,第一部分为矩形截面不变的直流段,第二部分为截面面积周期性变化的收缩-扩张段,所述收缩-扩张段由至少20个收缩-扩张单元交错构成。在收缩-扩张段末端,设置分流通道将主流道与两个出口相连。
(1)微流体通道结构整体尺寸高为20~70μm
(2)所述主流道第一部分直流段尺寸为宽80~150μm,长1~2.5mm
(3)所述收缩-扩张单元中收缩段尺寸为宽80~150μm、长150~300μm;
(4)所述收缩-扩张单元中扩张段尺寸为宽200~400μm、长150~300μm;
(5)各液体入口支流通道的宽度为100~400μm;
(6)各液体出口分流通道的宽度为50~300μm。
该微流控芯片的制造方法:
(1)通过湿法刻蚀在玻璃基底上制作处通道阳模;
(2)在模具上浇筑聚合物材料获得微流体通道结构;
(3)对聚合物材料和载玻片进行表面等离子处理;
(4)将聚合物材料和载玻片键合,获得用于肿瘤细胞筛分的微流控芯片。
该微流控芯片的使用方法:
(1)样品制备:通过胸腔穿刺等方法获得胸腔积液样品;将聚环氧乙烷(peo)均匀分散于水中,获得粘度高于1.36mpa·s的鞘流溶液2(以同等测试条件下,去离子水粘度1.02mpa·s为基准);依使用需要准备粘度低于1.36mpa·s的鞘流溶液1,如磷酸盐缓冲液(pbs)、氯化钠缓冲液等(以同等测试条件下,去离子水粘度1.02mpa·s为基准)。
(2)样品注入:分别将鞘流溶液1、鞘流溶液2和胸腔积液样品从入口1、入口2和入口3注入。调整各液体体积流率,使鞘流溶液1:胸腔积液样品大于3:1、鞘流溶液2:胸腔积液样品大于1:1。注意,该过程中,流率比的调节规则为:1)保证三相流体直接存在稳定界面,2)保证胸腔积液中的肿瘤细胞可以从胸腔积液样品迁移到鞘流溶液1,3)从处理液出口流出的流体全部是鞘流溶液1而无鞘流溶液2或胸腔积液样品。
(3)处理液收集:从出口1得到收集液,收集液中液相为鞘流溶液1,肿瘤细胞浓度应大于80%。从出口2得到废液,废液中液相为胸腔积液样品、鞘流溶液1、鞘流溶液2;
(4)细胞涂片的制备:取收集液0.25-0.5ml,均匀涂布在载玻片上观察镜检。
有益效果
传统的涂片方法分为两种,一种是直接对胸腔积液离心获得胸腔积液细胞浓缩液,再将细胞浓缩液涂布于载玻片,获得待染色涂片。这种方法的缺点在于没有对肿瘤细胞进行筛分,所以获得的涂片中包含大量红细胞和白细胞,干扰了肿瘤细胞的观察;另一种是通过膜过滤等方法对胸腔积液进行预处理,过滤掉一部分红细胞和白细胞,再将膜上的肿瘤细胞群涂布于载玻片,获得待染色涂片。这种方法的缺点在于设备和操作复杂、处理时间长和样品用量大,所以检测效率不够高。
本发明利用微流控方法,设计一种从胸腔积液中筛分肿瘤细胞的微流控芯片,对胸腔积液样品进行处理,其具有以下优点:1)处理速度快,操作简单,该方法适用于各种粘度的胸腔积液样品,无需对样品进行预处理即可直接通入微流控芯片;2)设备体积小,可在临床检验中大规模使用,提高检验量;3)样品用量少,提高了样品利用率,拓展了应用场景4)筛分纯度高,利用界面作用获得高纯度的肿瘤细胞,去除了红细胞、白细胞等的影响,制得细胞涂片背景干扰少。
附图说明
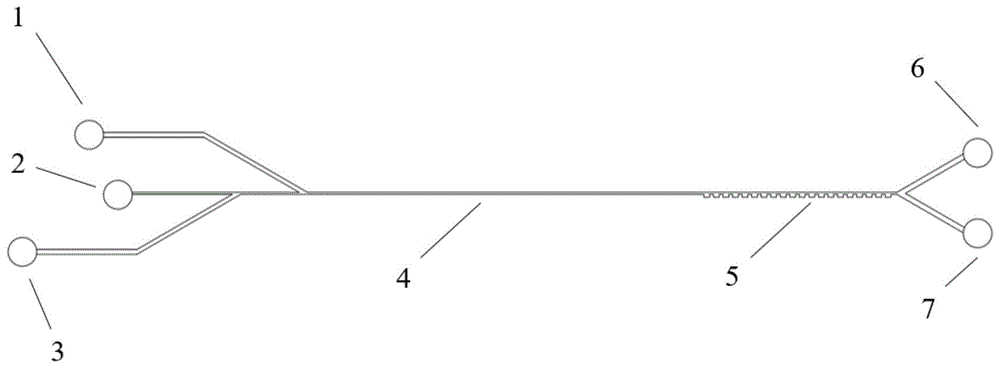
图1是本发明所述一种从胸腔积液中筛分肿瘤细胞的微流控芯片的形貌俯视图;1-微流道系统中入口1,2-微流道系统中的入口2,3-微流道系统中的入口3,4-微流道系统中的直流段,5-微流道系统中的收缩-扩张段,6-微流道系统中的出口1,7-微流道系统中的出口2;
图2是本发明所述一种从胸腔积液中筛分肿瘤细胞的微流控芯片的收缩-扩张结构局部放大图;8-微流道收缩-扩张单元中的收缩段,9-微流道收缩-扩张单元中的扩张段;
图3是本发明所述一种从胸腔积液中筛分肿瘤细胞的微流控芯片的出口结构局部放大图;10-微流道系统中与出口1相连的分流道,11-微流道系统中与出口2相连的分流道;
图4是本发明所述一种从胸腔积液中筛分肿瘤细胞的微流控芯片的使用流程图;
图5是本发明所述一种从胸腔积液中筛分肿瘤细胞的微流控芯片中大小细胞在运动过程中的受力分析示意图;12-胸腔积液样品,13-鞘流溶液2,14-鞘流溶液1,15-小于临界粒径的小细胞,16-大于临界粒径的大细胞;
图6是本发明所述一种从胸腔积液中筛分肿瘤细胞的微流控芯片的分离示意图;
图7是实施例2的实验结果图,17-肿瘤细胞,18-白细胞,19-红细胞;
图8是实施例3的实验结果图;
图9是实施例4的实验结果图;
图10是实施例2与传统方法的染色涂片对比图。
具体实施方式
下面结合附图和具体实施例进一步说明本发明。本发明提供的一种从胸腔积液中筛分肿瘤细胞的微流控芯片如图1所示,是一种从胸腔积液中筛分肿瘤细胞的微流控芯片装置,图2和图3分别是收缩-扩张结构和液体出口的局部结构图,该芯片的主要构造包括:1-微流道系统中入口1,2-微流道系统中的入口2,3-微流道系统中的入口3,4-微流道系统中的直流段,5-微流道系统中的收缩-扩张段,6-微流道系统中的出口1,7-微流道系统中的出口2,芯片上的进样口与出样口均与外界相通,便于接通微管,装载或排出液体。该芯片可以由玻璃片、硅片加工获得阳模,然后利用在模具上浇筑聚合物材料的方式获得微通道结构,最后将聚合物材料与玻璃进行键合。
上述一种从胸腔积液中筛分肿瘤细胞的微流控芯片中,微通道整体厚度为30~60μm。
上述一种从胸腔积液中筛分肿瘤细胞的微流控芯片中,各入口的宽度为100~400μm。
上述一种从胸腔积液中筛分肿瘤细胞的微流控芯片中各出口的宽度为50~300μm。
上述一种从胸腔积液中筛分肿瘤细胞的微流控芯片中,收缩段尺寸为宽80~150μm、长150~300μm。
上述一种从胸腔积液中筛分肿瘤细胞的微流控芯片中,扩张段尺寸为宽200~400μm、长150~300μm。
该芯片的操作方法如图4所示,首先,利用注射泵将鞘流溶液1从入口1注入,使微通道内充满鞘流溶液1;之后,鞘流溶液2从入口2注入,使鞘流溶液1和鞘流溶液2之间形成稳定的二层并流结构;然后,将含有红细胞、白细胞和肿瘤细胞的胸腔积液样品从入口3注入,三股流体间形成稳定的三层并流结构;最后,收集液从出口1流出,废液从出口2流出。本发明利用惯性升力和界面粘弹性力对大小细胞筛分;在筛分后,利用迪恩力扩大肿瘤细胞侧向迁移距离并完成细胞洗涤。最终在出口1得到包含高纯度肿瘤细胞的收集液,在出口2得到包含红细胞和白细胞的废液。取收集液0.25-0.5ml涂片,显微镜下即可观察到无红细胞干扰的高纯度肿瘤细胞。
筛分过程的细胞受力分析如图5所示,12-样品溶液,13-鞘流溶液2,14-鞘流溶液1,15-小于临界粒径的小细胞,16-大于临界粒径的大细胞。如图5a,在实验流率比(3:1:1)下,鞘流溶液1占据流道收缩-扩张侧,样品溶液受到挤压以一薄层沿直边侧流动,中间区域为一薄层鞘流溶液2,样品溶液中的细胞在壁面附近受到的惯性升力fl的粘弹性力fe驱动作用,向通道中心迁移;如图5b,细胞运动至并流界面时,试图从样品溶液穿越界面进入鞘流溶液2,进入鞘流溶液2的部分此时受到指向直边侧的粘弹性力fe2,惯性升力和粘弹性力的大小分别正比于粒径的6次方和3次方,因此只有特定粒径的细胞可以在界面处受力平衡,这个粒径就称为临界粒径。红细胞和白细胞粒径均小于临界粒径,所以不能穿越界面而留在样品溶液中。而肿瘤细胞的粒径大于临界粒径因而可以穿越界面进入鞘流溶液2中;如图5c,在鞘流溶液2中,肿瘤细胞继续受到惯性升力和粘弹性力的作用而进入鞘流溶液1;如图5d,在鞘流溶液1中,肿瘤细胞受到指向收缩-扩张侧的迪恩力以及指向直边侧的惯性升力作用,最终稳定在平衡位置。该分离过程示意图如图6所示
实施例1
如图1所示的芯片上设有收缩-扩张微流体通道,在通道一端设有两个入口,直边侧为样品入口,收缩-扩张侧为鞘流入口,在通道另一端设有两个出口,直边侧为废液出口,收缩-扩张侧为样品收集出口。结构尺寸设计为:微通道整体厚度为30μm,样品入口、鞘流入口的尺寸为100μm,废液出口、样品收集出口的尺寸为50μm,收缩段尺寸为宽80μm、长150μn,扩张段尺寸为宽200μm、长150μm,该尺寸能满足胸腔积液样品溶液、鞘流溶液1和鞘流溶液2的流动要求和肿瘤细胞筛分要求。其制作过程为:
(1)通过湿法刻蚀在玻璃基底上制作处通道阳模;
(2)在模具上浇筑聚合物材料获得微通道结构;
(3)对聚合物材料和载玻片进行表面等离子处理;
(4)将聚合物材料和载玻片键合,获得微流控芯片。
实施例2
本实施例中,微流控芯片的制作方法与实施例1相同,利用该芯片处理胸腔积液样品1,该样品性质为:红细胞浓度8×106/ml,白细胞2×105/ml,粘性1.13mpa·s。其操作步骤如图6所示,具体为:
(1)将鞘流溶液1(磷酸盐缓冲液)、鞘流溶液2(聚环氧乙烷溶液)和样品溶液分别吸取至注射器中,注射器与微流控芯片间通过塑料软管相连;
(2)使用精密注射泵按顺序将上述三种溶液沿各自入口注射到微通道中,首先通入鞘流溶液1,体积流率设置为30μl/min,待微通道内充满鞘流溶液1后,以10μl/min的体积流率通入鞘流溶液2,待两相溶液形成稳定并流界面后以10μl/min的体积流率通入样品溶液。
各溶液之间的流率比为3:1:1;
(3)样品中的肿瘤细胞与其他细胞在微流控芯片中实现分离,在出口1获得高纯度的肿瘤细胞收集液,在出口2获得以红细胞和白细胞为主的废液;
(4)取收集液0.25-0.5ml均匀涂抹在载玻片上,盖好盖玻片,得到细胞涂片;
(5)镜检观察。
微流道出口处的分离效果如图7所示,17-肿瘤细胞,18-白细胞,19-红细胞。可见红细胞和白细胞紧贴直边侧沿出口2流出,而肿瘤细胞从样品溶液中迁移出来,沿出口1流出。从而实现了肿瘤细胞的分选。
实施例3
本实施例中,微流控芯片的制作方法与实施例1相同,芯片的使用方法与实施例2相同,不同之处在于所处理胸腔积液样品2的性质:红细胞浓度70×106/ml,白细胞6×105/ml,粘性1.28mpa·s。如图8所示,在更高的粘度下,红细胞和白细胞仍在直边侧附近运动,但其迹线更宽。这说明红细胞和白细胞在样品中受到的粘弹性力增加,不能被鞘流溶液2完全封锁于样品溶液中。但是,大部分红细胞和白细胞仍从出口2流出,证明该芯片能从高粘度的胸腔积液中高效筛分肿瘤细胞。
实施例4
本实施例中,微流控芯片的制作方法与实施例1相同,芯片的使用方法与实施例3相同,不同之处在于所处理胸腔积液样品2的性质:红细胞浓度120×106/ml,白细胞11×105/ml,粘性1.34mpa·s。如图9所示,在更高的粘度和细胞浓度下,大部分红细胞和白细胞仍在直边侧附近运动,但其迹线更宽且有少量红细胞和白细胞沿出口1流出。产生这一现象的原因为:1)红细胞和白细胞在样品中受到的粘弹性力增加,在鞘流溶液2中受到的粘弹性力不够大2)细胞浓度增加导致细胞间相互作用加剧,影响了细胞在样品溶液中的单分散状态。但此时,大部分红细胞和白细胞仍从出口2流出,证明该芯片能从高粘度、高细胞浓度的胸腔积液中高效筛分肿瘤细胞。
取实施例2处理前后的胸腔积液样品制作细胞染色涂片。图10a所示,由未经筛分的胸腔积液所获得的细胞涂片细胞数量多,背景干扰大,目标肿瘤细胞的观察受到影响。相比于在入口注入的胸腔积液样品溶液中含有红细胞、白细胞和肿瘤细胞,处理后的样品收集液为高纯度的肿瘤细胞。取0.25-0.5ml样品收集液均匀涂布在载玻片上,经瑞氏-姬姆萨染色,即可得到细胞涂片。如图10b所示,胸腔积液样品经该微流控芯片筛分后所获得的细胞涂片细胞数量少,背景干扰小,目标肿瘤细胞的观察清晰准确。
以上所述实施方式仅仅是对本发明的优先实施方式进行描述,并非对本发明的范围进行限定,在不脱离本发明设计精神的前提下,任何熟悉本专业的技术人员对本发明的技术方案做出的各种变形和改进,均应落入本发明的权利要求书确定的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!