一种检测大肠埃希菌的方法及试剂盒与流程
本说明书实施例涉及生物检测技术领域,尤其涉及一种检测大肠埃希菌的方法及试剂盒。
背景技术:
大肠埃希菌(escherichiacoli,e.coli)又称大肠杆菌,是粪便污染指示菌之一。在大肠菌群、耐热大肠菌群和大肠埃希菌三种粪便污染指示菌中,大肠埃希菌检出的意义最大。所以,大肠埃希菌在样品检验中是经常被检验的指标。在水体中大肠埃希菌的数量反映水体被人畜粪便污染的情况。我国生活饮用水大肠埃希菌限量标准为不得检出(gb5479—2006)。《中华人民共和国国家标准》发布的生活饮用水中大肠埃希菌检测的方法有三种(以下简称国标法),分别为:多管发酵法、滤膜法和酶底物法(gb/t5750.12-2006)。三种方法均是利用大肠埃希菌特有的生化反应进行鉴定,所以三种方法均需要细菌培养步骤,其中多管发酵法培养时间为48小时,滤膜法为28小时,酶底物法为24小时。
自从1985年美国化学家karymullis发明了pcr(polymerasechainreaction,聚合酶链式反应)技术以来,该技术便被广泛应用于微生物检验领域。pcr技术的原理是以特定的dna链为目标,利用人工合成的该dna链的上下游引物和dna聚合酶,通过数十次的变性、退火和延伸循环,在体外实现目标dna的扩增。扩增产物的鉴定可以利用琼脂糖凝胶电泳、寡核苷酸探针、dna芯片、免疫技术或者其他的发光技术等。不同于国标法,pcr技术不需要微生物的培养步骤,通过鉴定特定dna片段的有无来间接反映待检微生物的有无。而且该技术具有灵敏性高、特异性好,省时、易操作等特点。
随着pcr技术的广泛应用,许多延伸技术也不断被开发出来,比如:(一)多重pcr技术,也称之为复合pcr(multiplexpcr),即一个反应体系中加入两对以上不同的引物同时扩增,这两对引物可以是不同来源的不同基因,也可以是同一来源的不同基因;(二)巢式pcr(nestingpcr),利用内外两套引物先后扩增靶基因;(三)实时荧光定量pcr(real-timeflurescentquantitivepcr),利用荧光信号强度与dna浓度成正比的原理,借助相应的仪器进行定量检测的pcr技术;(四)免疫-pcr,是将抗原-抗体免疫反应同pcr结合的技术;(五)rep-pcr,(重复序列引物聚合酶链反应),是在随机扩增dna多态性(rapd)分析基础上发展的对细菌进行指纹图谱分析的一种新方法,可用于细菌的分型;(六)环介导等温扩增法(loop-mediatedisothermalamplification,lamp),是2000年开发的一种新颖的恒温核酸扩增方法,其特点是针对靶基因的6个区域设计4种特异引物,利用一种链置换dna聚合酶在等温条件(63℃左右)保温30-60分钟,即可完成核酸扩增反应。
目前,文献公开的利用pcr技术检验大肠埃希菌的方法中,对于食品和临床样品中致病性大肠埃希菌的检测较多,而且主要是利用致病性大肠埃希菌的毒力基因进行检测,比如赵红庆等2009年公布的“多重pcr检测致腹泻大肠埃希菌方法的建立”[1]、徐仪刚等2010年公布的“多重pcr方法快速检测4种主要致腹泻性大肠埃希菌”[2]、赵春燕等2010年公布的“免疫pcr技术检测肠出血型大肠埃希菌o157:h7”[3]、2012年公布的“感染性腹泻快速检测试剂盒”(专利授权公告号cn202322847u,利用免疫磁珠捕获特异性细胞,然后利用pcr扩增特定的一个基因检验大肠杆菌o157:h7)、2016年公布的“食源性致病微生物检测的扩增引物和液相芯片试剂盒”(专利申请公布号cn105316398a)、2017年公布的“果蔬中六种食源性致病菌多重lamp检测引物、检测试剂盒及检测方法”(专利申请公布号cn107022644a)、2018年公布的“多重qpcr快速检测五种致泻大肠埃希氏菌的方法、感染性腹泻快速检测试剂盒”(专利申请公布号cn107760766a)等。
而对于饮用水或者水源水中大肠埃希菌指示微生物的鉴定,除了国标法,公开发表的主要包括下列几种:
方法一、1990年,bej等报道的利用多重pcr检验环境水体中总大肠菌群的方法[4],该方法使用了lacz和lacb基因检测人类粪便污染有关的细菌包括e.coli、肠源致病沙门氏菌和志贺氏菌。该方法并不是针对大肠埃希菌指示菌的检验,而是检验包括大肠埃希菌在内的三种人类粪便污染细菌,利用的是总大肠菌群lacz区,粪大肠杆菌lamb区,两者均为乳糖操纵子基因。该方法证明了乳糖操纵子基因可以应用于大肠埃希菌的检验中。并且受当时技术的限制,采用的是点对点固定的多聚dt尾捕捉探针与生物素标记的dna杂交进行检验的,操作性对复杂。
方法二、2012年,方振东等公布基于基因芯片的水体中13种病原微生物同步快速检测方法的专利申请(专利申请公布号cn102703589a)[5],该方法主要检验水源水、处理后的污水和废水中的病原微生物,其中包括大肠埃希菌和大肠杆菌o15:h7,方法为13重pcr技术联合芯片检测。该技术因为需要13对不同的引物和13种不同的探针,所以操作相对复杂。而且还需要芯片、共聚焦激光扫描仪和相应的处理软件等硬件设施,很难普及。虽然具有较高的灵敏性和特异度,但是操作时间相对较长(约8小时)。
方法三、2014年,单旭亮等公布了一种检测水中大肠埃希氏菌的方法和检测培养液专利申请(专利申请公布号cn104087652a),该方法没有利用分子生物学技术,而是利用酶底物原理,利用特定的培养液梯度稀释培养大肠埃希菌,建立浓度和特征时间的线性方程,然后检测待测样本410nm吸光度有明显变化前提下的特征时间,带入方程求大肠埃希菌的浓度,检测时间约为10小时。
方法四、2016年,孙宗科等公布一种能够同时检测两种粪便污染指示菌的酶底物培养基专利申请(专利申请公布号cn106086159a),也是一种基于酶底物法原理的培养检验方法,该方法能够检验大肠菌群、大肠埃希菌和耐热大肠菌群,需要至少24小时。
方法五、2016年,肖国生公布了一种水样中快速联合检测总大肠菌群和大肠埃希氏菌的方法专利申请(专利申请公布号cn105907874a),采用多管发酵法联合双重pcr检测总大肠菌群和大肠埃希菌,总大肠菌群使用lacz基因,大肠埃希菌使用uida基因。具体方法为先将水样梯度稀释后进行多管发酵,发酵时间为8~18时间,然后将培养液煮沸提取基因组进行双重pcr,最后通过琼脂糖凝胶电泳鉴定结果。该方式实际是国标法和pcr技术的联合应用,既有细菌的培养,也有分子生物学技术,操作时间约为十几个小时。
方法六、2018年,贾瑞宝等公布了一种饮用水中总大肠菌群的快速检测方法(专利申请公布号cn109082455a),该方法需要借助流式细胞仪,可检测不同的总大肠菌群活性细胞,包括活细胞、死细胞和受损细胞。该方法需要借助精密仪器,所以不易推广。
综上所述,现有的大肠埃希菌的检测方案,实现较为复杂,且耗时较长,不易推广,因此,亟需找到一种新的检测大肠埃希菌的方案来解决上述问题。
技术实现要素:
本说明书实施例提供一种检测大肠埃希菌的方法及试剂盒,用以快速、简便、成本低而且灵敏度和特异度较高的方式实现对大肠埃希菌的检测。
为了解决上述技术问题,本说明书实施例采用下述技术方案:
第一方面,提供了一种试剂盒,包括:用于构建检测大肠埃希菌的双重pcr反应体系的引物组合;
其中,所述引物组合包括:基于大肠埃希菌中16srrna的同源序列设计并合成的上游引物16f19和下游引物16r1514,以及,基于大肠埃希菌k-12mg1655乳糖操纵子laci基因的同源序列设计并合成的上游引物lf20和下游引物lr1039。
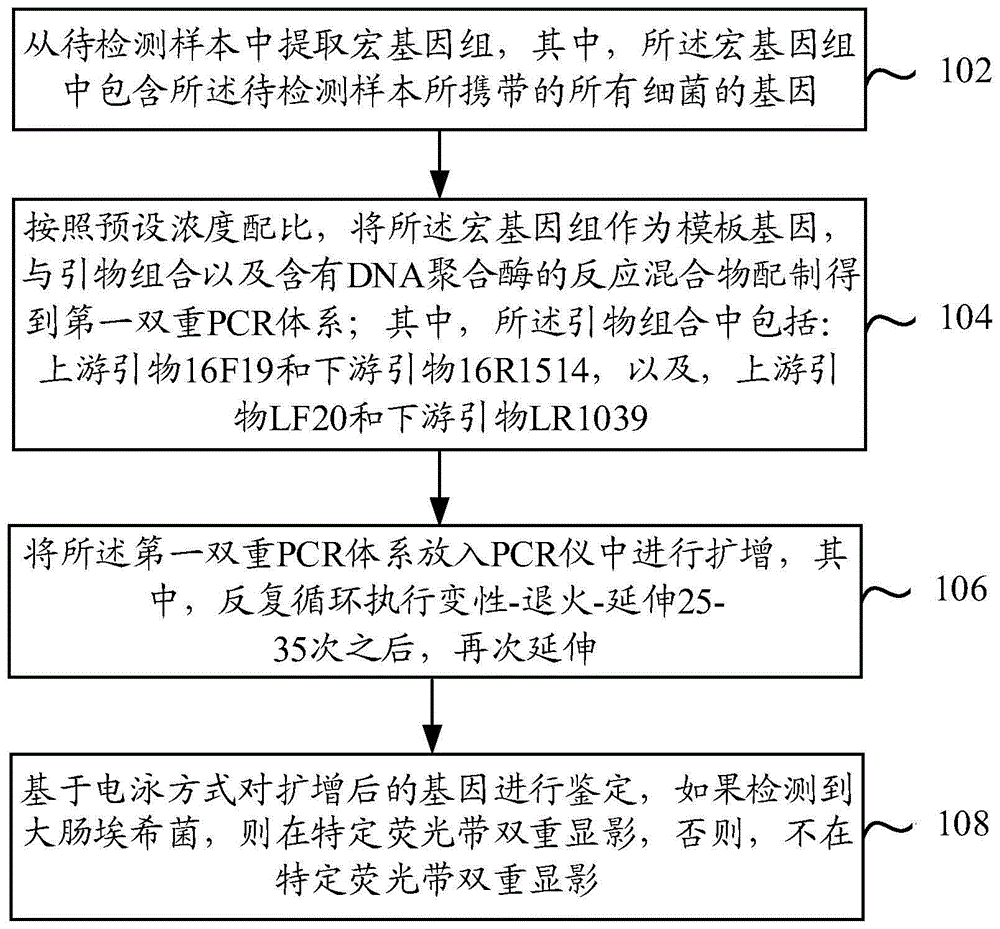
第二方面,提供了一种检测大肠埃希菌的方法,包括:
从待检测样本中提取宏基因组,其中,所述宏基因组中包含所述待检测样本所携带的所有细菌的基因;
按照预设浓度配比,将所述宏基因组作为模板基因,与引物组合以及反应原料混合物配制得到第一双重pcr体系;其中,所述引物组合中包括:上游引物16f19和下游引物16r1514,以及,上游引物lf20和下游引物lr1039;
将所述第一双重pcr体系放入pcr仪中进行扩增,其中,反复循环执行变性-退火-延伸25-35次之后,再次延伸;
基于电泳方式对扩增后的基因进行鉴定,如果检测到大肠埃希菌,则在特定荧光带双重显影,否则,不在特定荧光带双重显影。
本说明书实施例采用的上述至少一个技术方案能够达到以下有益效果:
1、同国标法相比,用时短,过滤法收集样本中的微生物约需要5分钟,煮沸提取基因组需要10分钟,配制pcr体系约需要10分钟,pcr循环约需要90分钟,电泳鉴定越需要30分钟,所以大约2.5小时便取得了鉴定结果;
2、同实时荧光定量pcr技术、基因芯片技术和流式细胞仪技术相比,成本低,就检验所使用的试剂或者耗材来说,每个样品需要一张直径50mm、孔径0.45μm的水系醋酸纤维滤膜,一个可重复使用的容积为15ml的离心管,一个pcr管,4种引物各0.5μl,2×taqpcrmastermix11μl以及0.2g琼脂糖等,成本较低;
3、灵敏性较高,最低检测浓度为40cfu/l;灵敏度和特异度相对较高,45个样本的同步检验结果证明,该方法与国标法相比,符合率为100%;
4、不需要大型或者精密仪器,可以开展分子生物学实验的实验室都可以做,仅需要普通的pcr仪,电泳仪,电泳槽,紫外线观察装置等常见仪器;
5、同抗原-抗体免疫反应同pcr结合的技术和环介导等温扩增法相比,步骤简单,易操作,易推广。
附图说明
为了更清楚地说明本说明书实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本说明书实施例中记载的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其他的附图。
图1为本说明书实施例提供的内容推荐方案的系统架构示意图;
图2为本说明书实施例提供的构建成功后的双重pcr体系对应的泳道显影结果示意图;
图3为本说明书实施例提供的检测大肠埃希菌的显影结果示意图;
图4为本说明书实施例提供的6种水样通过国标法在显微镜下观察的菌落示意图;
图5为本说明书实施例提供的饮用水水样通过本申请双重pcr检测大肠埃希菌时的显影结果示意图。
具体实施方式
为使本说明书实施例的目的、技术方案和优点更加清楚,下面将结合本说明书具体实施例及相应的附图对本说明书实施例的技术方案进行清楚、完整地描述。显然,所描述的实施例仅是本说明书一部分实施例,而不是全部的实施例。基于本说明书中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本说明书实施例保护的范围。
以下结合附图,详细说明本说明书各实施例提供的技术方案。
本说明书实施例提供了一种试剂盒,包括:用于构建检测大肠埃希菌的双重pcr反应体系的引物组合;其中,所述引物组合包括:基于大肠埃希菌中16srrna的同源序列设计并合成的上游引物16f19和下游引物16r1514,以及,基于大肠埃希菌k-12mg1655乳糖操纵子laci基因的同源序列设计并合成的上游引物lf20和下游引物lr1039。
进一步,所述试剂盒中各引物的浓度均为1mm;其中,上游引物16f19的体积为0.5μl,下游引物16r1514的体积为0.5μl,上游引物lf20的体积为0.5μl,下游引物lr1039的体积为0.5μl。
这样,在进行双重pcr检测时,不需要额外设计并合成引物组合,只需要从该试剂盒中采集引物组合即可方便快捷的构建所需的双重pcr反应体系。
参照图1所示,为本说明书实施例提供的一种利用双重pcr检测大肠埃希菌的方法,可以包括以下步骤:
步骤102:从待检测样本中提取宏基因组,其中,所述宏基因组中包含所述待检测样本所携带的所有细菌的基因。
所述待检测样本包括:饮用水,或,其它可携带细菌的食品。
可选地,步骤102在从待检测样本中提取宏基因组时,具体执行为:使用抽真空过滤泵装置,将待检测样本通过水系醋酸纤维滤膜过滤;将过滤后的滤膜置于装有超纯无菌水的离心管中浸没,煮沸后提取宏基因组。
步骤104:按照预设浓度配比,将所述宏基因组作为模板基因,与引物组合以及含有dna聚合酶的反应混合物配制得到第一双重pcr体系;其中,所述引物组合中包括:上游引物16f19和下游引物16r1514,以及,上游引物lf20和下游引物lr1039。
在本说明书实施例中,所述引物组合中,上游引物16f19和下游引物16r1514是基于根据genbank(美国国家生物技术信息中心)上大肠埃希菌16srrna(e-16sdna)的同源序列(genbank号j01859.1)设计并合成,上游引物lf20和下游引物lr1039是基于genbank上大肠埃希菌escherichiacolik-12mg1655乳糖操纵子laci基因(e-laci)的同源序列设计并合成。双重pcr,既保证特异性,又操作简单,避免复杂因素影响;使用16srdna作为控制指标,确保大肠埃希菌属不漏检,laci基因为本发明首次使用,该基因为大肠埃希菌特有基因,可以控制假阳性。各引物的引物序列参见以下表1。
表1
之后,按照已构建的e-16srdna和e-laci双重pcr方法,参照表2,配置第一双重pcr体系。
表2
应理解,本说明书中所述引物组合,可以是直接从上述所述的试剂盒中采集,从而,节省检测时间;或者,通过以下方式配置得到:
基于大肠埃希菌中16srrna的同源序列,设计并合成上游引物16f19和下游引物16r1514;基于大肠埃希菌k-12mg1655乳糖操纵子laci基因的同源序列,设计并合成上游引物lf20和下游引物lr1039;将各引物以浓度为1mm进行配置,其中,上游引物16f19的体积为0.5μl,下游引物16r1514的体积为0.5μl,上游引物lf20的体积为0.5μl,下游引物lr1039的体积为0.5μl。
步骤106:将所述第一双重pcr体系放入pcr仪中进行扩增,其中,反复循环执行变性-退火-延伸25-35次之后,再次延伸。
将配制好的pcr反应体系放入pcr仪(例如,biometra公司生产的pcr仪)中进行扩增,扩增条件均为94℃预变性30秒;94℃变性30秒,56℃退火30秒,72℃延伸1.5分钟,共25-35个循环;扩增循环结束后,再次以72℃延伸5-10分钟。
步骤108:基于电泳方式对扩增后的基因进行鉴定,如果检测到大肠埃希菌,则在特定荧光带双重显影,否则,不在特定荧光带双重显影。
所述特定荧光带通过以下方式确定为检测出大肠埃希菌的标记:
将作为阳性对照的大肠埃希菌和作为阴性对照的两种其它菌种中提取基因组;按照预设浓度配比,将所述基因组与所述引物组合以及含有dna聚合酶的反应混合物配制得到第二双重pcr体系;其中,所述引物组合中各引物的浓度均为1mm,上游引物16f19的体积为0.5μl,下游引物16r1514的体积为0.5μl,上游引物lf20的体积为0.5μl,下游引物lr1039的体积为0.5μl;所述基因组的体积为11μl;所述含有dna聚合酶的反应混合物的体积为12μl;将所述第二双重pcr体系放入pcr仪中进行扩增,其中,反复循环执行变性-退火-延伸25-35次之后,再次延伸;基于电泳方式对经pcr仪扩增后的基因进行鉴定,在特定荧光带显影,其中,所述特定荧光带在阳性对照下双重显影,在阴性对照下不双重显影。
其实,确定特定荧光带的操作应在检测之前实现,通过阳性对照以及阴性对照,找出大肠埃希菌所对应的荧光带显影位置,从而,便于后续检测判定样本是否携带大肠埃希菌。
在所述特定荧光带为1000bp和1500bp。如图2所示,其中泳道1-3分别是大肠埃希菌e-16srdnapcr结果(e-16)、e-lacipcr结果(e-l)、e-16srdna和e-laci的双重pcr结果(e-16l),泳道4-6分别是金黄色葡萄球菌的16srdnapcr结果(s-16)、lacipcr结果(s-l)、16srdna和laci的双重pcr结果(s-16l),泳道7-9分别是铜绿假单胞菌的16srdnapcr结果(p-16)、lacipcr结果(p-l)、16srdna和laci的双重pcr结果(p-16l)。
需要说明的时,用于双重pcr的基因均使用长片段,避免在琼脂糖凝胶电泳鉴定结果时引物间形成的聚合物干扰。
下面通过一个完整的流程对本说明书的检测方法进行详述。
应理解,在对待检测样本进行检测之前,需要先构建双重pcr方法体系。
-引物设计与合成
根据genbank(美国国家生物技术信息中心)上大肠埃希菌16srrna(e-16sdna)的同源序列(genbank号j01859.1)设计并合成上下游引物16f19和16r1514,再根据genbank上大肠埃希菌escherichiacolik-12mg1655乳糖操纵子laci基因(e-laci)的同源序列设计并合成上下游引物lf20和lr1039,两种同时用于检验大肠埃希菌,引物由博迈德公司合成,引物序列见表1。
-构建双重pcr方法体系
使用大肠埃希菌1.3344(escherichiacoli,购自中国微生物菌种保藏管理委员会中心)为阳性对照,金黄色葡萄球菌(staphylococcusaureus)和铜绿假单胞菌(pseudomonasaeruginosa)为阴性对照,建立e-16srdna和e-laci双重pcr方法。将过夜培养的三种细菌的培养液煮沸10分钟,6000rpm离心10分钟后取上清作为pcr的模板配制双重pcr体系,见表3。
表3
将配制好的pcr反应体系放入pcr仪(biometra公司)中进行扩增,扩增条件均为94℃预变性30秒;94℃变性30秒,56℃退火30秒,72℃延伸1.5分钟,共325-350个循环;72℃延伸5-10分钟。
1%琼脂糖凝胶电泳鉴定,电泳结果在紫外凝胶成像仪(biospectrum310,美国uvp公司)下观察。结果为阳性对照在1500bp(dna单位:碱基对)和1000bp左右出现两条特征性荧光条带,而阴性对照不会出现这两条特征条带,或者只出现一条,证明方法构建成功。
通过该方法体系的构建,一方面确定了引物组合,另一方面确定阳性对照下荧光带的位置,以便于后续检测观察。
-提取待检测样本中的宏基因组
将水样充分摇匀,取200ml通过水系醋酸纤维滤膜过滤,过滤使用抽真空过滤泵装置。用无菌镊子夹取滤膜边缘,将滤膜从过滤装置上取下。然后使用两把干净的无菌镊子使菌膜朝向内侧将滤膜对折两次,对折过程中注意镊子不要碰到菌膜,避免损失。
将对折好的滤膜置于装有2ml超纯无菌水的离心管中,离心管的容积为15ml,务必要将滤膜完全浸于水面下,煮沸10分钟,提取样本中的宏基因组备用(煮完后超纯水中即含有样本中微生物的宏基因组,不需要离心处理)。采用滤膜过滤收集待检微生物,解决了饮水中因为微生物含量低导致检验假阴性高的问题。同时,煮沸法收集宏基因组为pcr模板,省却了很多繁琐的步骤,同时也大量节约了时间,只需10分钟,而手工法提取基因组大约需要一个小时的时间。
-配置pcr反应体系、扩增
以提取的宏基因组作为模板基因,从上述试剂盒或是按照引物组合的合成方法确定的引物组合,并将聚合物反应原料混合物按照表2中的比例进行配置,之后,将配置好的pcr反应体系放入pcr仪中进行扩增,其中,扩增条件参照上述扩增方案。
-结果鉴定
结果为出现1500bp和1000bp两条特征性荧光条带为阳性,否则为阴性。
此外,本说明书还对提供的检测方法的灵敏度或准确度进行测定。具体采用以下方式:
挑取大肠埃希菌1.3344单菌落至营养肉汁液体培养基中,37℃,100rpm培养4-5小时;
离心弃上清液,2ml灭菌水洗涤两次;
再加入100ml灭菌水制备模拟水样并标记为“原液”,充分混匀后,十倍稀释九个梯度备用;将每个梯度的模拟水样充分摇匀后,分别取100μl涂布于营养肉汁琼脂平板上,37℃培养12h后计数菌落数并计算每毫升含有的大肠埃希菌细胞数;
使用滤膜法分别将每个稀释梯度的模拟水样过滤40ml,取滤膜于无菌离心管中,加入2ml无菌水,煮沸10分钟后取11μl溶液用于双重pcr,体系同表4,电泳观察扩增的条带亮度。取无明显条带浓度的上一梯度计算最低检测浓度,结果见图3。如图3所示,大肠埃希菌模拟水样经过10倍梯度稀释后,生长的菌落数量呈逐渐减少至最后一个稀释度(10-9)没有菌落生长,所以该方法检测的最低稀释度为10-8,对应的浓度为40cfu/l。
下面给出16srrna基因和laci基因双重pcr检测饮用水中大肠埃希菌的方案。
1、水样采集
采集娃哈哈、农夫山泉等22个品牌(1~2瓶/品牌),共计45个样品;其中,样品来源于市售瓶装饮用水、自来水和直饮水。市售瓶装饮用水购自超市,自来水和直饮水为就近取样,为非随机采样。
2、水样检测
每瓶水样分等体积两份分别过滤,使用本申请的滤膜法按照各瓶体积的大小过滤100-250ml,其中一个滤膜使用于本申请的双重pcr法;另一个滤膜置入亚硫酸钠品红平板用于国标法检测。
3、结果分析
将国标法和本申请的双重pcr法检测得到的结果整理成四格表,国标法作为“金标准”统计分析双重pcr法的灵敏度、特异度、符合率(一致率)及预测概率。
其中,数据使用excel2007软件进行数据录入整理,使用spss19.0软件进行统计分析。效果评价指标使用百分比和均数±标准
国标法在43个瓶装饮用水样中检出一个阳性水样,自来水样为阳性,直饮水样为阳性,见图4,其中a:阳性对照;b:阳性自来水样;c:阳性市售瓶装水样;d:阳性直饮水样;e:阴性市售瓶装水样;f:阴性对照
本申请的双重pcr法在瓶装饮用水中未检出,自来水样为阳性,直饮水样为阳性,见图5,其中1-39以及41-44为市售瓶装水样;40为自来水样;45为箱式直饮水样;46为阳性对照;47为阴性对照,m为marker2000。
4、本申请双重pcr法效果
双重pcr法和国标法均检出大肠埃希菌的水样有2份,均未检出大肠埃希菌的水样有42份。国标法检出率为6.7%,双重pcr法检出率为4.4%。双重pcr法的灵敏度为66.7%;特异度为100%;阳性预测值为100%;阴性预测值为97.67%;与国标法相比符合率为97.8%。
由此可知,本申请双重pcr检测法的灵敏度和特异度均较高,而且,检测实现简单、快速、准确;既可以节省成本又易于推广。
本说明书实施例中的各个实施例均采用递进的方式描述,各个实施例之间相同相似的部分互相参见即可,每个实施例重点说明的都是与其他实施例的不同之处。尤其,对于系统实施例而言,由于其基本相似于方法实施例,所以描述的比较简单,相关之处参见方法实施例的部分说明即可。
- 还没有人留言评论。精彩留言会获得点赞!