一种检测氟虫腈及其代谢物的胶体金试纸条及其制备方法与流程
本发明属于食品安全检测技术领域,具体涉及一种同时快速检测氟虫腈及其代谢物的胶体金试纸条及其制备方法。
背景技术:
氟虫腈,英文名称是芬普尼(fipronil),化学名称是(rs)-5-氨基-1-(2,6-二氯-4-三氟甲苯基)-4-三氟甲基亚磺酰基砒唑-3-腈,是在20世纪八十年代开发出的一种苯基吡唑类杀虫剂,是有机磷农药的替代物之一,由于其杀菌效果好且广谱性高,广泛应用在水果、蔬菜等农作物的害虫防治、家庭和娱乐场所的寄生虫和害虫的防控。氟虫腈是通过破坏害虫的γ-氨基丁酸(gaba)控制的氯离子通道,从而破坏其正常的神经中枢系统来控制害虫。相关研究表明氟虫腈具有慢性的神经毒性,已经被定为c类的致癌物质,氟虫腈可影响人体健康并导致结膜炎,头晕,癫痫发作,躁动,出汗等症状。氟虫腈在自然环境中通过光解,氧化,还原作用降解为更加具有毒性的氟甲腈、氟虫腈砜和氟虫腈亚砜代谢产物。氟甲腈的大鼠的ld50仅仅是其母体本身的1/6,其对大鼠的毒性远远大于其本身。氟虫腈砜对溞类的毒性约是为其母体本身的6倍,氟虫腈亚砜的生物累积性是氟虫腈母体的5倍。我国在2009年发布的1157号公告中规定了氟虫腈只限制于玉米等部分种子包衣中使用,在国标食品中农药残留限量(gb-2763-2016)中规定了氟虫腈及其代谢物在谷物、油料和油脂、蔬菜、水果、糖料和食用菌的残留限量范围是0.02~0.1mg/kg。
目前,氟虫腈的检测方法主要是仪器分析法,主要包括气相色谱-串联质谱联用(gc-ms),液相色谱-串联质谱联用(lc-ms/ms),高效液相色谱(hplc),高效液相二极管阵列检测法(hplc-dad),这些方法虽然灵敏度和准确度高,但是需要昂贵的仪器、专业操作人员、前处理复杂且耗时,因此,不适宜现场大量样本的快速筛选。免疫分析方法是基于抗原抗体的特异性反应的一种的检测方式。目前国内已授权或公告的关于氟虫腈的免疫分析检测法主要有:公开号为cn201710990416.6的一种检测氟虫腈的试剂盒及其制备方法和应用、公开号为cn201711059643.3的一种检测茶叶中氟虫腈的化学发光免疫检测试剂盒,以上两种发明均是elisa试剂盒的发明应用,检测过程需反复洗板且耗时长,结果因操作人员不同会有一定的差异性,结果需仪器进行读数,不适宜现场大量样本的快速筛选;公开号为cn201810005898.x的一种快速检测微量氟虫睛的表面增强拉曼金标试纸条及其制备方法,该发明的检测方法拉曼信号不稳定易出现假阳现象,检测结果需借助拉曼仪器的辅助,拉曼仪器昂贵,检测成本高;公开号为2018103135712.0的一种利用光照和表面增强拉曼快速检测氟虫腈的方法,该发明的方法是通过检测氟虫腈的主要光解产物氟甲腈来间接的检测氟虫腈的存在,增加了检测步骤和时间,结果准确度不高,拉曼仪器昂贵,成本升高;公开号为201810005478.1的一种快速检测微量氟虫腈的胶体金标试纸条及其制备方法,该发明的检测方法只针对氟虫腈本身,对更加具有毒性的氟虫腈代谢物的检测并没有涉及。氟虫腈在自然环境中极易被降解,该方法的准确度不高。
技术实现要素:
针对上述问题,本发明提供一种同时快速检测氟虫腈及其代谢物的胶体金试纸条及其制备方法,通过制备高灵敏度和高特异性的抗氟虫腈及其代谢物的单克隆抗体,而后在基于抗体之上建立速度快、成本低、灵敏度高且能同时检测氟虫腈及其代谢物胶体金试纸条,所述试纸条既能同时检测氟虫腈及其代谢物又无需仪器辅助,成本低、操作简单、适宜现场样本的快速筛选。
一种检测氟虫腈及其代谢物的胶体金试纸条制备方法,包括以下步骤:
半抗原的制备:将氟虫腈通过酸水解法并加入乙酸,引入羧基,制备得到半抗原;
免疫原和包被原的制备:将所述半抗原通过活化酯法偶联蛋白质分别制备免疫原和包被原;
单克隆抗体的制备:用所述免疫原制备单克隆抗体,用包被原通过ic-elisa检测单克隆抗体的灵敏度和特异性,得到抗氟虫腈及其代谢物的单克隆抗体;
金标抗体的制备:将所述单克隆抗体用胶体金标记制备得到金标抗体;
胶体金试纸条的制备:用氟虫腈偶联蛋白质的包被原在硝酸纤维素膜上制作检测线,以二抗在硝酸纤维素膜上制作质控线,然后组装成试纸条。
上述方案中,所述半抗原的制备具体为:
将氟虫腈溶于浓硫酸、乙酸和水中,加热回流,然后滴加氢氧化钠水溶液,直到ph达到碱性,加纯水溶解沉淀物,用正己烷洗涤水溶液,分液酸化水层溶液,直到ph到酸性,然后用乙酸乙酯萃取,合并有机相,用饱和的盐水洗涤,经无水硫酸钠干燥,减压蒸发,过硅胶柱,得到白色固体,即为半抗原。
上述方案中,所述浓硫酸的质量分数为98%;
所述氟虫腈、浓硫酸、乙酸、水用量比为300~500mg:1~4ml:1~3ml:1~2ml;
所述纯水和沉淀物的用量比为2~3ml:200~600mg。
上述方案中,所述免疫原和包被原的制备具体为:
半抗原的活化:将所述半抗原溶于二甲基甲酰胺dmf中,向其中加入n-羟基琥珀酰亚胺nhs和1-乙基碳二亚胺盐酸盐edc,并将混合物搅拌活化,得到已活化的半抗原;
免疫原的制备:将牛血清白蛋白bsa充分地溶解在碳酸盐缓冲液cbs中,得到bsa溶液,在磁力搅拌下将已活化的半抗原溶液逐滴地加到bsa溶液中,将混合物搅拌反应,得到免疫原,免疫原用磷酸盐缓冲pbs透析;
包被原的制备:将鸡卵清白蛋白ova充分地溶解在碳酸盐缓冲液cbs中,得到ova质溶液,在磁力搅拌下将已活化的半抗原溶液逐滴地加到ova溶液中,将混合物搅拌反应,得到包被原,包被原用磷酸盐缓冲pbs透析。
上述方案中,所述半抗原的活化过程中,所述半抗原、dmf、nhs和edc的用量比为2~4mg:0.5~1ml:1~4mg:2~7mg;所述搅拌活化时间为6~8h。
上述方案中,所述免疫原的制备过程中,所述bsa和cbs缓冲液的用量比为7~15mg:3~5ml;
所述包被原的制备过程中,所述ova和cbs缓冲液的用量比为5~10mg:2~5ml;
所述已活化的半抗原溶液中的半抗原与bsa溶液中的蛋白质的摩尔比,以及已活化的半抗原溶液中的半抗原与ova溶液中的蛋白质的摩尔比均为20:1~40:1;
所述搅拌反应的温度为4℃,搅拌反应的时间为12~18h;
所述pbs缓冲液透析时的温度为4℃,时间为36~78h。
上述方案中,所述金标抗体的制备具体为:
取纯水加热沸腾,在搅拌条件下加入氯金酸溶液,再加入柠檬酸三钠溶液,得到胶体金溶液;
取胶体金溶液,加入硼酸缓冲液,充分混匀之后逐滴加入所述单克隆抗体溶液反应,然后逐滴加入10%bsa封闭,得到混合溶液;
将所述混合溶液离心,弃去上清液,得到沉淀物,将所述沉淀物溶于重悬液中,得到金标抗体。
上述方案中,所述纯水、氯金酸溶液与柠檬酸三钠溶液的用量比500~900ml:1~2ml:1~3ml;
所述胶体金溶液、单克隆抗体溶液、硼酸缓冲液和10%bsa用量比是3~6ml:18~48μg:300~600μl:200~800μl;
所述沉淀物和重悬液的用量比为0.1~1mg:300~500μl。
上述方案中,所述胶体金试纸条的制备具体包括以下步骤:
将样品垫放进含有0.2%tween-20、1%蔗糖和1%bsa的0.01mph7.4pbs溶液中浸泡后烘干;
将0.5~1mg/ml包被原喷涂在硝酸纤维素膜上作为检测线,将0.2~0.6mg/ml二抗喷涂在硝酸纤维素膜上作为质控线;
将所述样品垫、硝酸纤维素膜、吸水垫和底板进行组装。
一种检测氟虫腈及其代谢物的胶体金试纸条,根据所述检测氟虫腈及其代谢物的胶体金试纸条的检测方法制备。
与现有技术相比,本发明的有益效果是:
1.本发明通过酸水解法加入乙酸引入羧基,增加反应速率,制备得到半抗原,而后通过活化酯法偶联蛋白质制备免疫原性较强的免疫原,制备出能够同时识别氟虫腈及其代谢物的单克隆抗体,且抗体的灵敏度较高。
2.本发明通过采用胶体金标记单克隆抗体制备的试纸条可同时检测氟虫腈及其毒性更强的代谢物,因此该方法在保障食品安全方面将更加具有意义和价值。
3.本发明制备的胶体金试纸条成本低、检测速度快、灵敏度高;该方法的检测结果可直接视觉判读,无需仪器的辅助,节省昂贵仪器的费用,且适宜现场大量样本的检测;直接将样本提取液与金标抗体孵育,插入试纸条,5min后即可判读检测结果;试验表明该检测方法灵敏度高。
4.本发明制备的胶体金试纸条操作简单、适用性广;检测方法简单易懂,无需专业人员操作,可适用于执法部门、养殖户、消费者等人群使用。另外,该方法能为消费者的生命安全提供一定保障。
附图说明
本发明的上述和/或附加的方面和优点从结合下面附图对实施例的描述中将变得明显和容易理解,其中:
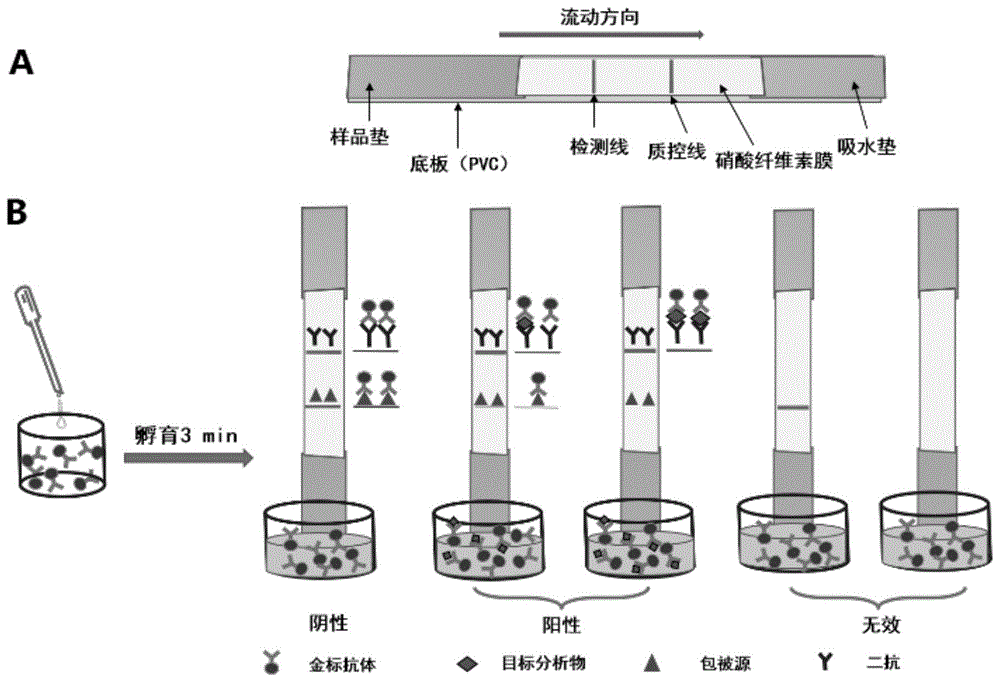
图1中图1a为本发明胶体金试纸条的结构示意图;图1b为胶体金试纸条原理图。
图2为胶体金紫外图;其中插图为胶体金的tem图。
图3为抗体间接竞争抑制曲线。
图4为胶体金试纸条检测氟虫腈及其代谢物残留的效果图。
具体实施方式
下面结合附图详细描述本发明的实施例,下面通过参考附图描述的实施例是示例性的,旨在用于解释本发明,而不能理解为对本发明的限制。
本发明所述检测氟虫腈及其代谢物的胶体金试纸条的制备方法,包括以下步骤:
(1)半抗原的制备:将适量的氟虫腈溶于浓硫酸、乙酸和水中,加热回流2~3h,然后滴加氢氧化钠水溶液,直到ph达到9~10,加纯水溶解沉淀物,用5~15ml正己烷洗涤水溶液,分液酸化水层溶液,直到ph到1,然后用乙酸乙酯萃取,合并有机相,用饱和的盐水洗涤,经无水硫酸钠干燥,减压蒸发。过硅胶柱,得到白色固体,即为半抗原;
所述浓硫酸的质量分数为98%;
所述氟虫腈、浓硫酸、乙酸、水用量比为300~500mg:1~4ml:1~3ml:1~2ml;
所述纯水和沉淀物的用量比为2~3ml:200~600mg。
(2)免疫原和包被原的制备:
半抗原的活化:将半抗原的制备步骤中得到的半抗原溶于二甲基甲酰胺dmf中,向其中加入n-羟基琥珀酰亚胺nhs和1-乙基碳二亚胺盐酸盐edc,并将混合物在室温下搅拌,得到已活化的半抗原;
免疫原的制备:将牛血清白蛋白bsa充分地溶解在碳酸盐缓冲液cbs中,得到bsa溶液,然后在磁力搅拌下将已活化的半抗原溶液逐滴地加到bsa溶液中,将混合物在一定温度条件下进行搅拌反应,得到免疫原;
包被原的制备:将鸡卵清白蛋白ova充分地溶解在碳酸盐缓冲液cbs中,得到ova质溶液,然后在磁力搅拌下将已活化的半抗原溶液逐滴地加到ova溶液中,将混合物在一定温度条件下进行搅拌反应,得到包被原;免疫原和包被原分别用磷酸盐缓冲pbs透析,并在透析过程中将透析液更换8次,透析结束后分装并于-20℃保存备用。
所述半抗原、dmf、nhs和edc的用量比为2~4mg:0.5~1ml:1~4mg:2~7mg;所述搅拌时间为6~8h;
所述免疫原的制备过程中,所述bsa和cbs缓冲液的用量比为7~15mg:3~5ml;
所述包被原的制备过程中,所述ova和cbs缓冲液的用量比为5~10mg:2~5ml;
所述已活化的半抗原溶液中的半抗原与bsa溶液中的蛋白质的摩尔比,以及已活化的半抗原溶液中的半抗原与ova溶液中的蛋白质的摩尔比均为20:1~40:1;
所述搅拌反应的温度为4℃,搅拌反应的时间为12~18h;
所述pbs缓冲液透析时的温度为4℃,时间为36~78h;
所述bsa、ova购自上海sigma-aldrich化学试剂公司,氟虫腈购自上海百灵威生物试剂有限公司。
(3)单克隆抗体的制备:将制备得到的免疫原用生理盐水稀释至1~2mg/ml,然后和等体积的弗氏完全佐剂混合后分乳化;通过背部皮下多点注射的方式给小鼠(balb/c)免疫,每只小鼠的免疫量是75~100μg;
之后每隔三周对小鼠进行加强免疫,将稀释至2mg/ml的免疫原和等体积的弗氏不完全佐剂充分乳化,通过背部皮下多点注射的方式给小鼠(balb/c)免疫,每只小鼠的免疫量是25~50μg。
从第三次免疫开始,对小鼠进行尾部采血检测;筛选出效价高和抑制率高的小鼠进行腹腔注射20μg的免疫原;注射三天后将该小鼠拉颈处死,浸泡在75%酒精中10min,在无菌的条件下取其脾脏细胞,将脾脏于铜网上充分的研磨,然后用prmi-1640培养基冲洗三遍,得到细胞悬液于1200r/min条件下离心10min;弃上清液,再用prmi-1640培养基重悬沉淀的细胞,进行离心,按照上述操作重复三次后对脾细胞进行计数;
按照小鼠脾细胞和骨髓瘤细胞10:1的比例将两者充分混匀,得到混合溶液于1200r/min条件下离心10min,振荡、使离心管底部是细胞分散开来,在第一分钟内缓慢的加入的peg4000,静置1min后加入的prmi-1640培养基以终止peg的作用;所述混合溶液、peg4000、prmi-1640培养基的用量比0.5ml:10ml。将融合的细胞静置放于37℃烘箱中培养15min,然后于3500r/min下离心10min。然后用含有10%胎牛血清的hat的完全培养基重悬细胞,混匀后加入到96孔板的中,并置于37℃、5%co2培养箱中进行培养。用包被原采用间接竞争ic-elisa法对上清液筛选,选择抑制率高、阳性强的细胞孔进行亚克隆,而后再进行扩大培养,进行2~3次亚克隆后,获得纯度高的阳性杂交瘤细胞株。
腹水的制备和纯化:将上述筛选的杂交瘤细胞用prmi-1640培养基稀释至每毫升的1×106细胞的杂交瘤细胞,每只小鼠注射按照500~800ul进行腹腔注射,小鼠腹部肿大,采集腹水于3500r/min离心10min,收集上清液进行正辛酸-硫酸铵纯化,得到单克隆抗体。
所述正辛酸-硫酸铵纯化的具体操作为:取抗血清1ml,用0.06mol/l、ph5.0的醋酸缓冲液稀释2倍,用1mol/lhcl溶液调ph至4.5;按照33μl/ml原始血清的比例,室温搅拌下逐滴缓慢加入正辛酸,4℃静置2h以上,使杂蛋白充分沉淀,于4℃、9000r/min离心30min,弃沉淀,收集上清液并用滤纸过滤,加入体积为上清液体积的1/10的0.1mol/l、ph7.4pbs,并将溶液ph调至7.4,按每毫升0.277g加入硫酸铵,搅拌均匀,4℃静置4h以上。而后于4℃、9000r/min离心30min,弃上清,收集沉淀,将沉淀溶于一定体积的pbs中,并在4℃条件下置于1l的pbs中透析以除盐,透析3~4天,每天更换3次透析液。
(4)金标抗体的制备:取500~900ml的超纯水于烧瓶中于102℃中加热沸腾平衡30~50min,于磁力搅拌下加入10%氯金酸溶液,10min后加入10%柠檬酸三钠溶液,继续搅拌直至溶液颜色变成深红色且不变色,得到胶体金溶液,冷却至室温于阴暗处保存备用。取3~6ml的胶体金溶液,加入ph8.5的硼酸缓冲液,充分混匀之后逐滴加入制备的单克隆抗体溶液反应30~60min。然后向上述溶液中逐滴加入10%bsa来封闭没有结合的位点,且室温下孵育0.5~1h。将该混合溶液于4℃,10000r/min下离心25min以除去没有结合的抗体和金纳米粒子,弃去上清液,将沉淀物溶于重悬液,重悬液含2%bsa、1%蔗糖、0.02%叠氮化钠的pbs溶液中,并于4℃下保存备用。将上述制备的金标抗体稀释20~50倍,取50μl于96孔板中进行冷冻干燥备用。将二抗和制备的包被原分别用喷膜仪喷涂在硝酸纤维素膜上作为质控线(c线)和检测线(t线),并于37℃烘箱过夜备用。
所述纯水、氯金酸溶液与柠檬酸三钠溶液的用量比500~900ml:1~2ml:1~3ml;
所述胶体金溶液、单克隆抗体、硼酸缓冲液和10%bsa用量比是3~6ml:18~48μg:300~600μl:200~800μl;
所述沉淀物和重悬液的用量比为0.1~1mg:300~500μl;
所述二抗为hrp-羊抗鼠igg购自于上海生工生物工程有限公司。
(5)胶体金试纸条的制备:用氟虫腈偶联蛋白质的包被原在硝酸纤维素膜上制作检测线,以二抗在硝酸纤维素膜上制作质控线,然后组装成试纸条。具体的,该试纸条包括样品垫、硝酸纤维素膜(nc膜)、吸水垫和底板,将nc膜贴在底板的中间,吸水垫和样品垫分别贴在底板的上下两边,与nc膜重叠2~3mm。用喷膜仪分别将0.3~1mg/ml的二抗和0.5~1mg/ml所述包被源喷在nc膜上作为c线和t线,然后用切条机将其切成3.8~4mm长的试纸条,放入自封袋于干燥箱中保存备用。
氟虫腈及其代谢物的检测:将样本提取液与所述金标抗体孵育,插入所述试纸条进行检测。
实施例1
如图1a所示,本发明的能同时检测氟虫腈及其代谢物的胶体金试纸条,是以底板(pvc)为支撑,两者的中间部分是硝酸纤维素膜,且该膜上有质控线和检测线,左边的样品垫和右边的吸水垫分别与硝酸纤维素膜搭接。质控线上喷涂的是辣根过氧化物酶标记的二抗,检测线上喷涂的是合成的包被原。96孔板中的是胶体金标记氟虫腈单克隆抗体的偶联物。
所述的试纸条中的样品垫的材料的主要成分是玻璃纤维膜,底板是聚氯乙烯材料。样品垫最左边有一层箭头朝下的贴纸,以指示试纸条插进样本提取液的方向。
实施例2
要制备能同时快速检测氟虫腈及其代谢物的胶体金试纸条,首先要制备免疫原性强的免疫原和抗氟虫腈及其代谢物的单克隆抗体,然后进行试纸条组装和制备。具体操作步骤如下:
(1)半抗原的制备:采用酸水解法将氟虫腈上的氰基水解为羧基。称取437mg、1mmol的氟虫腈,加入2.5ml乙酸和1.25ml、98%的浓硫酸、1.5ml水,充分混合均匀后将混合物加热回流3h。而后冷却至室温,在0℃的条件下缓慢地逐滴加入1m氢氧化钠溶液,将该溶液的ph调至10后,加入3ml水溶解沉淀物,用10ml正己烷洗涤该水溶液。分液后收集水层溶液,用1m盐酸溶液酸化,直到ph达到1,然后用3×15ml乙酸乙酯萃取。合并所有的有机相,用15ml饱和盐水洗涤,经无水硫酸钠干燥,减压蒸发去除有机溶剂。最后过硅胶柱,得到白色固体。
(2)免疫原和包被原的制备:将3mg半抗原溶于1mldmf中,向其中加入2.2mgnhs和4mgedc,并将混合物在室温下搅拌6h。将14mgbsa和10mgova分别充分地溶解在5mlcbs缓冲液中,然后在磁力搅拌下将已活化的半抗原溶液分别逐滴地加到bsa溶液和ova溶液中。将混合物在4℃下搅拌反应12h,得到免疫原和包被原,将免疫原和包被原分别在4℃下用pbs缓冲液透析72小时,并在透析过程中将透析液更换8次,透析结束后分装保存于-20℃保存备用。
(3)单克隆抗体的制备:小鼠的第一次免疫(首免)是将制备好的免疫原用生理盐水稀释至2mg/ml,然后和等体积的弗氏完全佐剂混合,用乳化器充分乳化。而后以背部皮下多点注射的方式给balb/c小鼠免疫,每只小鼠的免疫量是100μg。之后每隔三周对小鼠进行加强免疫,将稀释至2mg/ml的免疫原和等体积的弗氏不完全佐剂充分乳化,采用与首免相同的方式进行免疫,每只小鼠的免疫量是50μg。从第三次免疫开始,对小鼠进行尾部采血检测。筛选出效价高和抑制率高的小鼠进行冲免即腹腔注射20μg的免疫原。三天后将该小鼠拉颈处死,浸泡在75%酒精中10min,在无菌的条件下取其脾脏细胞,用注射器芯将脾脏于铜网上充分的研磨,然后用prmi-1640培养基冲洗三遍,将细胞悬液与50ml离心管中1200r/min,离心10min。弃上清液,用prmi-1640培养基重悬沉淀的细胞,按照上述操作重复三次后对脾细胞进行计数。按照小鼠脾细胞和骨髓瘤细胞10:1的比例将两者充分的混匀后于50ml离心管中1200r/min,离心10min,轻轻地弹离心管底部是细胞分散开来,在第一分钟内缓慢的加入1ml的peg4000,静置1min后加入10ml的prmi-1640培养基以终止peg的作用。将融合的细胞静置放于37℃烘箱中15min,然后于800r/min下离心10min。然后用含有15%胎牛血清的hat的完全培养基重悬细胞,混匀后加入到96孔板的中,并置于37℃、5%的co2培养箱中进行培养。用间接竞争elisa法对上清液筛选,选择抑制率高、阳性强的细胞孔进行亚克隆,而后进行扩大培养,需进行2~3次亚克隆以获得纯度高的阳性杂交瘤细胞株。
腹水的制备和纯化:将上述筛选的杂交瘤细胞用prmi-1640培养基稀释至每毫升的1×106细胞的杂交瘤细胞,每只小鼠注射按照800ul进行腹腔注射,小鼠腹部肿大,用5ml的注射器采集腹水于3500r/min离心10min,收集上清液进行正辛酸-硫酸铵纯化。取抗血清1ml,用0.06mol/l、ph5.0的醋酸缓冲液稀释2倍,用1mol/lhcl溶液调ph至4.5;按照33μl/ml原始血清的比例,室温搅拌下逐滴缓慢加入正辛酸,4℃静置2h以上,使杂蛋白充分沉淀,于4℃、9000r/min离心30min,弃沉淀,收集上清液并用滤纸过滤,加入体积为上清液体积的1/10的0.1mol/l、ph7.4的pbs,并将溶液ph调至7.4,按每毫升0.277g加入硫酸铵,搅拌均匀,4℃静置4h以上。而后于4℃、9000r/min离心30min,弃上清,收集沉淀,将沉淀溶于一定体积的pbs中,并在4℃条件下置于1l的pbs中透析除盐,透析3~4天,每天更换3次透析液。
(4)抗体灵敏度和交叉率的测定:将浓度分别为0、0.1、0.3、0.9、2.7、8.1ng/ml的氟虫腈,浓度分别为0、0.05、0.15、0.45、1.35、4.05ng/ml的氟甲腈,浓度分别为0、0.1、0.3、0.9、2.7、8.1ng/ml的氟虫腈砜,浓度分别为0、0.1、0.3、0.9、2.7、8.1ng/ml的氟虫腈亚砜,用ic-elisa方法测其半数抑制浓度(ic50),而后计算抗体交叉率。交叉率的计算公式如下:交叉率(%)=(氟虫腈ic50/类似物ic50)×100%。结果如表1和图3所示,氟虫腈抗体的ic50是0.44ng/ml,对氟虫腈亚砜、氟虫腈砜、氟甲腈的交叉率分别是69.84、75.86、112.82%。本发明制备的氟虫腈抗体的灵敏度比developmentofanenzymeimmunoassayfordetectionoffipronilinenvironmentalsamples和poly-andmonoclonalantibody-basedelisasforfipronil中抗体的灵敏度分别提高了700和14倍,且以上两篇文章中制备的抗体仅识别氟虫腈本身。综上说明本发明制备的抗体是同时识别氟虫腈及其三种代谢物,且灵敏度较高。
表1抗体交叉率的测定
(5)金标抗体的制备:取800ml的超纯水于烧瓶中于102℃中加热沸腾平衡30min,于磁力搅拌下加入1.6ml的10%氯金酸溶液,10min后加入2.08ml10%柠檬酸三钠溶液,继续搅拌直至溶液颜色变成深红色且不变色。冷却至室温保存备用。如图2所示,胶体金制备成功,胶体金颗粒大小均匀,计算其粒径大小为15nm左右,分散性较好,无聚集现象。取3ml的胶体金溶液,加入300μl的ph8.5的硼酸缓冲液,充分混匀之后逐滴加入18μg抗体溶液反应1h。然后向上述溶液中逐滴加入300μl10%bsa来封闭没有结合的位点来减少试验中的非特异性的吸附,且室温下孵育0.5h。将液于4℃,10000r/min下离心25min以除去未结合的抗体和胶体金,弃去上清液,将沉淀物溶于200μl重悬液中,所述重悬液为含2%bsa、1%蔗糖、0.02%叠氮化钠的pbs溶液,该重悬液有利于对金标抗体的保护,而后4℃下保存备用。将上述制备的金标抗体稀释20倍,取50μl于96孔板中进行冷冻干燥备用。
(6)试纸条的制备:将0.8mg/ml包被原和0.4mg/ml二抗分别用喷膜仪喷涂在nc膜上作为t线和c线,并于37℃烘箱过夜备用而后按照图1a所示试纸条的结构进行组装。组装前将样品垫于0.2%tween-20,1%蔗糖、1%bsa的0.01m、ph7.4的pbs溶液中浸泡30min后37℃烘干,该溶液有利于金标抗体向上爬升和与t线的包被原和c线的二抗结合。本发明的检测方法的规则:如图1b所示:取150μl的样本提取液加入至已冻干的金标抗体中,混合均匀后于室温下孵育3min,将试纸条插入孔中,五分钟后视觉判读检测结果,有利于待测物、金标抗体、包被源、二抗的充分结合,提高检测方法的灵敏度。根据毛细管作用,混合物向上爬升的时会由于抗原抗体特异性反应被c线的二抗和t线的包被原捕获而显色。若t线和c线颜色深度一致,则该样品中无待测物即为阴性结果。若t线的颜色深度比c线浅或者t线没有颜色,则该样品中含待测物即为阳性结果。若c线没有颜色,则表明该试纸条为失效产品。
(7)试纸条检测限测定:取5g混合均匀的鸡蛋置于50ml离心管中,添加不同浓度的氟虫腈及其代谢物的标准品,氟虫腈、氟虫腈砜、氟虫腈亚砜均为:0、5、10、20ng/g;氟甲腈为:0、2.5、5、10ng/g,加入3g的中性氧化铝和5ml乙腈,然后剧烈震荡5min,在室温下以4000r/min离心3min,弃去沉淀物收集上清液。取1ml的上清液于2ml的离心管中,于60℃氮吹至有机试剂完全蒸发。将残留物重新溶解于1ml正己烷,再加入1ml的0.01mpbs,在4000r/min离心3min,收集下层溶液。检测限定义为检测限定义为与阴性对照相比,t线颜色比c线浅的最低浓度。检测结果如图4所示:氟虫腈,氟虫腈亚砜、氟虫腈砜、氟甲腈的检测限分别是10、10、10、5ng/g。
图3为抗体间接竞争抑制曲线,氟虫腈抗体的ic50是0.44ng/ml,对氟虫腈亚砜、氟虫腈砜、氟甲腈的交叉率分别是69.84、75.86、112.82%。说明本发明制备的抗体是能同时识别氟虫腈及其代谢物的单克隆抗体,且灵敏度较高。为制备能同时检测氟虫腈及其代谢物的胶体金试纸条提供强有力的条件。
直接将样本提取液与金标抗体孵育3min,插入试纸条,5min后即可判读检测结果;试验表明该检测方法灵敏度高,氟虫腈、氟虫腈砜、氟虫腈亚砜、氟甲腈的检测限分别为10、10、10、5ng/g。
图4为胶体金试纸条检测氟虫腈及其代谢物残留的效果图。其中a、b、c为分别为氟虫腈、氟虫腈砜、氟虫腈亚砜,三者浓度梯度皆为0、5、10、20ng/g;d为氟甲腈,浓度梯度为0、2.5、5、10ng/g。图中试纸条检测结果表明氟虫腈,氟虫腈亚砜、氟虫腈砜、氟甲腈的检测限分别是10、10、10、5ng/g。
上文所列出的一系列的详细说明仅仅是针对本发明的可行性实施例的具体说明,它们并非用以限制本发明的保护范围,凡未脱离本发明技艺精神所作的等效实施例或变更均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!