一种高效快速检测及定量血清或血浆核酸的试剂盒及方法与流程
本发明涉及生物医学临床分子诊断和动物防疫分子诊断,提供一种试剂盒及其方法,高效快速检测及定量人及动物血清(或血浆)中特定的病原微生物及其他特定的游离核酸分子。
技术背景
很多病原微生物的筛查和诊断,是通过检测血清或者血浆中的病原微生物,比如人类血筛的dna病毒主要为hav、hbv、hcv、hiv、梅毒螺旋体菌、eb病毒、cmv、新生儿肠道dna病毒等。在动物防疫方面,比如asfv、pdcov、高致病性猪蓝耳病病毒、猪伪狂犬病毒等,都可以对血清或血浆进行检测及定量。传统的免疫学和微生物等方法检测各种病原微生物,其缺点是灵敏度低、窗口期长。目前核酸分子检测技术得到了很好的发展,其灵敏度高、特异性好、能定量,而且极大的缩短了检测的窗口期。当前常用的荧光定量pcr技术,是先将样品中的核酸提取出来,再对提取出来的核酸进行检测及诊断。但是核酸提取过程复杂、耗时长,且容易产生污染,而且需要消耗大量试剂及其它耗材。
通常,荧光定量pcr检测dna、rna所用的模板是纯化好的核酸,核酸从复杂样品中纯化出来需要经过繁琐的操作,从而将核酸从杂质中释放、纯化出来,避免杂质随核酸进入pcr体系进而抑制pcr。不同的样品类型,杂质类型的复杂程度及含量都不同。常见的杂质有胆酸盐、复杂多糖、胶原质、血红素、血色素、各种离子、蛋白质类、脂类等,这些杂质对pcr产生严重的抑制,需要经过繁琐的操作步骤将杂质去除。核酸的提取过程,一般需要经过:裂解样品释放核酸→核酸沉淀出来或释放的核酸被固体介质吸附→吸弃杂质→洗涤液洗涤,吸弃洗涤液(多次操作)→洗脱液从介质上洗脱核酸,最终才能得到纯度比较高的核酸,该过程涉及液体的多次转移,操作复杂,耗时长,易产生污染,效率低下,且需要大量试剂及其它耗材。其中核酸释放剂和反应液是影响核酸定量和快速检测结果的主要因素。
核酸的纯化原理无外乎是裂解试剂裂解样品释放出核酸,然后加入有机溶剂使核酸沉淀出来或者吸附于固体介质,再吸弃上清液(废液),再多次用洗涤液洗涤核酸,最后用溶解液溶解沉淀的核酸或将核酸从固体介质上洗脱下来。目前市场上,核酸纯化试剂盒从纯化方式上大体可以分为三类:离心沉淀抽提、纯化柱法、磁珠法,纯化柱法、磁珠法的核酸提取试剂盒使用的比较广泛,因为柱提、磁珠法可以获得纯度比较高的核酸。但不管是纯化柱法还是磁珠法,其过程涉及液体的多次转移,操作复杂,耗时长,易产生污染,效率低下,且需要大量试剂及其它耗材。
荧光定量pcr技术中最关键的就是要预防核酸的污染,避免出现假阳性结果,特别是要防止扩增产物对pcr的污染。由于pcr有着高效的扩增效率,其扩增产物的浓度是初始浓度的几百万倍,一个气溶胶颗粒可含48000拷贝。由于uv照射对500bp以下的dna片段的去污效果不好,而分子诊断扩增的片段在200bp左右,uv照射不能有效清除分子诊断扩增带来的污染问题。
目前市场上,有很多核酸检测试剂盒,而且很多已经应用于医学临床诊断、防疫、食品安全领域。而目前市场上的核酸检测试剂盒绝大部分是需要经过复杂的核酸提取纯化过程,然后再进行pcr检测。针对目前核酸检测试剂盒的诸多缺陷,急需改进核酸检测技术,研发一款操作简单、污染可能性低、耗时短、效率高、灵敏度高、试剂及其耗材消耗量少的检测试剂盒。
技术实现要素:
本发明的目的在于提供一种高效快速检测及定量血清或血浆核酸的试剂盒及其检测方法。
本发明的高效快速检测及定量血清或血浆核酸的试剂盒,包括核酸释放剂、反应液、对照品、标准品、内标,
当模板为dna时,所述的核酸释放剂由300mm~600mm的koh、质量浓度为0.06%~0.1%的十二烷基硫酸锂或十二烷基硫酸钠、体积百分浓度为0.05%~2%的吐温20组成,溶剂为无核酶的去离子水;
当模板为rna时,所述的核酸释放剂由200mm~400mm的koh、质量浓度为0.06%~0.1%的十二烷基硫酸锂或十二烷基硫酸钠、体积百分浓度为0.05%~2%的吐温20组成,溶剂为无核酸酶的去离子水。
进一步,所述反应液由5mm~30mm的kcl、1mm~7mm的mgcl2、0.1mm~3mm的edta-2na、5mm~100mm的tris-乙酸或tris-hcl、5mm~20mm的(nh4)2so4、质量浓度为0.01%~0.04%的bsa、体积百分浓度为2%~8%的甘油、0.1m~1.4m的甜菜碱、质量浓度为5%~15%的海藻糖、50nm~500nm的上下游引物、50nm~400nm的探针、0~400nm的内标探针、0.1mm~2.5mm的dntps、混合酶、质量浓度为0.02%~0.05%的proclin300组成,ph7.0~8.5,溶剂为无核酸酶的去离子水。
进一步,当模板为dna时,所述的混合酶由终浓度为1~7u/50μl抗体酶、0.5~2.5u/50μlung酶、1~7u/50μltaq酶组成;
进一步,当模板为rna时,所述的混合酶由终浓度为5~200u/50μl逆转酶、1~7u/50μl抗体酶、0.5~2.5u/50μlung酶、1~7u/50μltaq酶组成。
进一步,所述的dntps组成的浓度比例为:
datp:dgtp:dctp:dttp:dutp=1:1:1:1:2。
进一步,所述的上下游引物、探针,其核酸序列是根据与试剂盒检测项目一致的病原微生物的核酸序列而设计的特异性序列。所述的内标探针是根据内标序列设计的特异性探针。其中,探针、内标探针分别标记cy5、rox、joe、fam、hex、tet、tamra中的一种荧光。
本发明提供的高效快速检测及定量血清或血浆核酸的试剂盒在病原微生物检测中的应用,包括但不限于肝炎病毒。
本发明还提供了一种高效快速检测及定量血清或血浆中肝炎病毒核酸的方法,包括如下步骤:
1)分别吸取微量权利要求1所述核酸释放剂加入到数个pcr反应管中,再分别吸取微量待测样本、阴性对照、阳性对照加入到相应pcr反应管中,用移液器反复吹打5-7次,室温静置2-5分钟;所述核酸释放剂与待测样本的体积比为1:1~4;
2)向pcr管中加入40μl上述反应液,或1μl内标及39μl上述反应液,混匀、离心,最后于荧光定量pcr仪上,选择fam荧光通道,设置扩增程序进行反应。
进一步,当检测及定量肝炎病毒为乙肝病毒hbv时,所述扩增程序包括:
1)ung酶反应,50℃,2分钟,循环1次;
2)taq酶激活及dna预变性,95℃,5分钟,循环1次;
3)变性,95℃,10秒,退火、延伸、荧光信号采集,55℃,40秒,循环45次;
当检测及定量肝炎病毒为丙肝病毒hcv时,所述扩增程序包括:1)逆转录,
50℃,15分钟,循环1次;
2)taq酶激活及dna预变性,95℃,5分钟,循环1次;
3)变性,95℃,10秒,退火、延伸、荧光信号采集,55℃,40秒,循环45次。
本发明提供的高效快速检测及定量血清或血浆核酸的试剂盒用于检测的样本可以是人或动物的血清、血浆。
本发明的有益效果如下:
1、一步操作,简单快捷,无污染,结果准确:本发明的高效快速检测及定量血清或血浆核酸的试剂盒,其中的核酸释放剂能够高效快速释放血清(或血浆)中各种形态的核酸,然后直接加入所述的pcr反应液即可进行检测。配方简单,对核酸扩增无污染影响,检测结果准确。
2、本发明的核酸释放剂的特点如下:本发明的核酸释放剂不含有nac、tritonx-100等会影响核酸释放或抑制后续pcr扩增的组分,因此具有如下特点:(1)强碱性环境更彻底地破坏样品中的蛋白质、脂质等组分,将样品中的核酸更充分释放出来,且速度快,2分钟即可将核酸从样品释放出来,而且还能使样品中的rna酶、dna酶失去活性,保护核酸不被rna酶/dna酶降解;(2)强碱性环境可以破坏其他很多种类的高浓度抑制物(如脂质、胶原质等),以降低抑制物对酶的抑制作用。比如,某些高血脂症患者,血清中血脂过高,使血浆呈乳白色或混浊状,与本发明类似的发明中的表面活性剂由于血脂浓度过高(表面活性剂浓度太高会抑制逆转录、聚合酶等的活性,浓度太低又无法较好地消除高浓度抑制物对扩增的抑制作用和较好地释放出样品中的核酸),无法将样品中的核酸彻底释放外,还会影响下游的逆转酶、聚合酶等的活性,而本发明的核酸释放剂凭借其强碱性不仅能有效地消除高血脂带来的抑制作用,也能将样品的核酸彻底释放出来;(3)重金属离子可以使酶不可逆性失活,若是样品中存在重金属离子而不除去,将影响逆转录、dna聚合酶的活性,在强碱性溶液中,重金属离子与-oh会形成氢氧化物沉淀,从而消除重金属离子对酶的失活或抑制作用;(4)本发明的核酸释放剂在化学组分构成上简单,不含有生物活性成分,如莎梵婷(表面活性多肽)、蛋白酶k等活性成分,且也不含有化学性质不稳定的成分,如甲酰胺、n-乙酰半胱氨酸等,存储条件简单;(5)该核酸释放剂在释放核酸之后进入所述的pcr反应液中,对pcr反应液中的酶没有抑制作用,不会抑制pcr反应;(6)该核酸释放剂在室温条件下(18℃~30℃)即可将样品中的核酸释放出来,无需加热,方便简单;(7)该核酸释放剂进入反应液中并无影响,因此可将释放了核酸的样品直接加入上述反应液进行pcr检测,极大的简化了操作,提高了检测效率;(8)与需要单独提取核酸的检测试剂盒相比,本发明的检测试剂盒环保,且成本也大大降低,该核酸释放剂的消耗量小,且由于不用涉及液体的多次转移,移液枪头的消耗量极大地减少,进而也大大降低试剂盒的耗材成本;(9)由于从核酸释放剂释放样品中的核酸到加入反应液进行pcr检测,无需加热,产生的气泡量很少,并且不用过多的液体转移,出现污染的可能性大大降低。(10)目前的“纯化柱”和“磁珠纯化”法,核酸得率都不高,得率仅有2%-4%,大量核酸被丢失,而本发明的方法建立了ung酶防污染体系,降低了交叉污染的可能性,且不涉及核酸的纯化,避免了在核酸纯化过程中核酸的大量损失,因此检测的灵敏度、结果的精准度高,本发明针对hbv检测下限达到30iu/ml。
3、本发明的反应液的特点:本发明的反应液对本反应液中具有生物活性的组分(如逆转录酶、ung酶、taq酶等)具有强大的保护作用,无需将反应液中具有生物活性的组分分离单独保存,可以直接使用,无需配制,避免了其他类似发明在检测过程中需要配制反应液的过程。比如,其他类似发明中,核酸扩增过程中所需要的酶(如逆转录酶、ung酶、taq酶)是以酶混液的形式单独保存在酶保存液中,没有提前将酶添加到pcrbuffer中,这就需要在检测时将酶添加到pcrbuffer配制成反应液,本发明的反应液更进一步简化了检测流程。本发明的反应液既能有效抑菌,又不影响大多数酶的活性。本发明的反应液能大幅度提高逆转录酶、dna聚合酶的热稳定性和对抑制物的耐受性。本发明的反应液中k+对逆转录酶、dna聚合酶起到促进作用,而非抑制作用。本发明的反应液中的mg2+浓度,既能促进dna聚合酶高效扩增,又不会出现非特异扩增。本发明的反应液的冻融稳定性、储存稳定性进一步提升。本发明的反应液既能消除少量重金属离子,又不会影响核酸扩增过程。本发明的反应液既能防止酶分解和减少酶的非特异性吸附,又不会对逆转录、dna聚合酶产生抑制作用。
4、既能检测dna,也能检测rna:本发明不仅能保护dna聚合酶实现扩增过程,也能保护逆转录酶实现逆转录过程。因此,本发明不仅能检测dna,也能检测rna。
5、普适性好,复杂模版也能扩增:本发明的试剂盒对不同复杂程度的核酸更具普适性,轻松地解决了大多数复杂模板(如具有gc-rich、发卡结构等)扩增困难的问题。
附图说明
图1为核酸释放剂中添加nac的对比实验pcr荧光扩增曲线图;
图2为核酸释放剂中添加不同浓度的lls的pcr荧光扩增曲线图;
图3为核酸释放剂中添加不同浓度的koh(模板为dna)的pcr荧光扩增曲线图;
图4为核酸释放剂中添加不同浓度的koh(模板为rna)的pcr荧光扩增曲线图;
图5为反应液中添加甜菜碱的对比实验pcr荧光扩增曲线图;
图6为反应液中添加不同浓度的海藻糖的pcr荧光扩增曲线图;
图7为反应液中添加不同浓度的kcl的pcr荧光扩增曲线图;
图8为反应液中添加不同浓度的mgcl2的pcr荧光扩增曲线图;
图9为反应液中添加不同浓度甘油的pcr荧光扩增曲线图;
图10为反应液中添加不同浓度bsa的pcr荧光扩增曲线图;
图11为反应液冻存稳定性测试的pcr荧光扩增曲线图;
图12本发明对hbv阴阳性血清检测的pcr荧光扩增曲线图;
图13本发明对hbv阴阳性血清检测结果的线性关系图;
图14本发明对hbv特异性检测的pcr荧光扩增曲线图;
图15本发明对hbv灵敏度检测的pcr荧光扩增曲线图;
图16本发明对hcv阴阳性血清检测的pcr荧光扩增曲线图。
具体实施方式
以下结合实施例对本发明作进一步说明。
以下实施例中,若是使用hbvdna阳性血清进行测试,本发明的反应液中添加的引物、探针则是根据hbv核酸序列设计的引物及探针,hbv引物、探针序列如下:
hbv上游引物:tgcccctatcttatcaacacttcc;
hbv下游引物:attgagattcccgagattgagac;
hbv探针:aagaagaactccctcgcctcgcaga,其中探针标记fam荧光基团。
以下实施例中,若是使用hcvrna阳性血清进行测试,本发明的反应液中添加的引物、探针则是根据hcv核酸序列设计的引物及探针,hcv引物、探针序列如下:
hcv上游引物:catggcgttagtatgagtgtcgt;
hcv下游引物:ggcaattccggtgtactcacc;
hcv探针:agagccatagtggtctgcggaaccg,其中探针标记fam荧光基团。
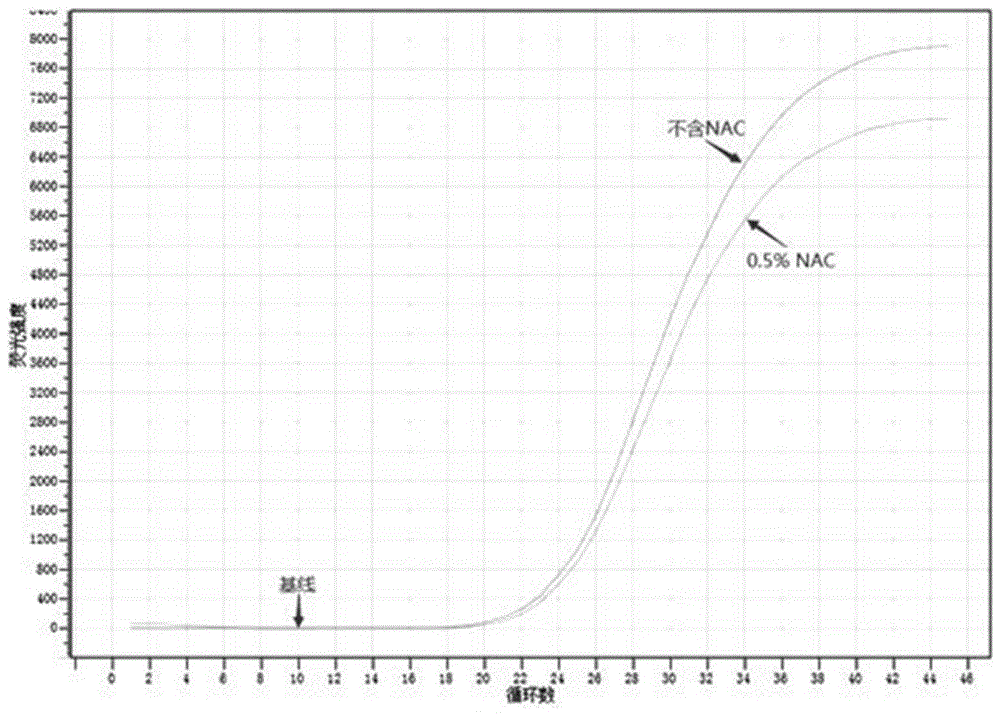
实施例1核酸释放剂中添加n-乙酰胱氨酸(nac)的评价
(1)配制核酸释放剂a(不含nac):由600mm的koh、0.06%(w/v)的lls、2%(v/v)的吐温20组成,溶剂为无核酸酶的去离子水。
(2)配制核酸释放剂b(含0.5%nac):由600mm的koh、0.06%~0.1%(w/v)的lls、0.05%~2%(v/v)的吐温20、0.5%的nac组成,溶剂为无核酸酶的去离子水。
(3)配制反应液:所述反应液配方如下:10mm的kcl、5mm的mgcl2、2mm的edta-2na、25mm的tris-乙酸、10mm的(nh4)2so4、质量浓度为0.02%的bsa、体积百分浓度为8%的甘油、1m的甜菜碱、质量浓度为12%的海藻糖、300nm的上下游引物、300nm的探针、1.5mm的dntps、混合酶、质量浓度为0.03%的proclin300组成,ph8.0,溶剂为无核酸酶的去离子水。所述的混合酶由终浓度为5u/50μl抗体酶、2u/50μlung酶、3u/50μltaq酶组成;所述的dntps组成的浓度比例为:datp:dgtp:dctp:dttp:dutp=1:1:1:1:2。
(4)方法:两个pcr反应管,其中一个加入5μl核酸释放剂a,另外一个加入5μl核酸释放剂b,再分别向这两个pcr反应管中加入5μlhbvdna阳性血清,用移液器反复吹打5-7次,分别混匀,室温静置2分钟;然后分别向这两个pcr管中加入40μl反应液;最后混匀、离心,将两个pcr反应管置于荧光定量pcr扩增仪上,选择fam荧光通道,设置扩增程序进行反应。扩增程序如下:
(5)结果如图1所示,不含nac的核酸释放剂、含0.5%nac的核酸释放剂参与反应的ct值分别为21.55、22.06,前者的ct比后者的ct提前0.51,且前者的荧光增量比后者稍大。由此可以看出,不含nac的核酸释放剂在效果不仅不比含0.5%nac的核酸释放剂的效果差,前者的效果甚至还稍好于后者的效果。说明,本发明的核酸释放剂不添加nac,一样具有强大的释放核酸的作用,同时还避免了nac对dna纤维的裂解作用。
实施例2核酸释放剂中lls(十二烷基硫酸锂)的浓度评价
(1)配制核酸释放剂a(0.1%lls):由600mm的koh、0.1%(w/v)的lls(十二烷基硫酸锂、2%(v/v)的吐温20组成,溶剂为无核酸酶的去离子水。
(2)配制核酸释放剂b(0.3%lls):由600mm的koh、0.3%(w/v)的lls(十二烷基硫酸锂)、2%(v/v)的吐温20组成,溶剂为无核酸酶的去离子水。
(3)配制反应液:如实施例1。
(4)方法:两个pcr反应管,其中一个加入5μl核酸释放剂a,另外一个加入5μl核酸释放剂b,再分别向这两个pcr反应管中加入5μlhbvdna阳性血清,用移液器反复吹打5-7次,分别混匀,室温静置2分钟;然后分别向这两个pcr管中加入40μl反应液;最后混匀、离心,将两个pcr反应管置于荧光定量pcr扩增仪上,选择fam荧光通道,设置扩增程序进行反应。扩增程序如下:
(5)结果如图2所示,0.1%lls的核酸释放剂、0.3%lls的核酸释放剂参与反应的ct分别为27.81、31.18,前者的ct比后者提前3.37,荧光扩增曲线及ct值反映,0.1%lls的核酸释放剂参与反应的扩增效率远好于0.3%lls的核酸释放剂参与反应的扩增效率。根据logyct=logx0+ct*log(1+e)计算,前者的扩增效率是后者的1.168倍,且前者的荧光增量是后者的3倍多。由此评估,核酸释放剂中0.1%lls的效果远好于0.3%的效果,0.1%lls既能很好的裂解样品,又对后续扩增的影响很小。
实施例3核酸释放剂中koh的浓度评价(模板为dna)
(1)配制7种不同koh浓度的核酸释放剂(koh浓度分别为300mm\350mm\400mm\450mm\500mm\550mm\600mm):由300mm~600mm的koh、0.06%(w/v)的lls、2%(v/v)的吐温20组成,溶剂为无核酸酶的去离子水。
(2)配制反应液:如实施例1。
(3)方法:向7个pcr反应管中分别加入7种不同koh浓度的核酸释放剂5μl,再分别向这7个pcr反应管中加入5μlhbvdna阳性血清,分别混匀,室温静置2分钟;然后分别向这7个pcr管中加入40μl反应液;最后混匀、离心,将7个pcr反应管置于荧光定量pcr扩增仪上,选择fam荧光通道,设置扩增程序进行反应。扩增程序如下:
(4)结果如图3所示,koh浓度分别为300mm\350mm\400mm\450mm\500mm\550mm\600mm的核酸释放剂参与hbv扩增反应的ct值分别为21.99、21.83、22.06、21.86、21.75、21.73、21.93,变异系数为0.558%,精密度非常好。由此,可以判断,koh浓度分别为300mm、350mm、400mm、450mm、500mm、550mm、600mm的核酸释放剂裂解hbvdna血清样品释放核酸的效果是一样的,另外也说明了本发明的试剂对koh具有强大的兼容性。
实施例4核酸释放剂中koh的浓度评价(模板为hcvrna)
(1)配制5种不同koh浓度的核酸释放剂(koh浓度分别为200mm\250mm\300mm\350mm\400mm):由200mm~400mm的koh、0.06%(w/v)的lls、2%(v/v)的吐温20组成,溶剂为无核酸酶的去离子水。
(2)配制反应液:其他组分如实施例1,但所述的混合酶由终浓度为10u/50μl逆转酶、5u/50μl抗体酶、1.5u/50μlung酶、4u/50μltaq酶组成。
(3)方法:向5个pcr反应管中分别加入5种不同koh浓度的核酸释放剂5μl,再分别向这5个pcr反应管中加入5μlhcvrna阳性血清,分别混匀,室温静置2分钟;然后分别向这5个pcr管中加入40μl反应液;最后混匀、离心,将5个pcr反应管置于荧光定量pcr扩增仪上,选择fam荧光通道,设置扩增程序进行反应。扩增程序如下:
(4)结果如图4所示,koh浓度分别为200mm\250mm\300mm\350mm\400mm的核酸释放剂参与hcv扩增反应的ct值分别为25.71、25.86、25.71、25.83、25.82,变异系数为0.275%,精密度非常好。由此,可以判断,koh浓度分别为200mm、250mm、300mm、350mm、400mm的核酸释放剂在裂解hcvrna血清样品释放核酸的效果是一样的,另外也说明了本发明的试剂对koh具有强大的兼容性。
实施例5反应液中添加甜菜碱(betaine)效果评价
(1)配制反应液a(含1m的betaine)和b(不含betaine)。
反应液a:如实施例1;
反应液b:其他组分如实施例1,但不含甜菜碱。
(2)方法:两个pcr反应管,每个加入5μl核酸释放剂(如实施例1核酸释放剂a)、5μlhbvdna阳性血清,分别混匀,室温静置2分钟;在向其中一个pcr反应管加入40μl反应液a,另外一个加入40μl反应液b;最后混匀、离心,将两个pcr反应管置于荧光定量pcr扩增仪上,选择fam荧光通道,设置扩增程序进行反应。扩增程序如下:
(3)结果如图5所示,1mbetaine的反应液、不含betiane的反应液参与反应的ct分别为26.64、27.06,前者的ct比后者提前0.42,荧光扩增曲线及ct值反映,1mbetaine的反应液参与反应的扩增效率好于不含betiane的反应液参与反应的扩增效率。
甜菜碱可帮助dna聚合酶顺利通过dna某些复杂二级结构,防止dna聚合酶的从模板dna中解离。dna局部区域因含有多个复杂碱基(gc-rich),会促使dna聚合酶的停滞,最终导致dna聚合酶停止有效延伸。而甜菜碱可提高dna小沟中富含鸟嘌呤和胞嘧啶区域的鸟嘌呤和胞嘧啶的水合作用,影响dna分子结构,改变dna灵活性,帮助dna聚合酶沿着dna模板延伸。
甜菜碱可消除变性温度对碱基的依赖性。浓度依赖性降低高gc含量序列的tm,并使pcr两引物的tm相接近,最终降低dnatm值
高浓度的甜菜碱溶液可稳定dna-蛋白复合物。
在逆转录温度条件下,甜菜碱可减少rna二级结构的形成。在甜菜碱和海藻糖联合用于逆转录实验时,甜菜碱减少rna分子内复杂二级结构的形成,降低rna溶解温度;海藻糖稳定逆转录酶,保持逆转录酶活性。通过二者联合,确保更长cdna的合成长度。
因此,添加甜菜碱,使本发明的试剂盒对不同复杂程度的核酸更具普适性,轻松地解决了大多数复杂模板(如具有gc-rich、发卡结构等)扩增困难的问题。
实施例6反应液中海藻糖浓度评价
(1)配制反应液a(含12%海藻糖)和b(含2.5%海藻糖):
反应液a:如实施例1;
反应液b:其他组分如实施例1,但海藻糖含量为2.5%;
(2)方法:两个pcr反应管,每个加入5μl核酸释放剂(如实施例1核酸释放剂a)、5μlhbvdna阳性血清,分别混匀,室温静置2分钟;在向其中一个pcr反应管加入40μl反应液a,另外一个加入40μl反应液b;最后混匀、离心,将两个pcr反应管置于荧光定量pcr扩增仪上,选择fam荧光通道,设置扩增程序进行反应。扩增程序如下:
(3)结果如图6所示,12%海藻糖的反应液、2.5%海藻糖的反应液参与反应的ct分别为26.53、27.55,前者的ct比后者提前1.02,荧光扩增曲线及ct值反映,12%海藻糖的反应液参与反应的扩增效率远好于2.5%海藻糖的反应液参与反应的扩增效率。根据logyct=logx0+ct*log(1+e)计算,前者的扩增效率是后者的1.054倍,且前者的荧光增量是后者的2倍多。由此评估,12%海藻糖的反应液参与反应的效果远好于2.5%海藻糖的反应液参与反应的效果。
海藻糖可以提高逆转录酶、dna聚合酶的热稳定性、冻存稳定性、对抑制物的耐受性。本发明的反应液在添加5%~15%(w/v)的海藻糖后,大幅度提高逆转录酶、dna聚合酶的热稳定性和对抑制物的耐受性。因此,本实施例的反应液a中海藻糖的浓度不仅能保护酶,而且还有助于提升反应液冻融稳定性。
实施例7反应液中kcl浓度评价
(1)配制4种反应液:其他组分如实施例1,kcl浓度分别为10mm、50mm、100mm、200mm;
(2)方法:四个pcr反应管,每个加入5μl核酸释放剂(如实施例1核酸释放剂a)、5μlhbvdna阳性血清,分别混匀,室温静置2分钟;向四个pcr反应管中分别加入40μl上述4种反应液;最后混匀、离心,将四个pcr反应管置于荧光定量pcr扩增仪上,选择fam荧光通道,设置扩增程序进行反应。扩增程序如下:
(3)结果如图7所示,kcl浓度分别为10mm、50mm、100mm的反应液参与反应的ct值分别为29.94、34.54、38.72,其中200mm的反应液参与的反应没有出现扩增。根据logyct=logx0+ct*log(1+e)计算,10mmkcl的反应液参与反应的扩增效率分别是后两者的1.214倍、1.410倍,其荧光增量是后两者的4倍多、14倍多。很明显kcl浓度为10mm的反应液参与反应的效果远好于kcl浓度分别为50mm、100mm的反应液参与反应的效果。k+有调节酶活性的作用,浓度太高对酶有抑制作用,浓度太低对酶无法起到促进作用,因此,反应液中k+浓度的大小对逆转录酶、dna酶的活性的影响是比较大的,本实施例中,当kcl的浓度达到200mm,核酸扩增反应完全受到抑制。
实施例8反应液中mgcl2浓度评价
(1)配制反应液a(含5mmmgcl2)和反应液b(含50mmmgcl2):
反应液a:如实施例1;
反应液b:其他组分如实施例1,mgcl2含量为50mm;
(2)方法:两个pcr反应管,每个加入5μl核酸释放剂(如实施例1核酸释放剂a)、5μlhbvdna阳性血清,分别混匀,室温静置2分钟;在向其中一个pcr反应管加入40μl反应液a,另外一个加入40μl反应液b;最后混匀、离心,将两个pcr反应管置于荧光定量pcr扩增仪上,选择fam荧光通道,设置扩增程序进行反应。扩增程序如下:
(3)结果如图8所示,5mmmgcl2的反应液参与反应的ct值为27.05,50mmmgcl2的反应液参与的反应没有出现扩增。dna聚合酶对mg2+的浓度非常敏感,是mg2+依赖性酶。mg2+浓度太低,dna聚合酶的活性显著降低;mg2+浓度偏高,dna聚合酶会出现特异性扩增;mg2+浓度太高,会抑制dna聚合酶的活性。本实施例中,当反应液中mgcl2的浓度为50mm时,核酸扩增反应完全受到抑制。
实施例9反应液中甘油浓度评价
(1)配制反应液a(包含8%甘油)和反应液b(包含1%甘油):
反应液a:如实施例4;
反应液b:其他组分如实施例4,甘油含量为1%;
(2)方法:两个pcr反应管,每个加入5μl核酸释放剂(如实施例1核酸释放剂a)、5μlhcvrna阳性血清,分别混匀,室温静置2分钟;在向其中一个pcr反应管加入40μl反应液a,另外一个加入40μl反应液b;最后混匀、离心,将两个pcr反应管置于荧光定量pcr扩增仪上,选择fam荧光通道,设置扩增程序进行反应。扩增程序如下:
(4)结果如图9所示,甘油浓度分别为8%、1%的反应液参与反应的ct值为25.1、25.67,前者的ct比后者提前0.57,前者的荧光增量比后稍高一点,结果显示,前者的扩增效果不比后者差,甚至稍稍好一点。高浓度的甘油对逆转录酶是有促进作用的,目前单独进行逆转录的试剂中甘油浓度高达10%,但甘油浓度太高却会对后续的聚合酶产生抑制作用,而本发明提供的反应液体系,添加了高达8%的甘油,不但对pcr中的聚合酶没有抑制作用,而且对逆转录酶还有促进作用。
实施例10反应液中bsa浓度评价
(1)配制反应液a(包含0.02%bsa)和反应液b(包含0.2%bsa):
反应液a:如实施例4;
反应液b:其他组分如实施例4,bsa为0.2%;
(2)方法:两个pcr反应管,每个加入5μl核酸释放剂(如实施例1核酸释放剂a)、5μlhcvrna阳性血清,分别混匀,室温静置2分钟;在向其中一个pcr反应管加入40μl反应液a,另外一个加入40μl反应液b;最后混匀、离心,将两个pcr反应管置于荧光定量pcr扩增仪上,选择fam荧光通道,设置扩增程序进行反应。扩增程序如下:
(3)结果如图10所示,0.02%bsa的反应液参与反应的ct为25.86,0.2%bsa的反应液参与反应没有出现扩增。bsa具有稳定酶、防止酶分解的作用,同时可以减少酶的非特异性吸附,但是,本发明的研发实验发现,bsa浓度太高,对逆转录、dna聚合酶抑制作用较为显著。本实施例中,当bsa的浓度高达0.2%时,逆转录酶完全受到抑制,无法实现逆转录过程。表明,尽管bsa有稳定酶的作用,但浓度不能太高,否则会影响酶的活性,甚至完全抑制酶的活性。
实施例11反应液的冻存稳定性测试
(1)配制反应液:如实施例1;
(2)方法:将反应液分成4个批次,第一批次不作反复冻融处理;第二批次反复冻融5次;第三批次反复冻融10次;第四批次反复冻融15次。然后向这四个批次加入相应量的核酸释放液(如实施例1核酸释放剂a)(核酸释放剂与hbvdna阳性血清1:1混合,室温静置2分钟),然后置于荧光定量pcr仪上,设置运行程序进行检测。运行程序如下:
(3)结果如图11所示,反复冻融5、10、15次的反应液参与反应的ct相比于反复冻融0次的反应液参与反应的ct分别滞后0.1、0.125、0.08,四个批次ct的变异系数为0.393%,其精密度很好。因此,我们可以忽略这种极小的差异,认为反应液反复冻融5、10、15次与反复冻融0次没有差异。表明,本发明的反应液有着极好的反复冻融稳定性。
由于在组分、浓度上的合理设计,本发明的反应液的贮藏稳定性和冻融稳定性极佳,因此,本发明的反应液已经包含了除模板外核酸扩增所需的各种组分,可以直接使用,无需配制,避免了其他类似发明在检测过程中需要配制反应液的过程。
实施例12hbv阴阳性血清的检测
1)配制核酸释放剂:600mm的koh、质量浓度为0.06%的十二烷基硫酸锂、体积百分浓度为2%的吐温20组成,溶剂为无核酶的去离子水;
2)配制反应液:如实施例1;
3)方法:用移液器吸取5μl核酸释放剂到pcr反应管中,再分别吸取5μl待测样本、阴性对照、阳性对照加入到核酸释放剂中,用移液器反复吹打5-7次,室温静置2分钟。然后根据反应数向每个pcr管中加入40μl反应液,混匀、离心,最后于荧光定量pcr仪上,选择fam荧光通道,设置扩增程序进行反应。扩增程序如下:
(4)中检所hbv核酸血清标准物质的检测:用中检所的阴性血清将中检所的hbv血清标准品(4.6*106iu/ml)进行稀释,稀释后的hbv核酸载量如下:4.6*105iu/ml,4.6*104iu/ml,4.6*103iu/ml,4.6*102iu/ml,4.6*101iu/ml,然后用这5个样本做标准曲线,每个样本重复2次,结果显示(参见图12),这5个浓度梯度的样本ct值的变异系数分别为1.41%,0.05%,1.39%,0.33%,0.06%,表明本发明的试剂盒检测血清样本的重复性很好,线性关系r=0.994(见图13),具有良好的线性关系,表明本发明的试剂盒定量血清样本中hbv核酸浓度的准确性高。且从扩增曲线上来看,各浓度样品的荧光扩增曲线的平行性较好,说明扩增体系中酶的活性及稳定性比较好。
(5)临床hbv阴阳性样本检测:已知临床hbv血清样本(12例阳性,8例阴性)、hav阳性血清样本、hcv阳性血清样本、ebv阳性血清样本、cmv阳性血清样本,按上述步骤进行检测。结果显示(见图14),hbv血清样本的阴阳性检测结果的一致性为100%(检出12例阳性,8例阴性),hav阳性血清样本、hcv阳性血清样本、ebv阳性血清样本、cmv阳性血清样本都没有出现扩增曲线,表明,本发明的试剂盒针对hbv检测具有良好的特异性。
(3)灵敏度测试。用中检所的阴性血清将中检所的hbvdna血清标准品(1.41*103iu/ml)先稀释至1.41*102iu/ml,再稀释至30iu/ml,最后按上述步骤检测30iu/ml样品,该样品重复8次,结果显示(见图15),都出现了扩增曲线。表明,本发明的试剂盒具有良好的检测灵敏度,检出下限达到30iu/ml。
实施例13hcv阴阳性血清检测
1)配制核酸释放剂:400mm的koh、质量浓度为0.06%的十二烷基硫酸锂、体积百分浓度为2%的吐温20组成,溶剂为无核酸酶的去离子水。;
2)配制反应液:其他组分如实施例1,但所述的混合酶由终浓度为10u/50μl逆转酶、5u/50μl抗体酶、1.5u/50μlung酶、4u/50μltaq酶组成。
3)方法:用移液器吸取5μl核酸释放剂到pcr反应管中,再分别吸取5μl待测样本、阴性对照、阳性对照加入到核酸释放剂中,用移液器反复吹打5-7次,室温静置2分钟。然后根据反应数向每个pcr管中加入40μl反应液,混匀、离心,最后于荧光定量pcr仪上,选择fam荧光通道,设置扩增程序进行反应。扩增程序如下:
本发明检测中检所hcv核酸血清标准物质,用中检所的阴性血清将hcv核酸血清标准物质(4.4*105iu/ml)进行稀释稀释,获得如下浓度的hcv核酸血清:4.4*105iu/ml,4.4*104iu/ml,4.4*103iu/ml,按上述方法进行检测,结果见图16,ct依次分别为28.29、32.09、35.51,前后的△ct为3.3左右,且曲线的相互平行性较好。
综上,采用本发明的核酸稀释液及反应液,制备的一种高效快速检测及定量血清或血浆中病原微生物或其他特定核酸的试剂盒,样本核酸被释放后,直接在反应液中扩增,扩增效果好,杂质少,污染少,检测效率高,针对hbv检测下限达到30iu/ml,而且可以实现快速定量及检测血清或血浆样本中病毒dna或rna。
本技术方案提供的试剂盒,试剂的冻存稳定性好、灵敏度高,针对30iu/mlhbv核酸血清的阳性检出率是100%、重复性好、特异性强,20例hbv临床样本,阴阳性结果的一致性是100%(实施例12中有阐述)。本发明的核酸释放剂中不含有生物活性成分,灵敏度更高、结果更准确;本发明不需要核酸纯化,所以大大提高了检测效率,不需要消耗大量移液枪嘴、试剂等耗材,降低了检测成本。
对于本领域技术人员而言,显然本发明不限于上述示范性实施例的细节,而且在不背离本发明的精神或基本特征的情况下,能够以其他的具体形式实现本发明。因此,无论从哪一点来看,均应将实施例看作是示范性的,而且是非限制性的,本发明的范围由所附权利要求而不是上述说明限定,因此旨在将落在权利要求的等同要件的含义和范围内的所有变化囊括在本发明内。不应将权利要求中的任何附图标记视为限制所涉及的权利要求。
此外,应当理解,虽然本说明书按照实施方式加以描述,但并非每个实施方式仅包含一个独立的技术方案,说明书的这种叙述方式仅仅是为清楚起见,本领域技术人员应当将说明书作为一个整体,各实施例中的技术方案也可以经适当组合,形成本领域技术人员可以理解的其他实施方式。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种基于CRISPR‑Cas9系统的基因编辑载体及其应用的制造方法与工艺
- 一种基于CRISPR/Cas9技术制备水稻OsPIL15突变体的方法及应用与流程
- 检测黄曲霉毒素M1的核酸适配体、传感器、试剂盒及应用的制造方法与工艺
- 一组肌酸激酶同工酶核酸适配体及其应用的制造方法与工艺
- 用于抑制KRAS靶基因mRNA表达的寡核酸分子及其成套组合物的制造方法与工艺
- 用于抑制EIF4E靶基因mRNA表达的寡核酸分子及其成套组合物的制造方法与工艺
- 用于抑制VEGFA靶基因mRNA表达的寡核酸分子及其成套组合物的制造方法与工艺
- 一种新型向导RNA表达盒及在CRISPR/Cas系统中的应用的制造方法与工艺
- 一种具备双单链末端PCR产物的获得方法及其检测方法与流程
- 一种通过生物技术扩增脱氧胸苷三磷酸的方法与流程