一种TNT∕IL-4∕G纳米生物材料的性能评估方法与流程
本发明涉及抗凝抗血生物材料
技术领域:
,特别涉及一种tnt/il-4/g纳米生物材料的性能评估方法。
背景技术:
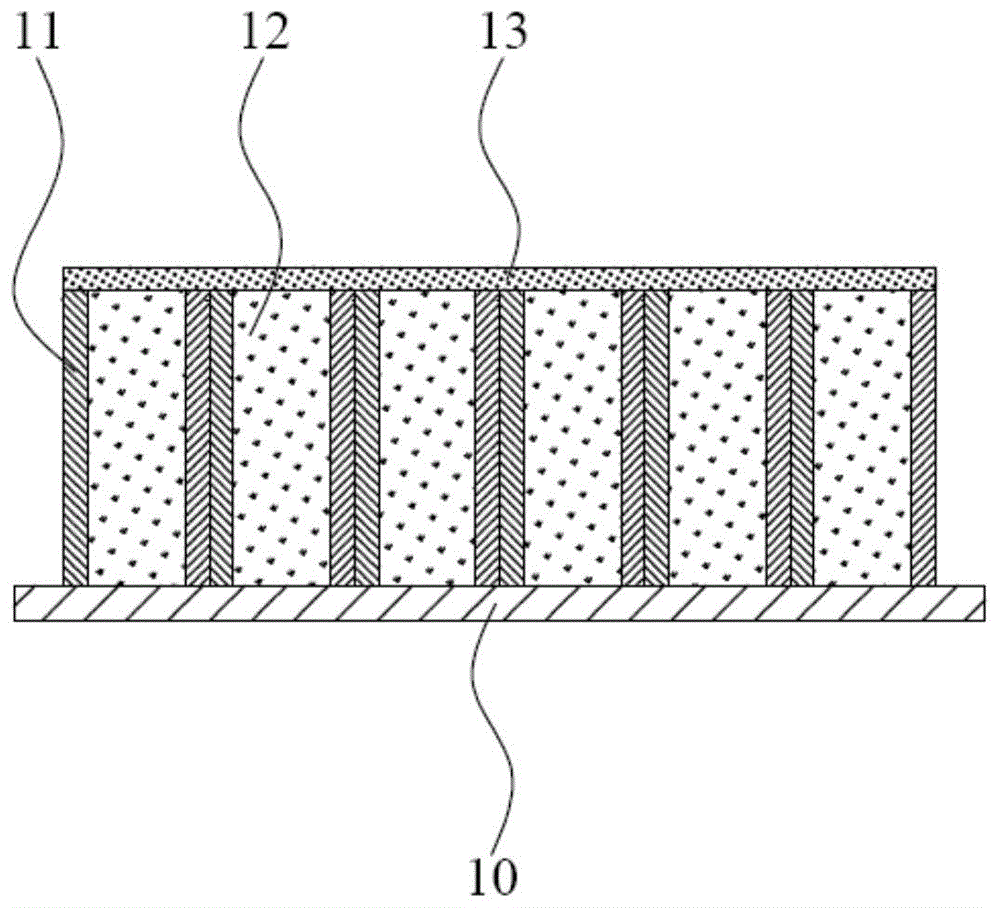
:钛广泛用于各种血液接触材料和装置,例如血栓过滤器和人造心脏瓣膜,在钛具有有限的生物相容性的基础上,用阳极氧化法制备得到表面有纳米管阵列的二氧化钛纳米管,增加了材料本身的亲水性(通常亲水性越高,防止血栓形成的作用越显著),也因其比表面积,管径以及长度,可使更多的细胞黏附在材料表面,从而植入物生物相容性有了质的提升。因此,通过表面修饰将钛转化为二氧化钛成为种植体材料的研究热点。然而随着研究的深入,单纯的二氧化钛纳米管已经无法达到预期调节炎症的效果。技术实现要素:基于此,本发明的目的是提供一种tnt/il-4/g纳米生物材料的性能评估方法,以验证其能够达到更好的调节炎症效果。一种tnt/il-4/g纳米生物材料的性能评估方法,通过将该tnt/il-4/g纳米生物材料用于对巨噬细胞表型转换中进行,该性能评估方法的步骤包括:步骤s100,在预设温度将tnt/il-4/g纳米生物材料浸泡在磷酸盐缓冲液中,并在不同时间点进行震荡后收集浸泡后的磷酸盐缓冲液,分别检测肝素和il-4的释放量,以确定肝素和il-4能够持续稳定释放;步骤s200,将小鼠的巨噬细胞分别种植在ti、tnt、tnt/h及tnt/il-4/g纳米生物材料的表面进行刺激后形成ti样品、tnt样品、tnt/h样品及tnt/il-4/g样品,在不同时间点对各样品中的巨噬细胞m1和巨噬细胞m2的相关基因表达进行rt-pcr分析,以确定tnt/il-4/g纳米生物材料促进巨噬细胞m2相关基因的表达及抑制巨噬细胞m1相关基因的表达;步骤s300,提取处理后的各样品中的上清液来检测巨噬细胞m1和巨噬细胞m2分泌的炎症因子的浓度,以确定tnt/il-4/g纳米生物材料促进巨噬细胞m2的表达;步骤s400,提取培养后的小鼠内皮细胞,分别加入各样品对应的条件培养基进行培养,并在不同时间点检测各组中小鼠内皮细胞的内皮化率,以确定tnt/il-4/g纳米生物材料更能促进巨噬细胞m2的表达;步骤s500,向单独加入各样品的磷酸盐缓冲液中,分别加入含有柠檬酸钠的新西兰兔血液进行孵育后,进行抗凝及抗血小板实验,以确定tnt/il-4/g纳米生物材料具有更优的抗凝及抗血效率;步骤s600,将单独植入ti、tnt、tnt/h及tnt/il-4/g纳米生物材的不同小鼠进行饲养预设时间后取出各材料,分别进行he染色和cd31免疫组化染色,以确定tnt/il-4/g纳米生物材料更能促进新生血管的生成。相较现有技术,本发明通过巨噬细胞在tnt/il-4/g纳米生物材料表面的极化,及体外抗凝抗血测定来评估其性能。与ti、tnt及tnt/h相比,tnt/il-4/g纳米生物材更能促进巨噬细胞m2极化,使得巨噬细胞m2相关基因表达上调,炎症因子释放减少,达到抗炎的目的,使得巨噬细胞m2细胞释放的血管内皮生长因子增多,从而加速内皮化,减少血栓形成。同时,释放的肝素直接作用血小板,也表现出高效的抗凝效率,达到减少血栓形成的目的。进一步地,在步骤s100中,所述预设温度为37℃,不同时间点分别为12h、1d、2d、3d、5d、7d、11d;通过酶联免疫吸附测定法来检测il-4的释放量,通过肝素钠试剂来检测肝素的释放量;在3d内,肝素和il-4的释放效率均达到最高。进一步地,所述步骤s200具体包括:步骤s201,将小鼠的巨噬细胞分别种植在ti、tnt、tnt/h及tnt/il-4/g纳米生物材料的表面进行刺激后形成ti样品、tnt样品、tnt/h样品及tnt/il-4/g样品;步骤s202,提取各样品中的总rna进行逆转录形成dna,并进行基因扩增;步骤s203,在1d、3d、5d、7d后分别检测各样品中的巨噬细胞m1相关基因il-1、il-6及inos的表达,及巨噬细胞m2相关基因arg、cd206及il-10的表达;步骤s204,确定在tnt/il-4/g样品中,巨噬细胞m2相关基因arg、cd206及il-10的表达上调,巨噬细胞m1相关基因il-1、il-6及inos的表达下降,即tnt/il-4/g纳米生物材料促进巨噬细胞m2相关基因的表达及抑制巨噬细胞m1相关基因的表达。进一步地,所述步骤s300具体包括:步骤s301,将标准品和各样品分别加入浸泡后不同培养皿中;步骤s302,在室温下加入特异性一抗进行孵育一段时间后,采用磷酸盐吐温缓冲液进行洗涤;步骤s303,向各培养皿中加入抗辣根过氧化物酶进行培养后,依次加入着色溶液和终止溶液;步骤s304,提取各培养皿中的上清液,采用滤波器检测巨噬细胞m1分泌的炎症因子il-1、il-6及tnf-α,巨噬细胞m2分泌的炎症因子il-10;步骤s305,确定在tnt/il-4/g样品中,巨噬细胞m2分泌的炎症因子il-10的浓度高,巨噬细胞m1分泌的炎症因子il-1、il-6及tnf-α的浓度低,即tnt/il-4/g纳米生物材料促进巨噬细胞m2的表达。进一步地,特异性一抗为比例为1/100的稀释液,室温孵育时间为1.5h,洗涤次数为6次,抗辣根过氧化物酶的培养时间为30min,滤波器为刷选波长为450nm。进一步地,所述步骤s400具体包括:步骤s401,将划痕处理的小鼠内皮细胞接种在不同的培养皿中,在小鼠内皮细胞覆盖培养皿时,吸取各培养皿中的原始培养基,并向各培养皿中单独加入各样品对应的条件培养基进行培养,在不同的时间点观察各培养皿中小鼠内皮细胞的愈合情况;步骤s402,向不同的培养皿中加入等量的基质凝胶,在各培养皿中的基质凝胶固化后,向各培养皿中单独加入ti样品、tnt样品、tnt/h样品及tnt/il-4/g样品进行培养,并观察各培养皿中新管形成的数量以及总管长;步骤s403,向不同的培养皿中加入等量的基质凝胶,在各培养皿中的基质凝胶固化后,向各培养皿中单独加入ti样品、tnt样品、tnt/h样品及tnt/il-4/g样品进行培养,在不同时间点向各培养皿中分别加入cck8溶液进行温育后,用酶标仪读取各培养皿在450nm处的吸光度以测定细胞的增殖情况;步骤s404,确定小鼠内皮细胞在tnt/il-4/g样品中的内皮化率最佳,即tnt/il-4/g纳米生物材料更能促进巨噬细胞m2的表达。进一步地,在步骤s401中,分别在0h、6h及12h观察各培养皿中小鼠内皮细胞的愈合情况;在步骤s402中,将含有基质凝胶的不同的培养皿置于37℃的培养箱中进行固化30min,再加入各样品后进行培养6h;在步骤s403中,cck8溶液的量为0.5ml,在37℃条件下温育3.5h。进一步地,所述步骤s500具体包括:步骤s501,向单独加入各样品的磷酸盐缓冲液中,分别加入含有柠檬酸钠的新西兰兔血液进行孵育后,再分别添加氯化钙溶液触发凝血,并记录各样品的bct;步骤s502,向单独加入各样品的磷酸盐缓冲液中,分别加入含有柠檬酸钠的新西兰兔血液进行孵育后,在不同时间点检测各样品的pt和aptt;步骤s503,向单独加入各样品的磷酸盐缓冲液中,分别加入含有柠檬酸钠的新西兰兔血液进行孵育后,进行血小板黏附实验;步骤s504,确定在tnt/il-4/g样品中,bct值最大、pt值与另外三组无明显差异、aptt值最大,血小板黏附的浓度最小,即tnt/il-4/g纳米生物材料具有更优的抗凝及抗血效率。进一步地,所述步骤s503具体包括:步骤s5031,向单独加入各样品的磷酸盐缓冲液中,分别加入含有柠檬酸钠的新西兰兔血液进行孵育后,通过二次离心法获得对应富含血小板的血浆;步骤s5032,将孵育后的各样品放入不同的培养基中,加入对应的血浆覆盖后进行温育;步骤s5033,加入磷酸盐缓冲液进行冲洗以除去未黏附的血小板后,再加入聚乙二醇辛基苯基醚对黏附血小板进行溶解,对溶解后的裂解物用ldh/ld试剂盒进行分析,并根据校准曲线计算黏附血小板的浓度。进一步地,所述步骤s600具体包括:步骤s601,向不同小鼠的腹腔注射戊巴比妥钠进行麻醉,在各小鼠的背部开口并将皮下组织分开;步骤s602,将ti、tnt、tnt/h及tnt/il-4/g纳米生物材单独植入各小鼠的皮下组织后进行缝合切口,在各小鼠进行饲养预设时间后取出各材料,并观察各材料表面的血管新生情况;步骤s603,将取出的各材料进行切片包埋后,分别进行he染色和cd31免疫组化染色;步骤s604,确定植入tnt/il-4/g纳米生物材的内皮细胞中血管增加最多,即tnt/il-4/g纳米生物材料更能促进新生血管的生成。附图说明图1为本发明中tnt/il-4/g纳米生物材料的剖面示意图;图2为本发明中tnt/il-4/g纳米生物材料的制备方法的流程图;图3(a)为本发明中电镜扫描下纯钛ti的表面特征;图3(b)为本发明中电镜扫描下tnt的表面特征;图3(c)为本发明中电镜扫描下显示的tnt的长度;图3(d)为本发明中电镜扫描下tnt/il-4/g的表面特征;图3(e)为本发明中电镜扫描下tnt/il-4/g中水凝胶的厚度;图3(f)为本发明中电镜扫描下tnt/il-4/g中tnt的直径、长度,水凝胶的厚度统计图;图4为本发明中tnt/il-4/g纳米生物材料的性能评估方法的流程图;图5为本发明中tnt/il-4/g纳米生物材料的肝素和il-4的释放曲线图;图6(a)为本发明中巨噬细胞分别在各样品培养下培养1d,3d,5d及7d后,巨噬细胞m2相关基因arg的表达水平;图6(b)为本发明中巨噬细胞分别在各样品培养下培养1d,3d,5d及7d后,巨噬细胞m2相关基因cd206的表达水平;图6(c)为本发明中巨噬细胞分别在各样品培养下培养1d,3d,5d及7d后,巨噬细胞m2相关基因il-10的表达水平;图6(d)为本发明中巨噬细胞分别在各样品培养下培养1d,3d,5d及7d后,巨噬细胞m1相关基因il-1的表达水平;图6(e)为本发明中巨噬细胞分别在各样品培养下培养1d,3d,5d及7d后,巨噬细胞m1相关基因il-6的表达水平;图6(f)为本发明中巨噬细胞分别在各样品培养下培养1d,3d,5d及7d后,巨噬细胞m1相关基因inos的表达水平;图7(a)为本发明中各样品上清液中检测炎症因子il-1的释放情况;图7(b)为本发明中各样品上清液中检测炎症因子il-6的释放情况;图7(c)为本发明中各样品上清液中检测炎症因子il-10的释放情况;图7(d)为本发明中各样品上清液中检测炎症因子tnf-α的释放情况;图8(a)为本发明中各样品中细胞迁移的代表性图;图8(b)为本发明中各样品中成管6小时的代表性图;图8(c)为本发明中各样品中在1d、3d及5d的细胞增殖情况;图8(d)为本发明中各样品中细胞伤口愈合6小时后的覆盖率;图8(e)为本发明中各样品中新管长度的定量分析图;图8(f)为本发明中各样品中新管数量的定量分析图;图9(a)为本发明中各样品在37℃的条件下温育12h后所测的凝血时间bct;图9(b)为本发明中各样品分别在4h,8h以及12h检测的pt值;图9(c)为本发明中各样品分别在4h,8h以及12h检测的appt值;图9(d)为本发明中各样品在37℃的条件下温育12h后黏附血小板的浓度;图10为本发明中各样品植入小鼠背部及取出的示意图;图11(a)为本发明中小鼠皮下组织植入2周后的各样品材料;图11(b)为本发明中各样品的he染色图;图11(c)为本发明中各样品的cd31免疫组化染色图;图11(d)为本发明中各样品中每毫米cd31+血管数目的量化图。主要元件符号说明:纯钛基材10二氧化钛纳米管11il-412混合层13如下具体实施方式将结合上述附图进一步说明本发明。具体实施方式为了便于理解本发明,下面将参照相关附图对本发明进行更全面的描述。附图中给出了本发明的若干实施例。但是,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施例。相反地,提供这些实施例的目的是使对本发明的公开内容更加透彻全面。需要说明的是,当元件被称为“固设于”另一个元件,它可以直接在另一个元件上或者也可以存在居中的元件。当一个元件被认为是“连接”另一个元件,它可以是直接连接到另一个元件或者可能同时存在居中元件。本文所使用的术语“垂直的”、“水平的”、“左”、“右”以及类似的表述只是为了说明的目的。除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的
技术领域:
的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。本文所使用的术语“及/或”包括一个或多个相关的所列项目的任意的和所有的组合。请参阅图1,第一方面,本发明提供了一种tnt/il-4/g纳米生物材料,包括纯钛基材10,阵列设于纯钛基材10上的多个二氧化钛纳米管11,所述二氧化钛纳米管11的内部充满il-412,多个所述二氧化钛纳米管11的顶部覆盖混合层13,所述混合层13由水凝胶和肝素结合组成。需要说明的是,本发明中,tnt为二氧化钛纳米管,il-4为白介素-4,g(gellayercontainingheparin)为包含肝素的水凝胶。由于水凝胶具有良好的生物相容性和天然高分子材料的生物降解性,在药物传递系统中得到了广泛的应用,因此在tnt/il-4/g纳米生物材料中,加入了水凝胶。水凝胶中的壳聚糖是一种具有良好生物降解性、生物相容性、成膜性和无毒的多糖,其在细胞生长过程中起着不可小觑的作用。覆盖在二氧化钛纳米管表面的壳聚糖可与肝素结合,达到缓释的目的。将肝素装载在水凝胶内,可以减少凝血,增强血管腔内表面的再内皮化。本发明中的tnt/il-4/g纳米生物材料在植入细胞后,先释放具有抗凝作用的肝素,再释放促进巨噬细胞m2极化的il-4,最终达到加速内皮化、减少血栓形成的目的。通过本发明,可以增强二氧化钛纳米管对巨噬细胞m2极化的影响,加速内皮化,最终减少血栓形成。请参阅图2,第二方面,本发明提供了一种tnt/il-4/g纳米生物材料的制备方法,所述制备方法的步骤包括:步骤s10,采用阳极氧化法在纯钛基材10的表面制备阵列的二氧化钛纳米管11;请参阅图3(a)至图3(c)、和图3(f),扫描电子显微镜(sem,jeoljsm-6700f,东京,日本)分别观察纯钛基材10和二氧化钛纳米管11的表面特征,发现存在纳米阵列,即确定二氧化钛纳米管11的生存,且所述二氧化钛纳米管11的直径为110.80±6.80nm,长度为1698.71±107.78nm。步骤s11,在纯钛基材10的表面上滴加il-412,并通过真空干燥法将il-412载入二氧化钛纳米管11的管内;本步骤中,il-4(100ng/ul,r&dsystems,shanghai,china)的滴加量为20ul。步骤s12,在纯钛基材10的表面上涂抹水凝胶,并进行干燥至预设温度以使二氧化钛纳米管11的顶部形成覆盖的水凝胶层;本步骤中,所述水凝胶由浓度为10mg/ml的羧甲基壳聚糖和浓度为5.65mg/ml的京尼平以4:1的比例组成。用水凝胶覆盖的二氧化钛纳米管被标记为tnt/h,便于后续的性能评估实验备用。步骤s13,在水凝胶层的表面上滴加预设量的肝素,以使肝素与水凝胶层中的壳聚糖进行结合形成混合层13,即得到tnt/il-4/g纳米生物材料。本步骤中,在37°℃条件下滴加肝素,所述肝素的浓度为2mg/ml,预设量为20ul。以壳聚糖为聚阳离子,肝素为聚阴离子,它们将紧密结合在一起,最终制得tnt/il-4/g纳米生物材料。请参阅图3(d)至图3(f),通过电镜观察tnt/il-4/g纳米生物材料的表面,发现所述混合层的厚度为1515.43±264.08nm。在所述步骤s10之前,所述制备方法还包括:步骤s101,将纯钛基材10采用超声波清洗后,通过强酸对纯钛基材10的表面进行抛光;在步骤s101中,为了达到更好的清洗及抛光效果,清洗时间为5min,抛光时间为60s,强酸由氢氟酸、硝酸和水组成,且氢氟酸:硝酸:水=1:4:5。步骤s102,将抛光后的纯钛基材10放置电解质溶液中,采用阳极氧化法进行电解制备二氧化钛纳米管;在步骤s102中,所述电解质溶液为氟化铵加聚乙二醇溶液,电解电压为60v,电解时间为1小时,以使制备的二氧化钛纳米管11具有更好的生物相容性。步骤s103,将二氧化钛纳米管11依次放置无水酒精、离子水中进行超声波清洗后,再进行紫外线消毒。在步骤s103中,为了达到更好的清洗效果,在无水酒精中的清洗时间为3min,在离子水中的清洗次数为两次。请参阅图4,第三方面,本发明提供了一种tnt/il-4/g纳米生物材料的性能评估方法,通过将该tnt/il-4/g纳米生物材料用于对巨噬细胞表型转换中进行,该性能评估方法的步骤包括:步骤s100,在预设温度将tnt/il-4/g纳米生物材料浸泡在磷酸盐缓冲液中,并在不同时间点进行震荡后收集浸泡后的磷酸盐缓冲液,分别检测肝素和il-4的释放量,以确定肝素和il-4能够持续稳定释放;步骤s200,将小鼠的巨噬细胞分别种植在ti、tnt、tnt/h及tnt/il-4/g纳米生物材料的表面进行刺激后形成ti样品、tnt样品、tnt/h样品及tnt/il-4/g样品,在不同时间点对各样品中的巨噬细胞m1和巨噬细胞m2的相关基因表达进行rt-pcr分析,以确定tnt/il-4/g纳米生物材料促进巨噬细胞m2相关基因的表达及抑制巨噬细胞m1相关基因的表达;步骤s300,提取处理后的各样品中的上清液来检测巨噬细胞m1和巨噬细胞m2分泌的炎症因子的浓度,以确定tnt/il-4/g纳米生物材料促进巨噬细胞m2的表达;步骤s400,提取培养后的小鼠内皮细胞,分别加入各样品对应的条件培养基进行培养,并在不同时间点检测各组中小鼠内皮细胞的内皮化率,以确定tnt/il-4/g纳米生物材料更能促进巨噬细胞m2的表达;步骤s500,向单独加入各样品的磷酸盐缓冲液中,分别加入含有柠檬酸钠的新西兰兔血液进行孵育后,进行抗凝及抗血小板实验,以确定tnt/il-4/g纳米生物材料具有更优的抗凝及抗血效率;步骤s600,将单独植入ti、tnt、tnt/h及tnt/il-4/g纳米生物材的不同小鼠进行饲养预设时间后取出各材料,分别进行he染色和cd31免疫组化染色,以确定tnt/il-4/g纳米生物材料更能促进新生血管的生成。需要说明的是,ti为纯钛,tnt为二氧化钛纳米管,tnt/h为水凝胶覆盖的二氧化钛纳米管,tnt/il-4/g为本发明制备的新型生物材料。下面以实验进行具体说明,各数据用mean+-sem(均值±标准差)表示,所有试验数据均来自至少3个独立的重复,且采用graphpadprism7单因素方差分析进行统计分析,*p<0.05,**p<0.01被认为是有意义的。由于肝素和il-4能否稳定持续的释放是对tnt/il-4/g纳米生物材料进行性能评估最为重要的一环,所以本发明进行肝素和il-4的体外释放实验。请参阅图5,在步骤s100中,所述预设温度为37℃,不同时间点分别为12h、1d、2d、3d、5d、7d、11d;通过酶联免疫吸附测定法(elisa)(r&dsystems,shanghai,china)来检测il-4的释放量,通过肝素钠试剂盒(leagenebiotechnology,beijing,china)来检测肝素的释放量;由图5可知,两条释放曲线,随着培养时间的延长,释放速率逐渐下降。可以很明显的看出,在3d内,肝素和il-4的释放效率均达到最高。累计释放量约分别达到了423.84ng(il-4)以及374.64ng(肝素),分别占总释放量的58.49%和56.63%。随着释放速率的下降,两者在11d累计释放量约为724.63ng(il-4)和661.56ng(肝素)。在本发明一优选实施方式中,所述步骤s200具体包括:步骤s201,将小鼠的巨噬细胞分别种植在ti、tnt、tnt/h及tnt/il-4/g纳米生物材料的表面进行刺激后形成ti样品、tnt样品、tnt/h样品及tnt/il-4/g样品;步骤s202,提取各样品中的总rna进行逆转录形成dna,并进行基因扩增;本步骤中,总rna由rneasymini试剂盒(qiagen,hilden,germany)收集。然后使用primescript第一链cdna合成试剂盒(takara,otsu,japan)进行逆转录形成dna。最后,使用bio-rad实时荧光定量pcr系统(hercules,ca,usa)进行基因扩增。步骤s203,在1d、3d、5d、7d后分别检测各样品中的巨噬细胞m1相关基因il-1、il-6及inos的表达,及巨噬细胞m2相关基因arg、cd206及il-10的表达;需要明确的是,本步骤中,il-1为白介素-1,il-6为白介素-6,inos为诱导型一氧化氮合酶,arg为抗生素抗性基因,cd206为巨噬细胞甘露糖受体cd206抗体,及il-10为白介素-10。请参阅图6(a)至图6(c),在1d或3d,m2型相关基因除了cd206表达相对下降以外,arg、il-10都有不同程度的表达上调;而在5d或7d时,m2相关基因都表达上调,其中tnt/il-4/g载药系统是表达最高的,其次是tnt和tnt/h,且tnt/il-4/g与对照组比较有显著差异(p<0.01)。请参阅图6(d)至图6(f),m1型相关基因il-1、il-6、inos的表达除ti以外,其他纳米管中巨噬细胞的表达都有所降低,其中tnt/il-4/g表达下降的尤为显著(p<0.05)。步骤s204,确定在tnt/il-4/g样品中,巨噬细胞m2相关基因arg、cd206及il-10的表达上调,巨噬细胞m1相关基因il-1、il-6及inos的表达下降,即tnt/il-4/g纳米生物材料促进巨噬细胞m2相关基因的表达及抑制巨噬细胞m1相关基因的表达。因此,本步骤中研究的数据证明了“tnt会促进巨噬细胞m2型极化”这一观点,并且tnt/il-4/g较tnt纳米粒促进巨噬细胞m2型极化的效率更高。在本发明一优选实施方式中,所述步骤s300具体包括:步骤s301,将标准品和各样品分别加入浸泡后不同培养皿中;步骤s302,在室温下加入特异性一抗进行孵育一段时间后,采用磷酸盐吐温缓冲液进行洗涤;本步骤中,特异性一抗为比例为1/100的稀释液,室温孵育时间为1.5h,洗涤次数为6次。步骤s303,向各培养皿中加入抗辣根过氧化物酶进行培养后,依次加入着色溶液和终止溶液;本步骤中,抗辣根过氧化物酶的培养时间为30min。步骤s304,提取各培养皿中的上清液,采用滤波器检测巨噬细胞m1分泌的炎症因子il-1、il-6及tnf-α,巨噬细胞m2分泌的炎症因子il-10;本步骤中,tnf-α为人肿瘤坏死因子α,滤波器为刷选波长为450nm。请参阅图7(a)至图7(d),与ti样品上清液相比,tnt样品、tnt/h样品、tnt/il-4/g样品上清液中炎症因子有所下降,且tnt/il-4/g上清液中炎症因子下降的更为显著(p<0.01)。相反,在tnt/il-4/g样品上清液中,由m2型巨噬细胞分泌为主的il-10与ti以及其他纳米管上清液比较,浓度较相对增高,且与对照组比较,有统计学差异(p<0.05)。结合rt-pcr和elisa的数据,arg、cd206、il-10基因的表达,以及il-10炎症因子的分泌都有较大的增高,而il-1、il-6、inos基因的表达以及il-1、tnf-α等炎症因子的分泌有明显下降。步骤s305,确定在tnt/il-4/g样品中,巨噬细胞m2分泌的炎症因子il-10的浓度高,巨噬细胞m1分泌的炎症因子il-1、il-6及tnf-α的浓度低,即tnt/il-4/g纳米生物材料促进巨噬细胞m2的表达。在本发明一优选实施方式中,所述步骤s400具体包括:步骤s401,将划痕处理的小鼠内皮细胞接种在不同的培养皿中,在小鼠内皮细胞覆盖培养皿时,吸取各培养皿中的原始培养基,并向各培养皿中单独加入各样品对应的条件培养基进行培养,在不同的时间点观察各培养皿中小鼠内皮细胞的愈合情况;请参阅图8(a)和8(d),本步骤中,分别在0h、6h及12h观察各培养皿中小鼠内皮细胞的愈合情况。ti样品中细胞的愈合率约为23.68%,tnt样品、tnt/h样品、tnt/il-4/g样品中细胞的愈合率分别约为47.50%,46.34%,60.46%,且tnt/il-4/g样品较tnt样品的差异较明显(p<0.05)。需要说明的是,各样品对应的条件培养基是指将ti、tnt、tnt/h及tnt/il-4/g纳米材料放入巨噬细胞中一起培养,培养期间,巨噬细胞会分泌各种细胞因子等待,培养一段时间后,收集的培养基。步骤s402,向不同的培养皿中加入等量的基质凝胶,在各培养皿中的基质凝胶固化后,向各培养皿中单独加入ti样品、tnt样品、tnt/h样品及tnt/il-4/g样品进行培养,并观察各培养皿中新管形成的数量以及总管长;请参阅图8(b),本步骤中,基质凝胶的加入量为50ul,各样品的加入量为150ml,将含有基质凝胶的不同的培养皿置于37℃的培养箱中进行固化30min,再加入各样品后进行培养6h。除了对照组以外,我们在其他组别均观察到了类血管网状结构,并且可以看到,tnt/il-4/g样品中形成的网站结构尤为致密。步骤s403,向不同的培养皿中加入等量的基质凝胶,在各培养皿中的基质凝胶固化后,向各培养皿中单独加入ti样品、tnt样品、tnt/h样品及tnt/il-4/g样品进行培养,在不同时间点向各培养皿中分别加入cck8溶液进行温育后,用酶标仪读取各培养皿在450nm处的吸光度以测定细胞的增殖情况;在步骤s403中,cck8溶液的量为0.5ml,在37℃条件下温育3.5h。请参阅图8(c),我们用cck8试剂盒测定了细胞的增殖情况,细胞增殖分别在1d、3d、5d时都无明显差异,说明材料生物相容性较好,对细胞的增殖影响不大。请参阅图8(e)和图8(f),此外,我们对各样品中人脐静脉内皮细胞(huvecs)中新管形成的数量以及总管长进行了定量分析,数据显示新管形成以及总管长都是tnt/il-4/g>tnt>tnt/h>ti,且tnt/il-4/g样品相较于tnt样品有统计学差异(p<0.05)。从以上的数据分析,tnt/il-4/g样品不管是愈合率(反映细胞迁移)、管形成都优于ti样品、tnt样品和tnt/h样品。各样品都会不同程度的促进huvecs内皮化,特别是tnt/il-4/g样品的效果尤为明显。步骤s404,确定小鼠内皮细胞在tnt/il-4/g样品中的内皮化率最佳,即tnt/il-4/g纳米生物材料更能促进巨噬细胞m2的表达。在本发明一优选实施方式中,所述步骤s500具体包括:步骤s501,向单独加入各样品的磷酸盐缓冲液中,分别加入含有柠檬酸钠的新西兰兔血液进行孵育后,再分别添加氯化钙溶液触发凝血,并记录各样品的bct;具体的,本步骤中,将新西兰兔的血液样本收集到含有3.8%柠檬酸钠的离心管中。将样品放入每孔含有0.5ml磷酸盐缓冲液的24孔板中,12h后用1.5ml离心管收集各组pbs液为样品。对照组仅加入等量的pbs液。将样品加入5ml玻璃管中,37℃孵育5min。然后,1ml含有柠檬酸钠的兔血混合样品并37℃孵育3分钟。接下来,500μl、0.025mol/l氯化钙溶液添加到管触发凝血。将试管从水浴中取出,每隔15秒倒置一次,直到试管中的血液不再流动(倒置度最高可达180°),记录凝血时间bct。请参阅图9(a),只加磷酸盐缓冲液的空白对照组的凝血时间bct与tnt样品以及tnt/h样品无统计学差异。然而,tnt/il-4/g样品相对与对照组,凝血时间bct延长,有统计学差异(p<0.05)。同理相比与其他两组,tnt/il-4/g样品在凝血时间bct上有着显著延长(p<0.01)。步骤s502,向单独加入各样品的磷酸盐缓冲液中,分别加入含有柠檬酸钠的新西兰兔血液进行孵育后,在不同时间点检测各样品的pt和aptt;本步骤中,pt为活化部分凝血酶原时间,aptt为凝血酶原时间。具体的,将新西兰兔血液收集在含有3.8%柠檬酸钠的试管中,其柠檬酸比率为9:1。样品放入每孔含有0.5ml磷酸盐缓冲液的24孔板中,12h后用2ml离心管收集各组磷酸盐缓冲液为样品。往离心管中加入1ml血液混合样本,震荡摇匀,并用凝血检测仪qv-1(micropointcorporation,china)检测pt和aptt并记录数据。请参阅图9(b),四组分别在4h,8h以及12h检测的pt值无明显差异,说明各样品具有良好的生物相容性。请参阅图9(c),考虑到肝素的释放需要一段时间,参照肝素的释放曲线在第一天的释放效率较高,我们取了4h、8h、12h三个时间点来测量aptt值。空白组和tnt样品、tnt/h样品的aptt水平基本持平,而tnt/il-4/g样品却远高与其他三组,且时间越长,差距就越显著(p<0.05)。步骤s503,向单独加入各样品的磷酸盐缓冲液中,分别加入含有柠檬酸钠的新西兰兔血液进行孵育后,进行血小板黏附实验;所述步骤s503具体包括:步骤s5031,向单独加入各样品的磷酸盐缓冲液中,分别加入含有柠檬酸钠的新西兰兔血液进行孵育后,通过二次离心法获得对应富含血小板的血浆;本步骤中,二次离心法的条件具体为在离心力215g、863g条件下各离心10min。步骤s5032,将孵育后的各样品放入不同的培养基中,加入对应的血浆覆盖后进行温育;本步骤中,对应的血浆的加入量为0.5ml,并在37℃的条件下温育12h。步骤s5033,加入磷酸盐缓冲液进行冲洗以除去未黏附的血小板后,再加入聚乙二醇辛基苯基醚对黏附血小板进行溶解,对溶解后的裂解物用ldh/ld试剂盒进行分析,并根据校准曲线计算黏附血小板的浓度。本步骤中,磷酸盐缓冲液冲洗次数为5次,聚乙二醇辛基苯基醚的加入量为加入0.25ml,浓度为1%(用磷酸盐缓冲液稀释),在37℃的条件下,溶解黏附血小板1h。请参阅图9(d),血小板黏附于各样品表面的浓度为tnt/h样品>tnt样品>ti样品>tnt/il-4/g样品,且tnt/il-4/g样品显著低于其他三组(p<0.05)。步骤s504,确定在tnt/il-4/g样品中,bct值最大、pt值与另外三组无明显差异、aptt值最大,血小板黏附的浓度最小,即tnt/il-4/g纳米生物材料具有更优的抗凝及抗血效率。需要说明的是,本发明中,在血小板黏附测量后,各样品在血小板血浆孵育12h后,用4%戊二醛(用磷酸盐缓冲液稀释)固定12h,再用一系列乙醇溶液(30507090100v/v)脱水并冻干,干燥样品涂铂,扫描电镜观察。请参阅图10,在本发明一优选实施方式中,所述步骤s600具体包括:步骤s601,向不同小鼠的腹腔注射戊巴比妥钠进行麻醉,在各小鼠的背部开口并将皮下组织分开;本步骤中,采用饲养6周的c57雌性小鼠进行试验,戊巴比妥钠的注射量为100mg/kg。步骤s602,将ti、tnt、tnt/h及tnt/il-4/g纳米生物材单独植入各小鼠的皮下组织后进行缝合切口,在各小鼠进行饲养预设时间后取出各材料,并观察各材料表面的血管新生情况;本步骤中,各小鼠的饲养预设时间为2周。步骤s603,将取出的各材料进行切片包埋后,分别进行he染色和cd31免疫组化染色;请参阅图11(a)至图11(d),he染色可见所有材料都被细胞完全浸润。此外,我们进行了cd31免疫组化染色,除ti样品以外,tnt样品、tnt/h样品和tnt/il-4/g样品都出现大血管结构,且tnt/il-4/g样品中的大血管结构明显多于tnt样品和tnt/h样品。与tnt样品相比,tnt/il-4/g样品的cd31+血管明显增多(p<0.05)。步骤s604,确定植入tnt/il-4/g纳米生物材的内皮细胞中血管增加最多,即tnt/il-4/g纳米生物材料更能促进新生血管的生成。综上,本发明先制备tnt/il-4/g纳米生物材,再通过巨噬细胞在tnt/il-4/g纳米生物材料表面的极化,及体外抗凝抗血测定来评估其性能。与ti、tnt及tnt/h相比,tnt/il-4/g纳米生物材更能促进巨噬细胞m2极化,使得巨噬细胞m2相关基因表达上调,炎症因子释放减少,达到抗炎的目的,使得巨噬细胞m2细胞释放的vegf(血管内皮生长因子)增多,从而加速内皮化,减少血栓形成。同时,释放的肝素直接作用血小板,也表现出高效的抗凝效率,达到减少血栓形成的目的。所以,tnt/il-4/g纳米生物材料是一种非常有应用前景的心脏瓣膜植入物,具有快速实现内皮化和抗凝的作用。以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1