一种能够调控MSCs成脂肪分化能力的基因及其衍生产品的制作方法
本发明涉及生物技术领域,具体涉及一种能够调控mscs成脂肪分化能力的基因及其衍生产品。
背景技术:
间充质干细胞(mscs)是属于中胚层的一类多能干细胞,主要存在于结缔组织和器官间质中,以骨髓组织中含量最为丰富,由于骨髓是其主要来源,因此统称为骨髓间充质干细胞。骨髓间充质干细胞具有以下特性:一、具有强大的增殖能力和多向分化潜能,在适宜的体内或体外环境下具有分化为肌细胞、肝细胞、成骨细胞、脂肪细胞、软骨细胞、基质细胞等多种细胞的能力。二、具有免疫调节功能,通过细胞间的相互作用及产生细胞因子抑制t细胞的增殖及其免疫反应,从而发挥免疫重建的功能。三、具有来源方便,易于分离、培养、扩增和纯化,多次传代扩增后仍具有干细胞特性,不存在免疫排斥的特性。四、面目模糊,表面抗原不明显,异体移植排异较轻,配型要求不严格。正是由于间充质干细胞所具备的这些免疫学特性,使其在血液病治疗方面具有广阔的临床应用前景。通过自体移植可以重建组织器官的结构和功能,并且可避免免疫排斥反应。
间充质干细胞(mesenchymalstemcells,mscs)来源于不同组织,是具有自我更新和多向分化潜能的成体干细胞,体内和体外培养均可使其向成脂肪、成骨和成软骨分化。但其具体的分化机制研究甚少。
磷酸酶wip1(野生型p53诱导的磷酸酶1)是由ppm1d基因编码的一种丝氨酸/苏氨酸蛋白磷酸酶,是一种p53依赖的基因,属于pp2c(蛋白磷酸酶2c)家族,该家族成员主要参与细胞代谢过程,包括增殖、凋亡、分化等等。wip1在原核生物和真核生物中均有表达,主要存在细胞核中。在细胞稳态调控、dna损伤修复、抗衰老、肿瘤发生及免疫调控等方面具有重要作用,并作为原癌基因受到越来越多的关注。
pp2a是丝氨酸/苏氨酸蛋白磷酸酶2,在人类其由ppp2ca基因编码,由a和b两个亚单位组成。对磷酸酶的调节起到重要作用,对细胞内多种信号通路产生影响。研究已经发现pp2a影响成骨细胞和脂肪细胞的分化,通过调节相关转录因子的表达来确定成骨细胞或脂肪细胞的表型。
过氧化物酶体增殖体激活受体-γ(peroxisomeproliferatoractivatedreceptorγ,ppar-γ),是重要的细胞分化转录因子,在哺乳动物的脂肪组织、血管平滑肌组织、心肌组织中均有表达。ppar-γ是由配体激活的核转录因子,活化后可以调控多种核内靶基因的表达。研究发现,ppar-γ具有调节脂肪代谢、炎症、免疫以及细胞分化等作用,参与诸多慢性免疫性疾病的发生及发展。ppar-γ是mscs成脂早期过程中的转录因子,ppar-γ高表达,说明细胞成脂分化能力强。
技术实现要素:
我们通过研究发现,wip1基因敲除后mscs成脂分化能力显著下降,进一步研究发现,具体机制是wip1基因通过调控pp2a-ppar-γ信号通路促进mscs的成脂分化。
本发明目的之一是wip1基因调控mscs成脂肪分化能力的分子机制研究提供新的线索,为临床研究应用mscs治疗疾病提供新靶标。
具体方案:本发明人利用成熟的小鼠骨组织来源的mscs分离培养和体外诱导培养体系,经实验研究发现wip1基因通过调节pp2a-ppar-γ信号通路调控mscs的成脂分化;具体实施过程,体外分离培养wip1+/+mscs和wip1-/-mscs,进一步诱导,成脂分化后检测成脂相关转录因子ppar-γ,c/ebpα变化。结果表明,wip1-/-mscs成脂诱导后,脂滴数量显著减少,成脂相关转录因子表达显著降低。采用基因芯片结合生物信息学分析,发现wip1-/-mscs中pp2a表达降低。收集mscs成脂诱导第0天,第2天,第4天和第5天的样本,q-pcr检测发现成脂相关转录因子ppar-γ与pp2a变化一致。利用pp2asirna敲低mscs中pp2a,q-pcr和westernblot检测结果显示,敲低pp2a基因后,成脂分化关键转录因子ppar-γ表达显著下调,说明成脂分化能力降低,从而证实wip1具有促进mscs成脂分化能力。
首先,本发明提供了一种能够调控mscs成脂肪分化能力的基因,所述基因为wip1基因。
优选的,所述wip1基因正向调控mscs成脂肪分化能力。
优选的,所述wip1基因通过调节pp2a-ppar-γ信号通路调控mscs的成脂分化。
优选的,所述间充质干细胞包括牙髓间充质干细胞、脐带间充质干细胞、脂肪间充质干细胞或骨髓间充质干细胞。
在本发明上述应用的一些实施方案中,所述间充质干细胞(mscs)为小鼠骨组织来源的间充质干细胞。
进一步地,本发明提供了一种基因修饰间充质干细胞的生物制剂,所述基因为wip1基因,所述制剂中含有促进wip1基因表达的试剂和促进wip1基因表达产物的试剂。如mscs成脂分化的促进剂。
优选的,所述促进wip1基因表达的试剂包括促进基因转录的试剂,促进基因翻译的试剂,促进wip1蛋白含量提高的试剂;所述促进wip1基因表达产物的试剂包括促进wip1基因表达稳定性的试剂,促进wip1基因表达产物活性的试剂,促进wip1基因表达产物功能的试剂。
进一步地,本发明提供了一种基因修饰间充质干细胞的生物制剂,所述基因为wip1基因,所述制剂中含有降低wip1基因表达的试剂和降低wip1基因表达产物的试剂。
优选的,所述降低wip1基因表达的试剂是通过sirna敲低pp2a基因使得成脂关键转录因子ppar-γ表达显著下调,从而抑制msc成脂分化能力。
优选的,pp2asirna具有seqidno:9-seqidno:14所示的核苷酸序列。
更进一步地,本发明提供了一种细胞治疗药物,所述药物通过wip1基因修饰间充质干细胞起作用。
优选地,所述细胞治疗药物包括外用细胞治疗药物或注射细胞治疗药物。
再进一步地,本发明还提供了一种基因改造mscs的方法,所述方法是通过调控wip1基因的表达进而调节pp2a-ppar-γ信号通路来改造mscs。
具体为:
1)从1周龄c57bl/6小鼠骨组织中分离获取间充质干细胞,然后进行原代培养和传代培养;
2)利用sirna瞬时转染技术将pp2asirna导入p3代间充质干细胞,然后培养。
sirna瞬时转染的转染体系为:jetprimereagentbuffer200ul/2ml、sirna3ul/2ml、jetprimereagent4ul/2ml,转染时间为48h。
最后,本发明还提供了一种基因改造mscs的方法在制备利用mscs治疗疾病药物中的应用,所述利用mscs治疗疾病药物包括肿瘤药物等。
有益效果
本发明人通过实验发现,wip1基因通过pp2a-ppar-γ信号通路调节mscs成脂分化的能力,为mscs生物学特性的研究及临床应用提供了理论与实验依据,也为临床研究应用mscs治疗疾病提供新靶标。因此,可将wip1用于制备调控mscs成脂分化的产品,如mscs成脂分化的促进剂。本发明采用成熟的小鼠骨组织来源的mscs分离培养技术,结合特定的成脂诱导分化体系及特定的接种细胞数,稳定的基因转染敲低技术,可操作性强,方便实用。
附图说明
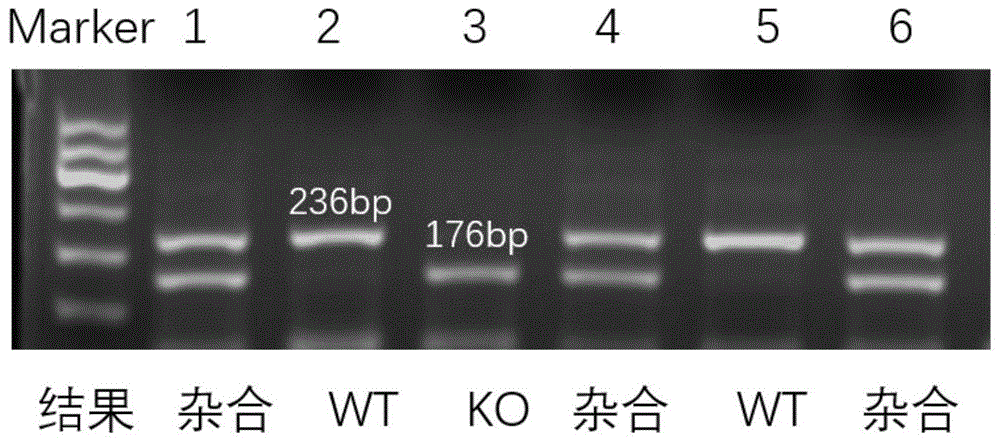
图1所示为鼠尾基因型鉴定结果;
图2为wip1+/+mscs和wip1-/-mscs成脂诱导后油红o染色结果;
图3为wip1+/+mscs和wip1-/-mscs成脂诱导后油红o染色,显微镜下脂滴计数结果和成脂相关转录因子ppar-γ和c/ebpα变化;
图4为293t细胞过表达wip1后pp2a表达升高;
图5为mscs成脂诱导后相关因子变化;
图6为敲低mscs中pp2a,ppar-γ表达降低。
具体实施方式
以下实施例用于说明本发明,但不用来限制本发明的范围。若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段。
本发明所用常规基础方法示例如下:
wip1:geneid:53892
ppar-γ:geneid:19016
pp2a:geneid:19052
c/ebpα:geneid:12606
基因型鉴定方法如下:
首先提取鼠尾dna,然后pcr扩增,最后水平电泳检测基因型。
鼠尾dna提取如下:收集需要检测的小鼠尾尖0.5~1cm,至于1.5mlep管中,并做好标记(或-20℃冰箱暂存);加入200μl裂解液,用眼科剪把组织剪成小块;55℃孵育2h,间断混匀裂解液使组织消化充分;在通风橱内,加入200μl酚/氯仿/异戊醇(25:24:1)至裂解液中,剧烈震荡,充分混匀变性蛋白质,至于离心机中最高转速离心10min;取出离心管,小心的收取上层水相的上清约180μl(<200μl,切勿吸入中间层沉淀),加入10%体积的醋酸钠和60%体积的异丙醇,混合均匀,至于离心机中最高转速离心10min;去除上清,加入70%的乙醇溶液洗涤沉淀两次,离心机中最高转速离心后去除上清;晾干,加入50μlte溶液或ddh2o溶解dna,得到的基因组即可用于pcr。
原代mscs培养方法:
1)断颈处死1周龄小鼠,75%酒精浸泡5分钟;
2)无菌条件下剪取胫骨、股骨骨干,置于含10%血清的完全培养基的青瓶中;
3)眼科剪剪碎,1%ⅱ型胶原酶消化45min;
4)将骨片移至装有10%血清的完全培养基的25cm2培养瓶中,用电动移液枪吹散,放置孵箱培养;
5)72h后换液,弃去悬浮细胞,每2~3d换一次液;
6)待细胞长至80~90%融合后,胰蛋白酶消化,传代,重复上述步骤,直至细胞培养至p3待用。
继代培养方法:
胰酶消化细胞,血清终止,拍打培养瓶瓶壁,使所有细胞脱落,移入离心管,1000rpm/min,离心10min,弃去上清,完全培养基重悬细胞,接种于培养瓶。
293t细胞过表达方法:
首先复苏实验室保存的293t细胞,接种于t75培养瓶培养,传代后接种于六孔板,1×105/孔,长到80%融合换液,加入转染试剂(jetprimereagentbuffer200ul/孔、质粒1ug/孔、jetprimereagent4ul/孔),转染时间为48h,收取细胞用于继续实验。
芯片方法:
委托康普森公司,按照程序化流程操作。
实施例1:小鼠基因组总dna提取及基因型鉴定
通过wip1+/-小鼠的交配,获得1周龄小鼠,剪取鼠尾进行基因型鉴定。图1为基因型鉴定结果,2号和5号是wip1+/+小鼠,1号,6号和4号是杂合小鼠,3号为wip1-/-小鼠。
实施例2:wip1+/+mscs和wip1-/-mscs体外分离培养和成脂诱导分化
将上述例一中鉴定出的wip1+/+小鼠和wip1-/-小鼠消毒后超净工作台内提取骨片,行原代mscs培养。将体外分离培养的p2代wip1+/+mscs和wip1-/-mscs,接种于六孔板进行成脂诱导。用油红o染色,检测wip1+/+mscs和wip1-/-mscs成脂分化结果计数形成的脂滴数。如图2为油红o染色结果,可以发现两种mscs均可向成脂细胞分化,a、b:wip1+/+mscs;c、d:wip1-/-mscs;a、c:自分化组;b、d:诱导组。如图3a为高倍视野下脂滴计数结果,发现wip1+/+mscs脂滴更多。图3b和图3c为q-pcr检测成脂相关转录因子结果。显示与wip1-/-mscs成脂关键转录因子ppar-γ和c/ebpα表达显著降低。q-pcr检测所用引物如表1所示。
以上结果表明wip1缺失可使mscs成脂分化能力显著降低。
表1:引物与基因序列
实施例3:wip1+/+mscs和wip1-/-mscs中pp2a表达差异
wip1+/+mscs和wip1-/-mscs芯片显示pp2a在两种细胞中的表达存在明显差异,为此,提取p3代wip1+/+mscs和wip1-/-mscs蛋白,westernblot进行验证。结果如图4a所示wip1-/-mscs中pp2a表达下降,差异显著。
为探讨wip1与pp2a是否存在相互作用,我们将293t细胞过表达wip1-gfp。如图4b所示,流式细胞术检测结果显示转染效率为57.5%,说明wip1基因成功转入293t细胞。如图4c所示,荧光显微镜下可见大量荧光细胞。图4d所示结果为westernblot检测发现wip1过表达,同时pp2a表达亦显著升高。
实施例4:成脂诱导过程中pp2a与成脂相关转录因子变化一致
mscs成脂诱导分化后,收集第0天,第2天,第4天和第5天的样本,q-pcr检测成脂诱导分化过程中成脂相关关键转录因子ppar-γ、c/ebpα和pp2a表达。如图5所示,成脂过程中ppar-γ和c/ebpα均先升高后降低,pp2a与其变化趋势一致。
实施例5:干扰pp2a表达后ppar-γ表达亦降低
体外分离培养mscs,传至p3代接种于6孔板,转染pp2asirna。合成3对sirnapp2a,(序列为seqidno:9-seqidno:14),转染48h后,收集细胞,q-pcr验证,挑选一组敲低效果最好的用于后续实验。如图6a所示,sirna-615敲低效果最好。选择sirna-615,再次转染mscs,如图6b所示pp2a敲低。进一步检测,pp2a敲低后成脂肪相关转录因子变化。如图6c所示,q-pcr检测发现ppar-γ表达亦显著降低。图6d所示,westernblot检测发现pp2a表达降低同时ppar-γ表达也降低。
上述实验结果表明,wip1基因敲低的mscs成脂分化能力亦显著降低,wip1通过调节pp2a-ppar-γ信号通路影响mscs的成脂分化。
以上结果表明,wip1基因具有促进mscs成脂分化作用。可用于制备mscs促分化产品,或者在治疗肥胖时,敲除wip1基因可更好的治疗肥胖,为成脂分化机制提供了新的信号通路机制。
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
序列表
<110>中国人民解放军军事科学院军事医学研究院
<120>一种能够调控mscs成脂肪分化能力的基因及其衍生产品
<130>p200123
<141>2020-01-16
<160>16
<170>siposequencelisting1.0
<210>1
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>1
tcaagatcatcagcaatgcc20
<210>2
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>2
cgataccaaagttgtcatgga21
<210>3
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>3
gaccactcccactcctttga20
<210>4
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>4
attcaattgccatgagggag20
<210>5
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>5
acgagacgtctatagacatcag22
<210>6
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>6
aggaactcgtcgttgaagg19
<210>7
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>7
ttatgggagactatgtggacag22
<210>8
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>8
ctcggtaacgaaccttaagag21
<210>9
<211>21
<212>dna/rna
<213>人工序列(artificialsequence)
<400>9
cuaaagaaauccugacaaatt21
<210>10
<211>21
<212>dna/rna
<213>人工序列(artificialsequence)
<400>10
uuugucaggauuucuuuagtt21
<210>11
<211>21
<212>dna/rna
<213>人工序列(artificialsequence)
<400>11
cgacgaguguuuaaggaaatt21
<210>12
<211>21
<212>dna/rna
<213>人工序列(artificialsequence)
<400>12
uuuccuuaaacacucgucgtt21
<210>13
<211>21
<212>dna/rna
<213>人工序列(artificialsequence)
<400>13
ggaaauacggaaaugcaaatt21
<210>14
<211>21
<212>dna/rna
<213>人工序列(artificialsequence)
<400>14
uuugcauuuccguauuucctt21
<210>15
<211>21
<212>dna/rna
<213>人工序列(artificialsequence)
<400>15
uucuccgaacgugucacgutt21
<210>16
<211>21
<212>dna/rna
<213>人工序列(artificialsequence)
<400>16
acgugacacguucggagaatt21
- 还没有人留言评论。精彩留言会获得点赞!