一种光致变色含氟萘并吡喃化合物的制作方法
本发明涉及有机光致变色材料合成技术领域,特别涉及一种光致变色含氟萘并吡喃化合物。
背景技术:
光致变色是指某些化合物在经含紫外线的光线照射时颜色迅速发生改变,而在停止光线照射而置于暗处时,颜色能够恢复到原状态的可逆现象。具有该性质的化合物被称为光致变色化合物或光致变色材料,目前被广泛用于具有光致变色性能的塑料透镜之中。良好的光致变色化合物性能主要体现在以下几个方面:
1.照射紫外线之前的可见光区域中的初期着色低;
2.照射紫外线时的显色浓度高;
3.从开始照射紫外线起至显色浓度达到饱和状态的显色灵敏度快;
4.从停止照射紫外线起至恢复到原始状态为主的褪色速度快;
5.显色和褪色的可逆作用的反复耐久性好;
6.光致变色化合物褪色干净不留底色。
吡喃类光致变色化合物所具有的可逆光致变色效应首次由hirshberg于1952年提出(j.am.chem.soc.,1956,78,2304-2312),而claude等人在随后的工作中发现其变色体为酚菁类化合物(ep0050558),这一系列研究为吡喃类化合物作为光致变色材料在光信息等领域中的应用奠定了基础。目前,吡喃类光致变色化合物作为一类重要的分子光开关材料,因其具有较高的化学稳定性、光致变色灵敏性和抗光疲劳性,其应用得到了很大的扩展,从最开始的变色眼镜,到如今在ph传感器、高分子材料、金属离子荧光/变色探针等方面均有不错的发展。为了获得性能更好的光致变色化合物,设计、制备萘并吡喃光致变色化合物用于拓展其应用特性仍具有非常大的经济及社会价值。
技术实现要素:
本发明的目的在于提供一种光致变色含氟萘并吡喃化合物,初期着色度小,显色浓度高,变色灵敏,褪色速度快,耐久性好,无底色。
本发明解决其技术问题所采用的技术方案是:
一种光致变色含氟萘并吡喃化合物,其分子结构如下:
其中r1为c1-c4的烷基或三氟甲基,r2为氟原子或三甲基硅基氧基。
所述r3为c1-c4的烷基、c1-c4的氟代烷基、c1-c4的烷氧基、c1-c4的硅氧基、二甲胺基、二乙氨基、吡咯、吗啉、氰基、硝基、氢原子、卤素原子中的一种。
所述r4为c1-c4的烷基、c1-c4的氟代烷基、c1-c4的烷氧基、c1-c4的硅氧基、二甲胺基、二乙氨基、吡咯、吗啉、氰基、硝基、氢原子、卤素原子中的一种。
ar1为苯基、取代苯基、取代吡啶、取代呋喃、取代噻吩中的一种。
ar2为苯基、取代苯基、取代吡啶、取代呋喃、取代噻吩中的一种。
取代苯基、取代吡啶、取代呋喃、取代噻吩的取代基团选自c1-c4的烷基、c1-c4的氟代烷基、c1-c4的烷氧基、c1-c4的硅氧基、二甲胺基、二乙氨基、吡咯、吗啉、氰基、硝基、氢原子、卤素原子中的一种或几种,取代基团的取代位置为邻位、间位或对位。
所述光致变色含氟萘并吡喃化合物具体分子结构如下:
光致变色含氟萘并吡喃化合物作为制备低温光致变色材料类原料的用途。本发明的产品用于20℃至零下15℃的环境中使用变色眼镜、变色薄膜等材料。
作为优选,一种光致变色含氟萘并吡喃化合物,其分子结构如下:
其中r1为c1-c4的烷基或三氟甲基,r2为氟原子或三甲基硅基氧基。
上述光致变色含氟萘并吡喃化合物的制备方法,
以3,3-双(4-甲氧基苯基)-6,11-二甲基苯并[h]茚并[2,1-f]苯并哌喃-13(3h)-酮为原料,通过如下所述方法进行制备:
其中,r1为烷基的光致变色含氟萘并吡喃化合物通过低温下与有机金属试剂对羰基的加成形成对应醇类中间体;随后在dast试剂(二乙胺基三氟化硫)的作用下发生脱羟氟代反应,从而得到如分子结构式为sp1-f、sp2-f、sp3-f的目标化合物;
其中,r2为三氟甲基的光致变色含氟萘并吡喃化合物通过ruppert-parkash试剂进行羰基加成,得到sp4-si;后经水解,dast试剂介导的脱羟氟代反应,从而得到如分子结构式为sp4-f的目标化合物。
所述低温为0℃以下。
本发明的有益效果是:
本发明的光致变色含氟萘并吡喃化合物主要用于变色眼镜、光致变色薄膜、纺织品或服装等产品的光致变色图案等材料。
本发明的光致变色含氟萘并吡喃化合物的优点主要在于初期着色度小,显色浓度高,变色灵敏,褪色速度快,耐久性好,无底色。
附图说明
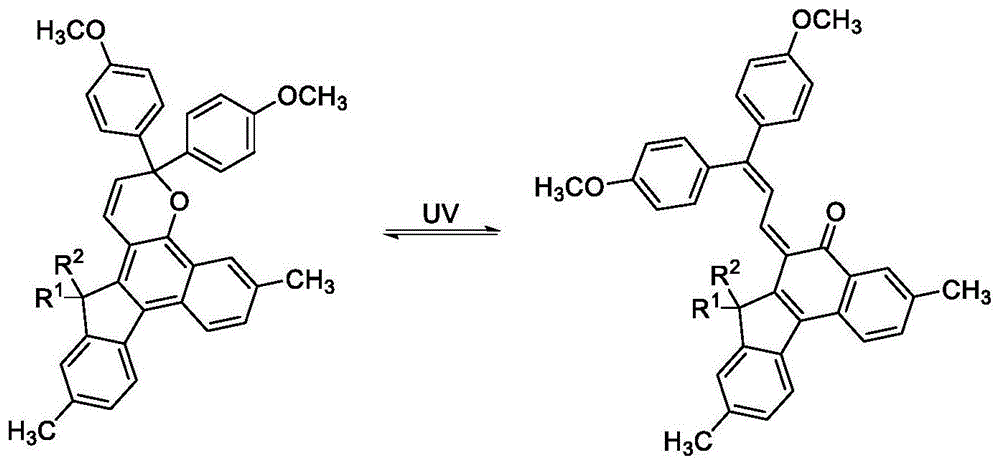
图1是本发明所涉及的光致变色含氟萘并吡喃化合物的光致变色反应原理图;
图2是本发明化合物sp1-f在不同照射时间下波长-吸光度曲线及褪色速率曲线;
图3是本发明化合物sp2-f在不同照射时间下波长-吸光度曲线及褪色速率曲线;
图4是本发明化合物sp3-f在不同照射时间下波长-吸光度曲线及褪色速率曲线;
图5是本发明化合物sp4-si在不同照射时间下波长-吸光度曲线及褪色速率曲线;
图6是本发明化合物sp4-f在不同照射时间下波长-吸光度曲线及褪色速率曲线。
具体实施方式
下面通过具体实施例,对本发明的技术方案作进一步的具体说明。
本发明中,若非特指,所采用的原料和设备等均可从市场购得或是本领域常用的。下述实施例中的方法,如无特别说明,均为本领域的常规方法。
实施例1
在分子结构通式中,当r1为甲基,r2为氟原子时,即构成光致变色化合物sp1-f,其化学名为13-氟-3,3-双(4-甲氧基苯基)-6,11,13-三甲基-3,13-二氢苯并[h]茚[2,1-f]苯并哌喃,结构式如下:
该化合物的合成方案如下所示:
具体合成方案如下所述:
中间体3,3-双(4-甲氧基)-6,11,13-三甲基-3,13-二氢苯并[h]茚[2,1-f]苯并哌喃-13-醇(int-i)的制备:
在n2气保护下,将原料s(1.0552g,2mmol)溶于30ml二氯甲烷之中,冷却至0℃,缓慢加入甲基溴化镁2m乙醚溶液(1.8ml,3.6mmol,1.8equiv),反应温度保持在0℃以下搅拌反应4小时。反应结束后,加入1m盐酸淬灭反应,二氯甲烷萃取(2×50ml)并合并有机相,随后依次用水、饱和食盐水各50ml洗涤,无水硫酸钠干燥。硅胶柱色谱(石油醚:乙酸乙酯=4:1)分离纯化,得int-i为紫色固体(0.8162g,73%)。
sp1-f的制备:
取上步所制备中间体int-i(234.2mg,0.43mmol)溶于6ml二氯甲烷之中,冷却至0℃,加入dast试剂(200μl,2.3equiv),反应温度保持在0℃以下搅拌反应1小时。反应结束后,加入5ml饱和nahco3溶液淬灭,二氯甲烷萃取(2×15ml)并合并有机相,随后用10ml饱和食盐水洗涤,无水硫酸钠干燥。硅胶柱色谱(石油醚:乙酸乙酯=20:1)分离纯化,得sp1-f为金黄色固体(104.7mg,45%)。化合物表征:1hnmr(500mhz,cdcl3)δ8.38(t,j=7.6hz,1h),8.15(d,j=9.8hz,1h),7.94(t,j=6.9hz,1h),7.73(s,1h),7.51–7.36(m,6h),7.27(d,j=7.3hz,1h),6.88(t,j=9.5hz,2h),6.79(t,j=8.7hz,2h),6.42(s,1h),6.17(dd,j=29.6,9.9hz,1h),3.79(d,j=8.9hz,3h),3.72(d,j=8.9hz,3h),2.54(d,j=3.8hz,3h),2.43(d,j=13.1hz,3h);19fnmr(471mhz,cdcl3)δ-158.70。
实施例2
在分子结构通式中,当r1为乙基,r2为氟原子时,即构成光致变色化合物sp2-f,其化学名为13-乙基-13-氟-3,3-双(4-甲氧基苯基)-6,11-二甲基-3,13-二氢苯并[h]茚[2,1-f]苯并哌喃,结构式如下:
该化合物的合成方案如下所示:
具体合成方案如下所述:
中间体13-乙基-3,3-双(4-甲氧基)-6,11-二甲基-3,13-二氢苯并[h]茚[2,1-f]苯并哌喃-13-醇(int-ii)的制备:
在n2气保护下,将原料s(1.055g,2mmol)溶于30ml二氯甲烷之中,冷却至0℃,缓慢加入乙基溴化镁2m乙醚溶液(1.8ml,3.6mmol,1.8equiv),反应温度保持在0℃以下搅拌反应4小时。反应结束后,加入1m盐酸淬灭反应,二氯甲烷萃取(2×50ml)并合并有机相,随后依次用水、饱和食盐水各50ml洗涤,无水硫酸钠干燥。硅胶柱色谱(石油醚:乙酸乙酯=4:1)分离纯化,得int-ii为紫色固体(0.8162g,73%)。
化合物表征:1hnmr(500mhz,cdcl3)δ8.36(d,j=8.6hz,1h),8.14(s,1h),7.88(d,j=7.8hz,1h),7.47(d,j=8.9hz,2h),7.40(dd,j=12.5,9.6hz,3h),7.32(s,1h),7.25(d,j=10.1hz,2h),7.20(d,j=7.8hz,1h),6.89(d,j=8.9hz,2h),6.78(d,j=8.9hz,2h),6.17(d,j=9.8hz,1h),3.81(s,3h),3.73(s,3h),2.54(s,3h),2.46(dd,j=16.9,7.6hz,2h),2.41(s,3h),0.36(t,j=7.5hz,3h);13cnmr(126mhz,cdcl3)δ159.0,158.9,147.9,144.7,144.6,138.9,137.8,136.8,136.7,136.3,136.0,135.4,130.3,129.5,128.7,128.6,128.3,127.7,126.2,124.0,123.9,122.2,121.7,120.5,113.5,113.5,113.3,104.3,102.9,82.7,55.3,55.2,31.0,30.8,22.0,21.4,8.0,7.9。
sp2-f的制备:
取上步所制备中间体int-ii(234.2mg,0.42mmol)溶于6ml二氯甲烷之中,冷却至0℃,加入dast试剂(200μl,2.2equiv),反应温度保持在0℃以下搅拌反应1小时。反应结束后,加入5ml饱和nahco3溶液淬灭,二氯甲烷萃取(2×15ml)并合并有机相,随后用10ml饱和食盐水洗涤,无水硫酸钠干燥。硅胶柱色谱(石油醚:乙酸乙酯=20:1)分离纯化,得sp3-f为金黄色固体(104.7mg,45%)。化合物表征:1hnmr(500mhz,cdcl3)δ8.36(d,j=8.6hz,1h),8.14(s,1h),7.88(d,j=7.8hz,1h),7.47(d,j=8.9hz,2h),7.40(dd,j=12.5,9.6hz,3h),7.32(s,1h),7.25(d,j=10.1hz,2h),7.20(d,j=7.8hz,1h),6.89(d,j=8.9hz,2h),6.78(d,j=8.9hz,2h),6.17(d,j=9.8hz,1h),3.81(s,3h),3.73(s,3h),2.54(s,3h),2.46(dd,j=16.9,7.6hz,2h),2.41(s,3h),0.36(t,j=7.5hz,3h);13cnmr(126mhz,cdcl3)δ159.0,158.9,147.9,137.8,136.3,136.0,135.4,130.3,129.5,128.7,128.6,128.3,127.7,126.2,124.0(d,j=7.9hz),122.2,121.7,120.5,120.5,113.5,113.5,113.3,104.3,102.9,82.7,77.3,55.3,55.2,31.0,30.8,22.0,21.4,8.0,7.9;19fnmr(471mhz,cdcl3)δ-159.24(s)。
实施例3
在分子结构通式中,当r1为正丁基,r2为氟原子时,即构成光致变色化合物sp3-f,其化学名为13-正丁基-13-氟-3,3-双(4-甲氧基苯基)-6,11-二甲基-3,13-二氢苯并[h]茚[2,1-f]苯并哌喃,结构式如下:
该化合物的合成方案如下所示:
具体合成方案如下所述:
中间体13-正丁基-3,3-双(4-甲氧基苯基)-6,11-二甲基-3,13-二氢苯并[h]茚[2,1-f]苯并哌喃-13-醇(int-iii)的制备:
在n2气保护下,将原料s(0.954g,1.8mmol)溶于25ml二氯甲烷之中,冷却至-30℃,缓慢加入正丁基锂(1.07ml,2.7mmol,1.5equiv),反应温度保持在-30℃以下搅拌反应3小时。反应结束后,加入1m盐酸淬灭反应,二氯甲烷萃取(2×50ml)并合并有机相,随后依次用水、饱和食盐水各50ml洗涤,无水硫酸钠干燥。硅胶柱色谱(石油醚:乙酸乙酯=20:1)分离,得黄绿色固体混合物(0.82g);后采用乙腈重结晶纯化,得白色固体(0.096g,57%)。化合物表征:1hnmr(500mhz,cdcl3)δ8.38(d,j=8.6hz,1h),8.16(s,1h),7.88(d,j=7.9hz,1h),7.50–7.40(m,5h),7.38(dd,j=8.6,1.4hz,1h),7.30(s,1h),7.16(d,j=7.7hz,1h),6.88(d,j=8.8hz,2h),6.75(d,j=8.8hz,2h),6.14(d,j=9.8hz,1h),3.79(s,3h),3.71(s,3h),2.54(s,3h),2.41(s,3h),2.31(td,j=12.5,4.6hz,1h),2.25–2.16(m,2h),1.27(s,1h),1.10–0.96(m,2h),0.58(t,j=7.3hz,3h),0.48(dt,j=13.1,7.9hz,1h),0.38–0.25(m,1h)。
sp3-f的制备:
取上步所制备中间体int-iii(251.2mg,0.43mmol)溶于5ml二氯甲烷之中,冷却至0℃,加入dast试剂(230μl,2.3equiv),反应温度保持在0℃以下搅拌反应1小时。反应结束后,加入5ml饱和nahco3溶液淬灭,二氯甲烷萃取(2×15ml)并合并有机相,随后用10ml饱和食盐水洗涤,无水硫酸钠干燥。硅胶柱色谱(石油醚:乙酸乙酯=20:1)分离纯化,得sp3-f为固体(138.2mg,53%)。化合物表征:1hnmr(500mhz,cdcl3)δ8.38(t,j=7.6hz,1h),8.15(d,j=9.8hz,1h),7.94(t,j=6.9hz,1h),7.73(s,1h),7.51–7.36(m,6h),7.27(d,j=7.3hz,1h),6.88(t,j=9.5hz,2h),6.79(t,j=8.7hz,2h),6.42(s,1h),6.17(dd,j=29.6,9.9hz,1h),3.79(d,j=8.9hz,3h),3.72(d,j=8.9hz,3h),2.54(d,j=3.8hz,3h),2.43(d,j=13.1hz,3h);13cnmr(126mhz,cdcl3)δ159.1,158.9,148.2,143.8,139.9,137.7,136.6,135.9,130.8,129.7,129.3,128.7,128.6,128.2,128.1,127.6,126.3,125.5,123.9,122.3,121.8,119.7,113.6,113.4,85.3,82.7,77.2,76.5,60.4,55.3,55.2,21.9,21.6,21.0,14.2;19fnmr(471mhz,cdcl3)δ-76.10。
实施例4
在分子结构通式中,当r1为三氟甲基,r2为三甲基硅氧基时,即构成光致变色化合物sp4-si,其化学名为((3,3-双(4-甲氧基苯基)-6,11-二甲基-13-(三氟甲基)-3,13-二氢苯并[h]茚[2,1-f]苯并哌喃-13-基)氧基)三甲基硅烷,结构式如下:
该化合物的合成方案如下所示:
具体合成方案如下所述:
在n2气保护下,将原料s(0.902g,1.7mmol)溶于30ml二氯甲烷之中,冷却至-78℃,依次加入tbaf(tbuoh)3(59.3mg,0.11mol,6mol%)及tmscf3(2.3mmol,1.35equiv)反应温度保持在-78℃以下搅拌反应5.5小时。反应结束后,加入1m盐酸淬灭反应,二氯甲烷萃取(2×40ml)并合并有机相,随后依次用水、饱和食盐水各50ml洗涤,无水硫酸钠干燥。硅胶柱色谱(石油醚:乙酸乙酯=40:1)分离纯化,得sp4-si紫色固体(0.619g,54%)。化合物表征:1hnmr(500mhz,cdcl3)δ8.41(s,1h),8.16(s,1h),7.96(d,j=3.9hz,1h),7.75(s,1h),7.43(m,6h),6.86(d,j=8.9hz,2h),6.80(d,j=8.9hz,2h),6.18(d,j=10.0hz,1h),3.78(s,3h),3.73(s,3h),2.54(s,3h),2.43(s,3h),-0.25(s,9h);13cnmr(126mhz,cdcl3)δ159.1,159.1,158.9,158.8,148.1,148.1,143.2,142.2,140.1,139.5,138.1,137.7,137.6,136.5,136.0,135.9,135.6,135.5,135.4,135.1,131.0,130.6,129.6,129.6,129.3,129.1,128.7,128.6,128.2,128.1,127.9,127.6,127.5,126.9,126.6,126.3,124.0,124.0,122.2,121.9,121.6,120.0,114.4,113.5,113.4(d,j=1.7hz),113.0,86.6,82.5,82.4,55.3,55.3,55.2,55.2–55.2(m),22.0,21.2,21.6,21.4,1.2,1.1;19fnmr(471mhz,cdcl3)δ-76.97。
实施例5
在分子结构通式中,当r1为三氟甲基,r2为氟原子时,即构成光致变色化合物sp4-f,其化学名为13-氟-3,3-双(4-甲氧基苯基)-6,11-二甲基-13-(三氟甲基)-3,13-二氢苯并[h]茚[2,1-f]苯并哌喃,结构式如下:
该化合物的合成方案如下所示:
具体合成方案如下所述:
中间体3,3-双(4-甲氧基苯基)-6,11-二甲基-13-(三氟甲基)-3,13-二氢苯并[h]茚[2,1-f]苯并哌喃-13-醇(int-iv)的制备:
取将sp4-si(286.7mg,0.43mmol)溶于2.5ml甲醇与3ml二氯甲烷的混合溶液之中,加入0.1m氢氧化钾水溶液(0.5ml),室温搅拌反应18小时。反应结束后,加水洗涤,二氯甲烷萃取(2×50ml)并合并有机相,随后依次用水、饱和食盐水各50ml洗涤,无水硫酸钠干燥。硅胶柱色谱(石油醚:乙酸乙酯=40:1)分离纯化,得int-iv为紫色固体(177.8mg,69.6%)。化合物表征:1hnmr(500mhz,cdcl3)δ8.38(t,j=7.6hz,1h),8.15(d,j=9.8hz,1h),7.94(t,j=6.9hz,1h),7.73(s,1h),7.51–7.36(m,6h),7.27(d,j=7.3hz,1h),6.88(t,j=9.5hz,2h),6.79(t,j=8.7hz,2h),6.42(s,1h),6.17(dd,j=29.6,9.9hz,1h),3.79(d,j=8.9hz,3h),3.72(d,j=8.9hz,3h),2.54(d,j=3.8hz,3h),2.43(d,j=13.1hz,3h);13cnmr(126mhz,cdcl3)δ159.1,158.9,148.2,143.8,139.9,137.7,136.6,135.9,130.8,129.7,129.3,128.7,128.6,128.2,128.1,127.6,126.3,125.5,123.9,122.3,121.8,119.7,113.6,113.4,85.3,82.7,77.2,76.5,60.4,55.3,55.2,22.0,21.6,21.0,14.2;19fnmr(471mhz,cdcl3)δ-76.10。
sp4-f的制备:
取上步所制备中间体int-iv(102.6mg,0.17mmol)溶于2.5ml二氯甲烷之中,冷却至0℃,加入dast试剂(35μl,1.0equiv),反应温度保持在0℃以下搅拌反应1小时。反应结束后,加入5ml饱和nahco3溶液淬灭,二氯甲烷萃取(2×15ml)并合并有机相,随后用10ml饱和食盐水洗涤,无水硫酸钠干燥。硅胶柱色谱(石油醚:乙酸乙酯=60:1)分离纯化,得sp4-f为金黄色固体(63.8mg,61%)。化合物表征:1hnmr(500mhz,cdcl3)δ8.38(t,j=7.6hz,1h),8.15(d,j=9.8hz,1h),7.94(t,j=6.9hz,1h),7.73(s,1h),7.51–7.36(m,6h),7.27(d,j=7.3hz,1h),6.88(t,j=9.5hz,2h),6.79(t,j=8.7hz,2h),6.42(s,1h),6.17(dd,j=29.6,9.9hz,1h),3.79(d,j=8.9hz,3h),3.72(d,j=8.9hz,3h),2.54(d,j=3.8hz,3h),2.43(d,j=13.1hz,3h);19fnmr(471mhz,cdcl3)-76.33(d,j=11.6hz),-182.88(d,j=11.5hz);hrms(esi)for[c37h29f4o3]+calcd597.2047,found:597.2031。
本发明所涉及光致变色含氟萘并吡喃化合物的光致变色反应原理如图1所示,图2-图6是本发明化合物sp1-f、sp2-f、sp3-f、sp4-si、sp4-f在不同照射时间下波长-吸光度曲线及褪色速率曲线。本发明的光致变色含氟萘并吡喃化合物的初期着色度小,显色浓度高,变色灵敏,,褪色速度快,耐久性好,无底色。
以上所述的实施例只是本发明的一种较佳的方案,并非对本发明作任何形式上的限制,在不超出权利要求所记载的技术方案的前提下还有其它的变体及改型。
- 还没有人留言评论。精彩留言会获得点赞!