利用麦芽糖进行CHO细胞培养的方法与流程
本发明涉及生物制药领域,特别是涉及cho(chinesehamsterovary,中国仓鼠卵巢细胞)的细胞培养及目标蛋白的表达。
背景技术:
由于在蛋白折叠及修饰方面具有天然的优势,以cho细胞为代表的哺乳动物细胞被广泛的用于重组蛋白的生产。在动物细胞的培养过程中,为了避免在引入动物源的潜在的致病污染物,细胞的培养一般采用化学成份明确的培养基。葡萄糖作为一种能被哺乳动物细胞高效利用的糖类,因而其被广泛的用作细胞培养的碳源。
作为cho细胞培养基中最常用的碳源,葡萄糖无论是在成本还是维持细胞代谢生长方面具有无可比拟的优势。但是,葡萄糖作为碳源也会导致培养过程中乳酸积累和代谢效率低下的问题。以葡萄糖作为碳源的培养环境中,cho细胞的这种表现通常被称为瓦氏效应(wurbergeeffect)。针对乳酸和代谢效率的问题,研究者尝试用其他单糖和寡糖来替代或者部分替代葡萄糖作为cho细胞培养的碳源,但是这些实验结果并不是很理想。
技术实现要素:
我们发现,选择麦芽糖作为碳源或部分碳源时,结合工艺优化,有利于地降低了乳酸,同时提高了蛋白表达量。在本发明中,我们主要建立了麦芽糖含量的测定方法,优化了麦芽糖补加量、补加时间等工艺条件,建立了一个完善的利用麦芽糖进行cho细胞培养的工艺。
在本发明的一个方面中,提供一种培养cho细胞的方法,其特征在于,所述方法包括以分批补料的方式向培养物中添加麦芽糖。
在本发明的另一个方面中,提供一种检测样品中麦芽糖水平的方法,其特征在于,所述方法包括:
检测第一份样品中的葡萄糖水平,作为第一葡萄糖水平;
在第二份样品中添加一定量的葡萄糖苷酶在足以令样品中可能存在的麦芽糖充分水解的条件下反应完全;
检测第二份样品中的葡萄糖水平,作为第二葡萄糖水平;和
根据第一与第二葡萄糖水平的差值确定样品中的麦芽糖水平;
所述第一份样品与第二份样品组成相同。
附图说明
下面结合附图对本发明作进一步说明,其中这些显示仅为了图示说明本发明的实施方案,而不是为了局限本发明的范围。
图1:显示不同葡萄糖苷酶用量水解麦芽糖的检测结果。
图2:显示采用本发明方法测得葡萄糖标准曲线。
图3:显示本发明cho细胞培养相比传统cho细胞培养的培养介质中麦芽糖水平的测定结果。
图4:显示本发明cho细胞培养相比传统cho细胞培养所造成的乳酸累积。
图5:显示本发明cho细胞培养相比传统cho细胞培养所得到的目标蛋白质产量和蛋白质生产能力。
具体实施方式
本申请中科技术语的含意与本领域技术人员的普遍理解一致,除非另做说明。本申请中,“一”或其与各种量词的组合既包括单数含意也包括复数含意,除非特别说明。本申请中,对于同一参数或变量,当给出多个数值、数值范围、或其组合予以说明时,相当于具体揭示了这些数值、范围端值以及由它们任意组合而成的数值范围。本申请中,任一数值不论是否带有“约”之类的修饰词,一律涵盖本领域技术人员能够理解的约略范围,例如正负10%、5%等。本文中,每一“实施方式”均同等地指代且涵盖了本申请各项方法和各项系统的实施方式。本申请中,任意实施方式中一项或多项技术特征可以与任何一个或多个其他实施方式中的一项或多项技术特征自由组合,由此得到的实施方式同样属于本申请公开的内容。
cho细胞培养
一方面,本发明提供一种培养cho细胞的方法,其特征在于,所述方法包括以分批补料的方式向培养物中添加麦芽糖。
本文中,“中国仓鼠卵巢(chinesehamsterovary)细胞”或“cho细胞”指衍生自成年中国仓鼠卵巢的活检组织的贴壁细胞系,其广泛用于生物制品(例如蛋白质)的表达。一般地,cho细胞培养所用培养基没有特别的限制,如本领域技术人员所能理解,只要所用培养基能够维持cho细胞的生长和生产即可。在一个实施方式中,cho细胞培养采用商品化的化学成分明确的不含血清的培养基。在一些实施方式中,cho细胞培养于5%co2、37℃环境中进行;1:5传代,2-3天传代一次。在一些实施方式中,cho细胞为经改造以表达外源蛋白质的cho细胞。
一般而言,可以通过定期补料的策略进行cho细胞的连续培养。在一些实施方式中,cho细胞培养期为14天。在一些实施方式中,cho细胞培养包括发酵。
本发明方法中,cho细胞培养采用选自下组的糖类物质:葡萄糖、麦芽糖,及它们的组合。
本发明方法中,以分批补料的方式向培养物中添加麦芽糖。在一些实施方式中,以分批补料的方式向培养物中添加的葡萄糖总量为10-30g/l,例如18-22g/l,15-25g/l,例如20g/l。
在一些实施方式中,在培养开始后分多次进行麦芽糖补料,例如四次。在一些实施方式中,相邻的两次麦芽糖补料之间间隔至少1天。在一些实施方式中,相邻的两次麦芽糖补料之间间隔1-3天。在一些实施方式中,每次补加1-10g/l麦芽糖,例如2-8g/l,3-7g/l,例如5g/l麦芽糖。在具体实施方式中,在第5、7、10、12天进行麦芽糖补料。本文中,每次麦芽糖补料的量为“5g/l”表示每次将麦芽糖补料添加至培养容器(例如发酵罐)后,容器内的麦芽糖浓度升高5g/l。
一般而言,首次麦芽糖补料前cho细胞培养所用碳源为葡萄糖,其用量没有特别的限制,只要所用葡萄糖能够维持cho细胞的生长和代谢即可。
在一些实施方式中,本发明方法还包括葡萄糖补料。在一些实施方式中,葡萄糖补料为针对麦芽糖补料间期的葡萄糖补料。本文中,“麦芽糖补料间期”意指从本次麦芽糖补料起至下次麦芽糖补料所隔天数。在一些实施方式中,在麦芽糖补料当天进行葡萄糖补料。在一些实施方式中,每次葡萄糖补料的量为0.1-1.5g/l/天×麦芽糖补料间期天数,例如0.6-1.3g/l/天×麦芽糖补料间期天数,例如0.8-1.2g/l/天×麦芽糖补料间期天数,例如1g/l/天×麦芽糖补料间期天数。本文中,补加“1g/l/天”的葡萄糖表示在将葡萄糖补料添加至培养容器(例如发酵罐)后,容器内的葡萄糖浓度升高的量为:1g/l/天×麦芽糖补料间期天数。例如,若在第7天进行麦芽糖补料,距离下次麦芽糖补料的第10天间隔3天,那么本次补加的葡萄糖的质量为[原始培养体积(v0)+补加体积(vs)]×1g/l/天×3天。一般而言,葡萄糖补料体积对原始体积的影响可忽略不计,则本次补加的葡萄糖的质量为原始培养体积(v0)×1g/l/天×3天。
麦芽糖水平的测定
又一方面,本发明提供一种检测样品中麦芽糖水平的方法,其特征在于,所述方法包括:
检测第一份样品中的葡萄糖水平,作为第一葡萄糖水平;
在第二份样品中添加一定量的葡萄糖苷酶在足以令样品中可能存在的麦芽糖充分水解的条件下反应完全;
检测第二份样品中的葡萄糖水平,作为第二葡萄糖水平;和
根据第一与第二葡萄糖水平的差值确定样品中的麦芽糖水平;
所述第一份样品与第二份样品组成相同。
在一些实施方式中,样品中的葡萄糖水平采用葡萄糖氧化酶法检测。在一些实施方式中,样品中的葡萄糖水平采用god-pod法检测。god-pod法是用于检测葡萄糖水平的常规方法。该方法中,葡萄糖氧化酶(god)利用氧和水将葡萄糖氧化为葡萄糖酸,并释放过氧化氢;过氧化物酶(pod)在4-氨基安替比林(4-app)和过氧化氢存在下,生成红色醌类化合物,即发生trinder反应。红色醌类化合物的生成量与葡萄糖含量成正比。在一些实施方式中,样品中的葡萄糖水平还可采用本领域已知的其它葡萄糖检测方法检测,例如,己糖激酶法。
本发明中,术语“麦芽糖水平”意在表示,一定介质(例如样品)中麦芽糖的质量或浓度,例如,质量浓度。类似地,“葡萄糖水平”意在表示一定介质(例如样品)中葡萄糖的质量或浓度,例如,质量浓度。应理解,在计算第一与第二葡萄糖水平的差值之前,将第一与第二葡萄糖水平的计算基础统一化。例如,若采用第一份样品中的葡萄糖质量浓度作为第一葡萄糖水平,则第二葡萄糖水平也应以葡萄糖质量浓度形式表达,以与第一葡萄糖水平形成有意义的差值。类似地,若采用一定体积的第一份样品中的葡萄糖质量作为第一葡萄糖水平,则第二葡萄糖水平也应以该相应体积的葡萄糖质量形式表达,以与第一葡萄糖水平形成有意义的差值。一般认为,第二葡萄糖水平高于或等于第一葡萄糖水平,而第一与第二葡萄糖水平的差值表示两者间相差的值,也即,第二葡萄糖水平减去第一葡萄糖水平所得的值。一般认为,所述第一与第二葡萄糖水平的差值为正值。在一个实施方式中,第一与第二葡萄糖水平的差值为第一葡萄糖质量浓度与第二葡萄糖质量浓度的差值,其表示样品中的麦芽糖质量浓度值。
在一些实施方式中,葡萄糖水平相对于葡萄糖浓度标准曲线标准化。在一些优选实施方式中,本发明方法还包括制作用于葡萄糖水平标准化的葡萄糖标准曲线。作为一个示例性实施方式,通过如下方式产生葡萄糖标准曲线:配制具有递增浓度的葡萄糖标准品溶液,并用相应的葡萄糖检测法(例如god-pod法)测定各葡萄糖标准品溶液所对应的检测值(例如红色醌类化合物水平),将所得多个检测值作为葡萄糖标准品浓度的函数作图,若线性关系良好,则用作葡萄糖标准曲线。在一些实施方式中,具有递增浓度的葡萄糖标准品溶液模拟待对照的反应体系配制。
“葡萄糖苷酶”是糖苷水解酶大家族中的一大类酶,主要功能为水解葡萄糖苷键,释放出葡萄糖作为产物。在一些实施方式中,所述葡萄糖苷酶是α-葡萄糖苷酶。在一些实施方式中,葡萄糖苷酶来自133个糖苷水解酶家族(gh1-gh133),例如,来自gh1、gh3、gh4、gh5、gh9、gh13、gh17、gh30、gh31、gh63、gh97、gh116与gh122等糖苷水解酶家族。在一些实施方式中,本发明所用的葡萄糖苷酶具有7×105u/g的酶活性。在一些实施方式中,采用葡萄糖苷酶g26690-100g(acmec,上海吉至生化科技有限公司)。
“足以令样品中可能存在的麦芽糖充分水解的条件”表示在这样的条件下,样品中可能存在的麦芽糖能够被葡萄糖苷酶完全水解。
在一些实施方式中,足以令样品中可能存在的麦芽糖充分水解的条件包括在30-60摄氏度,例如35-60、40-60、45-60、45-55摄氏度的温度范围,例如50摄氏度,进行反应。
在一些实施方式中,足以令样品中可能存在的麦芽糖充分水解的条件包括使反应进行5-60分钟,例如,进行10-50、20-40分钟,例如30分钟。
在一些实施方式中,足以令样品中可能存在的麦芽糖充分水解的条件包括足够的葡萄糖苷酶量。在一些实施方式中,足够的葡萄糖苷酶量基于预期存在的麦芽糖量和所用葡萄糖苷酶的已知酶活确定。在一些实施方式中,足够的葡萄糖苷酶量通过测试确定。
作为一个示例,使用递增的不同酶量,在确定的温度与已知量的麦芽糖反应确定的时间长度;检测并记录与生成的葡萄糖水平相对应的检测值(例如,若采用god-pod法,则检测值即为红色醌类化合物水平);使检测值水平稳定达到平台期(也即,使检测值不再随所用酶量增加而增加)的酶量即为足够的葡萄糖苷酶量。
作为另一个示例,使用递增的不同酶量,在确定的温度与已知量的麦芽糖反应确定的时间长度;检测并记录与生成的葡萄糖水平相对应的检测值(例如,若采用god-pod法,检测值即为红色醌类化合物水平);另采用经历相同条件葡萄糖标准品制作葡萄糖标准曲线;将所得检测值与葡萄糖标准曲线比对获得相应的葡萄糖水平;使生成的葡萄糖水平稳定达到已知量的麦芽糖所能生成的葡萄糖水平(也即,不再随所用酶量的增加而增加)的酶量即为足够的葡萄糖苷酶量。
本发明的方法中,第一葡萄糖水平反映样品中葡萄糖的水平;第二葡萄糖水平反映样品中葡萄糖与麦芽糖的总体水平,因而,第一与第二葡萄糖水平的差值反映样品中的麦芽糖水平。
应理解,第一份样品与第二份样品组成相同表示第一份样品与第二份样品之间没有顺序的限制,也不构成数量的限制。例如,第一份样品与第二份样品可互换使用。例如,在并行检测或验证时,可采用多于两份的样品。本发明方法中,第一份样品与第二份样品来自同一来源。例如,第一份样品与第二份样品同时或以紧密时间顺序(也即,无时间间隔所致的组成差异)获取自同一来源,如细胞培养物。例如,第一份样品与第二份样品来自同一次取样的再划分样品,例如,同一细胞培养物样品的进一步细分样品。
在一些实施方式中,所述样品包含麦芽糖。在一些实施方式中,所述样品中还包含葡萄糖。在一些实施方式中,所述样品不包含除葡萄糖和麦芽糖以外的其它糖。在一些实施方式中,所述样品为细胞培养介质,或由细胞培养介质制得(例如分离所得)的上清液。在一些实施方式中,所述样品为发酵液液体。
实施例
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。本领域技术人员可对本发明做出适当的修改、变动,这些修改和变动都在本发明的范围之内。
实施例1:两步差量法测定麦芽糖
使用两步差量法准确测定cho细胞培养体系中的麦芽糖水平。
具体地,将麦芽糖(m5885-500g,sigma)配制成400g/l的母液,过滤除菌。取适量用中性pbs稀释至20g/l备用。葡萄糖苷酶(g26690-100g,acmec,上海吉至生化科技有限公司;酶活:7×105u/g)按说明书要求用ddh2o稀释配制成70u/μl的酶母液,4℃保存备用。
(1)酶反应条件的确立
根据酶活力计算及试剂实验操作便捷性,我们设计、测试并采用以下反应体系:
样品测试体系:
样品:5μl
dpbs:92μl
葡萄糖苷酶:3μl
葡萄糖标曲体系:
葡萄糖标准品(纯水配制):10μl
dpbs:87μl
葡萄糖苷酶:3μl
其中,采用葡萄糖标准品配制成梯度浓度的葡萄糖溶液并制得标准曲线。样品和标曲均为100μl体系。在96尖底板中配制上述反应体系,混匀,置于50摄氏度恒温箱中孵育30min。
(2)god-pod法测定葡萄糖水平
葡萄糖标曲体系经过葡萄糖苷酶反应后经god-pod法检测生成葡萄糖浓度标准曲线。样品反应体系通过两步反应分别经god-pod法检测生成测定值,并参照标准曲线确定样品中测得的葡萄糖水平。
(3)结果分析
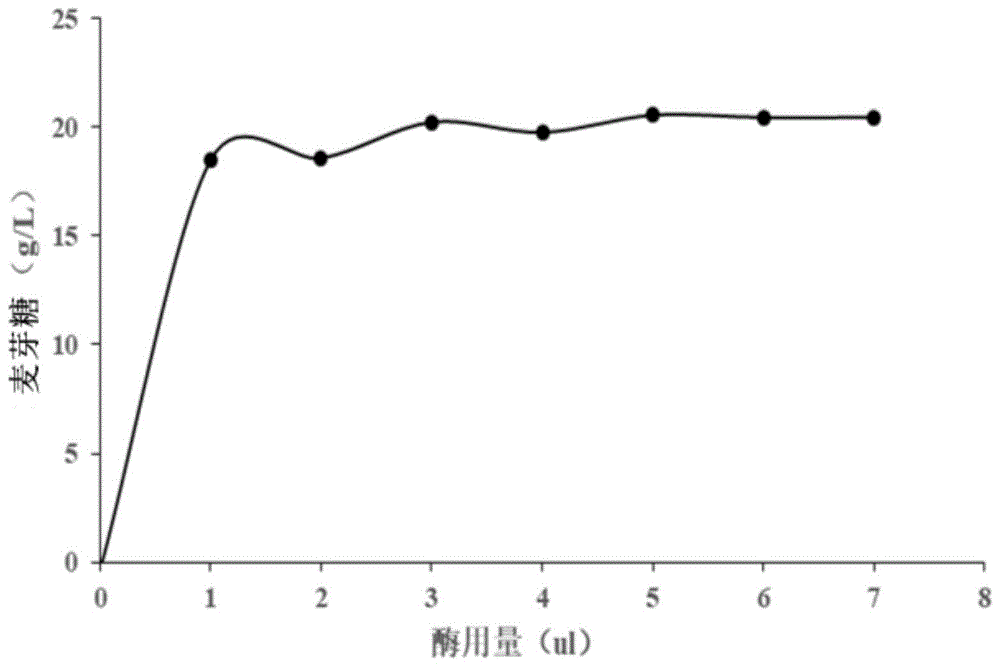
图1显示所测麦芽糖浓度作为各葡萄糖苷酶用量的函数作图,表明添加3μl葡萄糖苷酶,在50℃条件下反应30min,可有效精确检测20g/l浓度范围内的麦芽糖浓度。
生成葡萄糖浓度标准曲线示于图2,表明梯度葡萄糖标准品经反应后经酶标仪检测得到的吸光度值与葡萄糖标曲浓度具有良好线性关系。
实施例2:麦芽糖补加工艺的建立
我们使用平台a、b两株表达正常单抗mab的cho细胞株。基于平台工艺,确定下面的实验策略。实验使用的培养基包括用于利于cho细胞蛋白表达的商业化的productionmedium及feedmedium,和经纯净水溶解配制且经过滤除菌的400g/l麦芽糖母液。
(1)条件设计
分别用细胞株a、b进行以下工艺的实验,采用14天的cho细胞培养工艺作为对照组(-1),采用14天的本发明麦芽糖补料培养工艺作为实验组(-2)。其中,对照组培养过程中按消耗葡萄糖的量(具体是参考上次补糖后水平和此次测量之差)添加葡萄糖。与对照组相比,实验组在平台工艺的基础上改变补料策略,在第5天、第7天、第10天和第12天各补加5g/l的麦芽糖,并针对麦芽糖补料间期按1g/l/天×麦芽糖补料间期天数的补加量添加葡萄糖。每组实验设两个重复。
记录每次补料时间、补料比例、细胞生长活率和密度及细胞直径,测定发酵液中葡萄糖、乳酸及麦芽糖浓度,并在培养结束时测定目标蛋白质浓度。
其中,发酵液中的麦芽糖浓度采用本发明的两步差量法测定。具体为:获取一定体积的细胞培养液,生成体积均为5μl的两份样品。第一份样品用dpbs补至100μl,god-pod法检测并参照葡萄糖标准曲线获得第一葡萄糖水平。向第二份样品添加按先前确定的反应体系配制的3μl葡萄糖苷酶和92μldpbs。将其混匀,置于50摄氏度恒温箱中孵育30min。god-pod法检测并参考葡萄糖标准曲线获得第二葡萄糖水平。求得第二葡萄糖水平与第一葡萄糖水平之差,进而得到相应的麦芽糖水平。
(2)结果分析
a.麦芽糖水平分析
图3是细胞株a、b培养过程中麦芽糖水平的变化情况,显示麦芽糖水平并未出现阶梯状上升,表明麦芽糖作为碳源可被cho细胞持续利用。
b.乳酸积累分析
图4显示了细胞株a、b培养过程中乳酸积累的情况。细胞株a、b均是我们选择的存在乳酸积累的细胞株。由图4(a)可见,在第6天之后,相比平台工艺,采用麦芽糖工艺进行细胞培养缓解了乳酸积累问题。由4(b)可见类似结果。结果表明,麦芽糖工艺有助于缓解cho细胞培养过程中的乳酸(lac)积累问题。
c.蛋白质表达
通过比较第14天的目标蛋白质的表达量(titer)可见,相比对照组,采用麦芽糖工艺培养的细胞株a、b的目标蛋白质表达均有大幅度提高,如图5所示。其中,单个细胞蛋白质表达能力指标qp(由titer与ivcd的商值计算得到)也有明显提高。具体地,与对照组相比,细胞株a、b的蛋白质表达分别由0.38g/l提高至1.01g/l,0.57g/l提高至1.01g/l,表达量分别提高266%和177%。qp分别提高了271%和195%。
通过不同cho细胞培养工艺之比较,表明本发明的麦芽糖工艺可以有效地缓解cho细胞培养过程中的乳酸积累问题,并有效地提高目标蛋白质的表达量。
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
- 还没有人留言评论。精彩留言会获得点赞!