一种拟穴青蟹组织外泌体分离的方法与流程
本发明涉及外泌体提取分离的技术领域,具体为一种拟穴青蟹组织外泌体分离的方法。
背景技术:
外泌体是一类由胞内体的膜内馅产生的直径在30-200nm范围内的具有双层膜的脂质囊泡。这些囊泡在内体中形成,一旦内体与细胞膜融合,它们就会以胞吐方式释放到细胞外环境中。外泌体作为宿主细胞分泌的细胞代替物,广泛存在于多种生物体液中,包括血浆、唾液、滑膜液、痰液、脑脊液、淋巴液和腹水等,并携带大量以多种生物活性分子为主的种类丰富的内容物,如来源于细胞的特异性蛋白质、信号肽、脂质和核酸。胞外外泌体可以被其临近细胞接纳,而外泌体内含物质也会发挥相应的生物学功能,包括对细胞内的免疫调控、逃避细胞凋亡、免疫监视的逃避、耐药等。
外泌体领域的研究时间较短,涉及的物种较少。主要集中对脊椎动物的研究,对无脊椎动物的研究较少,而在甲壳动物中尚未报道。而关于外泌体的提取方法目前已经报道有超速离心、试剂盒、超滤、蔗糖密度梯度离心等方法,各种方法各有利弊。因为暂无可稳定培养的细胞系,目前针对甲壳动物外泌体的提取存在较大的难度。因此目前报道的利用培养基进行细胞培养从而获取胞外外泌体的方法暂不适用。另外,市场上的外泌体快速提取试剂盒主要针对的是哺乳动物,课题组在尝试过后发现此类试剂盒并不适用于青蟹等甲壳类动物。而常用的超速离心,步骤虽然简单,但是在课题组对实验方法探索时发现简单的超速离心无法分离到纯度较高的外泌体。因此,建立一套完整的,稳定有效,纯度较高并且操作简单的青蟹组织外泌体的制备及应用方法具有重要的实用价值。
技术实现要素:
本发明的目的在于提供一种拟穴青蟹组织外泌体提取分离的方法,以解决现有技术存在的问题。
一种拟穴青蟹组织外泌体分离的方法,主要包括以下步骤:
s1)组织提取:取螃蟹组织,将组织剪碎,置于预冷的0.3%胰蛋白酶液中;
s2)组织消化:37℃温育裂解20min;加入预冷的0.03%的胰酶抑制剂终止反应;
s3)低速离心:将s2)中组织单细胞悬液使用低温离心机进行低速离心10min,以期除去组织与细胞成分,离心完毕后将离心管内上清液转移至新管备用,弃掉沉淀;
s4)再次低速离心:将s3)中取得的上清使用低温离心机进行低速4℃离心30min,以期除去死细胞,离心完毕后将离心管内上清液转移至新管备用,弃掉沉淀;
s5)高速离心:将s4)中取得的上清使用低温离心机进行4℃高速离心1h,以期消除细胞碎片,离心完毕后将离心管内上清液转移至新管备用,弃掉沉淀;
s6)再次高速离心:将s5)中取得的上清使用低温离心机进行4℃高速离心2h,以沉淀外泌体,离心完毕后小心吸出上清保留沉淀部分;
s7)重悬沉淀:将s6)中获得的沉淀用0.95m蔗糖溶液重悬沉淀;
s8)蔗糖密度梯度离心:往超离管里依次加入2.0m蔗糖溶液、1.3m蔗糖溶液、s7)中获得的沉淀重悬液;
s9)超速离心:使用低温离心机进行4℃,超速离心16h,吸取适量1.3m、0.95m蔗糖溶液的中间层溶液,用适量预冷的pbs重悬;
s10)再次超速离心:将s9)中获得的上层溶液使用低温离心机进行4℃,超速离心2h,离心完毕后小心吸出上清保留沉淀部分;
s11)透析袋透析:将s10)中取得的沉淀用预冷的pbs重悬,使用mw:8000-14000的透析袋进行4℃透析3h至5h;
s12)滤膜过滤:用适量预冷的pbs重悬s11)中获得的透析后的溶液,使用一次性注射器吸取重悬后的液体缓慢滴至规格为0.22μm的细胞滤膜进行过滤;
s13)超速离心:将s12)中过滤后的溶液使用低温离心机进行4℃,超速离心2h,离心完毕后小心吸上清保留沉淀部分;
s14)重悬沉淀:使用适量的pbs将s13)中获得的重悬沉淀,即为所提取分离的外泌体产物。
透析后再超离的目的是通过超离获得透析处理过后的外泌体沉淀(透析过程中液体体积较大,外泌体浓度较低)。
两次超离的目的在于进一步出去杂蛋白以及达到稀释蔗糖的效果,且有利于提高透析效率。
进一步的,步骤3)中低速离心的速度为800×g,步骤4)中低速离心的速度为2000×g,步骤5)中高速离心的速度为10000×g,步骤6)中高速离心的速度为130000×g,步骤9)中超速离心的速度为200000×g,步骤10)中超速离心的速度为130000×g,步骤13)超速离心的速度为130000×g。
其中步骤s2)使用的剪刀为无菌解剖剪,在组织处理时,将组织置于灭菌并含有少量0.3%胰蛋白酶液的容器中进行剪碎。
步骤s3)和步骤s4)中在低速离心前对所使用的离心管进行灭菌处理。
步骤s5)、s6)、s9)、s10)和s13)中使用的超速离心管为14×89mm的超离管。离心时超离管的溶液不低于12ml。
步骤s7)和s8)中的蔗糖溶液为使用超纯水配制。
步骤s7)、s9)、s12)和s14)中的蔗糖溶液,pbs溶液为使用0.22μm滤膜除菌后的溶液。
步骤s9)中吸取1.3m、0.95m蔗糖溶液的中间层溶液时为从上往下吸取约7ml溶液。
步骤s11)中进行透析时用超纯水进行透析,中间进行多次换水。
步骤s14)中所用的pbs缓冲液使用体积为100μl,所得的外泌体放置于-80℃冰箱内长期保存。
与现有技术相比,本发明提取拟穴青蟹组织外泌体的方法结合了差速离心、蔗糖密度梯度离心和透析过滤的方法,稳定有效,纯度较高并且操作简单,不需要特殊装备。所提取的外泌体含量较多,纯度较高,可以用于一系列生物学实验。
附图说明
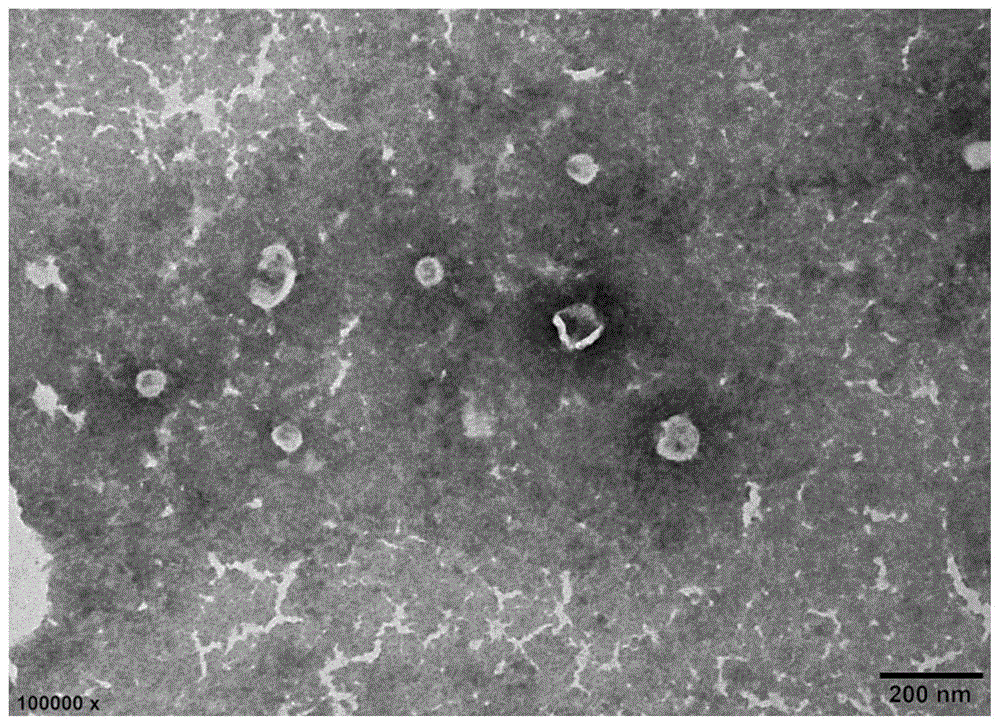
图1是实施例1结合差速离心、蔗糖密度梯度离心和透析过滤分离后的拟穴青蟹外泌体的透射电镜检测结果;
图2是实施例1结合差速离心、蔗糖密度梯度离心和透析过滤分离后的拟穴青蟹外泌体的的粒径分析结果;
图3是实施例1结合差速离心、蔗糖密度梯度离心和透析过滤分离后的拟穴青蟹外泌体的标志蛋白检测结果;
图4是实施例2简单差速离心获取的外泌体分离后的粒径分析结果;
图5是实施例3结合差速离心和蔗糖密度梯度离心获取的外泌体分离后的粒径分析结果;
图6是实施例2简单差速离心获取的外泌体分离后的透射电镜检测结果;
图7是实施例3结合差速离心和蔗糖密度梯度离心获取的外泌体分离后的透射电镜检测结果。
具体实施方式
为使本发明的目的、技术方案和优点更加清楚,下面将结合附图对本发明作进一步地详细描述。
实施例1
结合差速离心、蔗糖密度梯度离心和透析过滤法提取拟穴青蟹组织外泌体,包括以下操作步骤:
s1):组织提取:取螃蟹组织,将组织剪碎,置于2ml预冷的0.3%胰蛋白酶液中;
s2):组织消化:37℃温育裂解20min;加入6ml预冷的0.03%的胰酶抑制剂终止反应;
s3):低速离心:将s2)中组织单细胞悬液使用低温离心机进行4℃,800×g离心10min,离心完毕后将离心管内上清液转移至新管备用,弃掉沉淀;
s4):再次低速离心:将s3)中取得的上清使用低温离心机进行4℃,2000×g离心30min,离心完毕后将离心管内上清液转移至新管备用,弃掉沉淀;
s5):高速离心:将s4)中取得的上清使用低温离心机进行4℃,10000×g离心1h,离心完毕后将离心管内上清液转移至新管备用,弃掉沉淀;
s6):再次高速离心:将s5)中取得的上清使用低温离心机进行4℃,130000×g离心2h,离心完毕后小心吸出上清保留沉淀部分;
s7):重悬沉淀:将s6)中获得的沉淀用4.5ml0.95m蔗糖溶液重悬沉淀;
s8):蔗糖密度梯度离心:往超离管里依次加入4.5ml2.0m蔗糖溶液、4.5ml1.3m蔗糖溶液、4.5mls7)中获得的沉淀重悬液;
s9):超速离心:使用低温离心机进行4℃,200000×g,离心16h,吸取适量1.3m、0.95m蔗糖溶液的中间层溶液,用适量预冷的pbs重悬;
s10):再次超速离心:将s9)中获得的上层溶液使用低温离心机进行4℃,130000×g,离心2h,离心完毕后小心吸出上清保留沉淀部分;
s11):透析袋透析:将s10)中取得的沉淀用预冷的pbs重悬,使用mw:8000-14000的透析袋进行4℃透析3h至5h;
s12):滤膜过滤:用适量预冷的pbs重悬s11)中获得的透析后的溶液,使用一次性注射器吸取重悬后的液体缓慢滴至规格为0.22μm的细胞滤膜进行过滤;
s13):超速离心:将s12)中过滤后的溶液使用低温离心机进行4℃,130000×g离心2h,离心完毕后小心吸上清保留沉淀部分;
s14):重悬沉淀:使用适量的pbs将s13)中获得的重悬沉淀,即为所提取分离的外泌体产物。
其中,s3)和s4)中在低速离心前对所使用的离心管进行灭菌处理。s5)、s6)、s9)、s10)和s13)中使用的超速离心管为14×89mm的超离管。离心时超离管的溶液不低于12ml。s7)和s8)中的蔗糖溶液使用超纯水配制。s7)、s9)、s12)和s14)中的蔗糖溶液,pbs溶液为使用0.22μm滤膜除菌后的溶液。s9)中吸取1.3m、0.95m蔗糖溶液的中间层溶液时为从上往下吸取约7ml溶液。s11)中进行透析时用超纯水进行透析,中间进行多次换水。s14)中所用的pbs缓冲液使用体积为100μl,所得的外泌体放置于-80℃冰箱内长期保存。
实施例2
采用传统的简单差速离心法提取拟穴青蟹组织外泌体。
s1):组织提取:取螃蟹组织,将组织剪碎,置于2ml预冷的0.3%胰蛋白酶液中;
s2):组织消化:37℃温育裂解20min;加入6ml预冷的0.03%的胰酶抑制剂终止反应;
s3):低速离心:将s2)中组织单细胞悬液使用低温离心机进行4℃,800×g离心10min,离心完毕后将离心管内上清液转移至新管备用,弃掉沉淀;
s4):再次低速离心:将s3)中取得的上清使用低温离心机进行4℃,2000×g离心30min,离心完毕后将离心管内上清液转移至新管备用,弃掉沉淀;
s5):高速离心:将s4)中取得的上清使用低温离心机进行4℃,10000×g离心1h,离心完毕后将离心管内上清液转移至新管备用,弃掉沉淀;
s6):再次高速离心:将s5)中取得的上清使用低温离心机进行4℃,130000×g离心2h,离心完毕后小心吸出上清保留沉淀部分;
s7):重悬沉淀:将s6)中获得的沉淀,使用适量过滤除菌的1xpbs溶液重悬沉淀,即为外泌体产物。
实施例3
采用差速离心与蔗糖密度梯度离心法(无透析过滤)提取拟穴青蟹组织外泌体。
s1):组织提取:取螃蟹组织,将组织剪碎,置于2ml预冷的0.3%胰蛋白酶液中;
s2):组织消化:37℃温育裂解20min;加入6ml预冷的0.03%的胰酶抑制剂终止反应;
s3):低速离心:将s2)中组织单细胞悬液使用低温离心机进行4℃,800×g离心10min,离心完毕后将离心管内上清液转移至新管备用,弃掉沉淀;
s4):再次低速离心:将s3)中取得的上清使用低温离心机进行4℃,2000×g离心30min,离心完毕后将离心管内上清液转移至新管备用,弃掉沉淀;
s5):高速离心:将s4)中取得的上清使用低温离心机进行4℃,10000×g离心1h,离心完毕后将离心管内上清液转移至新管备用,弃掉沉淀;
s6):再次高速离心:将s5)中取得的上清使用低温离心机进行4℃,130000×g离心2h,离心完毕后小心吸出上清保留沉淀部分;
s7):重悬沉淀:将s6)中获得的沉淀用4.5ml0.95m蔗糖溶液重悬沉淀;
s8):蔗糖密度梯度离心:往超离管里依次加入4.5ml2.0m蔗糖溶液、4.5ml1.3m蔗糖溶液、4.5mls7)中获得的沉淀重悬液;
s9):超速离心:使用低温离心机进行4℃,200000×g,离心16h,吸取适量1.3m、0.95m蔗糖溶液的中间层溶液,用适量预冷的pbs重悬;
s10):再次超速离心:将s9)中获得的上层溶液使用低温离心机进行4℃,130000×g,离心2h,离心完毕后小心吸出上清保留沉淀部分;
s11):重悬沉淀:使用适量过滤除菌的1xpbs溶液将s10)中获得的重悬沉淀,即为所提取分离的外泌体产物。
测试
使用透射电镜对所提取的外泌体进行形态检测:
分别滴加20μl实施例1-3所得外泌体悬液至铜网上,室温静置10min后,用滤纸吸去铜网上剩余溶液,用2%磷钨酸染色1~3min,用滤纸吸去染色液。再滴一滴超纯水在铜网上,用滤纸吸去,然后室温静置干燥,干燥后使用投射电镜观察,可以观察到双层膜的囊泡结构。
图1可以看出,实施例1得到的拟穴青蟹外泌体和高等模式生物中外泌体的外观基本一致,都具备典型的杯托状结构。
图2可以看出,通过nanosight检测实施例1所分离拟穴青蟹外泌体,其粒径大小主要集中在100-200nm之间,与其它物种中基本一致。
图3可以看出,实施例1外泌体标志蛋白cd9及tsg101在所分离的拟穴青蟹外泌体中均能检测到,而非标志蛋白calnexin检测不到,说明所分离外泌体的纯度符合要求。
图4可以看出,通过nanosight检测实施例2所分离拟穴青蟹外泌体,其粒径大小在27-524nm之间均被检测到,大于200nm的囊泡占据较大比例,可能为外泌体之外的其他大囊泡,说明所分离外泌体的纯度很低。
图5可以看出,通过nanosight检测实施例3所分离拟穴青蟹外泌体,其粒径大小主要集中在100-200nm之间,但是也检测到了提取的外泌体样品中存在少部分的200-545nm的囊泡,说明所分离外泌体的纯度不够。
图6可以看出,实施例2在透射电镜下的形态观察,发现大量大小不一的囊泡,并且背景值很高,较难分辨囊泡形态。
图7可以看出,实施例3在透射电镜下的形态观察,实施例3得到的拟穴青蟹外泌体和高等模式生物中外泌体的外观基本一致,都具备典型的杯托状结构,但是背景值较高,形成大量的结晶,影响囊泡形态观察。
从上述实施例1-3可以看出本发明提取拟穴青蟹组织外泌体的方法,结合了差速离心、蔗糖密度梯度离心和透析过滤的方法,稳定有效,纯度较高并且操作简单,不需要特殊装备。所提取的外泌体含量较多,纯度较高,可以用于一系列生物实验。
另外探索实验时把实施例1中的两次低速离心和两次高速离心改为一次低速离心40min和一次高速离心3h,但是因为样品具有一定粘性,仅两次离心,发现容易导致外泌体被大颗粒细胞碎片或者大量的蛋白所包裹而随着离心被离心掉,造成大量的损失。
- 还没有人留言评论。精彩留言会获得点赞!