一种由苯胺制备对苯二胺的方法与流程
本发明属于精细化工技术领域,涉及一种对苯二胺的合成方法,尤其涉及一种由苯胺制备对苯二胺的方法。
背景技术:
对苯二胺(p-phenylenediamine),又名乌尔丝d,是最简单的芳香二胺之一,也是一种应用广泛的有机中间体,可用于制取偶氮染料,高分子聚合物,也可用于生产毛皮染色剂,橡胶防老剂和照片显影剂试剂。在国防工业中对苯二胺与对苯二酰氯缩聚得到的芳纶1414,它属于耐高温的高分子液晶树脂,可用于超音速飞机的复合材料中。另外,对苯二胺也是汽油阻聚剂的主要原料,目前中国对苯二胺的年需求量大约为2万吨,其中60%用于合成染料,25%用于合成橡胶助剂,15%用于其他领域。未来几年随着全球芳纶1414的产能不断增加,对苯二胺的年需求量会有高速的增长。
目前,对苯二胺合成的工业化路线主要有以下两条:
路线一:对氯硝基苯法。cn109651158a公开了一种对苯二胺的制备方法,所述对苯二胺采用氢气在催化剂条件下对硝基苯胺进行还原反应,该方法采用水作溶剂,氢气作还原剂催化还原硝基制对苯二胺,其制备过程可以由如下反应式表示:
所述制备方法通过对还原反应中的温度、压力和反应时间进行控制,实现对苯二胺转化率的控制。此发明利用加氢还原的生产方式,提高对硝基苯胺的转化率获得了高纯度的对苯二胺。
cn107619374a公开了一种连续法生产对苯二新工艺,该工艺以对硝基苯胺、溶剂、氢气为主要原料,在固定床反应器或者列管式反应器中,在催化剂存在的情况下,加氢反应制备对苯二胺粗产品,粗产品再经过精馏回收工艺制备高纯度的对苯二胺,产物经过分离和精馏可得到99.9%纯度的对苯二胺。
对氯硝基苯法是工业生产的常用方法,原料对硝基苯胺需由氯苯硝化、氨解得到,能耗较高、腐蚀设备,而且会产生大量酸渣、no、no2等废气和含酚废水。
路线二:对二氯苯氨化法。us1994845公开了一种以对二氯苯催化氨解制对苯二胺的方法,以氧化亚铜为催化剂,以28wt%氨水作为氨源,150-225℃反应16个小时,精馏后得到产品,其制备过程可以由如下反应式表示:
us4193938公开了一种以对二氯苯催化氨解制对苯二胺的方法,以氯化亚铜为催化剂,反应温度200-220℃反应12小时后得对苯二胺,收率为91%。然而该路线中反应温度较高,能耗较大。
因此,开发常压条件下苯胺直接氨化制得对苯二胺的合成路线,具有极大的科研价值和应用前景。
技术实现要素:
针对现有技术存在的不足,本发明的目的在于提供一种由苯胺制备对苯二胺的方法。本发明提供的合成路线较为简单,反应条件温和,反应过程安全,且产物对苯二胺的产率和纯度较高。
为达此目的,本发明采用以下技术方案:
本发明提供一种由苯胺制备对苯二胺的方法,所述方法包括如下步骤:将苯胺上的氨基使用对甲苯磺酰基进行保护,再与氨基供体、氧化剂和催化剂ru-cu/ts-1混合发生氨化反应,脱保护后分离得到对苯二胺。
所述反应过程可以由如下反应方程式表示:
本发明中,ts-1是一种钛硅分子筛,在具有催化氧化活性的同时兼具有择形催化性能,对有氧化剂参加的各种有机化合物的择形氧化反应具有独特的催化性能。将钌金属(ru)与铜金属(cu)结合在ts-1上作为催化剂ru-cu/ts-1,能够极大地提高反应效率和选择性。
本发明中,采用保护基策略以对甲苯磺酰基保护苯胺上的氨基,同时诱导活化苯环对位的c-h键,采用催化剂ru-cu/ts-1催化氨化反应,且氧化剂与反应过程中掉落的氢结合,推动反应的正向过程,可极大提高氨化效率和选择性,且反应条件温和,选择性好,是一条绿色环保的合成路线。
优选地,所述方法包括如下步骤:
(1)将对甲苯磺酰氯、缚酸剂(deacidreagent)、溶剂和所述苯胺混合后反应,得到对甲苯磺酰苯胺;
(2)将所述对甲苯磺酰苯胺、氨基供体、催化剂ru-cu/ts-1和溶剂混合,而后加入所述氧化剂反应,得到对氨基苯磺酰苯胺;
(3)将所述对氨基苯磺酰苯胺脱保护后分离,得到所述对苯二胺。
作为本发明优选的技术方案,所述方法中对甲苯磺酰氯与苯胺摩尔比为(1-1.2):1,例如可以是1:1、1.05:1、1.08:1、1.1:1、1.15:1、1.16:1、1.18:1或1.2:1等。
本发明中,所述对甲苯磺酰氯的含量应略高于苯胺,才能将氨基保护完全,但是若对甲苯磺酰氯的含量较高,可能导致在苯环的其他位置发生取代。
作为本发明优选的技术方案,所述方法中苯胺与氧化剂的摩尔比为1:(1-5),例如可以是1:1、1:1.5、1:2、1:2.5、1:3、1:3.5、1:4、1:4.5或1:5等。
优选地,所述方法中苯胺与氨水的摩尔比为1:(1-10),例如可以是1:1、1:2、1:3、1:4、1:5、1:6、1:7、1:8、1:9或1:10等。
优选地,所述方法中催化剂ru-cu/ts-1与苯胺的质量比为1:(5-100),例如可以是1:5、1:10、1:15、1:20、1:25、1:30、1:40、1:50、1:60、1:70、1:80、1:90或1:100等。
作为本发明优选的技术方案,步骤(1)中所述反应在氮气保护气氛下发生。
优选地,步骤(1)中所述反应的温度为50-80℃,例如可以是50℃、55℃、58℃、60℃、65℃、66℃、70℃、72℃、75℃、78℃或80℃等。
优选地,步骤(1)所述缚酸剂包括三乙胺、吡啶、哌啶、哌嗪、氢氧化钠、碳酸钠、碳酸氢钠、碳酸钾、碳酸氢钾、磷酸钾或醋酸钾中的任意一种或两种以上的组合。
优选地,步骤(1)所述溶剂包括二氯甲烷、四氢呋喃、石油醚或正己烷中的任意一种或两种以上的组合。
作为本发明优选的技术方案,步骤(2)所述氧化剂包括过氧化氢、对苯醌、过氧化叔丁醇或过硫酸钾中的任意一种或两种以上的组合。
优选地,步骤(2)所述氨基供体包括氨水或液氨。
优选地,所述氨水的质量浓度为20%-30%,例如可以是20%、21%、22%、23%、24%、25%、26%、27%、28%、29%或30%等。
优选地,步骤(2)中所述溶剂包括丙酮、甲醇、乙醇、异丙醇、n,n′-二甲基甲酰胺、n,n′-二甲基乙酰胺或二甲基亚砜中的任意一种或两种以上的组合。
优选地,步骤(2)中所述反应时间为3-5h,例如可以是3h、3.2h、3.5h、3.8h、4h、4.2h、4.5h、4.8h或5h等。
优选地,步骤(2)中所述反应温度为50-150℃,例如可以是50℃、55℃、60℃、70℃、80℃、90℃、100℃、110℃、120℃、130℃、140℃或150℃等。
优选地,步骤(2)所述催化剂ru-cu/ts-1使用等体积浸渍法制备得到。
优选地,所述催化剂ru-cu/ts-1的制备方法包括如下步骤:
将钌盐溶液和铜盐溶液浸渍于ts-1分子筛溶液中,加入碱调节ph使溶液中钌金属和铜金属沉淀完全,洗涤干燥后经氢气还原得到所述催化剂ru-cu/ts-1。
优选地,所述ts-1分子筛的比表面积为300-500m2/g,例如可以是300m2/g、320m2/g、350m2/g、380m2/g、400m2/g、420m2/g、450m2/g、480m2/g或500m2/g等;其堆积密度为0.45-0.55g/ml,例如可以是0.45g/ml、0.46g/ml、0.47g/ml、0.48g/ml、0.49g/ml、0.50g/ml、0.51g/ml、0.52g/ml、0.53g/ml、0.54g/ml或0.55g/ml等。
优选地,所述ts-1分子筛的孔容为0.45-0.8ml/g,例如可以是0.45ml/g、0.50ml/g、0.55ml/g、0.60ml/g、0.65ml/g、0.70ml/g、0.75ml/g、0.78ml/g或0.8ml/g等;催化吸水量为0.1-0.3g/g,例如可以是0.1g/g、0.12g/g、0.15g/g、0.18g/g、0.2g/g、0.22g/g、0.25g/g、0.28g/g或0.3g/g等。
优选地,所述催化剂ru-cu/ts-1中ru的负载量为0.5-2%,例如可以是0.5%、0.8%、1%、1.2%、1.5%、1.6%、1.8%或2%等。
优选地,所述催化剂ru-cu/ts-1中cu的负载量为0.5-2%,例如可以是0.5%、0.8%、1%、1.2%、1.5%、1.6%、1.8%或2%等。
作为本发明优选的技术方案,所述钌盐包括三氯化钌、醋酸钌、乙酰丙酮钌或亚硝酰基硝酸钌中的任意一种或两种以上的组合。
优选地,所述铜盐包括硫酸铜、硝酸铜、氯化铜或醋酸铜中的任意一种或两种以上的组合。
优选地,所述碱包括氢氧化钠、氢氧化钾、碳酸钠或碳酸钾中的任意一种或两种以上的组合。
优选地,加入所述碱将溶液ph调节至9-12,例如可以是9、9.2、9.5、9.8、10、10.2、10.5、11、11.2、11.5、11.8或12等。
优选地,所述氢气还原的操作在管式炉中进行,还原温度为350-450℃,例如可以是350℃、355℃、360℃、370℃、380℃、390℃、400℃、410℃、420℃、430℃、440℃或450℃等。
作为本发明优选的技术方案,步骤(3)中脱保护使用的脱保护组合物选自镁/甲醇(表示甲醇和mg同时使用)、溴化氢/苯酚、氟化氢/乙腈、锂/液氨或氟化钙/硅藻土中任意一种或两种以上的组合,优选为氟化钙/硅藻土。
优选地,步骤(3)中所述分离包括除盐、脱溶或精馏中任意一种或两种以上的操作。
作为本发明优选的技术方案,所述方法包括如下步骤:
(1)将对甲苯磺酰氯、缚酸剂、溶剂和所述苯胺混合,所述对甲苯磺酰氯与苯胺摩尔比为(1-1.2):1,在氮气保护气氛温度为50-80℃下反应,旋蒸后得到对甲苯磺酰苯胺;
(2)使用等体积浸渍法制备催化剂ru-cu/ts-1,所述催化剂ru-cu/ts-1中金属负载量为1-5%,再将所述对甲苯磺酰苯胺、氨水、催化剂ru-cu/ts-1和溶剂混合,所述苯胺与氨水的摩尔比为1:(1-10),所述催化剂ru-cu/ts-1与苯胺的质量比为1:(5-100),而后加入过氧化氢,所述苯胺与过氧化氢的摩尔比为1:(1-5),50-150℃反应3-5h得到对氨基苯磺酰苯胺;
(3)在惰性气体保护下将所述对氨基苯磺酰苯胺使用脱保护组合物进行脱保护,除盐、脱溶并精馏,得到所述对苯二胺。
本发明所述的数值范围不仅包括上述例举的点值,还包括没有例举出的上述数值范围之间的任意的点值,限于篇幅及出于简明的考虑,本发明不再穷尽列举所述范围包括的具体点值。
与现有技术相比,本发明的有益效果为:
(1)本发明中提供的对苯二胺的合成路线,以苯胺为制备原料,采用对甲苯磺酰基保护氨基,以ru-cu/ts-1为催化剂,在苯胺的对位上引入氨基得到对苯二胺,该工艺合成路线简单,反应条件较为温和,反应过程安全,解决现有技术中对设备要求苛刻,“三废”较多等问题;
(2)本发明中提供合成路线具有较高的收率,产物对苯二胺的收率>50%,且能够有效提高产物的纯度,使用本发明制备得到对苯二胺纯度>99.9%。
附图说明
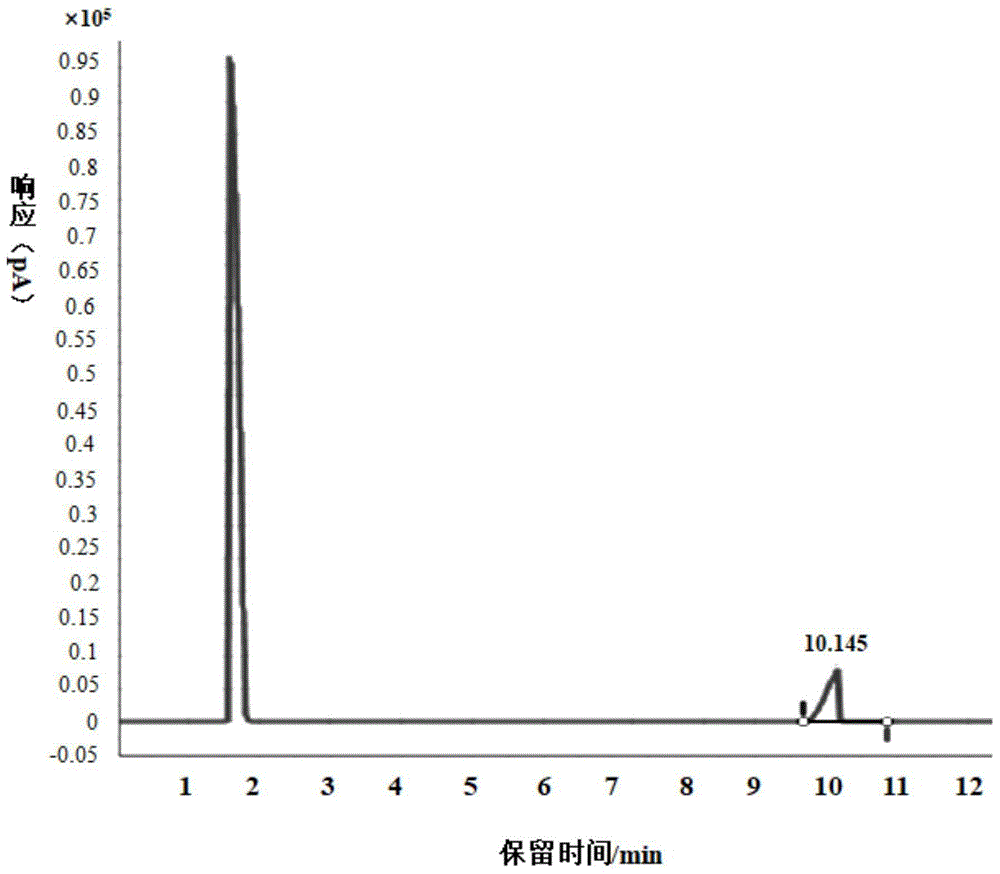
图1为实施例1中制备得到的产物的气相色谱图。
具体实施方式
下面结合附图并通过具体实施方式来进一步说明本发明的技术方案,但下述的实例仅仅是本发明的简易例子,并不代表或限制本发明的权利保护范围,本发明的保护范围以权利要求书为准。
以下实施例中,ts-1分子筛以如下方法进行制备:
将22.5g正硅酸四乙酯(teos)与7.0g四丙基氢氢化铵(tpaoh)、1gγ-缩水甘油醚丙基三甲氧基硅烷混合,并加入59.8g蒸馏水,搅拌混合均匀后于常压及60℃条件下水解1h,得teos预水解液;
在剧烈搅拌下加入由1.1g钛酸四丁酯(tbot)与5.0g无水乙醇所组成的溶液,将所得混合物在75℃条件下搅拌3h,得到澄清透明胶体。将此胶体放入水热反应釜中,在170℃温度下水热反应6天,得到晶化混合液;将此混合液离心、过滤、洗涤至ph为6~8,并于110℃条件下干燥2h,在空气气氛下550℃焙烧4h,得ts-1分子筛。
最终制得的ts-1分子筛作为催化剂载体,其直径为1mm,比表面积为350m2/g,堆积密度0.45-0.55g/ml,孔容0.45-0.8ml/g,催化吸水量为0.2g/g。
以下实施例中,含有不同ru-cu含量的ts-1催化剂均可通过钌盐和铜盐进行制备。
(1)以三氯化钌和硝酸铜制备催化剂0.5%ru-0.5%cu/ts-1为例,具体制备方法为:
称取1.02g三氯化钌和1.48g硝酸铜溶解于20ml去离子水中形成混合溶液,等体积浸渍于100gts-1分子筛载体后转移至80℃烘箱干燥12h,分子筛载体干燥后冷却至室温加入混合碱液(混合碱液的配方为naoh和na2co3总质量分数为1%的水溶液,且naoh与na2co3的质量比为2:1)至最终体系ph为10沉淀完全,加入去离子水洗涤至电导率50s/m后110℃烘箱干燥;
将负载后的ts-1小球转入管式炉,设置氢气流速为100ml/min,以5℃/min的速度程序升温至350℃,350℃保温2h得0.5%ru-0.5%cu/ts-1催化剂,还原后的催化剂冷却至室温后通入0.5%稀释氧氮混合气进行钝化处理30min得0.5%ru-0.5%cu/ts-1催化剂101g。
(2)以亚硝酰基硝酸钌和氯化铜制备催化剂0.5%ru-1%cu/ts-1为例,具体制备方法为:
称取1.56g亚硝酰基硝酸钌和5.4g氯化铜溶解于20ml去离子水中形成混合溶液,等体积浸渍于100gts-1分子筛载体后转移至80℃烘箱干燥12h,浸渍后的分子筛载体干燥后冷却至室温并加入混合碱液(混合碱液的配方为naoh和na2co3总质量分数为1%的水溶液,且naoh与na2co3的质量比为2:1)至最终体系ph为10沉淀完全,加入去离子水洗涤至电导率50s/m后110℃烘箱干燥;
将负载后ts-1小球转入管式炉,设置氢气流速为100ml/min,以5℃/min的速度程序升温至350℃,350℃保温2h得0.5%ru-1.0%cu/ts-1催化剂,还原后的催化剂冷却至室温后通入0.5%稀释氧氮混合气进行钝化处理30min得0.5%ru-1.0%cu/ts-1催化剂101.5g。
以下实施例中,催化剂1.0%ru-1.0%cu/ts-1的制备方法可以参照催化剂0.5%ru-0.5%cu/ts-1的制备方法进行制备。
实施例1
本实施例提供一种由苯胺制备对苯二胺的方法,具体步骤如下:
(1)向烧瓶中加入溶剂672g二氯甲烷(8.0mol)、46.5g苯胺(99.9%,0.5mol)、20g缚酸剂naoh(0.5mol),在冰水浴中搅拌条件下缓慢向烧瓶中滴加114.4g对甲苯磺酰氯(0.5mol)溶液,tlc(薄层色谱)跟踪至反应完全,滤去不溶物氯化钠,旋蒸除去溶剂二氯甲烷得对甲苯磺酰苯胺晶体;
(2)取对甲苯磺酰苯胺、580g丙酮(10.0mol)、212.5g20%氨水(2.5mol)、190gh2o2(1.5mol)和4.65g0.5%ru-0.5%cu/ts-1催化剂加入玻璃反应器中,设定反应温度为70℃,磁力搅拌4h后结束反应,催化剂过滤分离,减压蒸馏脱去溶剂得粗品;
(3)粗品加入500g三氟乙醇(5.0mol)、50g1%氟化钙/硅藻土(含有1wt%氟化钙的硅藻土)90℃氩气气氛回流,tlc进行跟踪至脱保护完全,脱保护所用时间为2.5h,通过除盐、脱溶、精馏得到产物对苯二胺29.7g,使用气相色谱(agilent8890)分析,检测得到的气相色谱图如图1所示,在1.8min左右的峰为溶剂峰,产物的出峰时间为10.145min,与对苯二胺标准品的出峰时间相同,因此所得产物为对苯二胺,产物纯度为99.98%。
实施例2
本实施例提供一种由苯胺制备对苯二胺的方法,具体步骤如下:
(1)向烧瓶中加入溶剂672g二氯甲烷(8.0mol)、46.5g苯胺(99.9%,0.5mol)、50g缚酸剂三乙胺(0.5mol),在冰水浴中搅拌条件下缓慢向烧瓶中滴加114.4g对甲苯磺酰氯(0.5mol)溶液,tlc跟踪至反应完全,水洗除去三乙胺盐酸盐,分层,旋蒸除去溶剂二氯甲烷得对甲苯磺酰苯胺;
(2)取对甲苯磺酰苯胺、480g甲醇(15.0mol)、125g氨水(1.25mol)、126.7gh2o2(1.0mol)和4.65g0.5%ru-1.0%cu/ts-1催化剂加入玻璃反应器中,设定反应温度为70℃,磁力搅拌4h后结束反应,催化剂过滤分离,减压蒸馏脱去溶剂得粗品;
(3)粗品加入500g三氟乙醇(5.0mol)、50g1%caf2/硅藻土90℃氩气气氛回流,tlc进行跟踪至脱保护完全,脱保护所用时间为3h,经过除盐、脱溶、精馏得到产物对苯二胺31.3g,纯度99.93%。
实施例3
本实施例提供一种由苯胺制备对苯二胺的方法,具体步骤如下:
(1)向烧瓶中加入溶剂672g二氯甲烷(8.0mol)、46.5g苯胺(99.9%,0.5mol)、42g缚酸剂碳酸氢钠(0.5mol),在冰水浴中搅拌条件下缓慢向烧杯中滴加114.4g对甲苯磺酰氯(0.5mol)溶液,tlc跟踪至反应完全,滤去不溶氯化钠,蒸去溶剂二氯甲烷得对甲苯磺酰苯胺;
(2)取对甲苯磺酰苯胺、460g乙醇(10.0mol)、125g氨水(1.25mol)、190gh2o2(1.5mol)和9.3g0.5%ru-0.5%cu/ts-1催化剂加入玻璃反应器中,设定反应温度为65℃,磁力搅拌保持4h后结束反应,催化剂过滤分离,减压蒸馏除去溶剂得到粗品;
(3)粗品加入500g三氟乙醇(5.0mol)、50g1%caf2/硅藻土90℃氩气气氛,tlc进行跟踪至脱保护完全,脱保护所用时间为4h,通过除盐、脱溶、精馏得到产物对苯二胺34.6g,纯度99.97%。
实施例4
本实施例提供一种由苯胺制备对苯二胺的方法,具体步骤如下:
(1)向烧瓶中加入溶剂576g四氢呋喃(8.0mol)、46.5g苯胺(99.9%,0.5mol)、42g缚酸剂碳酸氢钠(0.5mol),在冰水浴中搅拌条件下缓慢向烧瓶中滴加114.4g对甲苯磺酰氯(0.5mol)溶液,tlc跟踪至反应完全,水洗除盐,旋蒸除去溶剂四氢呋喃得对甲苯磺酰苯胺;
(2)取对甲苯磺酰苯胺、600g异丙醇(10.0mol)、250g氨水(17wt%,2.5mol)、190g氧化剂h2o2(1.5mol)和4.65g1.0%ru-1.0%cu/ts-1催化剂加入反应器中,设定反应温度为150℃,搅拌3h后结束反应,并将催化剂过滤分离,减压蒸馏除去溶剂得到粗品;
(3)粗品加入1265g48%hbr(15mol)及141g苯酚(1.5mol)氩气气氛保护加热至130℃回流8h,tlc进行跟踪至脱保护完全,通过除盐、脱溶、精馏得到产物对苯二胺28.11g,纯度99.95%。
实施例5
本实施例提供一种由苯胺制备对苯二胺的方法,具体步骤如下:
(1)向烧瓶中加入溶剂576g四氢呋喃(8.0mol)、46.5g苯胺(99.9%,0.5mol)、50g缚酸剂三乙胺(0.5mol),在冰水浴中搅拌条件下缓慢向烧瓶中滴加114.4g对甲苯磺酰氯(0.5mol)溶液,反应4h后,tlc跟踪至反应完全,水洗除盐,蒸去溶剂四氢呋喃得对甲苯磺酰苯胺;
(2)取对甲苯磺酰苯胺、580g丙酮、250g氨水(17wt%,2.5mol)、190g氧化剂h2o2(1.5mol)和9.3g1.0%ru-1.0%cu/ts-1催化剂加入反应器中,设定反应温度为50℃,磁力搅拌5h后结束反应,催化剂过滤分离,减压蒸馏脱去溶剂得粗品;
(3)粗品加入1265g48%hbr(15mol)及141g苯酚(1.5mol)氩气气氛保护加热至130℃回流8h脱除保护基,tlc进行跟踪至脱保护完全,通过除盐、脱溶、精馏得到产物对苯二胺44.33g,纯度99.97%。
实施例6
同实施例1,提供一种由苯胺制备对苯二胺的方法,区别仅在于,本实施例中将氨水替换为液氨42.5g(2.5mol),其余条件及制备方法同实施例1,得到产物对苯二胺34.68g,纯度99.97%。
实施例7
同实施例1,提供一种由苯胺制备对苯二胺的方法,区别仅在于,本实施例中将过氧化氢替换为过氧化叔丁醇135g(1.5mol),其余条件及制备方法同实施例1,得到产物对苯二胺23.71g,纯度99.92%。
实施例8
同实施例1,提供一种由苯胺制备对苯二胺的方法,区别仅在于,本实施例中将催化剂替换为3%ru-3%cu/ts-1催化剂,其余条件及制备方法同实施例1,得到产物对苯二胺26.14g,纯度99.87%。
实施例9
同实施例1,提供一种由苯胺制备对苯二胺的方法,区别仅在于,本实施例中将催化剂替换为0.1%ru-0.1%cu/ts-1催化剂,其余条件及制备方法同实施例1,得到产物对苯二胺21.36g,纯度99.90%。
对比例1
本对比例提供一种由苯胺制备邻苯二胺的方法,与实施例1的区别在于,使用4.65g0.5%cu/ts-1作为催化剂,其余试剂及反应条件同实施例1,最终得到产物对苯二胺3.24g,纯度99.91%。
其中,0.5%cu/ts-1催化剂的制备方法为:
称取1.48g硝酸铜溶解于10ml去离子水中形成混合溶液,等体积浸渍于100gts-1分子筛载体,其余步骤与催化剂0.5%ru-0.5%cu/ts-1的制备方法相同。
对比例2
本对比例提供一种由苯胺制备邻苯二胺的方法,与实施例1的区别在于,使用4.65g0.5%ru/ts-1作为催化剂,其余试剂及反应条件同实施例1,最终得到产物对苯二胺18.84g,纯度99.91%。
其中,0.5%ru/ts-1催化剂的制备方法为:
称取1.02g三氯化钌溶解于10ml去离子水中形成混合溶液,等体积浸渍于100gts-1分子筛载体,其余步骤与催化剂0.5%ru-0.5%cu/ts-1的制备方法相同。
对比例3
本对比例提供一种对苯二胺的制备方法,与实施例1的区别在于,将催化剂替换为0.5%pt-0.5%cu/ts-1催化剂,其余条件及制备方法同实施例1;得到产物对苯二胺19.47g,纯度99.90%。
其中,0.5%pt-0.5%cu/ts-1催化剂的制备方法为:
称取1.33g氯铂酸和1.48g硝酸铜溶解于20ml去离子水中形成混合溶液,等体积浸渍于100gts-1分子筛载体,其余步骤与催化剂0.5%ru-0.5%cu/ts-1的制备方法相同。
对比例4
本对比例提供一种对苯二胺的制备方法,与实施例1的区别在于,将对甲苯磺酰氯替换为三氟乙酰氯66.5g(0.5mol),其余条件及制备方法同实施例1,未得到对苯二胺。
结果分析
对实施例1-8与对比例1-4中对苯二胺的收率、纯度以及反应的选择性进行统计。其中,以理论上原料苯胺全部转变为对苯二胺的收率为100%计,计算对苯二胺的收率,同时通过气相色谱分析得到产物中对氨基苯酚的含量。
最终各实施例及对比例中对苯二胺的收率、选择性及对苯二胺的纯度如表1所示:
表1
由上表可知,实施例5中当使用1.0%ru-1.0%cu/ts-1作为催化剂,催化剂用量为苯胺质量的20%,且氧化剂与苯胺的摩尔比为3:1时,产品的收率最高,可达82%,由实施例1、实施例8和9比较可知,催化剂ru-cu/ts-1的金属负载量与使用量会影响对苯二胺的产量,若是分子筛中钌的负载量大于2%,铜负载量大于2%,两者总负载量大于5%,则会影响反应的选择性,导致副产物增多,产物的收率下降;若是分子筛中钌的负载量小于0.5%,铜负载量小于0.5%,两者总含量小于1%,反应选择性基本相同,但是产物的收率下降。
由实施例1与对比例1比较可知,单一的铜作为催化剂时,虽然反应的选择性较好,但是产品收率较低,不足10%;由实施例1与对比例2比较可知,单一的钌作为催化剂时,反应的选择性较差,副产物增多,同样的,对比例3中将钌替换为铂,产品的收率和反应的选择性较低;由实施例1与对比例4比较可知,若将保护基团由甲苯磺酰基替换为其他保护基团,如三氟乙酰,则无法得到对苯二胺。综上所述,使用本发明提供的工艺合成路线得到的对苯二胺纯度较高,对苯二胺纯度>99.87%,且收率≥40%,最高可达82%。
申请人声明,以上所述仅为本发明的具体实施方式,但本发明的保护范围并不局限于此,所属技术领域的技术人员应该明了,任何属于本技术领域的技术人员在本发明揭露的技术范围内,可轻易想到的变化或替换,均落在本发明的保护范围和公开范围之内。
- 还没有人留言评论。精彩留言会获得点赞!