一种硫醚化合物及其制备方法与应用与流程
本发明涉及有机合成技术领域,尤其涉及一种硫醚化合物及其制备方法与应用。
背景技术:
硫醚化合物在生物、制药等方面有着重要与广泛的应用。目前为止,已经有大量硫醚化合物被合成,合成方法通常是硫醇盐(如甲基硫钠、苄硫醇钠)与卤代芳烃进行亲核取代反应,得到硫醚化合物。然而,硫醇盐具有很强的碱性,与卤代芳烃的反应活性很强。当原料为多卤代芳烃化合物时,硫醇盐与卤代芳烃的亲核取代反应难以控制,可控地得到特定硫醚取代的化合物通常具有较高的难度。
技术实现要素:
本发明提供了一种硫醚化合物及其制备方法与应用,解决了硫醚化合物的合成中反应进程难以控制的问题。
其具体技术方案如下:
本发明提供了一种硫醚化合物的制备方法,包括以下步骤:
将式(ⅱ)化合物与硫醇盐进行亲核取代反应,得到式(ⅰ)所示硫醚化合物;
合成路线为:
其中,r为-ch3或
上述制备方法中,所述式(ⅱ)化合物与硫醇盐优选加入到两口圆底烧瓶中,优选将圆底烧瓶接到本领域技术人员熟知的schlenk线上,然后优选向圆底烧瓶中加入溶剂进行亲核取代反应;
本发明中,所述硫醇盐包括:苄基硫醇钠和甲基硫钠。
所述溶剂优选为甲醇、四氢呋喃、1,3-二甲基-2-咪唑啉酮或n,n-二甲基甲酰胺;
所述式(ⅱ)化合物与所述硫醇盐的用量比为(1g:0.175g)-(1g:8g)。
所述式(ⅱ)化合物所述亲核取代反应的溶剂的用量为(0.32g:10ml)~(0.32g:50ml)。
所述亲核取代反应的时间为2~168h,温度为25~80℃,优选为2~72h,室温。
本发明中,所述室温为25℃±5℃。
所述亲核取代反应优选在氮气或惰性气氛下进行。
当式(ⅱ)化合物与甲基硫钠、溶剂的用量比为(0.32g:0.056g:10ml)~(0.32g:0.2g:50ml),溶剂为甲醇、四氢呋喃、1,3-二甲基-2-咪唑啉酮或n,n-二甲基甲酰胺,亲核取代反应时间为2~5h时,硫醚化合物为1sme:
式(ⅱ)化合物与甲基硫钠、溶剂的用量比优选为0.32g:0.112g:25ml,亲核取代的溶剂优选为甲醇,亲核取代的时间优选为2h。
当式(ⅱ)化合物与甲基硫钠、溶剂的用量比为(0.32g:0.1g:10ml)~(0.32g:0.3g:50ml),溶剂为甲醇、四氢呋喃、1,3-二甲基-2-咪唑啉酮或n,n-二甲基甲酰胺,亲核取代反应时间为2~5h时,硫醚化合物为2sme:
式(ⅱ)化合物与甲基硫钠、溶剂的用量比优选为0.32g:0.168g:25ml,亲核取代的溶剂优选为甲醇,亲核取代的时间优选为2h。
当式(ⅱ)化合物与甲基硫钠、溶剂的用量比为(1.2g:0.5g:10ml)~(1.2g:2.0g:50ml),溶剂为甲醇、四氢呋喃、1,3-二甲基-2-咪唑啉酮或n,n-二甲基甲酰胺,亲核取代反应时间为4~8h时,硫醚化合物为3sme:
式(ⅱ)化合物与甲基硫钠、溶剂的用量比优选为1.2g:1.07g:20ml,溶剂优选为甲醇,亲核取代反应时间优选为4h。
当式(ⅱ)化合物与甲基硫钠、溶剂的用量比为(1.7g:1.8g:10ml)~(1.7g:3.0g:50ml),溶剂为甲醇、四氢呋喃、1,3-二甲基-2-咪唑啉酮或n,n-二甲基甲酰胺,亲核取代反应时间为5~10h时,硫醚化合物为4sme和5sme:
式(ⅱ)化合物与甲基硫钠、溶剂的用量比优选为1.7g:2.4g:20ml,溶剂优选为甲醇,亲核取代反应时间优选为5h。
当式(ⅱ)化合物与甲基硫钠、溶剂的用量比为(3.0g:3.2g:30ml)~(3.0g:4.8g:60ml),溶剂为甲醇、四氢呋喃、1,3-二甲基-2-咪唑啉酮或n,n-二甲基甲酰胺,亲核取代反应时间为4~8h时,硫醚化合物为6sme:
式(ⅱ)化合物与甲基硫钠、溶剂的用量比优选为3.0g:4.1g:40ml,溶剂优选为1,3-二甲基-2-咪唑啉酮,亲核取代反应时间优选为4h。
当式(ⅱ)化合物与甲基硫钠、溶剂的用量比为(0.3g:0.6g:10ml)~(0.3g:1.0g:50ml),溶剂为甲醇、四氢呋喃、1,3-二甲基-2-咪唑啉酮或n,n-二甲基甲酰胺,亲核取代反应时间为48~72h时,硫醚化合物为7sme:
式(ⅱ)化合物与甲基硫钠、溶剂的用量比优选为0.3g:0.81g:25ml,溶剂优选为四氢呋喃,亲核取代反应时间优选为48h。
当式(ⅱ)化合物与甲基硫钠、溶剂的用量比为(0.3g:0.6g:10ml)~(0.3g:1.0g:50ml),溶剂为甲醇、四氢呋喃、1,3-二甲基-2-咪唑啉酮或n,n-二甲基甲酰胺,亲核取代反应时间为72~96h时,硫醚化合物为8sme:
式(ⅱ)化合物与甲基硫钠、溶剂的用量比优选为0.3g:0.81g:25ml,溶剂优选为四氢呋喃,亲核取代反应时间优选为72h。
当式(ⅱ)化合物与苄硫醇钠、溶剂的用量比为(1.7g:4.2g:10ml)~(1.7g:6g:50ml),溶剂为甲醇、四氢呋喃、1,3-二甲基-2-咪唑啉酮或n,n-二甲基甲酰胺,亲核取代反应时间为5~10h,优选为5h时,硫醚化合物为m1:
式(ⅱ)化合物与甲基硫钠、溶剂的用量比优选为1.7g:4.8g:20ml,溶剂优选为甲醇,亲核取代反应时间优选为5h。
当式(ⅱ)化合物与苄硫醇钠、溶剂的用量比为(10g:40g:40ml)~(10g:80g:80ml),溶剂为甲醇、四氢呋喃、1,3-二甲基-2-咪唑啉酮或n,n-二甲基甲酰胺,亲核取代反应时间为48~72h时,硫醚化合物为m2:
式(ⅱ)化合物与甲基硫钠、溶剂的用量比优选为10g:56.3g:50ml,溶剂优选为四氢呋喃,亲核取代反应时间优选为48h。
所述亲核取代反应结束后,还包括:后处理。
所述后处理具体为:将亲核取代反应得到的混合物倒入水中,优选加入萃取溶剂进行萃取,然后优选用水洗涤萃取后的萃取溶剂,无水mgso4干燥萃取溶剂,再优选使用旋转蒸发器除去萃取溶剂,得到的浅黄色固体即为硫醚化合物粗品。
优选地,所述萃取溶剂选自乙酸乙酯、二氯甲烷或三氯甲烷。
优选地,使用萃取溶剂萃取的次数为3次,使用水洗涤的次数为3次。
上述制备方法操作简单,通过控制式(ⅱ)化合物与甲基硫类化物的比例、溶剂的类型、反应时间、反应物的浓度等条件,可以在温和的条件(室温)下实现硫醚化合物的精准与可控合成。
本发明提供了一种硫醚化合物,由上述制备方法制得。
本发明硫醚化合物丰富了硫醚化合物的种类。另外,该硫醚化合物可直接水解得到有机羧酸配体,可以应用在金属有机框架材料中。
本发明还提供了上述硫醚化合物在医药中的应用。
从以上技术方案可以看出,本发明具有以下优点:
本发明提供了一种硫醚化合物的制备方法,将式(ⅱ)化合物与硫醇盐进行亲核取代反应,得到式(ⅰ)所示硫醚化合物;所述硫醇盐为甲基硫钠和苄硫醇钠。该硫醚化合物的制备方法简单,该制备方法以多卤代化合物为原料,通过控制式(ⅱ)化合物与硫醇盐的比例、溶剂的类型、反应时间、反应物的浓度等条件,就可以在温和的条件下即可实现特定硫醚化合物的精准与可控合成。另外,该制备方法制得硫醚化合物的丰富了硫醚化合物的种类。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其它的附图。
图1为本发明实施例1提供的1sme氢谱图;
图2为本发明实施例1提供的1sme氟谱图;
图3为本发明实施例1提供的1sme碳谱图;
图4为本发明实施例2提供的2sme氢谱图;
图5为本发明实施例2提供的2sme氟谱图;
图6为本发明实施例2提供的2sme碳谱图;
图7为图6的局部放大图;
图8为本发明实施例3提供的3sme氢谱图;
图9为本发明实施例3提供的3sme氟谱图;
图10为本发明实施例3提供的3sme碳谱图;
图11为本发明实施例4提供的4sme氢谱图;
图12为本发明实施例4提供的4sme氟谱图;
图13为本发明实施例4提供的4sme碳谱图;
图14为本发明实施例5提供的6sme氢谱图;
图15为本发明实施例5提供的6sme氟谱图;
图16为本发明实施例5提供的6sme碳谱图;
图17为本发明实施例6提供的7sme氢谱图;
图18为本发明实施例6提供的7sme氟谱图;
图19为本发明实施例6提供的7sme碳谱图;
图20为本发明实施例7提供的8sme氢谱图;
图21为本发明实施例7提供的8sme碳谱图;
图22为本发明实施例8提供的m1的氢谱图;
图23为本发明实施例8提供的m1的氟谱图;
图24为本发明实施例8提供的m1的碳谱图;
图25为本发明实施例9提供的m2的氢谱图;
图26为本发明实施例9提供的m2的碳谱图。
具体实施方式
为使得本发明的发明目的、特征、优点能够更加的明显和易懂,下面将对本发明实施例中的技术方案进行清楚、完整地描述,显然,下面所描述的实施例仅仅是本发明一部分实施例,而非全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其它实施例,都属于本发明保护的范围。
本发明实施例中,4,4’-二甲酸甲酯-八氟联苯采用pengfeiji等人发表的tuninglewisacidityofmetal-organicframeworksviaperfluorinationofbridgingligands:spectroscopic,theoretical,andcatalyticstudies文章中的方法制备得到。
实施例1
本实施例为硫醚化合物3-甲硫基-4,4’-二甲酸甲脂-2,5,6,2’,3’,4’,5’-七氟联苯(1sme)的制备
1)在n2保护下,称取原料4,4’-二甲酸甲脂-八氟联苯(0.32g,0.77mmol)加入100ml两口圆底烧瓶。
2)称取nasme(0.112g,1.6mmol)加入100ml两口圆底烧瓶。
3)将两口圆底烧瓶连接到schlenk线上。
4)将25ml脱气后的甲醇溶液转移到圆底烧瓶。
5)在室温(25℃)下,搅拌反应2小时。
6)停止搅拌,随后将反应混合物倒入水中(150ml)。
7)用乙酸乙酯萃取(3×80ml)水溶液,然后合并乙酸乙酯溶液。
8)用水洗涤(3×100ml)萃取后的乙酸乙酯,后用无水mgso4干燥乙酸乙酯。
9)旋转蒸发器除去乙酸乙酯。得到无色粘稠状产物。
10)通过柱色谱(硅胶,使用pe和ea作为洗脱液)进一步纯化残余物,得到纯化后的无色粘稠状产物,即为3-甲硫基-4,4’-二甲酸甲脂-2,5,6,2’,3’,4’,5’-七氟联苯,记为1sme(1sme产量为150mg,产率为44%)。
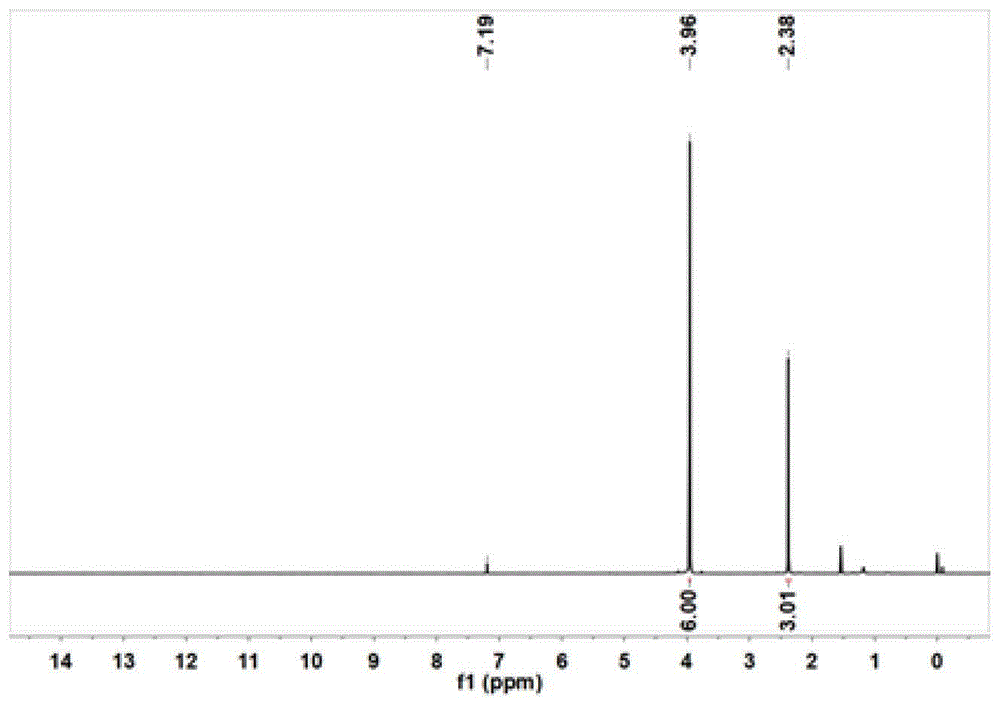
对无色粘稠物产物进行核磁共振氢谱、氟谱和碳谱测试,结果如图1~3所示。
1sme的核磁测试结果:1hnmr(400mhz,cdcl3)δ:=3.96(s,6h),2.38(s,3h);19fnmr(376mhz,cdcl3)δ:=-105.71–-105.88(m),-129.53(dt,j=21.9,8.1hz),-136.50–-136.77(m),-138.28–-138.52(m),-141.11(dd,j=22.0,14.6hz);13cnmr(101mhz,cdcl3)δ:=162.77(t,j=3.3hz),159.89–159.77(m),156.00(dt,j=250.3,3.5hz),147.96(ddd,j=258.9,15.4,6.0hz),144.82(ddt,j=258.0,15.2,4.8hz),144.31(ddt,j=14.9,9.7,4.3hz),143.94(ddd,j=253.9,14.5,4.4hz).130.62(d,j=14.6hz),119.16(ddd,j=22.9,4.7,1.6hz),114.56(t,j=16.3hz),110.45(t,j=18.1hz),107.97–107.20(m),53.77(s),53.65(s),19.14(d,j=4.9hz).
通过对核磁共振氢谱、氟谱和碳谱的综合分析,证明了化合物1sme的成功合成。
实施例2
本实施例为硫醚化合物2’,5’-二甲硫基-4,4’-二甲酸甲脂-2,3,5,6,3’,4’-六氟联苯(2sme)的制备
1)在n2保护下,称取原料4,4’-二甲酸甲脂-八氟联苯(0.32g,0.77mmol)加入100ml两口圆底烧瓶。
2)称取nasme(0.168g,2.4mmol)加入100ml两口圆底烧瓶。
3)将两口圆底烧瓶连接到schlenk线上。
4)将25ml脱气后的甲醇溶液转移到圆底烧瓶。
5)在室温(25℃)下,搅拌反应2小时。
6)停止搅拌,随后将反应混合物倒入水中(150ml)。
7)用乙酸乙酯萃取(3×80ml)水溶液,然后合并乙酸乙酯溶液。
8)用水洗涤(3×100ml)萃取后的乙酸乙酯,后用无水mgso4干燥乙酸乙酯。
9)旋转蒸发器除去乙酸乙酯,得到无色粘稠状产物。
通过柱色谱(硅胶,使用pe和ea作为洗脱液)进一步纯化残余物,得到纯化后的无色粘稠状产物,即为2’,5’-二甲硫基-4,4’-二甲酸甲脂-2,3,5,6,3’,4’-六氟联苯,记为2sme(2sme产量为140mg,产率为39%)。
对无色粘稠物产物进行核磁共振氢谱、氟谱和碳谱测试,结果如图4~7所示。
2sme-1的核磁测试结果:1hnmr(400mhz,cdcl3)δ:=4.00(s,3h),3.99(s,3h),2.45(s,3h),2.40(s,3h);19fnmr(376mhz,cdcl3)δ:=-107.59(dt,j=16.0,4.0hz),-111.28(d,j=16.0hz),-137.11–-137.74(m),-138.96–-139.45(m);13cnmr(101mhz,cdcl3)δ:=163.53(d,j=2.8hz),160.06(s),156.07(dd,j=248.7,2.6hz),155.42(dd,j=249.0,3.2hz),148.00(ddd,j=258.2,15.5,5.8hz),143.87(ddd,j=17.6,13.8,3.2hz),129.01(dd,j=22.3,2.1hz),127.48(d,j=21.5hz),124.13(dd,j=23.3,4.0hz),120.35(d,j=19.0hz),115.61(t,j=18.7hz),113.63(t,j=16.1hz),53.59(s),53.38(s),18.70(d,j=6.2hz),18.28(d,j=6.8hz).
2sme-2的核磁测试结果:1hnmr(400mhz,cdcl3)δ:=4.00(s,6h),2.43(s,6h);19fnmr(376mhz,cdcl3)δ:=-105.58–-106.07(m),-129.07–-130.21(m),-141.39–-141.81(m);13cnmr(101mhz,cdcl3)δ:=162.83(s),156.07(dd,j=248.7,2.6hz),144.69(ddt,j=257.3,15.3,4.7hz),144.21(ddt,j=250.5,15.3,4.7),130.15(d,j=15.6hz),118.82(dd,j=23.1,2.5hz),108.48(dd,j=22.3,16.5hz),53.53(s),19.10(d,j=4.0hz).
通过对核磁共振氢谱、氟谱和碳谱的综合分析,发现合成的二亲核取代产物2sme是两种产物的混合物,分别是2sme-1(2’,5’-二甲硫基-4,4’-二甲酸甲脂-2,3,5,6,2’,3’,4’-六氟联苯)和2sme-2(3,5’-二甲硫基-4,4’-二甲酸甲脂-2,5,6,3’,4’-六氟联苯)。它们是同分异构体,而且两者的量相当(2sme-1:2sme-2=1:0.8),具有极其相近的极性,通过对核磁共振氢谱、氟谱和碳谱的分析证明了两种2sme化合物的成功合成。
实施例3
本实施例为硫醚化合物3,6,5’-三甲硫基-4,4’-二甲酸甲脂-2,5,2’,3’,6’-五氟联苯(3sme)的制备
1)在n2保护下,称取原料4,4’-二甲酸甲脂-八氟联苯(1.2g,2.9mmol)加入100ml两口圆底烧瓶。
2)称取nasme(1.07g,15.3mmol)加入100ml两口圆底烧瓶。
3)将两口圆底烧瓶连接到schlenk线上。
4)将20ml脱气后的甲醇溶液转移到圆底烧瓶。
5)在室温(25℃)下,搅拌反应4小时。
6)停止搅拌,随后将反应混合物倒入水中(150ml)。
7)用乙酸乙酯萃取(3×80ml)水溶液,然后合并乙酸乙酯溶液。
8)用水洗涤(3×100ml)萃取后的乙酸乙酯,后用无水mgso4干燥乙酸乙酯。
9)旋转蒸发器除去乙酸乙酯,得到无色粘稠状产物。
通过柱色谱(硅胶,使用pe和ea作为洗脱液)进一步纯化残余物,得到纯化后的无色粘稠状产物3,6,5’-三甲硫基-4,4’-二甲酸甲脂-2,5,2’,3’,6’-五氟联苯,记为3sme(3sme产量为0.5g,产率35%)。
对无色粘稠物产物进行核磁共振氢谱、氟谱和碳谱测试,结果如图8~10所示。
3sme的核磁测试结果:1hnmr(400mhz,cdcl3)δ:=4.02(s,3h),4.01(s,3h),2.47(d,j=0.6hz,3h),2.44(s,3h),2.39(s,3h);19fnmr(376mhz,cdcl3)δ:=-106.83(d,j=13.4hz),-108.03(d,j=15.3hz),-111.94(d,j=15.8hz),-131.13(d,j=22.4hz),-142.76(dd,j=22.2,14.6hz);13cnmr(100mhz,cdcl3)δ:=162.95(s),162.41(s),157.36–155.82(m),155.38–153.26(m),147.47(ddd,j=20.5,14.1,5.8hz),143.41(ddd,j=17.9,14.1,3.1hz),129.02(d,j=15.5hz),128.46(d,j=22.2hz),127.20(d,j=21.3hz),123.57(d,j=23.5hz),120.90(d,j=19.3hz),118.09(d,j=22.6hz),113.37(d,j=17.1hz),113.12(d,j=17.4hz),52.84(s),52.69(s),18.49(d,j=4.5hz),18.10(d,j=5.9hz),17.65(d,j=6.7hz).
通过对核磁共振氢谱、氟谱和碳谱的综合分析,证明了化合物3sme的成功合成。
实施例4
本实施例为硫醚化合物3,6,2’,5’-四甲硫基-4,4’-二甲酸甲脂-2,5,3’,6’-四氟联苯(4sme)和3,5,6,2’,5’-四甲硫基-4,4’-五甲酸甲脂-2’,3’,6’-三氟联苯(5sme)的制备
1)在n2保护下,称取原料4,4’-二甲酸甲脂-八氟联苯(1.7g,4.1mmol)加入100ml两口圆底烧瓶。
2)称取nasme(2.4g,34.3mmol)加入100ml两口圆底烧瓶。
3)将两口圆底烧瓶连接到schlenk线上。
4)将20ml脱气后的甲醇溶液转移到圆底烧瓶。
5)在室温(25℃)下,搅拌反应5小时。
6)停止搅拌,随后将反应混合物倒入水中(150ml)。
7)用乙酸乙酯萃取(3×80ml)水溶液,然后合并乙酸乙酯溶液。
8)用水洗涤(3×100ml)萃取后的乙酸乙酯,后用无水mgso4干燥乙酸乙酯。
9)旋转蒸发器除去乙酸乙酯,得到白色固体产物。
通过柱色谱(硅胶,使用pe和ea作为洗脱液)进一步纯化残余物,得到纯化后的白色固体产物3,6,2’,5’-四甲硫基-4,4’-二甲酸甲脂-2,5,3’,6’-四氟联苯和3,5,6,2’,5’-四甲硫基-4,4’-五甲酸甲脂-2’,3’,6’-三氟联苯少量,分别记为4sme(产量为0.83g,产率37%)和5sme。
对4sme进行核磁共振氢谱、氟谱和碳谱测试,结果如图11~13所示。
4sme的核磁测试结果:1hnmr(400mhz,cdcl3)δ:=3.96(s,6h),2.40(s,6h),2.32(s,6h);19fnmr(376mhz,cdcl3)δ:=-108.29(d,j=15.7hz),-112.51(d,j=15.8hz);13cnmr(100mhz,cdcl3)δ:=163.78(s),156.64(dd,j=70.2,2.4hz),154.17(dd,j=69.4,5.9hz),127.79(d,j=22.2hz),127.04(d,j=20.9hz),126.50(d,j=19.9hz),123.19(dd,j=23.9,3.9hz),53.16(s),18.67(d,j=6.1hz),18.09(d,j=7.0hz).
通过对核磁共振氢谱、氟谱和碳谱的综合分析,证明了化合物4sme的成功合成。
实施例5
本实施例为硫醚化合物3,6,2’3’,5,6”-六甲硫基-4,4’-二甲酸甲脂-2,5-二氟联苯(6sme)的制备
1)在n2保护下,称取原料4,4’-二甲酸甲脂-八氟联苯(3.0g,7.2mmol)加入100ml两口圆底烧瓶。
2)称取nasme(4.1g,58.6mmol)加入100ml两口圆底烧瓶。
3)将两口圆底烧瓶连接到schlenk线上。
4)将40ml脱气后的1,3-二甲基-2-咪唑啉酮溶液转移到圆底烧瓶。
5)在室温(25℃)下,搅拌反应4小时。
6)停止搅拌,随后将反应混合物倒入水中(150ml)。
7)用乙酸乙酯萃取(3×80ml)水溶液,然后合并乙酸乙酯溶液。
8)用水洗涤(3×100ml)萃取后的乙酸乙酯,后用无水mgso4干燥乙酸乙酯。
9)旋转蒸发器除去乙酸乙酯,得到白色固体产物。
通过柱色谱(硅胶,使用pe和ea作为洗脱液)进一步纯化残余物,得到纯化后的白色固体产物3,6,2’3’,5,6”-六甲硫基-4,4’-二甲酸甲脂-2,5-二氟联苯,记为6sme(产量为1.7g,产率为40%)。
对白色固体产物进行核磁共振氢谱、氟谱和碳谱测试。
6sme的核磁测试结果:1hnmr(400mhz,cdcl3)δ:=3.97(s,3h),3.96(s,3h),2.45(s,6h),2.39(s,3h),2.34(s,3h),2.26(s,6h);19fnmr(376mhz,cdcl3)δ:=-108.70(d,j=15.6hz),-113.49(d,j=15.6hz);13cnmr(100mhz,cdcl3)δ:=167.17(s),164.08(d,j=2.8hz),156.33(dd,j=42.4,2.6hz),153.90(dd,j=48.7,2.7hz),149.18(s),146.10(s),144.23(s),139.63(s),134.31(dd,j=21.6,3.1hz),126.47(d,j=8.6hz),126.26(d,j=6.8hz),121.97(dd,j=24.1,4.0hz),53.03(s),52.53(s),20.99(s),20.36(s),18.70(d,j=5.8hz),17.76(d,j=8.3hz).
通过对核磁共振氢谱、氟谱和碳谱的综合分析,证明了化合物6sme的成功合成,结果如图14~16所示。
实施例6
本实施例为硫醚化合物3,5,6,6,2’3’,5,6”-七甲硫基-4,4’-二甲酸甲脂-2-氟联苯(7sme)的制备
1)在n2保护下,称取原料4,4’-二甲酸甲脂-八氟联苯(0.3g,0.72mmol)加入100ml两口圆底烧瓶。
2)称取nasme(0.81g,11.6mmol)加入100ml两口圆底烧瓶。
3)将两口圆底烧瓶连接到schlenk线上。
4)将25ml脱气后的四氢呋喃溶液转移到圆底烧瓶。
5)在室温(25℃)下,搅拌反应48小时。
6)停止搅拌,随后将反应混合物倒入水中(150ml)。
7)用乙酸乙酯萃取(3×80ml)水溶液,然后合并乙酸乙酯溶液。
8)用水洗涤(3×100ml)萃取后的乙酸乙酯,后用无水mgso4干燥乙酸乙酯。
9)旋转蒸发器除去乙酸乙酯,得到白色固体产物。
10)通过柱色谱(硅胶,使用pe和ea作为洗脱液)进一步纯化残余物,得到纯化后的白色固体产物3,5,6,6,2’3’,5,6”-七甲硫基-4,4’-二甲酸甲脂-2-氟联苯,记为7sme(产量为1.7g,产率为40%)。
对白色固体产物进行核磁共振氢谱、氟谱和碳谱测试,结果如图17~19所示。
7sme的核磁测试结果:1hnmr(400mhz,cdcl3)δ:=4.01(s,6h),2.50(s,6h),2.46(s,3h),2.41(s,3h),2.33(s,3h),2.30(s,6h);19fnmr(376mhz,cdcl3)δ:=-101.27(s);13cnmr(101mhz,cdcl3)δ:=167.45(s),167.01(d,j=3.5hz),159.55(d,j=247.8hz),149.09(s),147.68(s),145.81(dd,j=220.7,2.5hz),144.16(s),139.50(s),140.77(d,j=461.8hz),136.42(d,j=18.9hz),133.61(d,j=4.2hz),121.59(d,j=22.5hz),52.77(s),52.68(s),21.10(d,j=3.2hz),21.08(s),20.54(s),20.35(s),18.90(d,j=4.9hz).
通过对核磁共振氢谱、氟谱和碳谱的综合分析,证明了化合物7sme的成功合成。
实施例7
本实施例为4,4’-二甲酸甲脂-八甲硫基联苯(8sme)的制备
1)在n2保护下,称取原料4,4’-二甲酸甲脂-八氟联苯(10.0g,24.1mmol)加入100ml两口圆底烧瓶。
2)称取nasme(27.2g,386.1mmol)加入100ml两口圆底烧瓶。
3)将两口圆底烧瓶连接到schlenk线上。
4)将25ml脱气后的四氢呋喃溶液转移到圆底烧瓶。
5)在室温(25℃)下,搅拌反应72小时。
6)停止搅拌,随后将反应混合物倒入水中(150ml)。
7)用乙酸乙酯萃取(3×80ml)水溶液,然后合并乙酸乙酯溶液。
8)用水洗涤(3×100ml)萃取后的乙酸乙酯,后用无水mgso4干燥乙酸乙酯。
9)旋转蒸发器除去乙酸乙酯,得到黄色固体产物。
10)通过柱色谱(硅胶,使用pe和ea作为洗脱液)进一步纯化残余物,得到纯化后的黄色固体产物4,4’-二甲酸甲脂-八甲硫基联苯,记为8sme(产量为9.3g,产率为60%)。
对黄色固体产物进行核磁共振氢谱和碳谱测试,结果如图20和21所示。
8sme的核磁测试结果:1hnmr(400mhz,cdcl3)δ:=3.98(s,6h),2.45(s,12h),2.36(s,12h);13cnmr(100mhz,cdcl3)δ:=167.67(s),153.17(s),148.58(s),143.08(s),138.48(s),52.59(s),20.79(s),20.72(s).
经氢谱、氟谱和碳谱的综合分析,证明了化合物8sme的成功合成。
实施例8
本实施例为硫醚化合物3,6,2’,5’-四苄硫基-4,4’-二甲酸甲脂-2,5,3’,6’-四氟联苯(m1)的制备
1)在n2保护下,称取4,4’-二甲酸甲脂-八氟联苯(1.7g,4.1mmol)加入100ml两口圆底烧瓶。
2)称取苄硫醇钠(4.8g,32.8mmol)加入100ml两口圆底烧瓶。
3)将两口圆底烧瓶连接到schlenk线上。
4)将20ml脱气后的甲醇溶液转移到圆底烧瓶。
5)在室温(25℃)下,搅拌反应5小时。
6)停止搅拌,随后将反应混合物倒入水中(150ml)。
7)用乙酸乙酯萃取(3×80ml)水溶液,然后合并乙酸乙酯溶液。
8)用水洗涤(3×100ml)萃取后的乙酸乙酯,后用无水mgso4干燥乙酸乙酯。
9)旋转蒸发器除去乙酸乙酯,得到白色固体产物。
10)通过柱色谱(硅胶,使用pe和ea作为洗脱液)进一步纯化残余物,得到纯化后的白色固体产物3,6,2’,5’-四苄硫基-4,4’-二甲酸甲脂-2,5,3’,6’-四氟联苯,记为m1(产量0.83g,产率37%)。
对白色固体产物进行核磁共振氢谱、氟谱和碳谱测试。
m1的核磁测试结果:1hnmr(400mhz,cdcl3)δ7.20(m,12h),7.14(m,4h),7.07(m4h),4.06–3.89(m,8h),3.91(s,6h);19fnmr(376mhz,cdcl3)δ-106.27(d,j=15.5hz,1h),-110.89(d,j=15.6hz,4h);13cnmr(101mhz,cdcl3)δ=163.72(d,j=2.3),156.93(dd,j=106.2,2.5),154.46(dd,j=107.8,2.6),136.88(s),136.48(s),129.41(d,j=12.9),129.11(s),129.05(s),128.80(s),128.69(s),128.77–128.61(m),127.80(s),127.68(s),126.59(t,j=20.4),121.04(d,j=24.5),53.19(s),40.13(d,j=4.4),39.67(d,j=6.5).
经氢谱、氟谱和碳谱的综合分析,证明了化合物m1的成功合成。
实施例9
本实施例为硫醚化合物4,4’-二甲酸甲酯-八苄硫基联苯(m2)的制备
1)在n2保护下,称取原料4,4’-二甲酸甲脂-八氟联苯(10.0g,24.1mmol)加入100ml两口圆底烧瓶。
2)称取苄硫醇钠(56.3g,386.1mmol)加入100ml两口圆底烧瓶。
3)将两口圆底烧瓶连接到schlenk线上。
4)将50ml脱气后的四氢呋喃溶液转移到圆底烧瓶。
5)在室温(25℃)下,搅拌反应48小时。
6)停止搅拌,随后将反应混合物倒入水中(150ml)。
7)用乙酸乙酯萃取(3×80ml)水溶液,然后合并乙酸乙酯溶液。
8)用水洗涤(3×100ml)萃取后的乙酸乙酯,后用无水mgso4干燥乙酸乙酯。
9)旋转蒸发器除去乙酸乙酯,得到黄色固体产物。
10)通过柱色谱(硅胶,使用pe和ea作为洗脱液)进一步纯化残余物,得到纯化后的黄色固体产物4,4’-二甲酸甲酯-八苄硫基联苯,记为m2(产量9.3g,产率60%)。
对白色固体产物进行核磁共振氢谱、氟谱和碳谱测试。
m2的核磁测试结果:1hnmr(400mhz,cdcl3)δ7.44–6.98(m,40h),4.35(s,8h),4.23(s,8h),3.93(s,6h).13cnmr(101mhz,cdcl3)δ167.69,153.32,149.93,143.26,137.99,136.85,136.50,129.55,129.41,128.79,128.73,127.75,127.72,52.74,43.08,42.98.
经氢谱和碳谱的综合分析,证明了化合物m2的成功合成。
以上所述,以上实施例仅用以说明本发明的技术方案,而非对其限制;尽管参照前述实施例对本发明进行了详细的说明,本领域的普通技术人员应当理解:其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换;而这些修改或者替换,并不使相应技术方案的本质脱离本发明各实施例技术方案的精神和范围。
- 还没有人留言评论。精彩留言会获得点赞!