氯嘧磺隆降解酶Kj-GST、其编码基因Kj-gst及应用的制作方法
本发明属于微生物基因工程技术领域,具体涉及一种氯嘧磺隆降解酶kj-gst、其编码基因kj-gst及应用。
背景技术:
磺酰脲类除草剂是世界范围内控制主要农作物杂草的一类重要除草剂。磺酰脲类除草剂通过抑制植物体内乙氧基酸合酶(ahas)的合成来控制农田杂草的生长。ahas是细菌、真菌和植物中缬氨酸、亮氨酸和异亮氨酸生物合成途径中的关键酶。磺酰脲类除草剂具有高效、低用量、多品种选择性等特点,近年来发展迅速。氯嘧磺隆化学名称为2-(4-氯-6-甲氧基嘧啶-2-基氨基甲酰氨基磺酰基)苯甲酸乙酯,属于磺酰脲类除草剂的一种,为无色晶体,熔点181℃,密度1.51g/cm3(25℃),略溶于有机溶剂。在中性至碱性土壤中,氯嘧磺隆的降解速度非常缓慢,残留时间可持续数月至一年以上。土壤中的氯嘧磺隆残留严重危害豆科、油菜等磺脲类敏感作物的后续轮作,造成严重的农业损失。利用微生物降解残留的氯嘧磺隆是一条可行的道路。微生物对氯嘧磺隆的降解主要有两个途径:(1)微生物分泌降解酶,降解酶通过水解、氧化等作用使磺酰脲类除草剂的脲桥发生断裂;(2)对于一些有酯结构的磺酰脲类除草剂(如氯嘧磺隆、噻吩磺隆、甲磺隆等),酯键被微生物产生的相应酯酶水解。目前已经有一些关于菌株降解氯嘧磺隆的报导,但大多效果不显著。要利用微生物降解技术解决氯嘧磺隆残留问题首要要求就是找到优良的微生物资源。
吉林克雷伯氏菌2n3(klebsiellajilinsis2n3,简称2n3)是由吉林农业大学张浩教授2009年分离自农药厂废水处理池污泥的一株氯嘧磺隆降解菌(专利号zl200910218087.9),保藏于中国典型培养物保藏中心,保藏编号为cctccno:m209248。质谱分析结果表明,2n3可以将氯嘧磺隆脲桥水解产生邻磺酸苯甲酸亚胺和2-氨基-6-甲氧基嘧啶。在基础无机盐培养基中,2n3以氯嘧磺隆作为单氮源进行生长,在使用氯嘧磺隆进行诱导培养后,可以高效地降解氯嘧磺隆。在30℃~35℃、ph值为6~7的基础无机盐培养基中,12h内可将初始浓度20mg/l和100mg/l的氯嘧磺隆分别降解83.5%和92.5%。
技术实现要素:
本发明目的在于提供一种氯嘧磺隆降解酶kj-gst、其编码基因kj-gst以及二者的应用。基因kj-gst可以用于构建降解氯嘧磺隆的菌液,并且可以用于生产降解氯嘧磺隆的酶制剂用来消除不同环境里的氯嘧磺隆残留。
本发明所述的氯嘧磺隆降解基因kj-gst来自于2n3。实验证实在缺少基因kj-gst后,2n3降解氯嘧磺隆的能力大大下降,并且2n3的降解能力在基因kj-gst回补之后得到了回复。本发明成功在2n3中克隆出氯嘧磺隆降解基因kj-gst,其在genbank比对结果表明该基因为谷胱甘肽s转移酶基因。
本发明所述的氯嘧磺隆降解基因kj-gst,其dna序列如seqidno:1所示。该dna序列为kj-gst的开放阅读框,长度为669bp,编码222个氨基酸。本发明所述的氯嘧磺隆降解酶kj-gst,其氨基酸序列如seqidno:2所示。
本发明所述的氯嘧磺隆降解酶kj-gst可以高效地降解氯嘧磺隆,在敲除基因kj-gst后,2n3对氯嘧磺隆的降解能力有了明显的下降;在将敲除基因回补后,2n3降解氯嘧磺隆的能力有了恢复。基因kj-gst可用于构建降解氯嘧磺隆的转基因微生物或植物,亦可用于生产降解氯嘧磺隆的酶制剂,用于消除土壤、水体和农产品中的氯嘧磺隆残留。
附图说明
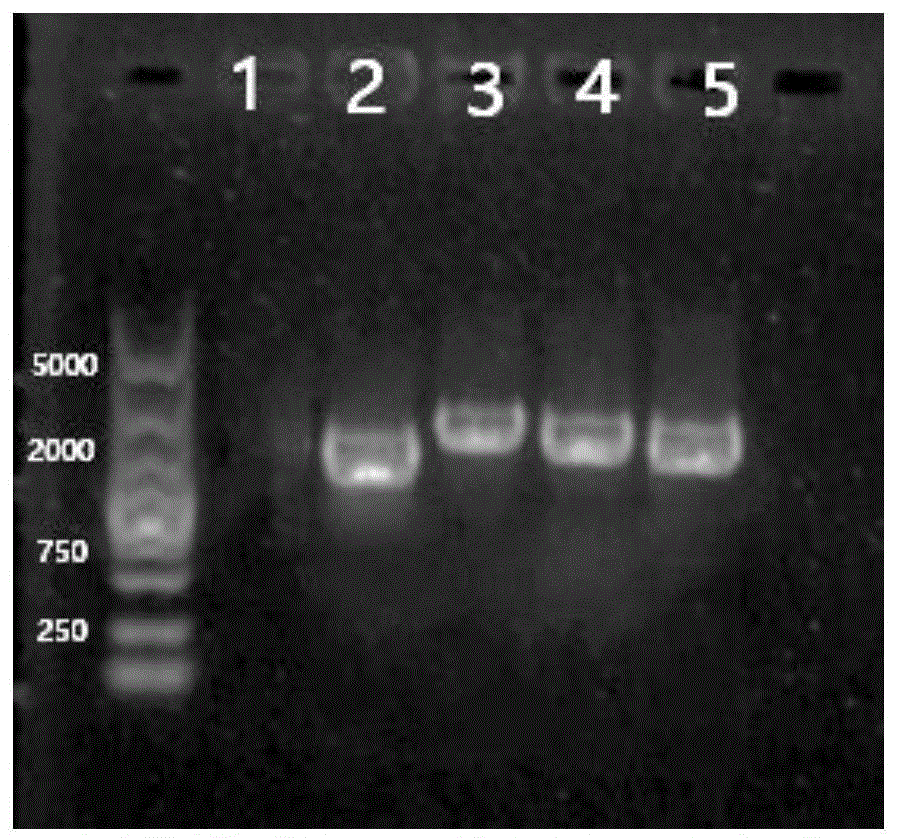
图1为实施例1中基因kj-gst敲除突变体验证电泳图,电泳图显示敲除成功。图中,泳道从左至右分别为基因kj-gst(1),卡那霉素线性盒(2),基因kj-gst全长(3),卡那霉素抗性序列+同源臂上臂(4),卡那霉素抗性序列+同源臂下臂(5)。
图2为实施例4中蛋白kj-gst的westernblot图,该蛋白图证实基因kj-gst表达成功并且蛋白kj-gst纯化成功。
图3为实施例3中2n3野生型(wildtype)、敲除突变体(mutant)、回补突变体(complementation)降解氯嘧磺隆能力及生长曲线。
图4为实施例4中氯嘧磺隆降解产物的hplc检测结果,检测结果表明氯嘧磺隆的降解产物主要有两个,即产物一和产物二。
图5为实施例4中降解产物1与降解产物2的一级质谱图。
图6为实施例4中产物一的二级质谱图。
图7为实施例4中产物二的二级质谱图。
具体实施方式
为了更好地描述本发明,下面通过实施例予以进一步说明,下述实施例中的方法,如无特别说明,均为常规方法。
实施例1基因kj-gst的基因敲除
1)基因kj-gst的扩增及打靶线性盒的扩增
扩增基因kj-gst的上游引物为
5’atgctgacggtacatcatcttaatcaatc3’
下游引物为:
tcaggcgccgggtaagg)
作为验证敲除是否成功的引物为:上游引物:
5’taaccagacgatgcgcaaacg3’
下游引物为:
5’tggcatctgccgtcgctttt3’
以载体pkd4为模板扩增同源打靶线性盒,使用的上游引物为
5’cgctaacaattttttagtgagttgctttcatttatcgacgtcatcggatccgctgatatctgtgtaggctggagctg3’
下游引物为
5’ttttcccggcaatgagcgcctgtttctatagttaatttgaacaaactacgggagaggctcatcctccttagttcctattcc3’
反应体系为10mmol/ldntpmixture1μl;5×pcrbuffer10μl;上、下游引物各2.5μl(10μmol/ml);模板dna(前两个引物对应的dna为2n3基因组,后一个引物对应的dna为pkd4)2μl;primerstarmix25μl;ddh2o,18μl;
扩增程序为:98℃预变性2分钟,然后(1)98℃,变性20秒;(2)65℃,退火30秒;(3)72℃,延伸30秒;(4)循环34次;(5)72℃延伸10分钟。
此步骤将分别得到基因kj-gst与打靶线性盒。
用于pcr扩增的酶、引物及其他消耗品均从生工公司购买。质粒pkd4购于索莱宝公司。
2)转入重组载体pkd46的2n3菌液的制备
将保存有同源重组质粒pkd46的大肠杆菌dh5α(购自北京华越洋生物公司)复苏摇混并使用质粒提取试剂盒提取质粒,得到同源重组质粒pkd46;
制备体积比1:9的10%甘油水溶液300ml;
将吉林克雷伯氏菌2n3野生型接入200ml的lb培养基中培养至od600值为0.5左右,然后立即将所得菌液在冰盒中冷却5分钟;用10%甘油水溶液反复冲洗3遍菌体得到2n3野生型感受态细胞;
将10μl同源重组质粒pkd46与100μl的2n3感受态细胞混合,在冰上预冷3分钟后将混合体系加入电击杯中,再将电击杯放入冰盒中预冷30分钟,准备电击转化。
电击条件为电压2400v、电流25uf、电阻200ω,电击完成后迅速向电击杯中加入700ml的soc培养基并在冰上放置3分钟;3分钟后将电击杯中soc培养基吸出,将该含有菌液的培养基放入30℃、200rpm的摇床内复苏1小时;1小时后将转化后的菌液均匀地涂在含有卡那霉素的平板上,次日挑取阳性克隆进行pcr验证转化是否成功,如成功则表明得到了转入重组载体pkd46的2n3菌液,-80℃冰箱中保存;
实验使用的lb培养基、soc培养基、甘油、卡那霉素板等均购于索莱宝公司,质粒提取试剂盒购于库美公司。
3)2n3感受态细胞的制作
将-80℃冰箱中保存的已经转入重组载体pkd46的2n3菌液取出,解冻后将其在固体lb培养基中划线培养,次日挑取单菌落接入20ml的lb培养基中以200rpm、37℃条件下隔夜培养;次日再将摇混的菌液接入100ml的lb培养基中在200rpm、37℃条件将菌液培养至od600达0.1左右,然后加入5ml、1mol/l的l-(+)arabinose,继续以37℃、200rpm的速度摇菌液;当菌液od600达到0.2时再次加入5ml、1mol/l的l-(+)arabinose,继续以相同的条件将菌液摇至od600达到0.5左右,然后迅速将菌液放置入冰盒内降温5分钟;降温后将菌液用10%甘油水溶液4℃低温离心冲洗3次,最终制得2n3感受态细胞。
此步骤所用到的l-(+)arabinos等均购于索莱宝公司。
4)基因kj-gst的敲除
在进行电击转化之前先将步骤1)得到的打靶线性盒10μl与100μl步骤3)制备的2n3感受态细胞混匀,并在冰上放置30分钟后再将混合体系转入事先预冷过的电击杯中准备进行电击转化。电击转化时,电击条件为电压2400v、电流25uf、电阻200ω,电击完成后迅速向电击杯中加入700ml的soc培养基并在冰上放置3分钟;3分钟后将电击杯中soc培养基吸出,将该含有菌液的培养基放入30℃、200rpm的摇床内复苏1小时;1小时后将转化后的菌液均匀地涂在含有卡那霉素的平板上,次日挑取阳性克隆pcr验证敲除是否成功,如成功则表明得到了2n3kj-gst敲除突变体,敲除验证电泳图如图1所示。
实施例2敲除基因回补
1)回补载体质粒pli50的改造
将含有质粒pli50的大肠杆菌dh5α从-80℃冰箱中取出(含有质粒pli50的大肠杆菌dh5α购于北京华越洋生物公司),划线培养复苏菌体。将复苏好的菌液接种入20ml的lb培养基中30℃、200rpm培养过夜,次日使用质粒提取试剂盒提取质粒pli50。将提取的质粒进行双酶切,酶切位点分别为hindⅲ与ecorⅰ,将其与步骤1)进行了pcr扩增的kj-gst基因片段相连接。质粒pli50进行双酶切的上游引物为5’gcgtcgac-atgctgacggtacatcatcttaatcaatc3’,下游引物为5’cccaagctt-tcaggcgccgggtaagg3’。所用引物在实施例1基因kj-gst扩增的上、下游引物的基础上加入了hindⅲ与ecorⅰ两个酶切位点。扩增体系与实施例1相同。
将10μl连接好kj-gst基因的质粒pli50与100μl大肠杆菌dh5α感受态细胞混合,在冰上预冷30分钟,30分钟以后将混合体系放入42℃水浴锅内90秒进行热击。热击结束后将混合体系置于冰上3分钟静置结束后向混合体系中加入700ml的soc培养基,然后将含有菌液的培养基放入30℃、200rpm的摇床内复苏1小时。1小时后将转化后的菌液均匀地涂在含有卡那霉素的平板上,次日挑选阳性克隆后提质粒pcr验证质粒是否转入。pcr验证成功后将含有连接好kj-gst基因的重组质粒pli50的dh5α菌液接入20ml的lb培养基中隔夜培养,次日使用质粒提取试剂盒提取质粒。大肠杆菌dh5α感受态细胞购买于生工公司。
2)基因kj-gst的回补
使用实施例1得到的已敲除基因kj-gst的2n3突变体制作感受态细胞。制作方式与实施例1步骤2)中制作2n3野生型的感受态细胞一致。
将步骤1得到的10μl连接好kj-gst基因的重组质粒pli50与100μl大肠杆菌dh5α感受态细胞混匀并在冰上放置30分钟后再将混合体系转入事先预冷过的电击杯中准备进行电击转化。电击转化时,电击条件为电压2400v、电流25uf、电阻200ω,电击完成后迅速向电击杯中加入soc培养基并在冰上放置3分钟。电击完成在30℃摇床复苏1h,然后将转化后的菌液均匀地涂在含有氨苄青霉素的平板上,次日挑取阳性克隆进行pcr验证回补是否成功,如成功则表明得到了2n3kj-gst回补突变体。
实施例3敲除突变体及回补突变体对氯嘧磺隆的降解能力测试
1)接种液的制作
将2n3野生型、2n3kj-gst敲除突变体(实施例1得到)、2n3kj-gst回补突变体(实施例2得到)三份菌液分别摇混。使用无菌水分别洗涤三份菌液三次,使三份菌液的od值最终都为0.5。
2)配制无机盐培养基
无机盐培养基的配方为:葡萄糖5g、kh2po41.0g、mgso4·7h2o0.2g、k2hpo41.0g、nacl0.2g、nh4no31.6g,加水定容至1l。加入氯嘧磺隆固体粉末使培养基内氯嘧磺隆的浓度最终为10mg/ml。
3)降解能力测试
将配制好的无机盐培养基分别接种相同量的本实施例步骤1)得到的三种不同菌液。将接种后的菌液放入37℃、200rpm的摇床内培养,培养期间每过2小时取样一次并测量菌液od值。最后将取得的样品收集,统一使用hplc测定氯嘧磺隆残留量。测定结果表明2n3kj-gst敲除突变体的降解能力较2n3野生型与2n3kj-gst回补突变体而言有明显的下降,2n3kj-gst敲除突变体的生长速度和2n3野生型与2n3kj-gst回补突变体相比也明显较慢。三者生长及降解能力曲线如图3所示。
实施例4基因kj-gst在pet-28a中的高效表达、纯化及其功能测定
1)基因kj-gst的扩增
扩增kj-gst的引物加上了ecorⅰ和bamhⅰ的酶切位点,上游引物为5’cgcggatcc-atgctgacggtacatcatcttaatcaatc3’、下游引物为5’ccggaattc-tcaggcgccgggtaagg3’。扩增完的片段加a尾后与pmt18-t载体相连。加a尾体系为1μltaqenzyme,3μl10×taqbuffer,dna25μl,dntp1μl。连接体系为pmt18-t1μl,dna4μl,solutionⅰ5μl。反应程序为加a尾72℃30分钟,连接为16℃1小时。将连接好的载体热击转化入大肠杆菌dh5α中(热击操作与实施例2步骤1中相同),复苏过后将其均匀地涂在含有氨苄抗生素的平板上,隔夜培养次日挑取阳性克隆测序验证连接是否成功。将连接成功后的菌液在lb培养基中扩大培养后使用质粒提取试剂盒提取pmt18-t-kj-gst质粒。
2)表达载体pet-28a双酶切
将含有将表达载体pet-28a的大肠杆菌dh5α使用质粒提取试剂盒提取质粒后进行双酶切,酶切体系为:10×quickcutgreenbuffer5μl,ecorⅰ2μl,bamh2μl,ddh2o11μl,质粒30μl。将酶切完的片段跑电泳后凝胶回收。
3)表达载体pet-28a-kj-gst的构建
将步骤1)和步骤2)中得到的分别进行了双酶切后的pet-28a与kj-gst片段连接,连接体系为pet-28a2μl,kj-gst片段3μl,solutionⅰ5μl,连接温度为16℃,时间为1小时。连接完成后将连接产物热击转化入表达菌株bl21(de3)中(操作方式与实施例2步骤1相同)得到重组菌株bl21-pet-28a-kj-gst。本步骤中菌株bl21(de3)购买于全式金公司。
4)kj-gst的表达、纯化和功能验证
将重组菌组bl21-pet-28a-kj-gst在200rpm、37℃条件下培养至od600为0.8时加入iptg使其最终浓度为0.5mm。将加入iptg后的菌液放入16℃摇床诱导24小时。诱导结束后收集菌体进行破碎得到粗酶液。利用ni-nta柱纯化粗酶液,纯化后的蛋白的westernblot结果如图2所示。条带单一,大小约为24kda,经过透析后可满足酶学特性要求。
本步骤中iptg购买于全式金公司,ni-nta柱购买于生工公司
5)kj-gst降解氯嘧磺隆产物的测定
酶活反应体系(1ml):0.5mmtris-hcl(ph7.5)490μl,100mg/l氯嘧磺隆10μl,反应酶量500μl,35℃反应30分钟。反应以加入酶液开始,反应结束立刻将体系过滤头后在冰上降温,立刻进行hplc检测,检测结果如图4所示。液相色谱仪测定条件:agilent1220高效液相色谱仪,c18色谱柱(10cm×4.6mm),进样量10μl,流动相为甲醇-水-乙酸(60:40:0.1,体积比),流速1.0ml/min。pda检测器,波长256nm,柱温30℃。hplc结果显示氯嘧磺隆的浓度明显下降,并在保留时间3.248分钟和3.785分钟时出现了2n3降解菌降解氯嘧磺隆的相同产物峰,进行进一步ms分析后确认降解产物与2n3降解氯嘧磺隆的产物相同(结果如图5所示),将产物一与产物二进行二级质朴分析确认产物一与产物二分别为为邻磺酸苯甲酸亚胺和2-氨基-6-甲氧基嘧啶,与2n3降解氯嘧磺隆的产物一致。二级产物质谱图如图6图7所示。本步骤中tris-hcl购买于生工公司。
<110>吉林农业大学
<120>氯嘧磺隆降解酶kj-gst、其编码基因kj-gst及应用
<160>2
<210>1
<211>669
<212>dna
<213>吉林克雷伯氏菌2n3
<220>
<221>cds
<222>(1)…(669)
<400>1
atgctgacggtacatcatcttaatcaatcacgatcgcaacgcgta
metleuthrvalhishisleuasnglnserargserglnargval
151015
ctgtgggcactggaagagctgcagctgccttatcagatagtccgc
leutrpalaleuglugluleuglnleuprotyrglnilevalarg
202530
tatcagcgggagaaaacgatgctggcgccggcggcgctgaaaaaa
tyrglnargglulysthrmetleualaproalaalaleulyslys
354045
atccatccgttgggcaaatcaccggtactggaagacaacggctat
ilehisproleuglylysserprovalleugluaspasnglytyr
505560
gtgctggcggagtccggggcgatcctcgagtatttgcaggaaacc
valleualagluserglyalaileleuglutyrleuglngluthr
657075
tgggacagcggcgggttgttgaagccgcagggaattgacgacaaa
trpaspserglyglyleuleulysproglnglyileaspasplys
808590
ctgcagtaccgcttctggctgcactatgccgaaggctcgctgatg
leuglntyrargphetrpleuhistyralagluglyserleumet
95100105
ccgctgctgttaatgaagctggtgttcgccagccttggcaaaccc
proleuleuleumetlysleuvalphealaserleuglylyspro
110115120
cctgtgccctttggcgttcgctcgctgggttcgctgctgggcaag
provalpropheglyvalargserleuglyserleuleuglylys
125130135
gggatacagaaaacgtggctcgatccgcagctggccacccatgcg
glyileglnlysthrtrpleuaspproglnleualathrhisala
140145150
cggttcattgacgaccatcttgccgcgcggccatggttcgctggc
argpheileaspasphisleualaalaargprotrpphealagly
155160165
gagcggctgagcatggccgatatccagatgagcttcccggtgatg
gluargleusermetalaaspileglnmetserpheprovalmet
170175180
gcattgttggcgcgcggcggcatgcatgaccttgtccatatcgag
alaleuleualaargglyglymethisaspleuvalhisileglu
185190195
gcctggcgtcagcgagtggaacagcgaccggcctggcaacgcgcc
alatrpargglnargvalgluglnargproalatrpglnargala
200205210
atcgagcgcggcggccccttcaccttacccggcgcctga
ilegluargglyglyprophethrleuproglyalaend
215220223
<210>2
<211>222
<212>prt
<213>吉林克雷伯氏菌2n3
<400>2
metleuthrvalhishisleuasnglnserargserglnargvalleutrp
151015
alaleuglugluleuglnleuprotyrglnilevalargtyrglnargglu
202530
lysthrmetleualaproalaalaleulyslysilehisproleuglylys
35404550
serprovalleugluaspasnglytyrvalleualagluserglyalaile
556065
leuglutyrleuglngluthrtrpaspserglyglyleuleulysprogln
70758085
glyileaspasplysleuglntyrargphetrpleuhistyralaglugly
9095100
serleumetproleuleuleumetlysleuvalphealaserleuglylys
105110115
proprovalpropheglyvalargserleuglyserleuleuglylysgly
120125130135
ileglnlysthrtrpleuaspproglnleualathrhisalaargpheile
140145150
aspasphisleualaalaargprotrpphealaglygluargleusermet
155160165170
alaaspileglnmetserpheprovalmetalaleuleualaargglygly
175180185
methisaspleuvalhisileglualatrpargglnargvalgluglnarg
190195200
proalatrpglnargalailegluargglyglyprophethrleuprogly
205210215220
alaend
222
核苷酸和氨基酸序列表
3
- 还没有人留言评论。精彩留言会获得点赞!