咪唑二肽的制备方法与流程
本发明涉及肌肽、鹅肌肽及鲸肌肽等咪唑二肽的制备方法。
背景技术:
咪唑二肽为包含咪唑基的氨基酸残基键合而成的肽的总称,包括:肌肽(carnosine:β-丙氨酰-l-组氨酸),鹅肌肽(anserine:β-丙氨酰-3-甲基-l-组氨酸)及鲸肌肽(balenine:nα-β-丙氨酰-1-甲基-l-组氨酸)等包含β-丙氨酸与组氨酸残基或其衍生物的二肽。这些二肽在长距离飞行的鸟类的胸肉,金枪鱼、鲣鱼、鲸等长距离回游的海洋生物的肌肉中含量较多,已知有抗疲劳效果、去除活性氧的能力、降血压作用、抗炎作用及降低尿酸值作用等,已将从鸡等家畜的肌肉提取的这些咪唑二肽用作营养补充剂食品(非专利文献1~3)。但是,尚未建立针对肌肽、鹅肌肽及鲸肌肽的高效率且低成本的制备方法。
虽然也尝试了制作l-氨基酸α-连接酶的突变体而在肌肽合成中的应用,但从效率且经济的观点出发仍不够充分(专利文献1)。
本发明人以建立咪唑二肽的简便且低成本的制备方法为目标,制作了各种作为l-氨基酸α-连接酶的来源于枯草芽孢杆菌(bacillussubtilis)的ywfe的突变型(专利文献2)。但是,l-氨基酸α-连接酶在β-丙氨酸与组氨酸或其衍生物进行缩合时,与atp的水解反应共轭反应,因此,以往在咪唑二肽的制备反应时需要添加atp。
另一方面,已知将肌肽转换为鹅肌肽的酶(非专利文献4)。但对于使用了大肠杆菌(e.coli)的由肌肽产生鹅肌肽的方法,尚属未知。
现有技术文献
专利文献
专利文献1:日本特开2013-081405号公报
专利文献2:日本特开2018-102287号公报
非专利文献
非专利文献1:songb.等,nutr.res.pract.2014,8:310
非专利文献2:belliaf.等,molecules2014,19:2299-2329
非专利文献3:boldyreva.a.等,physiol.rev.2013,93:1803-45
非专利文献4:drozakj.等,j.biol.chem.2015,290:17190-17205
技术实现要素:
发明所要解决的技术问题
本发明的课题在于提供能高效率且低成本地生产选自肌肽及鹅肌肽及鲸肌肽的咪唑二肽的制备方法。
解决问题的手段
作为咪唑二肽的酶合成法,本发明人着眼于通过与专利文献2中记载的atp的水解反应共轭,将无保护的氨基酸作为底物而形成肽键,由此合成咪唑二肽,发现通过将具有咪唑二肽合成活性的微生物与atp供给系统组合,能高效率且低成本地制备咪唑二肽,从而完成了本发明。
另外,本发明人建立了由肌肽制备鹅肌肽的方法。
具体而言,本发明提供一种使用具有咪唑二肽合成活性的微生物制备咪唑二肽的方法,前述制备方法通过利用前述微生物具有的atp供给系统,不包括添加atp的工序,或包括添加以摩尔数换算计少于制备的咪唑二肽量的atp量的工序。
在本发明的咪唑二肽的制备方法中,存在前述咪唑二肽选自肌肽、鹅肌肽或鲸肌肽的情况。
在本发明的咪唑二肽的制备方法中,存在前述微生物为表达l-氨基酸α-连接酶的微生物的情况。
在本发明的咪唑二肽的制备方法中,存在前述l-氨基酸α-连接酶为具有咪唑二肽合成活性的蛋白质的情况。
在本发明的咪唑二肽的制备方法中,存在包括下述的情况:
前述l-氨基酸α-连接酶为具有序列号12表示的氨基酸序列的野生型ywfe的氨基酸序列中有1个残基~3个残基的氨基酸残基被置换的突变型l-氨基酸α-连接酶,其中包括
对相当于序列号12的n末端起第108位天冬酰胺(n)残基的氨基酸残基进行的选自丙氨酸(a)、谷氨酸(e)或谷氨酰胺(q)的氨基酸置换,
对相当于序列号12的n末端起第112位异亮氨酸(i)残基的氨基酸残基进行的缬氨酸(v)置换,
和/或
对相当于序列号12的n末端起第378位组氨酸(h)残基的氨基酸残基进行的选自赖氨酸(k)或精氨酸(r)氨基酸置换。
在本发明的咪唑二肽的制备方法中,存在前述制备方法包括菌体反应法或发酵法的情况。
在本发明的咪唑二肽的制备方法中,存在包括添加前述微生物具有代谢能力的糖质的工序的情况。
在本发明的咪唑二肽的制备方法中,存在前述微生物为肽酶缺陷株的情况。
在本发明的咪唑二肽的制备方法中,存在前述肽酶为pepd的情况。
另外,本发明提供制备鹅肌肽的制备方法,前述方法通过包括使肌肽进一步与具有肌肽n-甲基转移酶活性的酶进行反应的工序来制备鹅肌肽,其中前述肌肽是作为前述微生物制备的咪唑二肽的肌肽。
在本发明的鹅肌肽的制备方法中,存在使用表达具有肌肽n-甲基转移酶活性的酶的微生物的情况。
在本发明的鹅肌肽的制备方法中,存在使用共表达作为前述l-氨基酸α-连接酶具有肌肽合成活性的酶和具有肌肽n-甲基转移酶活性的酶的微生物的情况。
在本发明的鹅肌肽的制备方法中,存在前述具有肌肽n-甲基转移酶活性的酶是以序列号36表示的酶的情况。
在本发明的鹅肌肽的制备方法中,存在前述制备方法为发酵法的情况。
附图说明
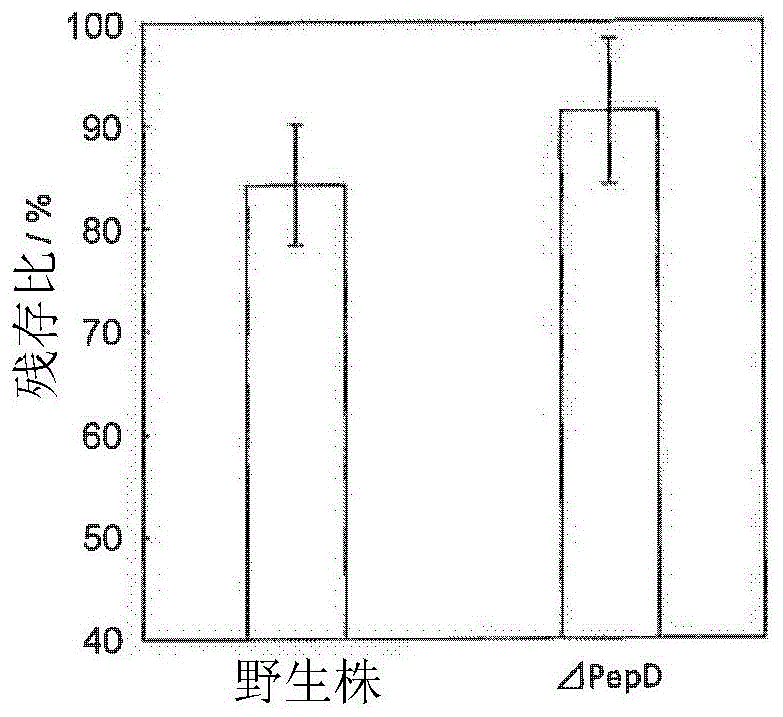
[图1]示出对在肌肽分解中的肽酶的影响进行了评价的结果的图。[野生株]表示使用了野生株,[δpepd]表示使用了pepd缺陷株。
[图2]示出对基于菌体反应法的肌肽合成中添加葡萄糖的影响进行了评价的结果的图。[wt/nehk]表示以野生株作为宿主、使其表达双重突变型ywfe(n108e/h378k)的转化株。[g+]表示葡萄糖添加组,[g-]表示葡萄糖非添加组。
[图3]示出对在基于菌体反应法的鹅肌肽合成中添加葡萄糖的影响进行了评价的结果图。[wt/ivhk]表示以野生株作为宿主、使其表达双重突变型ywfe(i112v/h378k)的转化株,[δpepd/ivhk]表示以pepd缺陷株作为宿主、使其表达双重突变型ywfe(i112v/h378k)的转化株。[g+]表示葡萄糖添加组,[g-]表示葡萄糖非添加组。
[图4]为hplc层析图,示出使用了肌肽n-甲基转移酶(ynl092w)表达转化株的菌体反应法中的鹅肌肽合成的评价。
具体实施方式
1.咪唑二肽的制备方法
本发明的实施方式之一为使用具有咪唑二肽合成活性能力的微生物制备咪唑二肽的方法。
更具体而言,本发明为使用具有咪唑二肽合成活性的微生物制备咪唑二肽的方法,前述制备方法通过利用前述微生物具有的atp供给系统,不包括添加atp的工序,或包括添加以摩尔数换算计少于制备的咪唑二肽量的atp量的工序。
在本说明书中,蛋白质的序列利用本领域技术人员众所周知的常用的氨基酸的利用3个字母或1个字母的标记法记载。本说明书中的氨基酸如无特别记载则为l型。另外,在表示突变型蛋白质时,使用待导入野生型蛋白质的突变的氨基酸的1个字母标记,表示突变位置的数字,及突变后氨基酸的1个字母标记的本领域技术人员众所周知常用的方法。
在本发明的制备方法中,作为前述微生物的例子,可列举表达l-氨基酸α-连接酶的微生物。
在本说明书中,l-氨基酸α-连接酶只要为具有咪唑二肽合成活性的酶即可,没有特别限定,作为l-氨基酸α-连接酶例如可列举突变型l-氨基酸α-连接酶,其包含具有序列号12表示的氨基酸序列的野生型ywfe的一部分的氨基酸序列的置换。
更具体而言,前述突变型l-氨基酸α-连接酶为对于具有序列号12表示的氨基酸序列的野生型ywfe的氨基酸序列,其中有1个残基~3个残基的氨基酸残基被置换的蛋白质,
优选为下述蛋白质,前述蛋白质包含:
对相当于序列号12的n末端起第108位天冬酰胺(n)残基的氨基酸残基进行的选自丙氨酸(a)、谷氨酸(e)或谷氨酰胺(q)的氨基酸置换,
对相当于序列号12的n末端起第112位异亮氨酸(i)残基的氨基酸残基进行的缬氨酸(v)置换,
和/或,
对相当于序列号12的n末端起第378位组氨酸(h)残基的氨基酸残基进行的选自赖氨酸(k)或精氨酸(r)的氨基酸置换。
作为前述蛋白质的更优选的例子,可以为下述蛋白质:
(i)具有序列号13~32的氨基酸序列的蛋白质,
(ii)与序列号13~32的氨基酸序列具有80%以上、优选为85%以上、更优选为90%以上,最优选为95%以上的同一性,且具有l-氨基酸α-连接酶活性的蛋白质,
(iii)包括序列号13~32的氨基酸序列中1或多个氨基酸残基的缺失、置换、插入和/或添加的氨基酸序列,且具有l-氨基酸α-连接酶活性的蛋白质。
前述突变型l-氨基酸α-连接酶可以依照专利文献1、2中记载的方法制备并使用。
在本说明书中,作为前述l-氨基酸α-连接酶活性的例子,是指咪唑二肽合成活性,作为利用l-氨基酸α-连接酶活性制备的咪唑二肽的例子,可列举肌肽、鹅肌肽及鲸肌肽。
即,作为前述l-氨基酸α-连接酶活性的优选例子,可列举下述式1表示的肌肽(carnosine)合成活性,下述式2表示的鹅肌肽(anserine)合成活性和/或下述式3表示的鲸肌肽(balenine)合成活性。
[化学式1]
[化学式2]
[化学式3]
在本说明书中,l-氨基酸α-连接酶活性是指使作为底物的氨基酸缩合,利用α位羧基进行肽键合的活性,其中,二肽合成活性是指2个分子的氨基酸缩合而合成二肽的活性。二肽合成活性的评价,可以例如在包含被测蛋白质和作为底物的氨基酸和atp的例如ph5~11的缓冲液中,在例如20~50℃的给定的温度,温育例如2~150小时的给定的时间,以通过温育产生的二肽的量或浓度的增加,作为底物的氨基酸的量或浓度的减少,atp的量或浓度的减少,adp的量或浓度的增加,或无机磷酸的量或浓度的增加中的至少一种作为指标,使用例如高效液相层析等测定。
另外,对前述具有咪唑二肽合成活性的微生物而言,可以进一步使用除了咪唑二肽合成活性以外,还具有l-组氨酸生产能力的微生物。具有l-组氨酸生产能力的微生物,可依照公知的方法(日本特开昭58-193695号公报,日本特开昭60-024193号公报,日本特开2001-086998号公报,日本特开2001-157596号公报)制备。通过使用具有l-组氨酸生产能力的微生物,在制备肌肽时,可以不加入l-组氨酸作为底物而制备、获得肌肽。
在本发明中,作为前述微生物的例子,可以为原核生物及真核生物中的任意一种,作为更具体的微生物的例子,优选可以使用属于:埃希氏(escherichia)属细菌,例如:大肠杆菌,放线菌(actinomyces)属细菌,芽孢杆菌(bacillus)属细菌,沙雷氏菌(serratia)属细菌,假单胞菌(pseudomonas)属细菌,棒状杆菌(corynebacterium)属细菌,短杆菌(brevibacterium)属细菌,红球菌(rhodococcus)属细菌,乳杆菌(lactobacillus)属细菌,链霉菌(streptomyces)属细菌,栖热菌属(thermus)属细菌,链球菌(streptococcus)属细菌,酵母(saccharomyces)属酵母,毕赤酵母(pichia)属酵母,克鲁维酵母菌(kluyveromyces)属酵母,假丝酵母(candida)属酵母,裂殖酵母(schizosaccharomyces)属酵母,德巴利酵母(debaryomyces)属酵母,亚罗酵母(yarrowia)属酵母,隐球酵母(cryptococcus)属酵母,发夫酵母(xanthophyllomyces)属酵母,被孢霉(mortierella)属丝状细菌,镰刀菌(fusarium)属丝状细菌,裂殖壶菌(schizochytrium)属,破囊壶菌(thraustochytrium)属等的微生物。
本发明的微生物,更具体而言,可以使用:大肠埃希氏菌(escherichiacoli,以下记载为[e.coli]),枯草芽孢杆菌(bacillussubtilis),短芽孢杆菌(bacillusbrevis),嗜热脂肪芽孢杆菌(bacillusstearothermophilus),粘质沙雷氏菌(serratiamarcescens),恶臭假单胞菌(pseudomonasputida),铜绿假单胞菌(pseudomonasaeruginosa),谷氨酸棒状杆菌(corynebacteriumglutamicum),黄色短杆菌(brevibacteriumflavum),乳糖发酵短杆菌(brevibacteriumlactofermentum),红串红球菌(rhodococcuserythropolis),嗜热栖热菌(thermusthermophilus),乳酸链球菌(streptococcuslactis),干酪乳杆菌(lactobacilluscasei),变铅青链霉菌(streptomyceslividans),酿酒酵母(saccharomycescerevisiae),贝酵母(saccharomycesbayanus),巴斯德毕赤酵母(pichiapastoris),乳酸克鲁维酵母(kluyveromyceslactis),产朊假丝酵母(candidautilis),光滑假丝酵母(candidaglabrata),粟酒裂殖酵母(schizosaccharomycespombe),汉氏德巴利酵母(debaryomyceshansenii),yarrowialypolitica),弯曲隐球菌(cryptococcuscurvatus),红发夫酵母(xanthophyllomycesdendrorhous),黑曲霉(aspergillusnigar),米曲霉(aspergillusoryzae),拉曼被孢霉(mortierellaramanniana),贝勒被孢霉(mortierellabainieri),高山被孢霉(mortierellaalpina),雅致小克银汉霉(cunninghamellaelegans),fusariumfujikuroi,schizochytriumlimacium,thraustochytriumaureum等。
作为前述微生物的优选例子,可列举:大肠杆菌,放线菌,棒状杆菌属细菌,芽孢杆菌属细菌,红球菌属细菌,酵母属酵母等微生物,作为最优选的微生物的例子,可列举大肠杆菌。
在本说明书中,前述微生物只要具有咪唑二肽合成活性即可,没有特别限定,例如:可以利用公知的方法(专利文献1,2)产生使前述的微生物表达前述源自枯草芽孢杆菌的具有l-氨基酸α-连接酶活性的突变型l-氨基酸α-连接酶的转化株,作为具有咪唑二肽合成活性的微生物使用。
简单来说,例如制作编码前述突变型l氨基酸α-连接酶的重组dna。例如,可通过以下获得:使用根据序列号12的多核苷酸序列设计的引物,使用将枯草芽孢杆菌168等编码ywfe蛋白质或其亲缘蛋白质的微生物的染色体dna作为模板的位点特异性突变法,而进行的位点特异性突变的导入。
向模板基因导入目标的突变,更具体而言,可以基本而言基于将序列号12的多核苷酸用作模板dna的pcr扩增,利用各种dna聚合酶的复制反应,使用本领域技术人员中众所周知的各种位点特异性突变导入法进行。位点特异性突变导入法,可以根据例如:pcr法,退火法等(村松等编,[改订第4版新基因工程学手册],羊土社,p.82-88)的任意方法进行。也可以根据需要使用quickchangeiisite-directedmutagenesiskit(stratagene公司,美国),quickchangemultisite-directedmutagenesiskit(agilenttechnologies公司,美国)等各种市售的用于导入位点特异性突变的试剂盒。
对包含ywfe基因的模板dna而言,可以从产生ywfe蛋白质的细菌利用常规方法提取基因组dna,或提取rna利用反转录合成cdna,由此而制备。对产生ywfe蛋白质的细菌而言,虽然除了包含枯草芽孢杆菌(bacillussubtilis)等芽孢杆菌属细菌,梭菌属(clostridium)细菌,热酸菌属(acidothermus)细菌的细菌以外,在植物、动物中也有报告,但优选为枯草芽孢杆菌(bacillussubtilis)等芽孢杆菌属细菌,本领域技术人员可容易地获取。
来自这些芽孢杆菌属细菌的基因组dna的制备,例如可以使用:pitcheretal.,lett.appl.microbiol.,1989,8:p.151-156中记载的方法等进行。包含ywfe基因的模板dna也可以利用将制备的cdna或从基因组dna切取的包含ywfe基因的dna片段插入任意载体中的形式制备。
向ywfe基因导入位点特异性突变,最通常可以使用包含应导入的核苷酸突变的突变引物进行。这样的突变引物只要设计为以下方式即可:与包含编码ywfe基因内的置换对象的氨基酸残基的核苷酸序列的区域退火,且代替编码其置换对象的氨基酸残基的核苷酸序列(密码子),而包含具有编码置换后的氨基酸残基的核苷酸序列(密码子)的碱基序列。
使用利用这些方法获得的重组dna,制作用于使下述的本发明的蛋白质利用宿主株表达的载体。用于制作重组dna的表达载体能够进行商业利用。可以通过获取,利用这些载体,制作本发明的核酸插入载体,用于下述的包含本核酸插入载体的宿主株,即转化株的制作。
作为载体,例如:在作为宿主株使用e.coli的情况下,可列举pcoldi(takarabio公司制),pcdf-1b,prsf-1b(均为novagen公司制),pmal-c2x(newenglandbiolabs公司制),pgex-4t-1(gehealthcarebioscience公司制),ptrchis(invitrogen公司制),pse280(invitrogen公司制),pgemex-1(promega公司制),pqe-30(qiagen公司制),pet-3(novagen公司制),pbluescriptiisk(+),pbluescriptiiks(-)(stratagene公司制),ptrs30[利用escherichiacolijm109/ptrs30(fermbp-5407)制备]等。
作为使用前述载体时的启动子,只有为在e.coli等宿主株中起作用的那些即可,可以是任意的,可以使用例如:trp启动子(ptrp),1ac启动子(plac),pl启动子,pr启动子,pse启动子等源自e.coli、噬菌体等的启动子。另外,在作为宿主株使用属于芽孢杆菌属的微生物情况下,也可以使用在枯草芽孢杆菌(bacillussubtilis)中起作用的spo1启动子,spo2启动子,penp启动子等。另外,也可以使用将2个ptrp串联的启动子,tac启动子,1act7启动子,leti启动子这样的人为设计修饰的启动子等。
在生成本发明的蛋白质的目标中利用载体的情况下,特别是表达载体是有用的。作为表达载体,只要是在试管内,大肠杆菌内,培养细胞内,生物个体内表达蛋白质的载体即可,没有特别限制,例如:如果在试管内表达优选pbest载体(promega公司制),如果在大肠杆菌优选pet载体(invitrogen公司制),如果在培养细胞优选pme18s-fl3载体(genbank登记号ab009864),如果在生物个体则优选pme18s载体(mol.cellbiol.8:466-472(1988))等。本发明的dna向载体的插入可通过常规方法,例如利用使用限制酶位点的连接酶反应进行(currentprotocolsinmolecularbiology,ausubeletal.编辑(1987)publish.johnwiley&sons.section11.4-11.11)。
前述核酸插入载体向宿主株的导入,可通过包括:磷酸钙转染,deae-葡聚糖介导的转染,聚凝胺介导的转染,原生质体融合,脂质体介导的转染(脂质转化),接合,天然的转化,电穿孔及本领域技术人员公知的其它方法的各种方法实施。另外,可通过获取可商业利用的转染试剂,通过利用这些实施前述表达载体向宿主株的导入[参考文献:currentprotocolsinmolecularbiology.3vols.ausubelf.m.etal.编辑,johnwiley&son,inc.,currentprotocols.]
咪唑二肽的制备可以例如,将表达突变型l-氨基酸α-连接酶的转化株作为具有l-氨基酸α-连接酶活性的微生物使用,将该转化株及前述式1~3示出的反应式的底物混合,即,前述底物在制备肌肽时为β-丙氨酸和l-组氨酸,在制备鹅肌肽时为β-丙氨酸和3-甲基-l-组氨酸,在制备鲸肌肽时为β-丙氨酸和1-甲基-l-组氨酸,并进一步与例如糖物质混合,通过该微生物代谢糖质而产生的atp作为atp供给系统利用,从而使用菌体反应法或发酵法等制备期望的咪唑二肽。
即,本发明的制备方法可以通过不包括atp的添加,或添加以摩尔数换算计少于制备的咪唑二肽量的atp量,由此制备肌肽,鹅肌肽,鲸肌肽等期望的咪唑二肽。
在本说明书中,[菌体反应法]是指用于利用微生物制备目标制备物的方法,是利用处于增殖休止或静止的状态的微生物的内部的酶活性的方法,不需要用于增殖或生长的培养基的原料。另外,在本说明书中,[发酵法]是指使用处于增殖或生长状态的微生物而制备目标制备物的方法。
作为前述atp供给系统中底物的例子,不限定于前述糖质,由前述微生物利用而产生atp即可,没有特别限定。具体而言,可列举碳水化合物及脂质。作为碳水化合物的例子,可列举糖质(糖类·单糖·二糖),三糖(低聚糖)及糖醇(丙三醇等)等。优选可列举葡萄糖及丙三醇。另外,作为脂质的例子,可列举棕榈酸,硬脂酸等脂肪酸。
下文进一步详细地记载利用本发明的制备方法,利用菌体反应法或发酵法制备咪唑二肽的实施方式的例子。
为了用本发明的制备方法制备期望的咪唑二肽,例如:使用前述具有咪唑二肽合成活性的微生物,将为作为本发明的蛋白质的底物的制备原料的氨基酸,在作为atp供给系统中的底物的糖质的共存下,在缓冲液中或不使用缓冲液而在调整适当ph的同时进行菌体反应,或在细胞培养用培养基中进行细胞培养而产生。通过从该反应后的不包含缓冲液,缓冲剂的反应液,或培养液中分离期望的二肽,可以制备这些二肽。作为用为原料的氨基酸,可列举从β-丙氨酸(β-ala)和l-组氨酸或l-组氨酸衍生物选择的一种氨基酸的组合,优选为β-ala和l-his,β-ala和3-甲基-l-组氨酸,β-ala和1-甲基-l-组氨酸的组合。
作为缓冲液,可列举例如:本领域技术人员常用的磷酸缓冲液,硼酸缓冲液,柠檬酸缓冲液,乙酸缓冲液及tris盐酸缓冲液等。另一方面,在本发明的制备方法中,通过适宜调整反应液或培养液的ph,可以不使用缓冲液而制备咪唑二肽。
作为细胞培养培养基中包含的成分,作为碳源,是本发明的具有咪唑二肽合成活性的微生物可同化的那些即可,可以使用葡萄糖,果糖,蔗糖,具有这些的糖蜜,淀粉或者淀粉水解物等碳水化合物,乙酸,丙酸等有机酸,乙醇,丙醇等醇类等。
作为氮源,可以使用:氨,氯化铵,硫酸铵,乙酸铵,磷酸铵等无机酸或者有机酸的铵盐,其它含氮化合物,以及蛋白胨,肉浸膏,酵母提取物,玉米浆(cornsteepliquor),酪蛋白水解物,大豆饼及大豆饼水解物,各种发酵菌体,及其消化物等。
作为无机盐,可以使用:磷酸二氢钾,磷酸氢二钾,磷酸镁,硫酸镁,氯化钠,硫酸铁,硫酸锰,硫酸铜,碳酸钙等。除此以外,可以在培养基中添加蛋白胨,肉浸膏,酵母提取物,玉米浆,酪蛋白氨基酸(casaminoacid),生物素等各种维生素等营养素。
培养通常在通气搅拌,振荡等有氧条件下进行。培养温度只要是本发明的具有咪唑二肽合成活性的微生物可生长的温度即可,没有特别限制,另外,对于培养途中的ph,只也要是本发明的具有咪唑二肽合成活性的微生物可生长的ph即可,没有特别的限制。培养中的ph调整可以添加酸或碱而进行。
下文对咪唑二肽为肌肽,鹅肌肽及鲸肌肽的情况下的制备方法的例子进行更具体的说明。
(1)肌肽的制备方法
肌肽通过以β-丙氨酸和l-组氨酸作为底物,将具有肌肽合成活性的微生物,典型地,表达具有序列号13~32中表示的氨基酸序列的突变型ywfe的微生物作为生物催化剂进行缩合反应,由此产生。因此,可以通过在包含β-丙氨酸及l-组氨酸和葡萄糖等糖质及硫酸镁的缓冲液中,与具有肌肽合成活性的微生物,典型地,表达具有在序列号13~32中表示的氨基酸序列的突变型ywfe的微生物共存,反应给定的时间后,分离、纯化产生的肌肽,由此制备期望的肌肽。或者,可以不使用缓冲液,通过适宜调整反应液或者培养液的ph的同时使其反应而制备肌肽。作为在反应液或者培养液中添加的糖质的例子,代表地为葡萄糖,作为葡萄糖的添加量为0.001~3mol/l的浓度,优选为0.005~2mol/l,更优选为0.01~1mol/l。
肌肽的生成反应在水性介质中,在ph5~11,优选为ph6~10,20~45℃,优选为25~40℃的条件下进行2~72小时,优选为6~36小时。
对在不包含缓冲液或者缓冲剂的反应液、培养液中生成、蓄积的肌肽的分离、纯化而言,可以采用本领域技术人员常用的使用活性炭、离子交换树脂等的方法,或者基于有机溶剂的萃取,形成结晶,薄层层析,高效液相层析等进行。
(2)鹅肌肽的制备方法
鹅肌肽为β-丙氨酸与3-甲基-l-组氨酸的肽键合的二肽。因此,在利用具有鹅肌肽合成活性的微生物,典型地,表达具有在序列号13~32中表示的氨基酸序列的突变型ywfe的微生物制备鹅肌肽的情况下,通过置换前述[(1)肌肽的制备方法]记载中为底物之一的l-组氨酸而使用3-甲基-l-组氨酸,除此以外,以与该[(1)肌肽的制备方法]相同的条件温育、分离、纯化合成的鹅肌肽,可制备、获得鹅肌肽。
(3)鲸肌肽的制备方法
鲸肌肽为β-丙氨酸和1-甲基-l-组氨酸的肽键合的二肽。因此,在利用具有鲸肌肽合成活性的微生物,典型地,表达具有在序列号13~32中表示的氨基酸序列的突变型ywfe的微生物制备鲸肌肽的情况下,通过置换前述[(1)肌肽的制备方法]的记载中为底物之一的l组氨酸而使用1-甲基-l-组氨酸,除此以外,以与该[(1)肌肽的制备方法]相同的条件实施,由此可制备、获得鲸肌肽。
(4)使用作为咪唑二肽分解酶的肽酶的缺陷株的制备方法
咪唑二肽被e.coli等微生物中包含的肽酶分解。为此,为了使用微生物以高产率制备咪唑二肽,也可以制作肽酶缺陷株,使用其进行制备。前述肽酶缺陷株的制作,可以利用可商业利用的染色体修饰系统。例如制作e.coli的肽酶缺陷株时,可以获取、利用quickandeasye.coligenedeletionkit(迅速简单的大肠杆菌基因缺失试剂盒)等可商业利用的e.coli染色体的修饰用试剂盒。可以使用例如对宿主赋予肽酶缺陷性的株,例如:对大肠杆菌株赋予肽酶pepd缺陷性的株。
利用前述的制备方法制备的肌肽,鹅肌肽及鲸肌肽等咪唑二肽,可以通过例如与医药品添加物和/或食品添加剂进行混合,利用周知常用的方法制备片剂,胶囊剂,液剂等,利用于基于抗疲劳效果,去除活性氧的能力,降血压作用,抗炎作用及降低尿酸值作用而用于疾病的预防或治疗的医药品、功能性食品·营养补充剂食品等。
2.由肌肽制备鹅肌肽的方法
本发明的另一个实施方式为由肌肽制备鹅肌肽的方法。
即,利用前述微生物制备的咪唑二肽为肌肽,通过包括对于利用前述微生物制备的肌肽或者对于从鸡肉等肌肉提取得到的肌肽,进一步与具有肌肽n-甲基转移酶活性的酶进行反应的工序,由此制备作为咪唑二肽的一种的鹅肌肽的制备方法。
更具体而言,可以通过使用表达具有肌肽n-甲基转移酶活性的酶的微生物而由肌肽制备鹅肌肽。
另外,本发明的实施方式通过使用共表达作为前述l-氨基酸α-连接酶的具有肌肽合成活性的酶,和具有肌肽n-甲基转移酶活性的酶的微生物,由此实现制备鹅肌肽。
在本说明书中,肌肽n-甲基转移酶活性是指将s-腺苷甲硫氨酸(s-adenosylmethionine,sam)作为甲基提供体,使肌肽的组氨酸残基转变为3-甲基组氨酸残基,产生鹅肌肽(anserine:β-丙氨酰-3-甲基-l-组氨酸)的酶活性。
本实施方式使用的具有前述肌肽n-甲基转移酶活性的酶可以通过本领域技术人员众所周知·常用的pcr法等进行克隆而获取。
作为本实施方式使用的具有前述肌肽n-甲基转移酶活性的酶的具体例子,可以使用源自酿酒酵母(saccharomycescerevisiae)的具有肌肽n-甲基转移活性的肽(ynl092w:序列号36)。
作为前述肽的更优选例子,可以为下述肽:
(i)具有序列号36的氨基酸序列的肽,
(ii)与序列号36的氨基酸序列具有80%以上,优选为85%以上,更优选为90%以上,最优选为95%以上的同一性,且具有肌肽n-甲基转移酶活性的肽,
(iii)包括序列号36的氨基酸序列中1或多个氨基酸残基的缺失,置换,插入,和/或添加的氨基酸序列,且具有肌肽n-甲基转移酶活性的肽。
在本实施方式中,前述制备方法可以使用选自菌体反应法或发酵法中任一个的方法,优选为发酵法。
菌体反应法及发酵法可以依照与前述[咪唑肽的制备方法]中记载同样的方法实施。
在菌体反应法及发酵法中,作为甲基的提供体的前述sam可通过在生物体内利用甲硫氨酸腺苷转移酶(amt)由atp和l-met合成。可以由在菌体内或微生物内利用代谢产生的源自d-葡萄糖的atp和l-met生成sam。为此,可以通过使用菌体反应法或发酵法,不添加sam而由肌肽制备鹅肌肽。即,在菌体反应法或发酵法中,可以通过向具有肌肽n-甲基转移酶活性的微生物添加肌肽、d-葡萄糖及l-甲硫氨酸,而不添加sam、atp而制备鹅肌肽。
作为本实施方式所使用的微生物,可以使用前述咪唑二肽的制备方法中记载的微生物,优选为大肠杆菌。作为物质生产系统,以大肠杆菌为宿主的方法是通常的,通过用大肠杆菌表达源自真核生物的酶基因,由此可提供实现更高表达,以与在大肠杆菌内集约的其它相关酶的协作而有效地制备目标的有用物质的方法。
另外,本发明人等发现的源自原核微生物的氨基酸连接酶ywfe的修饰体的高表达,可通过利用大肠杆菌而不是酵母为宿主而实现(专利文献2)。为此,在使用前述的肌肽合成酶和肌肽n-甲基转移酶的共表达系统的情况下,可以将大肠杆菌作为宿主使用。
以本实施方式制备的鹅肌肽,由于鹅肌肽具有抗疲劳效果、尿酸值降低作用,可以作为用于增进健康的食品、医药品使用。
本说明书中提及的全部文献以其全部通过引用并入本说明书。这里记载的实施例仅为例示本发明的实施方式用,不应解释为限定本发明的范围。
[实施例1]
在以下实施例中,多核苷酸(dna、mrna)的制备,pcr,碱基序列确定,转化,hplc分析等,可以使用本领域技术人员周知常用的方法进行。请参考例如sambrook,j.及russell,d.w.,molecularcloning,alaboratorymanual3rdedition,coldspringharborlaboratorypress(2012)等。
对ywfe的位点特异性突变的导入
以组装了ywfe基因(序列号1)的pet载体作为模板,依照制造者的指示使用quickchangesite-directedmutagenesis(strategene,美国)导入了目标突变。pcr反应利用表1(组成)及表2(pcr循环)所示的反应条件实施。在pcr反应中,使用了kod-plusneodna聚合酶(东洋纺织株式会社,大阪)。使用引物(序列号2~5),得到了导入了n108e或i112v的位点特异性突变的载体。需要说明的是,对于n108e的载体表示为编码ywfe蛋白质的第108位天冬酰胺(n)残基置换为谷氨酸(e)残基的ywfe蛋白质的多核苷酸(序列号6),对于i112v的载体表示为编码ywfe蛋白质的第112位异亮氨酸(i)残基置换为缬氨酸(v)残基的ywfe蛋白质的多核苷酸(序列号7)。
[表1]
[表2]
pcr反应(热变性/退火、延伸)的循环数:40循环
pcr反应后,对得到的pcr产物,利用dna测序仪(appliedbiosystems,lifetechnologies,japan株式会社,东京)进行分析,确认了导入了位点特异性突变。
从大肠杆菌提取的载体被dam甲基化酶使dpni位点甲基化,另一方面,pcr产物的dpni位点未被甲基化,因此,通过利用这点,可区别模板载体与pcr产物。简而言之,为了除去pcr后的反应液中包含的模板载体,将纯化的pcr产物于37℃利用dpni处理2小时。限制酶反应以表3所示的反应条件实施。
[表3]
利用dpni的消化之后,将采用苯酚·氯仿处理及乙醇沉淀而纯化的位点特异性突变导入载体,溶解于te缓冲液(tris-edtabuffer)ph8.0。
基于位点特异性突变导入载体的大肠杆菌宿主的转化
将大肠杆菌bl21(de3)的感受态细胞和位点特异性突变导入载体一起于42℃进行了热处理。之后加入soc(superoptimalbrothwithcataboliterepression)培养基进行培养,接种至含有卡那霉素50μg/ml的lb琼脂培养基,于37℃过夜培养。在此,将形成菌落的重组大肠杆菌作为位点特异性突变导入型ywfe表达转化株。
从生长的菌落中选择1个菌落,在含有卡那霉素的lb培养基3ml中悬浮,于37℃培养了5小时。培养之后,采用碱sds法从转化株提取了位点特异性突变导入载体。将提取的位点特异性突变导入载体采用苯酚·氯仿处理和乙醇沉淀进行纯化,溶解于te缓冲液(ph8.0)中。
基于位点特异性突变导入载体的大肠杆菌pepd缺陷株的转化
使用经纯化的位点特异性突变导入载体,采用热休克法进行了大肠杆菌pepd缺陷株的转化。将大肠杆菌pepd缺陷株的感受态细胞和位点特异性突变导入载体一起于42℃进行了热处理。之后,加入soc培养基培养,接种于含有卡那霉素50μg/ml的lb琼脂培养基中,于37℃过夜培养。在此,将形成菌落的重组大肠杆菌pepd缺陷株作为位点特异性突变导入型ywfe表达pepd缺陷转化株。
双重突变型酶表达转化株
在大肠杆菌bl21(de3)及pepd缺陷株中,制作了将n108e或i112v的突变与h378k的突变进行组合的双重突变型酶n108e/h378k(序列号8)及i112v/h378k(序列号9)表达大肠杆菌,对肌肽合成活性进行了评价。
简而言之,与前述位点特异性突变导入同样,以具有n108e或i112v的位点特异性突变的载体为模板,使用h378k的引物(序列号10及11)进一步导入了位点特异性突变(h378k),得到了具有双重位点特异性突变的载体。之后,与前述同样,得到了经纯化的导入了双重突变型ywfe(序列号23及28)的该表达转化株。
肌肽合成活性的评价
hplc分析
肌肽的标准品使用了市售的肌肽(sigma-aldrich,美国)。对于肽的合成量,实施了使用了nα-(5-氟-2,4-二硝基苯基)-l-丙氨酸酰胺(fdaa)衍生物化法的hplc分析,利用标准曲线法进行定量。该hplc分析以表4(洗脱液组成)及表5(梯度程序)所示的条件,依照通用的方法实施。
<分析条件>
使用仪器:hitachil-7000系列(株式会社日立制作所,东京)
使用的柱:wh-c18a(4×150mm)(株式会社日立hightechnologies,东京)
样品注入量:10μl
流速:0.5ml/分钟
柱温:40℃
uv检测波长:340nm
[表4]
hplc分析中洗脱液的组成
[表5]
hplc中洗脱液的梯度的条件
对肌肽分解中的肽酶的影响的评价
使用大肠杆菌bl21(de3)(野生型)及pepd缺陷株(δpepd),对肽酶pepd相对于肌肽分解的影响进行了评价。制备使得肌肽的初期浓度为5.0mm,湿菌体量为10mg/ml,于30℃进行了20小时反应。
结果显示,肌肽残存率在使用大肠杆菌bl21(de3)时为84.1%,使用了缺陷株时为91.3%(图1)。
因此,可知在pepd缺陷株中,基于pepd的肌肽的分解被抑制。
将基于菌体反应法的肌肽合成
以大肠杆菌bl21(de3)(野生型)作为宿主的双重突变型ywfe(n108e/h378k)表达转化株的肌肽合成反应,利用表6所示的组成的反应液,在温度30℃,ph7.0~8.0的条件实施了20小时。反应结束后,为了评价双重突变型ywfe(n108e/h378k)表达转化株的肌肽合成活性,利用与前述同样的方法,采用hplc进行了分析。
[表6]
结果
结果显示,对肌肽合成活性而言,在葡萄糖非添加组(g-)中,合成的肌肽浓度为1.9mm,相对于此,在葡萄糖添加组(g+)中,合成的肌肽浓度增大为9.4mm(图2)。
因此,可知通过不添加底物atp而添加葡萄糖,由此可有效地合成肌肽。
对菌体反应法中ph控制的影响的评价
在前述菌体反应法中,如表7所示,将由hepes缓冲液变为水溶液,添加葡萄糖,反应开始时,使调整为ph8.0的反应液量为100ml,也不对反应ph进行控制的情况,与利用naoh将ph的下限值控制为ph7.7的情况相比,与前述菌体反应法同样地进行了反应。
[表7]
结果
肌肽合成在不对ph进行控制的情况下,在反应20小时,反应液降低至ph6.6,合成的肌肽浓度为8.8mm,与此相对,在将ph的下限值控制为ph7.7的情况下,合成的肌肽的浓度为12.5mm。
因此,可知在不添加底物atp而添加葡萄糖时,即使不使用缓冲液而变更为水溶液,通过进行ph控制,由此也可有效地合成肌肽。
[实施例2]
基于菌体反应法的鹅肌肽合成
将大肠杆菌bl21(de3)(野生型)及该大肠杆菌的pepd缺陷株(apepd)作为宿主而表达双重突变型ywfe(i112v/h378k)的转化株的鹅肌肽合成,利用表7所示组成的反应液,在温度30℃,ph7.0~8.0的条件实施了20小时。反应结束后,通过与实施例1同样地利用hplc定量了鹅肌肽浓度,对鹅肌肽合成活性进行了评价。需要说明的是,鹅肌肽的标准品使用了市售的鹅肌肽(和光纯药工业株式会社,大阪),以湿菌体量为10mg/ml进行制备。
[表8]
结果
和葡萄糖非添加组(g-)相比,在葡萄糖添加组(g+)的大肠杆菌bl21(de3)及以该大肠杆菌的pepd缺陷株作为宿主的表达双重突变型ywfe(i112v/h378k)的转化株中,鹅肌肽浓度分别从1.0mm向3.7mm,从1.2mm向7.7mm而鹅肌肽合成活性增大了(图3)。
因此,可知在不添加底物atp而添加葡萄糖时,可有效地合成鹅肌肽。另外,可知在以pepd缺陷株作为宿主而表达双重突变型ywfe(i112v/h378k)的转化株中,鹅肌肽的分解被抑制,并且由于葡萄糖的添加,鹅肌肽合成活性增大了。
由这些结果启示,对于鲸肌肽也可利用基于具有鲸肌肽合成活性的微生物的菌体反应法或者发酵法的生成反应,不添加底物atp,而通过与源自葡萄糖的atp生产共轭反应,由此有效地合成。
[实施例3]
肌肽n-甲基转移酶的克隆
以从酿酒酵母(saccharomycescerevisiae)(x33)提取的基因组dna作为模板,利用pcr法克隆了肌肽n-甲基转移酶(ynl092w)(序列号35)。pcr反应利用表9(组成)及表10(pcr循环)所示的反应条件实施。在pcr反应中,使用了kodonetmpcrmastermix(东洋纺织株式会社,大阪)及引物(序列号33~34)(表11)。
[表9]
[表10]
[表11]
对pcr扩增产物进行琼脂糖电泳,切取与目标产物为相同大小的条带,进行了纯化。将得到的pcr扩增产物插入pet21a(+)载体中。此时,设计为表达的肌肽n-甲基转移酶(ynl092w)(序列号36)的c末端侧加上his标签。
pcr反应之后,对得到的pcr产物利用dna测序仪(appliedbiosystems,lifetechnologiesjapan株式会社,东京)进行分析,确认了得到了目标的肌肽n-甲基转移酶(ynl092w)表达载体。
基于表达载体的大肠杆菌宿主的转化
将大肠杆菌bl21(de3)的感受态细胞与肌肽n-甲基转移酶(ynl092w)表达载体一起于42℃进行了热处理。之后,将培养液中的200μl涂布于含有氨苄青霉素100μg/ml的lb琼脂培养基,过夜培养。之后,将琼脂培养基上生出的菌落(转化体)接种于含有氨苄青霉素100μg/ml的lb培养基3ml中,于37℃中培养5小时。
转化体中的肌肽n-甲基转移酶(ynl092w)的表达诱导
将在前述培养中得到的培养液2ml接种于含有氨苄青霉素100μg/ml的lb培养基200ml中,在od600的值达到0.5的时刻添加iptg(异丙基-β-硫代半乳糖:终浓度100μm),进行了肌肽n-甲基转移酶(ynl092w)的表达诱导。
收菌·洗菌
培养之后,将培养液离心(5,000×g,10分钟,4℃)而收集细菌之后,利用生理盐水洗涤沉淀,进行洗菌。
菌体破碎
洗菌之后,使用bugbusterht蛋白质提取试剂(novagen公司制)进行了菌体破碎,得到了菌体破碎液。之后,将该菌体破碎液离心分离(7,000×g,30分钟,4℃),得到了无细胞提取液。
酶纯化
将得到的无细胞提取液利用gehealthcare公司制的ni亲和柱hisgravitrap及pd-10柱进行纯化,得到了纯化酶溶液。纯化时,使用了binging缓冲液(tris50mm,nacl500mm,咪唑10mm于milliq水中于ph8.0)及洗脱缓冲液(tris50mm,nacl500mm,咪唑500mm于milliq水中于ph8.0)。
酶反应(鹅肌肽合成)
使用得到的纯化酶溶液,制备表12(组成)及表13(组成)所示的反应液,在温度37℃,ph7.0~8.0的条件进行了4小时或20小时酶反应。
[表12]
[表13]
基于酶反应法的鹅肌肽合成评价
反应结束后,通过与实施例1及2同样地利用hplc定量了鹅肌肽浓度,对鹅肌肽合成活性进行了评价。需要说明的是,鹅肌肽的标准品使用了市售的鹅肌肽(和光纯药工业株式会社,大阪),以湿菌体量为10mm进行制备。
基于菌体反应法的鹅肌肽合成
通过与前述转化相同的操作,得到了以大肠杆菌bl21(de3)(野生型)作为宿主的肌肽n-甲基转移酶(ynl092w)表达转化株。对于该表达转化株的鹅肌肽合成,制备表14及表15所示的组成的反应液,以在温度30℃,ph7.0~8.0的条件实施了20小时。反应结束后,为了评价该表达转化株的鹅肌肽合成活性,利用前述同样的方法,采用hplc进行了分析。
[表14]
[表15]
结果
酶反应法中的鹅肌肽合成量,在反应4小时为0.085mm,反应20小时为0.14mm。因此,确认了肌肽n甲基转移酶(ynl092w)具有鹅肌肽合成活性。
另外,图4为示出使用了肌肽n-甲基转移酶(ynl092w)表达转化株的菌体反应法中的鹅肌肽合成评价的hplc层析图。图4中,在6个层析图中,下方3个为添加了mgso4的反应液,上方3个为不添加mgso4的反应液的层析图。在任一反应液中(尽管仅少量)与鹅肌肽在相同保留时间(4.97分钟)确认到峰,鹅肌肽合成量为0.042mm,产率为0.85%。因此,可知在使用了肌肽n-甲基转移酶(ynl092w)表达转化株的菌体反应法中,可由肌肽合成鹅肌肽。
工业实用性
使用本发明的制备方法,通过与来自葡萄糖的atp供给共轭反应,由此不需要实际生产中造成成本高的底物atp的添加,可以有效地以低成本生产咪唑二肽,特别是肌肽、鹅肌肽和/或鲸肌肽。这些咪唑二肽可以用作基于抗疲劳效果,去除活性氧的能力,降血压作用,抗炎作用及降低尿酸值作用等而用于疾病的预防或治疗的医药品和/或功能性食品·营养补充剂食品等。
- 还没有人留言评论。精彩留言会获得点赞!