双甲基氘代鼠尾草酚及其制备方法、以及在制备治疗恶病质的药物中的应用
本发明涉及药物合成领域,具体涉及一种式(1)双甲基氘代鼠尾草酚及其制备方法和应用。
背景技术:
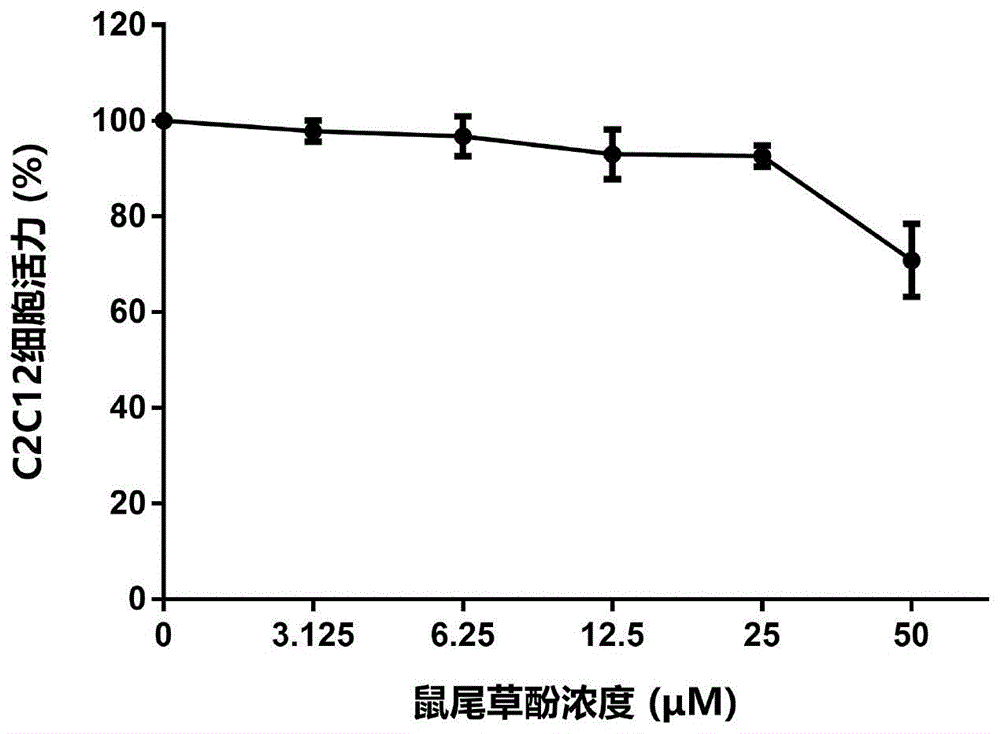
:恶病质是一种进行性消耗综合征,伴随消瘦、贫血、精神衰颓等全身机能衰竭的现象,多由癌症和其他严重慢性病(如慢性肺阻、慢性心力衰竭、艾滋病等)引起,其中由肿瘤引起的恶病质被称之为肿瘤恶病质。肿瘤恶病质(cancercachexia)是各种恶性肿瘤患者的主要并发症,是导致众多肿瘤患者死亡的主要原因。肿瘤恶病质的防治已成为恶性肿瘤多学科综合治疗的重要组成部分,正受到越来越多的关注。肿瘤恶病质是由肿瘤细胞产物及机体释放的细胞因子共同引起的以全身代谢紊乱、进行性肌肉及脂肪消耗、体重下降、全身脏器进行性衰竭为特征的一种消耗综合征,最主要的特征是骨骼肌萎缩所带来的病人体重的明显下降。在晚期肿瘤患者中,肿瘤恶病质的发生率高达50%-80%,其中乳腺癌和白血病患者发生率为40%,肺癌、结肠癌和前列腺癌患者发生率为50%,而胃癌和胰腺癌患者发生率高达80%,约20%的肿瘤患者直接死于由恶病质引起的心肺功能衰竭,故肿瘤恶病质是导致众多肿瘤患者死亡的主要原因。肿瘤恶病质的发生不仅削弱了化疗、放疗的效果,缩短生存期,同时也会严重影响患者的生存质量。2011年,lancetoncol杂志上发表了8国专家对于癌症恶病质诊断和分期标准的联合共识,该共识确定了肿瘤恶病质的筛查诊断标准:体重下降5%或体重指数bmi<20kg/m2或已经出现骨骼肌量减少者体重下降2%。细分为以下三个阶段,肿瘤恶病质前期:指体重下降<5%,伴有厌食症、代谢改变者;恶病质期:指6个月内体重下降>5%或bmi<20kg/m2者出现体重下降>2%,或四肢骨骼肌指数与肌少症症相符(男性<7.26kg/m2,女性<5.45kg/m2)者出现体重下降>2%;难治性恶病质期:晚期癌症患者分解代谢出现活跃,对抗癌治疗无反应,who体能状态评分低(3或4分),生存期不足3个月者。肿瘤恶病质的发病机制:肿瘤恶病质临床上多表现为患者体重下降、食欲不振、贫血虚弱等,是一种全身性多器官代谢紊乱综合征,肿瘤恶病质导致的骨骼肌和脂肪组织损耗是患者体重下降的主要原因。目前肿瘤恶病质正成为临床肿瘤患者死亡的主要原因,在肿瘤治疗中针对肿瘤恶病质的防治的重要性日益凸显。肿瘤恶病质的发生机制主要涉及系统炎症、骨骼肌消耗和萎缩、脂肪的消耗和降解以及能量代谢紊乱。系统炎症:肿瘤发生发展过程中会诱导免疫细胞产生多种炎症因子,如tnf-α、il-6、il-1、lmf、zag和pif等,另外肠道菌群异位失调、脂多糖和细菌毒素释放也会激活免疫细胞释放炎症因子。炎症因子激活相应的信号通路调控骨骼肌和脂肪组织的合成与分解,如骨骼肌中isulin/igf1-pi3k-akt通路可调控肌肉蛋白合成,nf-κb通路则与肌肉蛋白降解有关;脂肪组织中nf-κb通路影响hsl磷酸化以及atgl蛋白活性,调控着脂肪降解的过程。骨骼肌对体重的支持占很大的比重,骨骼肌的健康与否取决于骨骼肌蛋白质合成和降解是否处于动态平衡,骨骼肌蛋白质降解活跃被认为是体重减轻和疲劳虚弱等恶病质的重要因素。研究显示,在机体免疫系统与肿瘤细胞自身以及系统炎症诱导产生的细胞因子和炎症因子的共同作用下,骨骼肌蛋白质消耗产生并且加剧,具体表现为骨骼肌蛋白质合成减少、降解水平升高、肌肉细胞凋亡加剧以及再生减弱。炎症因子tnfα和il-1等可通过nf-κb信号通路激活foxo转录因子,上调e3泛素连接酶murf-1表达水平,促进肌原蛋白质的泛素化降解,也可激活肌细胞p38/mapk信号通路,诱导caspase活化,促进骨骼肌细胞凋亡;细胞因子myostatin和activin与受体actriia/b结合激活smad2,后者通过抑制akt/mtor信号通路减少肌肉蛋白合成、激活foxo转录因子增加肌肉蛋白降解、还可激活p38/mapk信号通路导致肌细胞凋亡。肿瘤恶病质是一种严重的全身性消耗性综合征,而脂肪是机体最重要的储能组织,因此在肿瘤恶病质发生发展过程中,脂肪组织往往先于骨骼肌发生消耗,其中白色脂肪组织的合成减少脂解增多、白色脂肪褐化增多以及棕色脂肪转变为白色脂肪减少是脂肪组织消耗降解的主要原因。脂蛋白酯酶(lpl)也诱导内源性和外源性甘油三酯的水解,其活性下降减缓了对脂肪酸的摄取,影响脂肪合成过程;激素敏感性酯酶(hsl)和甘油三酯酶(atgl)主要调控白色脂肪组织的降解,在炎症因子的诱导下,两者的表达均促进甘油三酯的水解;另外tnfα和il-1等炎症因子还通过增加线粒体内ucp1的表达促进白色脂肪组织褐化,加剧脂肪组织消耗。能量代谢紊乱:由于肿瘤生长需要与宿主竞争大量营养,对宿主机体而言表现出能量摄入和消耗失衡,机体能量消耗增加且不能通过单纯的营养支持手段逆转,对营养支持表现为部分敏感甚至不敏感。肿瘤组织大量消耗葡萄糖和谷氨酰胺,并产出大量乳酸,乳酸又通过糖异生消耗能量再生为葡萄糖,大量增加的无效乳酸循环造成能量低效利用;脂肪代谢异常,分解代谢增加但有效利用度低;肌肉关键蛋白的分解也恶化了骨骼肌蛋白的供需平衡。肿瘤恶病质发病机制十分复杂,缺乏有效的治疗手段,目前仅有甲地孕酮一种被美国药品监督管理局批准用于改善肿瘤恶病质患者的食欲。刺激食欲结合加强患者营养摄入的姑息治疗在临床上对肿瘤恶病质患者有一定的症状改善作用,但是还是难以达到非常有效的治疗目的。临床试验中也尝试了多种针对炎症细胞因子的抗体,包括il-1α、il-6、tnf-α、myostatin等的特异抗体,但是结果发现抑制其中一种因子不能完全阻止恶病质的发展。infliximab(tnfα的单克隆抗体)和clazakizumab(il-6的单克隆抗体),分别被应用于胰腺肿瘤恶病质与非小细胞肺癌肿瘤恶病质的临床治疗研究,对患者的体重减少、骨骼肌萎缩及生活质量并没有明显改善。此外,胃饥饿素受体激动剂、选择性雄性激素受体(ar)激动剂、肾上腺素β受体阻滞剂和anti-myostatin多肽等都是研究的热点。近期原本最有希望的处于临床研究阶段的新药是anamorelin(阿拉莫林,一种胃饥饿素受体激动剂)和enobosarm(一种选择性ar激动剂),但是目前该2种药物的iii期临床研究均以失败告终。总之,由于肿瘤恶病质是各种恶性肿瘤患者的主要并发症,不仅削弱了化疗、放疗的效果,缩短生存期,同时也会严重影响患者的生存质量。虽然肿瘤恶病质治疗的重要性和必要性已经获得了共识,但是由于其发病机制繁多复杂,目前的研究尚只是冰山一角,肿瘤恶病质的治疗方法和新药的研发尚无突破性的进展,临床治疗成效有限,目前尚没有任何一个药物被批准作为特异性针对肿瘤恶病质的药物上市应用,所以针对肿瘤恶病质的研究以及新药研发亟待深入。技术实现要素:针对现有治疗技术手段中的不足,本发明提出了中药单体成分及其衍生物在抗肿瘤恶病质相关领域的作用,涉及双甲基氘代鼠尾草酚类化合物及其制备方法和医药上新应用,提供鼠尾草酚类化合物的抗肿瘤恶病质新用途。本发明提出了鼠尾草酚类化合物在抗恶病质包括肿瘤恶病质方面的应用,尤其是治疗恶病质引起的肌肉萎缩和脂肪降解方面的应用。在具体实施方案中本发明提供了鼠尾草酚类化合物在细胞恶病质模型及动物恶病质模型中的作用。本发明提出了式(x)鼠尾草酚类化合物在制备治疗恶病质疾病的药物中的应用。其中,式(x)的结构如下:所述式(x)中,r1=h、ch3、甲基氘代;r2=h、ch3、甲基氘代。优选地,式(x)中,r1=h、ch3、r1=h、ch3,其结构式如下所示:其中,鼠尾草酚(结构式中r1=r2=h)单体化合物已有商业化的供应,来源于植物提取分离纯化的单体化合物,或者半合成或者全合成的单体化合物。其中,鼠尾草酚酚羟基甲基化制得双甲基鼠尾草酚(结构式中r1=r2=ch3)即式2所示的双甲基鼠尾草酚(化合物2)如以下:本发明还提出了一种全新结构的式(1)双甲基氘代鼠尾草酚(化合物1)的结构式如下:本发明还提出了全新结构的式(1)双甲基氘代鼠尾草酚(化合物1)在制备治疗恶病质的药物中的应用,其具有良好抗恶病质作用。本发明还提出了所述式(1)双甲基氘代鼠尾草酚(化合物1)的制备方法,以鼠尾草酚、氘代碘甲烷为原料,以碳酸钾为催化剂,以丙酮为溶剂,经一步反应,制备得到式(1)所述双甲基氘代鼠尾草酚(化合物1)。制备方法的反应过程及反应式如以下:本发明式(1)双甲基氘代鼠尾草酚(化合物1)可用于制备抗恶病质药物。其中,所述恶病质包括但不限于由肿瘤、慢性肾病、慢性肺阻塞、慢性心力衰竭、艾滋病诱发的进行性消耗综合征等。所述药物是用于人类和/或动物的药物。本发明还提出一种治疗恶病质疾病的药物组合物,所述组合物含有所述式(1)双甲基氘代鼠尾草酚,和/或与其他药学上可接受的成分。所述药物组合物的产品剂型包括但不限于胶囊剂、片剂、口服制剂、微囊制剂、注射剂、软膏剂、喷雾剂或栓剂等。所述药物组合物的产品给药方式包括但不限于注射、口服、胃肠外、吸入式喷雾或透皮给药等。所述式(1)所示双甲基氘代鼠尾草酚占所述组合物总干重0.001-100wt.-%。本发明应用中,所述恶病质疾病包括肿瘤恶病质;所述肿瘤为实体肿瘤。所述肿瘤恶病质包括但不限于肿瘤组织导致的肌肉萎缩,肿瘤组织导致的脂肪减少,肿瘤组织导致的食欲降低,肿瘤组织导致的炎症反应,以及消化道相关癌症、肝癌和肺癌、结肠癌导致的肿瘤恶病质等。本发明还提出了一种治疗恶病质疾病的方法,所述式(1)所示双甲基氘代鼠尾草酚的用量为0.01μg-100mg/千克体重/天。本发明还提出了式(2)双甲基鼠尾草酚(化合物2)的制备方法,以鼠尾草酚、碘甲烷为原料,以碳酸钾为催化剂,以丙酮为溶剂,经一步反应,制备得到式(2)所述双甲基鼠尾草酚(化合物2),如以下反应式所示;本发明还提出了式(2)所示的双甲基鼠尾草酚在制备治疗恶病质疾病的药物中的应用。所述恶病质包括但不限于由肿瘤、慢性肾病、慢性肺阻塞、慢性心力衰竭、艾滋病诱发的进行性消耗综合征等。所述药物是用于人类和/或动物的药物。本发明还提出了一种治疗恶病质疾病的药物组合物,所述组合物含有所述式(2)双甲基鼠尾草酚,和/或与其他药学上可接受的成分。所述药物组合物的产品剂型包括但不限于胶囊剂、片剂、口服制剂、微囊制剂、注射剂、软膏剂、喷雾剂或栓剂等。所述药物组合物的产品给药方式包括但不限于注射、口服、胃肠外、吸入式喷雾或透皮给药等。所述式(2)所示双甲基鼠尾草酚占所述组合物总干重0.001-100wt.-%。本发明中,所述恶病质疾病包括肿瘤恶病质;所述肿瘤为实体肿瘤。所述肿瘤恶病质包括肿瘤组织导致的肌肉萎缩,肿瘤组织导致的脂肪减少,肿瘤组织导致的食欲降低,肿瘤组织导致的炎症反应,以及消化道相关癌症、肝癌和肺癌、结肠癌导致的肿瘤恶病质。本发明还提出了治疗恶病质疾病的方法,所述式(2)双甲基鼠尾草酚的用量为0.01μg-100mg/千克体重/天。本发明中所用术语“鼠尾草酚类化合物”、“双甲基氘代鼠尾草酚”、“双甲基鼠尾草酚”指的是单一成分或与其他药学上可接受的成分构成组合物以联合作用。本发明中所用术语“其他药学上可接受的成分”指的是与“鼠尾草酚”、双甲基氘代鼠尾草酚(化合物1)、“双甲基鼠尾草酚(化合物2)”没有拮抗作用的药物,也可以是药学上允许的任一一种或多种辅料。本发明中所用术语“恶病质”指的是实体肿瘤诱发的恶病质。本发明中所用术语“实体肿瘤”指的是为原发性或继发性实体肿瘤如消化道相关癌症、肝癌和肺癌。本发明所述的肌肉萎缩为肿瘤恶病质诱发的肌肉萎缩。本发明所述的脂肪降解为肿瘤恶病质引发的脂肪降解。本发明所述式(x)鼠尾草酚类化合物、式(1)双甲基氘代鼠尾草酚(化合物1)、双甲基鼠尾草酚(化合物2)或其与其他药学上可接受的成分构成组合物的给药方式为注射、口服、胃肠外、吸入式喷雾或透皮给药。本发明看,式(x)鼠尾草酚类化合物、式(1)双甲基氘代鼠尾草酚(化合物1)、和/或双甲基鼠尾草酚(化合物2)在制备治疗恶病质疾病的药物中的应用,所述药物可用于人和/或动物。其中,所述式(x)鼠尾草酚类化合物、式(1)双甲基氘代鼠尾草酚(化合物1)、和/或双甲基鼠尾草酚(化合物2)的用量为0.01μg-100mg/千克体重/天。其中,所述药物包括治疗或抑制肌肉萎缩的药物或抑制剂、抑制或缓解脂肪细胞脂解的药物或抑制剂、抑制或缓解体重丢失或减少的药物或抑制剂。本发明还提出一种治疗恶病质疾病的药物组合物,所述组合物含有式(x)所示鼠尾草酚类化合物,和/或还含有其他药学上可接受的成分;其中,所述式(x)中,r1=h、ch3、甲基氘代;r2=h、ch3、甲基氘代。其中,所述组合物的产品剂型包括不限于胶囊剂、片剂、口服制剂、微囊制剂、注射剂、软膏剂、喷雾剂或栓剂等。其中,所述组合物的给药方式包括但不限于注射、口服、胃肠外、吸入式喷雾或透皮给药等。其中,所述式(x)所示鼠尾草酚类化合物占所述组合物总干重0.001-100wt.-%。本发明应用中,所述恶病质疾病包括肿瘤恶病质;所述肿瘤为实体肿瘤。其中,所述肿瘤恶病质包括但不限于肿瘤组织导致的肌肉萎缩,肿瘤组织导致的脂肪减少,肿瘤组织导致的食欲降低,肿瘤组织导致的炎症反应,以及消化道相关癌症、肝癌和肺癌、结肠癌导致的肿瘤恶病质等。本发明还提出了一种治疗恶病质疾病的方法,所述式(x)所示鼠尾草酚类化合物、式(1)双甲基氘代鼠尾草酚(化合物1)、和/或式(2)双甲基鼠尾草酚(化合物2)的用量为0.01μg-100mg/千克体重/天。所述给药方式包括但不限于注射、口服、胃肠外、吸入式喷雾或透皮给药等。本发明还提出了包含治疗有效量的所述式(x)所示鼠尾草酚类化合物、式(1)双甲基氘代鼠尾草酚(化合物1)、和/或式(2)双甲基鼠尾草酚(化合物2)及其药用盐的药物组合物。本发明还提出了所述组合物产品还包括蛋白质源、脂肪源和/或糖类源,还可以选自营养均衡的食物、全营养配方、乳制品、冷冻货常温稳定的饮料、汤、营养棒、甜食、宠物食物、药物组合物及其组合的形式等。所述产品含有式(x)所示鼠尾草酚类化合物、式(1)双甲基氘代鼠尾草酚(化合物1)、和/或式(2)双甲基鼠尾草酚(化合物2)。本发明还提出了所述式(x)所示鼠尾草酚类化合物、式(1)双甲基氘代鼠尾草酚(化合物1)、和/或式(2)双甲基鼠尾草酚(化合物2)包括不限于用于人类和/或宠物的药物、用于人类和/或宠物的食品、营养补充剂和/或保健品。本发明还提出了所述式(x)所示鼠尾草酚类化合物、式(1)双甲基氘代鼠尾草酚(化合物1)、和/或式(2)双甲基鼠尾草酚(化合物2)作为单一成分或与其他药学上可接受的成分构成组合物以制备治疗恶病质的产品。其包含的其他药学上可接受的成分可以是与该化合物没有拮抗作用的药物,也可以是药学上允许的任意一种或多种辅料。本发明中各英文及缩写的含义如下:carnsol:鼠尾草酚fbs:胎牛血清,hs:马血清,dmem培养液:含氨基酸和葡萄糖的培养液,pbs缓冲液:磷酸缓冲盐溶液,dmso:二甲基亚砜。本发明中,所采用的药效学试验方法,是本领域技术人员所熟知的方法。本发明中,所采用的c2c12细胞、3t3-l1细胞、c26细胞和balb/c小鼠是本领域技术人员可通过市购的途径所获得的。鼠尾草酚(carnosol)是一种植物多酚类化合物,来自于多种唇形科植物,比如工业上用作原材料的鼠尾草(salviaofficinalisl.)和迷迭香(rosmarinusofficinalisl),其分子式是c20h26o4,分子量为330.42。鼠尾草酚具有多种药理活性。有研究表明,鼠尾草酚有显著的抗炎抗氧化作用,能抑制cox1和cox2的表达,降低因子il4和il10的水平;能降低缺血再灌注导致的损伤,抑制nf-κb和icam-1的表达;另外鼠尾草酚没有抗肿瘤的显著活性,仅见报道能够抑制wehi-164纤维瘤的生长。中国专利文献cn102014893a公开了迷迭香提取物鼠尾草酚等多酚类用于改善软骨病症,尤其是预防和治疗肌肉骨骼疾病产品中的用途。但是关于鼠尾草酚在治疗肿瘤恶病质方面的作用还没有相关专利报道。我们的研究发现鼠尾草酚类化合物能浓度依赖性缓解肌肉萎缩,本专利新发现的机制主要有上调akt的磷酸化水平,促进肌细胞蛋白合成;下调e3泛素化连接酶murf-1的表达,缓解肌肉细胞蛋白降解;上调生肌决定因子myod的表达水平,促进肌细胞分化和生长。鼠尾草酚类化合物能浓度依赖性缓解脂肪降解,本专利新发现的机制主要有上调akt的磷酸化水平,促进脂肪细胞存活;下调激素敏感性甘油三酯脂肪酶hsl的磷酸化水平,减少脂肪动员,减少甘油三酯的分解;下调amp依赖的蛋白激酶ampkα的磷酸化激活,一方面减少ampkα的磷酸化激活导致的hsl的磷酸化水平上调,缓解脂解,另一方面缓解ampkα的磷酸化激活导致的过度能量代谢,缓解脂质损耗。总之,鼠尾草酚类化合物通过全新的分子作用机制,缓解肌肉细胞内蛋白降解,促进肌细胞分化和生长,减少脂肪降解,缓解能量过度消耗,在体外能够逆转肿瘤引发的肌管细胞萎缩和脂肪细胞的降解,在体内能逆转肿瘤引发的肌肉组织萎缩,缓解脂肪组织的降解,抑制炎症反应,并抑制体重降低,具有显著的抗肿瘤恶病质的作用,有利于恶病质的改善。鼠尾草酚是一种多酚类抗氧化物剂,被用于抗炎抗氧化方面的研究。本发明研究发现鼠尾草酚及其衍生物通过全新的分子作用机制,缓解肌肉细胞内蛋白降解,促进肌细胞分化和生长,减少脂肪降解,缓解能量过度消耗,在体外能够逆转肿瘤引发的肌管细胞萎缩和脂肪细胞的降解,在体内能逆转肿瘤引发的肌肉组织萎缩,缓解脂肪组织的降解,抑制体重降低,同时能够增强食欲,具有显著的抗肿瘤恶病质的作用,有利于恶病质的改善(已申请应用专利)。基于鼠尾草酚及其衍生物在缓解肿瘤恶病质肌萎缩与脂肪降解过程中的重要作用,我们对其酚羟基氘代双甲基,设计合成了双甲基氘代鼠尾草酚进行治疗肿瘤恶病质方面的专利研究。我们的研究发现双甲基氘代鼠尾草酚能浓度梯度性缓解肌肉萎缩,对肌管细胞的分子作用机制主要有上调akt的磷酸化水平,促进肌肉细胞存活;下调e3泛素化连接酶atrogin-1的表达,缓解肌肉细胞蛋白降解;上调生肌决定因子myod的表达水平,促进肌纤维的肥大和融合;抑制p65磷酸化激活,阻断nf-κb信号转导,从而抑制肌管细胞炎症反应。氘代双甲基鼠尾草酚能浓度梯度性缓解脂肪降解,对脂肪细胞的分子作用机制主要有上调akt的磷酸化水平,促进脂肪细胞存活;下调激素敏感性甘油三酯脂肪酶hsl的磷酸化水平,减少脂肪动员,减少甘油三酯的分解;下调amp依赖的蛋白激酶ampkα的磷酸化激活,一方面减少ampk-α的磷酸化激活导致的hsl的磷酸化水平上调,缓解脂解,另一方面缓解ampk-α的磷酸化激活导致的过度能量代谢,缓解脂质损耗;抑制p65磷酸化激活,阻断nf-κb信号转导,从而抑制脂肪细胞炎症反应。总之,双甲基氘代鼠尾草酚通过全新的分子作用机制,缓解肌肉细胞内蛋白降解,促进肌细胞分化和生长,减少脂肪降解,缓解能量过度消耗,在体外能够逆转肿瘤引发的肌管细胞萎缩和脂肪细胞的降解,在体内能逆转肿瘤引发的肌肉组织萎缩,缓解脂肪组织的降解,抑制炎症反应,并抑制体重降低,具有显著的抗肿瘤恶病质的作用,有利于恶病质的改善。本发明提出的化合物在不同组织中通过影响相关的信号通路来缓解肿瘤恶病质骨骼肌萎缩与脂肪降解过程,并且在动物实验中显示其能够明显缓解肿瘤恶病质引起的体重和摄食量下降,起到显著的抗肿瘤恶病质的作用。实验结果显示,所述的化合物具有良好的抗恶病质活性,能够应用于肿瘤恶病质及其相关病症的治疗,可进一步制备新型的抗恶病质药物。本发明公开了鼠尾草酚类化合物用于治疗肿瘤恶病质的新用途。本发明提供鼠尾草酚及其衍生物,发现鼠尾草酚及其衍生物通过全新的分子作用机制,缓解肌肉细胞内蛋白降解,促进肌细胞分化和生长,减少脂肪降解,缓解能量过度消耗,在体外能够逆转肿瘤引发的肌管细胞萎缩和脂肪细胞的降解,在体内能逆转肿瘤引发的肌肉组织萎缩,缓解脂肪组织的降解,抑制体重降低,同时能够增强食欲,具有显著的抗肿瘤恶病质的作用,有利于恶病质的改善。本发明创新提出的应用及机制包括,主要有上调akt的磷酸化水平,促进肌细胞蛋白合成;下调e3泛素化连接酶murf-1和atrogin-1的表达,缓解肌肉细胞蛋白降解;上调生肌决定因子myod的表达水平,促进肌细胞分化和生长。首次发现鼠尾草酚类化合物抑制肿瘤恶病质引起的脂肪降解,本专利新发现的机制主要有上调akt的磷酸化水平,促进脂肪细胞存活;下调激素敏感性甘油三酯脂肪酶hsl的磷酸化水平,减少脂肪动员,减少甘油三酯的分解;下调amp依赖的蛋白激酶ampkα的磷酸化激活,一方面减少ampkα的磷酸化激活导致的hsl的磷酸化水平上调,缓解脂解,另一方面缓解ampkα的磷酸化激活导致的过度能量代谢,缓解脂质损耗。首次发现鼠尾草酚类化合物可有效抑制肿瘤炎症因子tnf-α的分泌,说明鼠尾草酚及其衍生物具有抗肿瘤恶病质的作用,能够应用于肿瘤恶病质及其相关病症的治疗,是理想的肿瘤恶病质治疗药物。本发明有益效果及优点还包括:本发明首次提出鼠尾草酚及其衍生物新的用途,通过体内外实验首次发现鼠尾草酚类化合物抑制肿瘤恶病质引起的肌肉萎缩,包括式(x)鼠尾草酚类化合物、式(1)双甲基氘代鼠尾草酚(化合物1)、式(2)双甲基鼠尾草酚(化合物2)进行体内外实验发现能够缓解肿瘤恶病质引起的肌萎缩和脂解,并且在动物实验中显示其能够明显缓解肿瘤恶病质引起的体重和摄食量下降,说明式(x)鼠尾草酚、双甲基氘代鼠尾草酚(化合物1)、式(2)双甲基鼠尾草酚(化合物2)具有抗肿瘤恶病质的作用,能够应用于肿瘤恶病质及其相关病症的治疗,是理想的肿瘤恶病质治疗药物。附图说明附图1是实施例3中鼠尾草酚对c2c12肌肉细胞的活性影响实验结果。附图2是实施例3中双甲基鼠尾草酚对c2c12肌肉细胞的活性影响实验结果。附图3是实施例3中双甲基氘代鼠尾草酚对c2c12肌肉细胞的活性影响实验结果。附图4是实施例4中表2对照组的he染色图。附图5是实施例4中表2模型组的he染色图。附图6为实施例4中表2实验组1的he染色图。附图7为实施例4中表2实验组2的he染色图。附图8为实施例4中表2实验组3的he染色图。附图9为实施例4中表2实验组4的he染色图。附图10是实施例4中表3对照组的he染色图。附图11是实施例4中表3模型组的he染色图。附图12为实施例4中表3实验组1的he染色图。附图13为实施例4中表3实验组2的he染色图。附图14为实施例4中表3实验组3的he染色图。附图15是实施例4中表3实验组4的he染色图附图16是实施例4中表3实验组5的he染色图附图17为实施例4中表3实验组6的he染色图。附图18是实施例4中鼠尾草酚缓解c2c12肌肉细胞萎缩的统计结果图。附图19是实施例4中氘代双甲基鼠尾草酚和双甲基鼠尾草酚缓解c2c12肌肉细胞萎缩的统计结果图。附图20是实施例4中鼠尾草酚在c2c12细胞肌萎缩模型中的蛋白免疫印迹实验结果。附图21是实施例4中双甲基鼠尾草酚在c2c12细胞肌萎缩模型中的蛋白免疫印迹实验结果。附图22是实施例4中双甲基氘代鼠尾草酚在c2c12细胞肌萎缩模型中的蛋白免疫印迹实验结果。附图23是实施例5中鼠尾草酚对3t3-l1脂肪细胞的活性影响实验结果。附图24是实施例5中双甲基鼠尾草酚对3t3-l1脂肪细胞的活性影响实验结果。附图25是实施例5中双甲基氘代鼠尾草酚对3t3-l1脂肪细胞的活性影响实验结果。附图26是实施例6中表6的对照组的油红o染色图。附图27是实施例6中表6的c26模型组的油红o染色图。附图28是实施例6中表6的实验组1的油红o染色图。附图29是实施例6中表6的实验组2的油红o染色图。附图30是实施例6中表6的实验组3的油红o染色图。附图31是实施例6中表6的实验组4的油红o染色图。附图32是实施例6中表7的对照组的油红o染色图。附图33是实施例6中表7的c26模型组的油红o染色图。附图34是实施例6中表7的实验组1的油红o染色图。附图35是实施例6中表7的实验组2的油红o染色图。附图36是实施例6中表7的实验组3的油红o染色图。附图37是实施例6中表7的实验组4的油红o染色图。附图38是实施例6中表7的实验组5的油红o染色图。附图39是实施例6中表7的实验组6的油红o染色图。附图40是实施例6中鼠尾草酚缓解3t3-l1脂肪细胞脂解的油红o染色实验半定量结果图。附图41是实施例6中双甲基氘代鼠尾草酚和双甲基鼠尾草酚缓解3t3-l1脂肪细胞脂解的油红o染色实验半定量结果图。附图42是实施例6中鼠尾草酚缓解3t3-l1脂肪细胞脂解的甘油检测实验结果。附图43是实施例6中双甲基氘代鼠尾草酚和双甲基鼠尾草酚缓解3t3-l1脂肪细胞脂解的甘油检测实验结果。附图44是实施例6中鼠尾草酚缓解3t3-l1脂肪细胞脂解的甘油三酯检测实验结果。附图45是实施例6中双甲基氘代鼠尾草酚和双甲基鼠尾草酚缓解3t3-l1脂肪细胞脂解的甘油三酯检测实验结果。附图46是实施例6中鼠尾草酚在3t3-l1细胞脂解模型中的蛋白免疫印迹实验结果。附图47是实施例6中双甲基鼠尾草酚在3t3-l1细胞脂解模型中的蛋白免疫印迹实验结果。附图48是实施例6中双甲基氘代鼠尾草酚在3t3-l1细胞脂解模型中蛋白免疫印迹实验结果。附图49,50是实施例7中小鼠荷瘤体重图。附图51,52是实施例7中小鼠去瘤体重图附图53,54是实施例7中小鼠累积摄食量变化图。附图55,56是实施例7中小鼠日均摄食量变化图。附图57,58是实施例7中小鼠体温变化图。附图59,60是实施例7中小鼠肿瘤体积变化图。附图61,62是实施例7中小鼠肿瘤解剖图。附图63是实施例7中鼠尾草酚次实验小鼠腓肠肌质量图。附图64是实施例7中鼠尾草酚次实验小鼠腓肠肌解剖图。附图65是实施例7中鼠尾草酚次实验健康组小鼠腓肠肌切片he染色图。附图66是实施例7中鼠尾草酚次实验c26肿瘤模型组小鼠腓肠肌切片he染色图。附图67是实施例7中鼠尾草酚次实验鼠尾草酚(10mg/kg)小鼠腓肠肌切片he染色图。附图68是实施例7中鼠尾草酚次实验小鼠腓肠肌横截面积统计图。附图69是实施例7中鼠尾草酚次实验小鼠腓肠肌的蛋白免疫印迹实验结果。附图70是实施例7中双甲基氘代鼠尾草酚次实验小鼠腓肠肌质量图。附图71是实施例7中双甲基氘代鼠尾草酚次实验小鼠腓肠肌解剖图。附图72是实施例7中双甲基氘代鼠尾草酚次实验健康组小鼠腓肠肌切片he染色图。附图73是实施例7中双甲基氘代鼠尾草酚次实验c26肿瘤模型组小鼠腓肠肌切片he染色图。附图74是实施例7中双甲基氘代鼠尾草酚次实验双甲基氘代鼠尾草酚(20mg/kg)小鼠腓肠肌切片he染色图。附图75是实施例7中双甲基氘代鼠尾草酚次实验小鼠腓肠肌横截面积统计图。附图76是实施例7中鼠尾草酚次实验小鼠附睾脂肪质量图。附图77是实施例7中鼠尾草酚次实验小鼠附睾脂肪解剖图。附图78是实施例7中鼠尾草酚次实验健康组小鼠附睾脂肪切片he染色图。附图79是实施例7中鼠尾草酚次实验c26肿瘤模型组小鼠附睾脂肪切片he染色图。附图80是实施例7中鼠尾草酚次实验鼠尾草酚(10mg/kg)小鼠附睾脂肪切片he染色图。附图81是实施例7中鼠尾草酚次实验小鼠附睾脂肪横截面积统计图。附图82是实施例7中鼠尾草酚次实验小鼠附睾脂肪的蛋白免疫印迹实验结果。附图83是实施例7中双甲基氘代鼠尾草酚次实验小鼠附睾脂肪质量图。附图84是实施例7中双甲基氘代鼠尾草酚次实验小鼠附睾脂肪解剖图。附图85是实施例7中双甲基氘代鼠尾草酚次实验健康组小鼠附睾脂肪切片he染色图。附图86是实施例7中双甲基氘代鼠尾草酚次实验c26肿瘤模型组小鼠附睾脂肪切片he染色图。附图87是实施例7中双甲基氘代鼠尾草酚次实验双甲基氘代鼠尾草酚(20mg/kg)小鼠附睾脂肪切片he染色图。附图88是实施例7中双甲基氘代鼠尾草酚次实验小鼠附睾脂肪横截面积统计图。附图89是实施例7中鼠尾草酚次实验小鼠血清甘油含量的图。附图90是实施例7中鼠尾草酚次实验小鼠血清甘油三酯含量的图。附图91是实施例7中鼠尾草酚次实验小鼠血清tnf-α含量的图。附图92是实施例7中鼠尾草酚次实验小鼠血清il-6含量的图。具体实施方式结合以下具体实施例和附图,对本发明作进一步的详细说明。实施本发明的过程、条件、实验方法等,除以下专门提及的内容之外,均为本领域的普遍知识和公知常识,本发明没有特别限制内容。本发明提供鼠尾草酚、双甲基鼠尾草酚和双甲基氘代鼠尾草酚治疗肿瘤恶病质及相关病症治疗的新用途。本发明中,所采用的药效学试验方法,是本领域技术人员所熟知的方法。本发明中,所采用的c2c12细胞(小鼠成肌细胞)、3t3-l1细胞(小鼠脂肪细胞)和c26细胞(小鼠结肠癌细胞)是从中国科学院典型培养物保藏委员会细胞库购买获得。bablb/c小鼠是通过上海灵畅生物科技有限公司公司购买获得的。鼠尾草酚,购自上海诗丹德生物技术有限公司(shanghaistandardtechnologyco.,ltd)。碘甲烷,购自国药集团药业股份有限公司。氘代碘甲烷,购自国药集团药业股份有限公司。fbs(胎牛血清),购自biologicalindustries。horseserum(马血清),购自gibco。高糖dmem培养基,购自hyclone。rpmi-1640培养基,购自hyclone。无酚红高糖dmem培养基,购自hyclone。p/s双抗(青霉素-链霉素混合液)购自hyclone。地塞米松,购自sigma–aldrich。ibmx(3-异丁基-1-甲基黄嘌呤)广谱的磷酸二酯酶抑制剂,购自sigma–aldrich。人重组胰岛素,购自上海今迈生物。甘油检测试剂盒,购自北京普利莱基因技术有限公司。实施例1双甲基鼠尾草酚的合成向50ml反应瓶中加入300mg鼠尾草酚、250mg碳酸钾和20ml无水丙酮,氮气保护下加入1ml碘甲烷,室温下避光反应48小时,反应液由无色变成棕色,抽滤除去固体,滤液浓缩至干后柱层析分离得白色固体70mg,收率21.5%。lc-ms(esi)m/zc22h31o4[m+h]+calcdfor359.2,found359.4。实施例2双甲基氘代鼠尾草酚的合成向100ml反应瓶中加入750mg鼠尾草酚、600mg碳酸钾和50ml无水丙酮,氮气保护下加入3ml氘代碘甲烷,室温下避光反应48小时,反应液由无色变成棕色,抽滤除去固体,滤液浓缩至干后柱层析分离得白色固体135mg,收率16.3%。lc-ms(esi)m/zc22h25d6o4[m+h]+calcdfor364.3,found365.5。实施例3鼠尾草酚、双甲基鼠尾草酚与双甲基氘代鼠尾草酚对小鼠成肌细胞(c2c12)活力影响实验采用mtt法检测c2c12细胞的存活率。检测原理为活细胞线粒体中的琥珀酸脱氢酶能使外源性mtt还原为水不溶性的蓝紫色结晶甲臜(formazan)并沉积在细胞中,而死细胞无此功能。三联液(10%sds+5%异丁醇+0.01%浓盐酸,水溶液)能溶解细胞中的甲臜,用酶联免疫检测仪在570nm波长处测定其光吸收值,可间接反映活细胞数量。在一定细胞数范围内,mtt结晶形成的量与细胞数成正比。通过以上方法可评价药物对小鼠成肌细胞(c2c12)的活力影响。具体方法如下:将c2c12细胞接种于24孔板中,培养体系为含有10%fbs的高糖dmem培养液,并加入1%的双抗,置于5%co2,37℃环境中。待细胞生长密度达到50%~60%时,将培养体系换成含有2%hs的高糖dmem培养液,并加入1%的双抗,每48h换液一次,第5或第6天分化成熟。按以下浓度3.125μm,6.25μm,12.5μm,25μm,50μm加入鼠尾草酚或6.25μm,12.5μm,25μm,50μm,100μm的双甲基鼠尾草酚或6.25μm,12.5μm,25μm,50μm,100μm的双甲基氘代鼠尾草酚配制在2%hs分化液中,作用于分化成熟的c2c12肌管细胞48h。将培液换成mtt(5mg/ml):2%hs=1:10的溶液,500ul/孔,3h后每孔加入250ul三联液,过夜后用酶联免疫检测仪在570nm波长处测定其光吸收值。细胞活力(%)=(oddrug-odblank)/(odcontrol-odblank)×100%结果与结论:请参照附图1-3,附图1-3是不同浓度鼠尾草酚、双甲基鼠尾草酚与双甲基氘代鼠尾草酚作用下c2c12肌管细胞的存活率。如表1所示,当鼠尾草酚浓度为3.125μm时,存活率为97.78%;当鼠尾草酚浓度为6.25μm时,存活率为96.73%;浓度为12.5μm时,存活率为93.00%;浓度为25μm时,存活率为92.56%;浓度为50μm时,存活率为70.67%。当双甲基鼠尾草酚浓度为6.25μm时,存活率为97.69%;浓度为12.5μm时,存活率为99.63%;浓度为25μm时,存活率为95.10%;浓度为50μm时,存活率为92.11%,浓度为100μm时,存活率为73.74%;当双甲基氘代鼠尾草酚浓度为6.25μm时,存活率为101.72%;浓度为12.5μm时,存活率为99.49%;浓度为25μm时,存活率为103.47%;浓度为50μm时,存活率为103.32%,浓度为100μm时,存活率为70.43%。以上结果说明,鼠尾草酚对用于c2c12肌肉细胞的最大安全浓度为25μm;双甲基鼠尾草酚对用于c2c12肌肉细胞的最大安全浓度为50μm;双甲基氘代鼠尾草酚对用于c2c12肌肉细胞的最大安全浓度为50μm。表1是实施例3中鼠尾草酚对c2c12肌肉细胞的活性影响统计结果,对应附图1-3。表1鼠尾草酚、双甲基鼠尾草酚与双甲基氘代鼠尾草酚对c2c12细胞存活力影响结果表化合物(浓度)存活率(%)鼠尾草酚-3.125μm97.78鼠尾草酚-6.25μm96.73鼠尾草酚-12.5μm93.00鼠尾草酚-25μm92.56鼠尾草酚-50μm70.76双甲基鼠尾草酚-6.25μm97.69%双甲基鼠尾草酚-12.5μm99.63%双甲基鼠尾草酚-25μm95.10%双甲基鼠尾草酚-50μm92.11%双甲基鼠尾草酚-100μm73.74%双甲基氘代鼠尾草酚-6.25μm101.72%双甲基氘代鼠尾草酚-12.5μm99.49%双甲基氘代鼠尾草酚-25μm103.47%双甲基氘代鼠尾草酚-50μm103.32%双甲基氘代鼠尾草酚-100μm70.43%实施例4鼠尾草酚、双甲基鼠尾草酚与双甲基氘代鼠尾草酚缓解小鼠结肠癌细胞(c26)培养液上清诱导的小鼠成肌细胞(c2c12)萎缩实验采用直径测量法评价小鼠成肌细胞(c2c12)分化后的肌管直径。实验使用的染色方法为苏木精—伊红染色法,简称he染色法。苏木精染液为碱性,带正电荷,很容易以离子键结合细胞核中带负电荷且呈酸性的脱氧核糖核酸(dna)而染蓝色;伊红为酸性染料,在水中离解成带负电荷的阴离子,很容易与细胞质中蛋白质的氨基正电荷结合而染红色。染色后的细胞置于高倍显微镜下采图样,利用imagej软件可统计肌管细胞直径。采用蛋白免疫印迹实验评价小鼠成肌细胞(c2c12)中相关蛋白质水平的的变化。经过page(聚丙烯酰胺凝胶电泳)分离的蛋白质样品,转移到固相载体(例如硝酸纤维素薄膜)上,固相载体以非共价键形式吸附蛋白质,且能保持电泳分离的多肽类型及其生物学活性不变。以固相载体上的蛋白质或多肽作为抗原,与对应的抗体起免疫反应,再与酶或同位素标记的第二抗体起反应,经过底物显色或放射自显影以检测电泳分离的特异性目的基因表达的蛋白成分。通过以上方法可评价药物对c2c12细胞肌萎缩模型的作用。具体方法如下:将c2c12细胞接种于24孔板中,用含有2%hs的高糖dmem培养液分化为成熟肌管细胞。另外,将c26细胞接种于t75瓶子中,培养48h后收集取上清。将c26上清和2%hs分化液1:1混合,作为肌萎缩诱导液。除对照组加2%hs分化液以外,其他各组均加入等量的肌萎缩诱导液,一组作为模型组,其余组作为给药实验组。同时向细胞中按以下浓度3.125μm,6.25μm,12.5μm,25μm加入鼠尾草酚储备液,见表2;按6.25μm,12.5μm,25μm,50μm加入双甲基鼠尾草酚储备液;按6.25μm,12.5μm,25μm,50μm加入双甲基氘代鼠尾草酚储备液,见表3。表2是实施例4中鼠尾草酚对c2c12肌肉细胞肌萎缩逆转实验的给药方案。表2实施例4中成肌细胞(c2c12)萎缩实验的给药样品表3是实施例4中双甲基鼠尾草酚和双甲基氘代鼠尾草酚对c2c12肌肉细胞肌萎缩逆转实验的给药方案。表3实施例4中成肌细胞(c2c12)萎缩实验的给药样品其中,μm指的是μmol/l。肌管直径测量方法如下:药物作用48h后,用固定液(无水乙醇:甲醛:冰醋酸=20:2:1)固定1h以上,利用苏木精—伊红染色法进行染色,并置于高倍显微镜下采集图像,利用imagej统计肌管直径。按如下公式计算肌萎缩逆转率:肌萎缩逆转率=(给药组肌管平均值-模型组肌管平均值)/(对照组肌管平均值-模型组肌管平均值)x100%蛋白质免疫印迹方法如下:作用48h后,收集细胞,并按比例加入含1%磷酸蛋白酶抑制剂的ripa裂解液。裂解完成后,将裂解液置于4℃13000rpm条件下离心30min,取上清,稀释后进行bca蛋白定量,计算样品的蛋白浓度。上样量定为20μg,上样体系为20μl,根据蛋白浓度和稀释倍数分装蛋白,于100℃金属浴中加热变性10min,冰上冷却,离心后-80℃保存或直接上样电泳,转膜,免疫反应。结果与结论:请参照附图4-19。附图4-17是鼠尾草酚、双甲基鼠尾草酚和双甲基氘代鼠尾草酚分别缓解c26细胞培液诱导的c2c12成熟肌管细胞萎缩的he染色代表性图片,附图18,19是肌管统计结果图,附表4为肌管统计结果表。鼠尾草酚、双甲基鼠尾草酚和双甲基氘代鼠尾草酚对肌细胞萎缩有明显的逆转作用,且呈浓度依赖性关系。当鼠尾草酚浓度为3.125μm时,逆转率为23.21%;当鼠尾草酚浓度为6.25μm时,逆转率为36.43%;浓度为12.5μm时,逆转率为50.02%;浓度为25μm时,逆转率为66.39%;当双甲基鼠尾草酚浓度为12.5μm时,逆转率为28.40%;浓度为25μm时,逆转率为36.24%;浓度为50μm时,逆转率为69.73%;当双甲基氘代鼠尾草酚浓度为12.5μm时,逆转率为25.82%;浓度为25μm时,逆转率为33.87%;浓度为50μm时,逆转率为75.86%。表4是鼠尾草酚、双甲基鼠尾草酚和双甲基氘代鼠尾草酚缓解c2c12肌肉细胞萎缩的统计结果,对应附图4-17。表4鼠尾草酚、双甲基鼠尾草酚与双甲基氘代鼠尾草酚对c2c12肌管细胞肌萎缩的逆转率化合物(浓度)肌萎缩逆转率(%)鼠尾草酚-3.125μm23.21%鼠尾草酚-6.25μm36.43%鼠尾草酚-12.5μm50.02%鼠尾草酚-25μm66.36%双甲基鼠尾草酚-12.5μm28.40%双甲基鼠尾草酚-25μm36.24%双甲基鼠尾草酚-50μm69.73%双甲基氘代鼠尾草酚-12.5μm25.82%双甲基氘代鼠尾草酚-25μm33.87%双甲基氘代鼠尾草酚-50μm75.86%附图20-22是鼠尾草酚、双甲基鼠尾草酚与双甲基氘代鼠尾草酚在c2c12细胞肌萎缩模型中的蛋白免疫印迹实验结果。结果显示在c26细胞培液的刺激下c2c12肌管细胞中p-p65被激活,表达量上调,鼠尾草酚、双甲基鼠尾草酚与双甲基氘代鼠尾草酚能呈浓度梯度性降低p-p65的表达;同时,p-p65的上调也激活了e3泛素化连接酶murf-1和atrogin-1的表达,但这种表达的上调也被鼠尾草酚、双甲基鼠尾草酚与双甲基氘代鼠尾草酚所抑制;由于p-p65的上调,mhc和myod的表达水平明显下降,而鼠尾草酚、双甲基鼠尾草酚与双甲基氘代鼠尾草酚能缓解mhc和myod的减少,且这种缓解是成浓度依赖性的。另外,鼠尾草酚、双甲基鼠尾草酚与双甲基氘代鼠尾草酚还能逆转由于c26细胞培液造成的p-akt的减少。但是鼠尾草酚对p-p38的激活无缓解作用。以上结果说明,说明鼠尾草酚、双甲基鼠尾草酚与双甲基氘代鼠尾草酚通过全新的分子作用机制,缓解肌肉细胞内蛋白降解,促进肌细胞分化和生长,对肌肉细胞肌萎缩有明显的缓解作用,且呈浓度依赖性关系。实施例5鼠尾草酚、双甲基鼠尾草酚与双甲基氘代鼠尾草酚对小鼠前脂肪细胞(3t3-l1)活力影响实验采用mtt法检测3t3-l1细胞的存活率。检测原理为活细胞线粒体中的琥珀酸脱氢酶能使外源性mtt还原为水不溶性的蓝紫色结晶甲臜(formazan)并沉积在细胞中,而死细胞无此功能。三联液(10%sds+5%异丁醇+0.01%浓盐酸,水溶液)能溶解细胞中的甲臜,用酶联免疫检测仪在570nm波长处测定其光吸收值,可间接反映活细胞数量。在一定细胞数范围内,mtt结晶形成的量与细胞数成正比。通过以上方法可评价药物对小鼠前脂肪细胞(3t3-l1)的活力影响。具体方法如下:将3t3-l1细胞接种于96孔板中,培养体系为含有10%fbs的高糖dmem培养液,并加入1%的双抗,置于5%co2,37℃环境中。待细胞长满后继续融合后,用0.5mmibmx、5mg/ml胰岛素、1μm地塞米松和10%fbs的高糖dmem培养液分化为成熟脂肪细胞,分化成功后明显可见细胞内含有大量油滴。按以下浓度6.25μm,12.5μm,25μm,50μm,100μm加入鼠尾草酚或6.25μm,12.5μm,25μm,50μm,100μm加入双甲基鼠尾草酚配制在含10%fbs的高糖dmem培养液中,作用于分化成熟的3t3-l1脂肪细胞48h。将培液换成mtt(5mg/ml):培液=1:10的溶液,100ul/孔,3h后每孔加入50ul三联液,过夜后用酶联免疫检测仪在570nm波长处测定其光吸收值。细胞活力(%)=(oddrug-odblank)/(odcontrol-odblank)×100%结果与结论:请参照附图23-25。附图23-25是不同浓度鼠尾草酚、双甲基鼠尾草酚与双甲基氘代鼠尾草酚作用下3t3-l1细胞的存活率。如表5所示,当鼠尾草酚浓度为3.125μm时,存活率为99.82%;当鼠尾草酚浓度为6.25μm时,存活率为96.19%;浓度为12.5μm时,存活率为96.23%;浓度为25μm时,存活率为97.18%;浓度为50μm时,存活率为90.04%;浓度为100μm时,存活率为51.47%;当双甲基鼠尾草酚浓度为6.25μm时,存活率为99.03%;浓度为12.5μm时,存活率为95.76%;浓度为25μm时,存活率为93.60%;浓度为50μm时,存活率为91.84%;浓度为100μm时,存活率为90.73%;双甲基氘代鼠尾草酚浓度为25μm时,存活率为97.19%;浓度为50μm时,存活率为92.80%;浓度为100μm时,存活率为90.54%.以上结果说明,说明鼠尾草酚对于3t3-l1脂肪细胞的最大安全浓度为50μm;双甲基鼠尾草酚对于3t3-l1脂肪细胞的最大安全浓度为100μm;双甲基氘代鼠尾草酚对于3t3-l1脂肪细胞的最大安全浓度为100μm.表5是实施例5中鼠尾草酚、双甲基鼠尾草酚和双甲基氘代鼠尾草酚对3t3-l1脂肪细胞的毒性实验统计结果,对应附图23-25。表5.鼠尾草酚、双甲基鼠尾草酚和双甲基氘代鼠尾草酚对3t3-l1细胞存活力的影响结果表化合物(浓度)存活率(%)鼠尾草酚-3.125μm99.82%鼠尾草酚-6.25μm96.19%鼠尾草酚-12.5μm96.23%鼠尾草酚-25μm97.18%鼠尾草酚-50μm90.04%鼠尾草酚-100μm51.47%双甲基鼠尾草酚-6.25μm99.03%双甲基鼠尾草酚-12.5μm95.76%双甲基鼠尾草酚-25μm93.60%双甲基鼠尾草酚-50μm91.84%双甲基鼠尾草酚-100μm90.73%双甲基氘代鼠尾草酚-6.25μm99.54%双甲基氘代鼠尾草酚-12.5μm95.92%双甲基氘代鼠尾草酚-25μm97.19%双甲基氘代鼠尾草酚-50μm92.80%双甲基氘代鼠尾草酚-100μm90.54%实施例6鼠尾草酚、双甲基鼠尾草酚和双甲基氘代鼠尾草酚缓解3t3-l1脂肪细胞脂解的实验结果采用油红o脂肪染色法评价细胞内脂肪含量。油红o为脂溶性染料,在脂肪内能高度溶解,可特异性的使组织内甘油三酯等中性脂肪着色。采用甘油检测评价细胞内脂肪含量。甘油激酶将甘油磷酸化为3-磷酸甘油;3-磷酸甘油被甘油磷酸氧化酶氧化产生过氧化氢;在过氧化氢酶的作用下生色底物转化为苯醌亚胺,其光密度值和甘油浓度成正比。采用甘油三酯检测评价细胞内脂肪含量。脂肪酶分解血清中的甘油三酯为甘油;甘油激酶将甘油磷酸化为3-磷酸甘油;3-磷酸甘油被甘油磷酸氧化酶氧化产生过氧化氢;在过氧化氢酶的作用下生色底物转化为苯醌亚胺,其光密度值和甘油浓度成正比,进而和甘油三酯的含量成正比。采用蛋白免疫印迹实验评价小鼠脂肪细胞细胞(3t3-l1)中相关蛋白质水平的变化。通过以上方法可评价药物对细胞脂解模型的作用。具体方法如下:将3t3-l1细胞接种于6孔板中,培养体系为含有10%fbs的高糖dmem培养液,并加入1%的双抗,置于5%co2,37℃环境中。待细胞长满后继续融合后,用0.5mmibmx、5mg/ml胰岛素、1μm地塞米松和10%fbs的高糖dmem培养液分化为成熟脂肪细胞,分化成功后明显可见细胞内含有大量油滴。另外,将c26细胞接种于t75瓶子中,长满后收集48h无酚红高糖dmem培养液,1000rpm离心3min,取上清,4000rpm离心10min,取上清。将c26上清和无酚红高糖dmem培养液1:1混合,作为脂解诱导液。除对照组加无酚红高糖dmem培养液以外,其他各组均加入等量的脂解诱导液,一组作为模型组,其余组作为给药实验组。同时向细胞中按以下浓度6.25μm,12.5μm,25μm,50μm加入鼠尾草酚储备液,见表6;按25μm,50μm,100μm加入双甲基鼠尾草酚储备液,按25μm,50μm,100μm加入双甲基氘代鼠尾草酚储备液,见表7。表6是实施例6中鼠尾草酚对3t3-l1脂肪细胞脂解逆转实验的给药方案。表6实施例6中小鼠前脂肪细胞(3t3-l1)脂解实验的给药样品表7是实施例6中双甲基鼠尾草酚和双甲基氘代鼠尾草酚对3t3-l1脂肪细胞脂解逆转实验的给药方案。表7实施例6中小鼠前脂肪细胞(3t3-l1)脂解实验的给药样品油红o染色及半定量方法如下:作用48h后,将0.5%油红o染料(异丙醇配制)同蒸馏水3:2稀释,混匀后用0.42μm滤头过滤,作为染色剂。弃去细胞培液,用4%中性甲醛固定细胞1h以上,用吸泵吸净固定液,用pbs洗3遍,放置于室温通风处晾干20min,加入油红o染色液染色30min后除去,用pbs洗2遍后再用60%异丙醇洗去浮色,蒸馏水下洗2遍后置于倒高倍置显微镜下观察并拍摄照片。之后用异丙醇溶出细胞中结合的油红o,并用未分化的脂肪细胞染色组进行平行操作作为空白调零组,于510nm下测量od值。根据od值结果按照下列公式进行油红o半定量:脂肪含量(%)=(oddrug-odblank)/(odcontrol-odblank)×100%甘油和甘油三酯检测方法如下:作用48h后,利用北京普利莱基因技术有限公司的甘油检测试剂盒和甘油三酯检测试剂盒分别检测上清中甘油和细胞中的甘油三酯的含量。蛋白质免疫印迹方法同实施例4中所述。结果与结论:请参照附图26-41。附图26-39是鼠尾草酚、双甲基鼠尾草酚和双甲基氘代鼠尾草酚缓解c26细胞培液诱导的3t3-l1成熟脂肪细胞脂解的油红o染色代表性图片,正常对照组细胞中有大量脂滴堆积,脂滴较大,着色深且明亮;c26细胞培液单独作用后,细胞内脂滴显著变小且含量急剧减少;而在c26细胞培液作用下同时孵育鼠尾草酚或双甲基鼠尾草酚或双甲基氘代鼠尾草酚时,随着鼠尾草酚或双甲基鼠尾草酚或双甲基氘代鼠尾草酚浓度增加,细胞内油红o着色的脂肪滴含量也逐渐增多。附图40,41是油红o染色半定量结果,如图40,41所示,鼠尾草酚、双甲基鼠尾草酚和双甲基氘代鼠尾草酚呈浓度依赖性增加细胞内油红o含量,指征脂肪含量的增加。附图42-45分别是甘油检测结果和甘油三酯检测结果,鼠尾草酚、双甲基鼠尾草酚和双甲基氘代鼠尾草酚呈浓度依赖性减少c26细胞培液造成的3t3-l1成熟脂肪细胞甘油释放,减少细胞内甘油三酯的分解。附图46-48是鼠尾草酚、双甲基鼠尾草酚和双甲基氘代鼠尾草酚在3t3-l1细胞脂解模型中的蛋白免疫印迹实验结果。结果显示在c26细胞培液的刺激下3t3-l1脂肪细胞中p-p65被激活,表达量上调,鼠尾草酚、双甲基鼠尾草酚和双甲基氘代鼠尾草酚能呈浓度梯度性降低p-p65的表达;c26细胞培液激活hsl(激素敏感性酯酶)的磷酸化,p-hsl表达量上调,参与脂解进程,随着鼠尾草酚、双甲基鼠尾草酚和双甲基氘代鼠尾草酚浓度升高,p-hsl表达减少;c26细胞培液激活ampkα(amp依赖的蛋白激酶α亚型)的磷酸化,p-ampkα表达量上调,能量代谢加剧,随着鼠尾草酚、双甲基鼠尾草酚和双甲基氘代鼠尾草酚浓度升高,p-ampkα表达减少。但是鼠尾草酚或双甲基鼠尾草酚对p-p38的激活无缓解作用。以上结果说明,说明鼠尾草酚、双甲基鼠尾草酚和双甲基氘代鼠尾草酚通过全新的分子作用机制,减少脂肪降解,缓解能量过度消耗,对脂肪细胞脂解有明显的缓解作用,且呈浓度依赖性关系。实施例7鼠尾草酚和双甲基氘代鼠尾草酚治疗肿瘤恶病质动物模型实验结果将c26细胞悬液接种与balb/c小鼠左右两侧腋下各100万保种。待肿瘤体积增加至800cm3时取出肿瘤,按3.5ml冰生理盐水/g匀浆得到肿瘤组织悬液。待接种小鼠按体重分组,细胞悬液接种于balb/c小鼠左侧腋下,接种量为100ul/只。接种后第二天即开始给药。鼠尾草酚用dmso和预热的0.5%cmcna溶液混合溶解成均一稳定的溶液,终浓度为含3%dmso的1mg/ml,给药量为10mg/kg,给药途径为腹腔注射。双甲基氘代鼠尾草酚用3%dmso中,2%无水乙醇,2%聚氧乙烯蓖麻油和93%生理盐水混合溶解成均一稳定的溶液,终浓度为2mg/ml,给药量为20mg/kg,给药途径为腹腔注射。每天监测小鼠的体重、体温、肿瘤大小和摄食量。15天后模型组小鼠体重下10%左右,即认为进入恶病质晚期阶段。脱颈处死小鼠后取得胫骨前肌、附睾脂肪、肿瘤以及血清等生化样本。结果与结论:请参照附图49-92。附图49-62是小鼠存活期间的荷瘤体重,去瘤体重,平均累积摄食量,日均摄食量,体温变化,肿瘤体积和肿瘤解剖图。如图所示,健康组小鼠体重在持续增长;而c26肿瘤模型组小鼠荷瘤体重在实验开始至第10天先降后升,总体维持稳定,在第10天后至实验结束继续减少,去瘤体重同样如此;而鼠尾草酚组和双甲基氘代鼠尾草酚组荷瘤体重则持续增长,在第14天才开始出现体重明显下降,且直至实验结束荷瘤体重和去瘤体重均高c26model组,差异均有统计学意义(p<0.01)。c26肿瘤模型组小鼠摄食量较健康组出现了明显的下降,而鼠尾草酚和双甲基氘代鼠尾草酚可以轻微改善小鼠食欲。此外c26肿瘤模型组小鼠的体温较健康组也出现了明显的下降,鼠尾草酚组和双甲基氘代鼠尾草酚组体温高于c26肿瘤模型组,且差异有较大差异。但是鼠尾草酚和双甲基氘代鼠尾草酚对c26肿瘤无明显抑制作用。附图63-68,70-75是小鼠腓肠肌质量,腓肠肌实拍图,腓肠肌切片he染色结果,腓肠肌切片肌束直径统计图,如图所示,c26肿瘤模型组小鼠腓肠肌质量显著小于健康组,且差异有统计学意义(p<0.001),鼠尾草酚组和双甲基氘代鼠尾草酚组腓肠肌质量稍微大于c26肿瘤模型组组,虽然质量上无统计学意义,但是切片结果可见鼠尾草酚组腓肠肌肌束直径大于c26肿瘤模型组,双甲基氘代鼠尾草酚组腓肠肌肌束直径也大于c26肿瘤模型组(p=0.06)。附图69是小鼠腓肠肌组织蛋白质免疫印记实验结果。结果显示c26肿瘤激活了p-p65,其表达量上调,鼠尾草酚能降低p-p65的表达;同时,p-p65的上调也激活了e3泛素化连接酶murf-1的表达,但这种表达的上调也被鼠尾草酚所抑制;由于p-p65的上调,mhc和myod的表达水平明显下降,而鼠尾草酚能缓解mhc和myod的减少。另外,鼠尾草酚还能逆转由于c26肿瘤诱导的p-akt的减少。但是鼠尾草酚对p-p38的激活无缓解作用。附图76-81,83-88是小鼠附睾脂肪质量,附睾脂肪实拍图,附睾脂肪切片he染色结果,附睾脂肪切片脂肪直径统计图,如图所示,c26肿瘤模型组小鼠附睾脂肪质量显著小于健康组,且差异有统计学意义(p<0.001),鼠尾草酚组和双甲基氘代鼠尾草酚组附睾脂肪质量明显大于c26肿瘤模型组,且差异有统计学意义(p<0.01)。附图82是小鼠附睾脂肪组织蛋白质免疫印记实验结果。结果显示c26肿瘤激活了小鼠附睾脂肪中p-p65的表达,而鼠尾草酚能降低p-p65的表达;c26肿瘤激活小鼠附睾脂肪中hsl(激素敏感性酯酶)的磷酸化,p-hsl表达量上调,参与脂解进程,在鼠尾草酚的作用下p-hsl几乎无激活;c26肿瘤激活小鼠附睾脂肪中ampkα(amp依赖的蛋白激酶α亚型)的磷酸化,p-ampkα表达量上调,能量代谢加剧,鼠尾草酚使p-ampkα的表达量显著减少。但是同样鼠尾草酚对p-p38的激活无缓解作用。附图89是小鼠血清甘油含量检测。结果显示c26肿瘤模型组小鼠血清游离甘油含量显著高于健康组,且差异有统计学意义(p<0.001),鼠尾草酚组血清游离甘油含量明显低于c26肿瘤模型组,且差异有统计学意义(p<0.01)。附图90是小鼠血清甘油三酯含量检测。结果显示c26肿瘤模型组小鼠血清游离甘油三酯含量显著低于健康组,且差异有统计学意义(p<0.01),鼠尾草酚组血清游离甘油三酯含量明显高于c26肿瘤模型组,且差异有统计学意义(p<0.05)。附图91是小鼠血清炎症因子tnf-α含量检测。结果显示c26肿瘤模型组小鼠血清tnf-α含量显著高于健康组,且差异有统计学意义(p<0.05),鼠尾草酚组tnf-α含量明显低于c26肿瘤模型组,且差异有统计学意义(p<0.05)。附图92是小鼠血清炎症因子il-6含量检测。结果显示c26肿瘤模型组小鼠血清il-6含量显著高于健康组,且差异有统计学意义(p<0.01),鼠尾草酚组il-6含量与c26肿瘤模型组无显著性差异。以上结果说明,鼠尾草酚和双甲基氘代鼠尾草酚能在不影响肿瘤大小的情况下缓解肿瘤恶病质导致的体重下降、肌肉萎缩、脂肪降解和体温下降,并改善食欲。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1