苦瓜外泌体的提取方法及其在制备抗肿瘤药物中的应用与流程
本发明涉及医药领域,具体涉及一种苦瓜外泌体的提取方法及其在制备抗肿瘤药物中的应用。
背景技术:
临床应用的抗肿瘤药物有化疗药物、生物制剂等,但是这些药物在杀伤肿瘤细胞的同时,对正常细胞有很强的杀伤作用。近年来,随着分子肿瘤学、分子药理学的发展,抗肿瘤药正从传统的非选择性单一的细胞毒性药物转向多环节作用的新型药物,抗肿瘤药物的研究与开发已进入一个崭新的时代。
外泌体是由特定的蛋白质、脂质和核酸物质组成,携带多种mirna,能够与靶细胞膜表面的特定受体结合,调控多种信号通路,调节各种生理和病理过程。能否从苦瓜中提取外泌体,并用于抗肿瘤治疗中,未见报道。
技术实现要素:
本发明的目的之一是提供一种苦瓜外泌体的提取方法,能够从植物苦瓜中提取外泌体。
本发明的目的之二是提供上述方法提取的苦瓜外泌体在制备治疗抗肿瘤药物中的应用。
为实现上述目的,本发明采用的技术方案如下:一种苦瓜外泌体的提取方法,包括以下步骤:
(1)取适量新鲜云南山野苦瓜,去籽洗净后晾干;
(2)晾干后榨取苦瓜汁,将苦瓜汁连续离心,于4℃,1000g,10min;3000g,20min;10000g,40min;离心后取上清,弃沉淀;
(3)将取得的上清超速离心,于超速冷冻离心机中4℃,150000g,离心90min,离心后弃上清,取沉淀,沉淀悬浮于1-2ml的pbs缓冲液中;
(4)将悬浮液用0.22μm的滤膜过滤,滤液再次于超速冷冻离心机中4℃,150000g,离心90min,离心后弃上清,取沉淀,沉淀悬浮于1-2ml的pbs缓冲液中。
本发明还提供上述方法提取的苦瓜外泌体在制备抗肿瘤药物中的应用。
本发明还提供上述方法提取的苦瓜外泌体在制备肿瘤细胞增殖抑制剂中的应用。其中,所述肿瘤细胞为t98g胶质瘤细胞或hepg2肝癌细胞。
将苦瓜外泌体与人胶质瘤细胞(t98g)、正常神经细胞(ht22)、人肝癌细胞(hepg2)、正常肝细胞(qsg7701)共培养,通过细胞计数试剂盒(cck-8)实验发现,在0.3-3μg/ml浓度范围内,苦瓜外泌体能明显抑制肿瘤细胞t98g、hepg2的增殖,而对正常细胞ht22、qsg7701没有抑制作用。
在苦瓜外泌体浓度为3μg/ml的条件下,通过细胞克隆形成实验、细胞迁移实验(transwell小室)证实苦瓜外泌体可以抑制t98g系的胶质瘤细胞和hepg2人肝癌细胞的增殖和迁移浸润;通过蛋白质免疫印迹实验bcl-2/bax的比值降低,证明外泌体能够促进肿瘤细胞的凋亡。
与现有技术相比,本发明具有如下有益效果:
1.本发明提供的苦瓜外泌体提取方法能够从植物苦瓜中提取得到外泌体,方便有效,提取纯度高;
2.本发明提取的苦瓜外泌体能够抑制肿瘤细胞的增殖和迁移浸润,同时能够促进肿瘤细胞的凋亡,达到有效治疗肿瘤疾病的效果,从而实现在制备抗肿瘤的药物中的用途。
附图说明
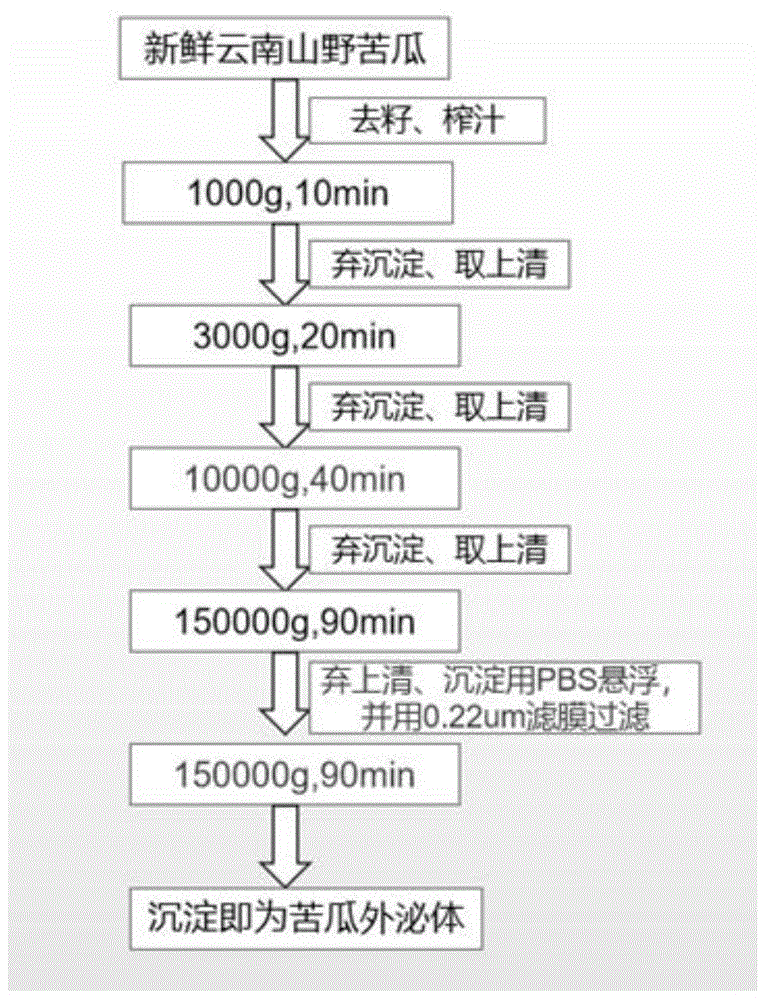
图1为本发明实施例1的苦瓜外泌体提取流程图;
图2为本发明实施例1提取的苦瓜外泌体的透射电镜图;
图3为本发明实施例1提取的苦瓜外泌体的粒径分布图;
图4为本发明实施例1提取的苦瓜外泌体的标志蛋白条带图;
图5为本发明实施例2的肿瘤细胞t98g、hepg2和正常细胞ht22、qsg7701的活性检测cck8实验;
图6为本发明实施例2的t98g胶质瘤细胞克隆形成实验:a图中ctrl代表空白对照组,exosome代表苦瓜外泌体组,b图是形成细胞克隆的数量统计图;
图7为本发明实施例2的hepg2肝癌细胞克隆形成实验:a图中ctrl代表空白对照组,exosome代表苦瓜外泌体组,b图是形成细胞克隆的数量统计图;
图8为本发明实施例2的t98g胶质瘤细胞的细胞迁移浸润实验(transwell小室):a图中ctrl代表空白对照组,exosome代表苦瓜外泌体组,b图是迁移浸润细胞数量统计图;
图9为本发明实施例2的hepg2肝癌细胞的细胞迁移浸润实验(transwell小室):a图中ctrl代表空白对照组,exosome代表苦瓜外泌体组,b图是迁移浸润细胞数量统计图;
图10为本发明实施例2的t98g胶质瘤细胞蛋白质印迹法检测:a图是蛋白质印迹检测结果图,b图是bcl-2/bax比值的统计图;
图11为本发明实施例2的hepg2肝癌细胞蛋白质印迹法检测:c图是蛋白质印迹检测结果图,d图是bcl-2/bax比值的统计图。
具体实施方式
下面结合附图和具体实施例对本发明作进一步详细说明。
实施例1:苦瓜外泌体的提取方法
参见附图1所示的提取流程,取新鲜云南山野苦瓜500g,去籽洗三次,每次1-3min,洗完晾干;
晾干后用鲜榨原汁机榨取苦瓜汁,约200ml,将苦瓜汁连续离心,于4℃,1000g,10min;3000g,20min;10000g,40min;离心后取上清,弃沉淀;
将取得的上清超速离心,于超速冷冻离心机中4℃,150000g,离心90min,离心后弃上清,取沉淀,沉淀悬浮于1-2ml的pbs缓冲液中;
将悬浮液用0.22um的滤膜过滤,滤液再次于超速离心机中4℃,150000g,离心90min,离心后取沉淀,弃上清,沉淀悬浮于1-2ml的pbs缓冲液中。
将提取的苦瓜外泌体置于透射电镜下观察形态,步骤如下:将新鲜低温超速离心所得的苦瓜外泌体溶液滴在封口膜洁净面;将铜网膜面放在苦瓜外泌体液滴上,悬浮10分钟,用滤纸缓慢吸干;转移铜网至3%戊二醛液滴上,悬浮5分钟,用滤纸吸干;转移铜网至dw液滴上,10次,每次2分钟,每次均用滤纸吸干;转移铜网至4%醋酸双氧铀液滴上,10分钟,用滤纸吸干;自然晾干后(30分钟),tem观察记录。结果如图2所示,本实施例提取的外泌体在电镜视野中大多是120nm左右的具有清晰膜的茶托样膜泡结构。
测量提取的苦瓜外泌体的粒径,将外泌体与磷酸盐缓冲液1:10稀释混匀,加500微升至专用的比色皿中进行检测,结果如图3所示,外泌体大小主要集中在120nm左右,属于外泌体的大小(30-200nm)范围。
用免疫印迹法测定外泌体的三种标志蛋白cd54、cd63、tsg101,外泌体标志蛋白条带清晰可见(如图4所示)。
实施例2:苦瓜外泌体在制备抗肿瘤药物中的应用
(1)实验材料和药品
1实验药品:dmem培养基,小牛血清,0.25%胰蛋白酶,磷酸盐缓冲液,苦瓜外泌体,结晶紫,4%多聚甲醛,蛋白印迹试剂盒,电子显微镜观察外泌体试剂盒,cck-8试剂盒。
2实验仪器和材料:二氧化碳培养箱,倒置显微镜,超净台,电子显微镜,培养皿,巴氏吸管,离心管,牛鲍计数板,加样枪,一次性枪头,6孔板,酒精灯,培养细胞(ht22海马神经元细胞、t98g人胶质瘤细胞、7701人肝细胞、hepg2人肝癌细胞,均购自于中国科学院上海细胞库)。
(2)实验步骤
1、细胞胰酶消化
1.1入无菌室之前用肥皂洗手,用75%酒精擦拭消毒双手。
1.2倒置显微镜下观察细胞形态,确定细胞状态是否良好。将实验所需培养基置37℃下预热。
1.3手在进入超净台前消毒;用75%酒精溶液擦净超净台台面。
1.4打开超净台的紫外灯照射台面30分钟左右,打开抽风机,关闭超净台的紫外灯,清洁空气,除去臭氧。
1.5点燃酒精灯;所有东西在进入超净台前用75%酒精消毒。
1.6将培养基瓶口用75%酒精消毒,过酒精灯火焰后斜置于酒精灯旁的架子上。
1.7倒掉培养细胞的旧培养基。用适量的磷酸盐缓冲液液清洗培养皿,以除去残留的旧培养基。
1.8每个大培养皿加入1毫升胰酶,小皿用量酌减,使皿底细胞都浸入到酶溶液中。肉眼观察,当见到皿底有细胞滑落,酶溶液变浑浊时终止消化。一般室温消化时间约为1-3分钟。
1.9加入少量的含血清的新鲜培养基终止反应,反复吹打消化好的细胞使其脱壁并分散,用巴氏吸管转移至离心管中,1000转/秒离心5分钟后弃上清液。加入2毫升的新鲜培养基,吹打均匀后用巴氏吸管转移部分至0.5毫升的塑料离心管中。
2、牛鲍计数板计数
2.1用70%的乙醇清洗计数板表面。
2.2清洗盖玻片,在边缘稍微沾些水,然后将盖玻片压到计数板的凹槽和半银的计数区域上。
2.3充分混合细胞样品,用力吹打以分散所有的细胞团块,然后用移液器枪头吸取20微升的样品。
2.4立即将细胞悬液移到血细胞计数板小室的边缘,挤出细胞悬液,利用毛细作用使之充满计数板和盖玻片的空隙。小室内的液体既不能多,也不能少;以液体刚好流到计数板凹槽的边缘为准,否则由于表面张力的改变,小室的容积将发生改变。
2.5按照上面的操作,将计数板的另一个小室用细胞悬液充满。
2.6洇干多余的液体,把计数板放在显微镜载物台上。
2.7选择一个10x物镜,利用网格线对焦。如果由于对比弱而使聚焦困难,可以调节可变光阑,减少进入的光线,或者通过偏置聚光器而使光线略微倾斜。
2.8移动计数板,使镜下的视野恰好是整个网络区域中心的一个大方格,而且是你所能看到的以3条平行线为界的最大范围。由于目镜的原因,大方格的四个角有可能略微位于视野之外。
2.9利用更细的划分区域(同样3条平行线分界)和单线网格线来计算这1平方毫米范围内的细胞数。为了避免重复计算,压线的细胞只计算左线和上线者,右线和下线不计算在内。
2.10将第二个小室移入视野内进行第二次计数。
3、细胞计数cck8细胞活性检测
3.1细胞接种及处理
3.1.1配置细胞悬液,细胞浓度为10×104/ml;
3.1.2将配置好的细胞悬液加入苦瓜外泌体,使苦瓜外泌体的浓度为3ng/μl;
3.1.3在96孔板中每孔加入100μl的细胞悬液(每个浓度做5个复孔),将没有加细胞悬液的其他孔用去离子水填充,将培养板在培养箱培养48小时(37℃,5%co2)。
3.2cck8活性
3.2.1向每孔加入10μlcck8溶液。
3.2.2将培养板在培养箱内孵育1-4小时。
3.2.3用酶标仪测定在450nm处的吸光度。
3.3结果处理:用graphpadprism7软件制作od值曲线。
3.4重复实验:独立重复3次实验。
4、肿瘤细胞克隆形成实验
4.1根据计数的细胞浓度换算成每个培养皿中500个细胞的体积,分别加入此体积的细胞悬浮液至6孔板中(每种细胞2个孔),每个培养皿中加入培养基至1毫升。
4.2每种细胞的第一个孔作为对照孔,其余一个孔按照3μg/ml的外泌体与培养基比例加入苦瓜外泌体。
4.3盖上皿盖,将培养皿放回二氧化碳培养箱,连续培养7到14天,至细胞约50倍增殖。
4.4倒掉培养基,用枪吸走残余培养基,用磷酸盐缓存液洗3次。
4.5每孔加入4%的多聚甲醛固定10分钟。倒掉甲醇,用枪吸走残余甲醇,再用磷酸盐缓冲液洗3次。
4.6每孔加入结晶紫(至铺满孔底即可),染10到15分钟。
4.7丢弃染液。
5、细胞迁移(transwell小室)实验
5.1接种细胞
5.1.1细胞悬液200μl加入transwell小室。
5.1.224孔板下室一般加入500μl含15%fbs的培养基,特别注意的是,下层培养液和小室间常会有气泡产生,一旦产生气泡,下层培养液的趋化作用就减弱甚至消失。在种板的时候要特别留心,一旦出现气泡,要将小室提起,去除气泡,再将小室放进培养板。
5.2培养细胞:常规培养12-48h(主要依癌细胞侵袭能力而定)。24h较常见,时间点的选择除了要考虑到细胞侵袭力外,处理因素对细胞数目的影响也不可忽视。
5.3固定染色:取出transwell小室,弃去孔中培养液,用无钙的pbs洗2遍,用棉签轻轻擦掉上层未迁移细胞,甲醇或者甲醛固定30分钟,将小室适当风干。用0.1%结晶紫染色30-60min,用pbs洗3遍。用棉签轻轻擦掉上室水分。
6、蛋白质印迹
6.1电泳
6.1.1sds-page凝胶配制:参考试剂的说明书配制sds-page凝胶(分离胶及浓缩胶)。
6.2样品处理:在收集的蛋白样品中加入适量浓缩的sds-page蛋白上样缓冲液,100℃水浴加热5分钟,以充分变性蛋白。
6.3上样与电泳
6.3.1冷却到室温后,把蛋白样品直接上样到sds-page胶加样孔内。
6.3.2电泳时通常推荐在上层胶时使用低电压恒压电泳,而在溴酚蓝进入下层胶时使用高电压恒压电泳。低电压可以设置在80-100v,高电压可以设置在120v左右。
6.3.3根据预染蛋白质分子量标准的电泳情况,预计目的蛋白已经被适当分离后即可停止电泳。
6.4转膜:实验中选用pvdf膜,设定转膜电流为300ma,转膜时间为30-60分钟。目的蛋白的分子量越大,需要的转膜时间越长,目的蛋白的分子量越小,需要的转膜时间越短。
6.5封闭
6.5.1转膜完毕后,立即把蛋白膜放置到预先准备好的洗涤液中,漂洗1-2分钟,以洗去膜上的转膜液。从转膜完毕后所有的步骤,一定要注意膜的保湿,避免膜的干燥,否则极易产生较高的背景。
6.5.2加入封闭液,在摇床上缓慢摇动,室温封闭120分钟。
6.6一抗孵育
6.6.1参考一抗的说明书(cd54、cd63、tsg101三个外泌体标志蛋白),按照适当比例用一抗稀释液稀释一抗
6.6.2立即加入稀释好的一抗,4℃孵育过夜。
6.6.3回收一抗。加入洗涤液,在侧摆摇床上缓慢摇动洗涤5-10分钟。吸尽洗涤液后,再加入洗涤液,洗涤5-10分钟。共洗涤3次。如果结果背景较高可以适当延长洗涤时间并增加洗涤次数。
6.7二抗孵育
6.7.1参考二抗的说明书,按照适当比例用二抗稀释液稀释辣根过氧化物酶(hrp)标记的二抗。
6.7.2立即加入稀释好的二抗,室温或4℃在侧摆摇床上缓慢摇动孵育一小时。
6.7.3回收二抗。加入洗涤液,在侧摆摇床上缓慢摇动洗涤5-10分钟。吸尽洗涤液后,再加入洗涤液,洗涤5-10分钟。共洗涤3次。如果结果背景较高可以适当延长洗涤时间并增加洗涤次数。
6.8蛋白检测。bio-rad伯乐chemidocmp化学发光凝胶成像系统/全能型成像仪westernblot成像。
(3)实验结果
cck8实验结果如图5所示。苦瓜外泌体浓度达到3μg/ml的条件下,正常细胞(ht22、qsg7701)活性没有降低,而肿瘤细胞(t98g、hepg2)的活性明显降低,表明苦瓜外泌体浓度在3μg/ml的条件下可以降低肿瘤细胞的活性。
克隆形成实验结果如图6、图7所示。苦瓜外泌体浓度在3μg/ml的条件下,图6的t98g胶质瘤细胞和图7的hepg2肝癌细胞的克隆形成数都明显减少,揭示苦瓜外泌体可以抑制肿瘤细胞的增殖。
细胞迁移浸润实验结果如图8、图9所示。苦瓜外泌体浓度在3μg/ml的条件下,图8的t98g胶质瘤细胞和图9的hepg2肝癌细胞的细胞迁移浸润数量都明显减少,揭示苦瓜外泌体可以抑制肿瘤细胞的迁移浸润。
蛋白质印迹实验结果如图10、图11所示。苦瓜外泌体浓度在3μg/ml的条件下,t98g胶质瘤细胞和hepg2肝癌细胞的bcl-2/bax的比值降低,bcl-2/bax比值决定着细胞凋亡的走向,bcl-2/bax比值上调,抑制细胞凋亡;bcl-2/bax比值下调,促进细胞凋亡,bcl-2/bax的比值降低提示苦瓜外泌体可以诱导肿瘤细胞凋亡。
- 还没有人留言评论。精彩留言会获得点赞!