一种基于苯并噻唑联杂环的半花菁类化合物及其制备方法与应用与流程
本发明涉及一种基于苯并噻唑联杂环的半花菁类化合物及其制备方法与应用,属于小分子荧光材料领域。
背景技术:
核酸含有生命所必需的遗传信息,是体内最重要的生物大分子之一。核酸在生理条件下能够形成许多空间二级结构以帮助增加分子稳定性和发挥相应生物学功能,这些二级结构包括单链发夹结构、同型双链、三链体和四链体结构。dna通常通过watson-crick碱基对之间的氢键相互作用以b型双螺旋结构存在;在基因启动子区常含有富含鸟嘌呤g的寡核苷酸片段,这类寡核苷酸片段可折叠形成四链体结构,又称为g-四链体。不同于dna双链的watson-crick碱基对氢键相互作用,g-四链体通过碱基鸟嘌呤之间的hoogsteen氢键形成一个大的共轭平面。根据形成g-四链体的富g寡聚核苷酸链的数目,g-四链体可分为分子内(1条核酸链)g-四链体和分子间(2条或多条核酸链)g-四链体。根据dna主链的走向可将g-四链体分为三种结构:平行(parallel)、反平行(antiparallel)和混合平行(mixedparallel)。dna通过这些二级结构精确调控其不同生理状态下的生物学功能,如g-四链体dna不仅具有独特的结构,而且还有着丰富的生物学功能。富含g的序列通常位于基因组许多重要的生物学功能区域(疾病基因启动子区、疾病基因表达区、免疫球蛋白转换区、端粒区等),如c-myc、kras、ret、bcl-2和vegf等,现已成为重要的基因调控区域和癌症诊疗研究的新型靶点。对不同核酸二级结构的分析和检测不仅有助于核酸二级结构在细胞周期中的动态监控,也有助于对核酸特殊二级结构的变化-功能关系等的研究。
荧光响应探针技术具有设备简单、操作方便、分析速度快,灵敏度高、表征参数多以及宽的动态响应线性范围等诸多优点。近年来,靶向核酸不同二级结构的新型有机荧光探针已有报道,但探针数量远远不够,无法满足科研工作者的研究需要,常见的双链核酸荧光探针有eb、yoyo、sybr、dapi及hoechst染料等,但它们有的具有强的致癌性,有的则合成过程复杂,价格昂贵,因此发展低毒、低成本、合成简单的核酸荧光染料意义重大。半花菁结构染料是花菁染料家族的一个主要成员。半花菁类化合物具有donor-π-acceptor(d-π-a)的结构,包含一个带正电荷的氮杂环作为电子受体,和一个末端结构为羟基、烷氧基或氨基的基团作为电子供体,两者通过一个共轭次甲基桥相连。半花菁类化合物具有广泛的生物活性,如抗癌、消炎等,是一类很重要的药物中间体,在医学和药学领域被广泛应用。其平面芳香结构以及具有的正电荷可使探针分子与核酸碱基发生π-π堆积和静电相互作用,易于嵌插入核酸沟槽中或者堆积核酸表面;具有一定柔性的次甲基桥有助于探针分子构象扭转,使共轭链两侧芳香环嵌插核酸沟槽区,具有重要研究意义和价值。
技术实现要素:
本发明的目的是提供一种基于苯并噻唑联杂环的半花菁类化合物及其制备方法与应用,本发明制备步骤简单易行、原料廉价易得;化合物结构稳定,能对不同二级结构的核酸具有选择性荧光增强,用于特异性检测核酸的g-四链体和双螺旋的二级结构。
本发明提供的一种化合物,其结构式如式i所示:
式i中,ra为结构式如式i-1、i-2、i-3、i-4、i-5所示的基团;
x为卤素;rb为含有碳原子数为1~5的烷基链。
本发明中,式i-1、i-2、i-3、i-4、i-5所示的基团中
上述的化合物中,所述卤素选自溴、氟、氯中的一种;
rb为甲基。
本发明中,上述的式i所示化合物为基于苯并噻唑联杂环的半花菁类化合物。
本发明中,所述式ⅰ所示化合物具体为式a至式e所示化合物中任意一种:
本发明还提供了上述的式i所示化合物的制备方法,包括如下步骤:
1)将式ⅱ所示的苯并噻唑类化合物与卤代烷rbx进行烷基化反应,得到如式ⅲ所示化合物;
式ⅱ、式ⅲ中,rb为含有碳原子数为1~5的烷基链;x为卤素;
2)将式ⅲ所示化合物分别与式ⅳ、式ⅴ、式ⅸ、式ⅶ、式ⅷ所示化合物进行knoevenagel缩合反应,即得到如式i所示的化合物;
上述的方法步骤1)中,所述烷基化反应在乙腈、甲醇、乙醇、甲醚、乙醚、异丙醇和丁醇中的至少一种中进行;
所述烷基化反应的条件如下:温度可为78~85℃,加热回流,时间可为8~18h,具体可为12h、8~12h、12~18h或10~15h;
所述烷基化反应结束后还包括浓缩除去溶剂的步骤。
上述的方法步骤2)中,所述knoevenagel缩合反应在乙腈、甲醇、乙醇和丁醇中的至少一种中进行;
所述knoevenagel缩合反应的条件如下:温度可为78~85℃,加热回流,时间可为6~18h,具体可为12h、6~12h、12~18h或10~15h;
步骤2)中还包括在所述knoevenagel缩合反应步骤之后,将反应体系干燥和纯化的步骤。
上述的方法中,所述纯化具体可为柱层析分离和高效液相色谱纯化;所述柱层析分离采用的洗脱液为体积比30:1的二氯甲烷:甲醇;
所述高效液相色谱纯化的条件具体可为色谱柱为promisil-c18柱,250mm×4.6mm,20μm;流动相为甲醇-水;梯度洗脱,洗脱程序:0~25min、甲醇30%~95%,25~30min、甲醇95%;检测波长分别为482nm、484nm、492nm、561nm;柱温为25℃;体积流量为1.0ml·min-1;进样量为100μl。
上述的方法中,所述式ⅱ所示的苯并噻唑类化合物与所述rbx的摩尔比可为1:0.5~10,具体可为1:2、1:0.5~2、1:2~10、1:1~5或1:0.75~8.5;
所述式ⅲ所示化合物与所述式ⅳ、式ⅴ、式ⅸ、式ⅶ或式ⅷ所示化合物的摩尔比可为1:0.2~2,具体可为1.5:1、1:0.2~1.5、1:1.5~2、1:1~1.75或1:0.5~1.5。
本发明还提供了一种试剂盒,包括上述的式i所示化合物和和溶剂组成;
所述式ⅰ所示化合物在所述溶剂中的浓度可为0.1~100mm,具体可为20mm、0.1~20mm、20~100mm、10~50mm或10~75mm。
上述试剂盒中,所述溶剂具体为pbs缓冲液、hepes缓冲液、细胞培养基或二甲基亚砜;
所述细胞培养基具体为rpmi-1640和dmem。
本发明进一步提供了所述的式i所示化合物或所述试剂盒在如下a)-b)中的应用:
a)在溶液中识别核酸结构;
b)在活细胞和/或固定细胞中荧光成像。
上述的应用中,所述核酸结构包括g-四链体结构和/或核酸双链结构;
所述活细胞为癌细胞,所述活细胞具体为人宫颈癌细胞(即hela细胞);
所述固定细胞为采用甲醛、多聚甲醛、戊二醛、甲醇、乙醇和丙酮中的至少一种固定剂所固定的癌细胞,所述固定细胞均为死细胞,所述固定细胞具体为人宫颈癌细胞、人前列腺癌细胞(又称pc3细胞)和卵巢癌耐药细胞(又称a2780t细胞)等多种癌细胞。
上述的应用中,所述核酸结构的核苷酸序列如seqidno.1-20中的任一种所示。
上述的应用中,所述式a识别核酸双链结构,具体可为seqidno.1-33、seqidno.13、seqidno.14-20;
所述式b识别核酸双链结构,具体可为seqidno.1-3、seqidno.13-20;
所述式e识别核酸双链结构,具体可为seqidno.1-3、seqidno.13-20;
所述式c识别平行g-四链体结构,具体可为seqidno.5-10;
所述式d识别平行g-四链体结构,具体可为seqidno.5-10。
本发明具有以下优点:
1)本发明所提供的苯并噻唑联杂环的半花菁类化合物可以特异性的结合平行g-四链体结构和双链结构,实现了与核酸结构的区别,利用紫外/可见吸收光谱和荧光光谱即可区别核酸结构,检测简单、快捷,成本低廉。
2)本发明所提供的苯并噻唑联杂环的半花菁类化合物可以特异性定位活细胞中线粒体或溶酶体,固定细胞中定位于细胞核或者核仁,适合活细胞或者固定细胞的荧光成像。
3)本发明所提供的苯并噻唑联杂环的半花菁类化合物,步骤少,容易合成,价格低廉并且十分稳定,便于储存,量子产率较高,细胞毒性低,易于推广。
附图说明
图1为本发明实施例1式a所述荧光探针采用的合成线路图。
图2为本发明实施例1式a所述荧光探针在dmso中的核磁共振谱图(氢谱)。
图3为本发明实施例1式a所述荧光探针在dmso中的核磁共振谱图(碳谱)。
图4为本发明实施例1式a所述荧光探针在不同溶剂中的紫外吸收光谱图,图4中1-13的溶剂分别为1.乙酸乙酯、2.二氯甲烷、3.n,n’-二甲基甲酰胺、4.二甲基亚砜、5.甲醇、6.乙醇、7.乙腈、8.水、9.生理盐水pbs、10.聚乙二醇辛基苯基醚水溶液、11.十二烷基磺酸钠水溶液、12.十二烷基苯磺酸钠水溶液、13.十六烷基三甲基溴化铵水溶液。
图5为本发明实施例1式a所述荧光探针在不同溶剂中的荧光发射光谱图,所用激发光为561nm;图5中1-13的溶剂分别为1.生理盐水pbs、2.水、3.十六烷基三甲基溴化铵水溶液、4.聚乙二醇辛基苯基醚水溶液、5.十二烷基磺酸钠水溶液、6.十二烷基苯磺酸钠水溶液、7.二氯甲烷、8.n,n’-二甲基甲酰胺、9.二甲基亚砜、10.乙酸乙酯、11.乙醇、12.甲醇、13.乙腈。
图6为本发明实施例1式a所述荧光探针在pbs溶液中滴定不同dna(包括单链、双链)的荧光发射光谱图,其中单链dna为:seqidno.1和seqidno.2,双链dna为:seqidno.1和seqidno.2反向互补形成,式a所述荧光探针:dna=1:1.5(当量),所用激发光为540nm。
图7为本发明实施例1式a所述荧光探针在pbs溶液中滴定具有不同腺嘌呤含量的双链dna的荧光发射光谱图,其中使用的双链dna的腺嘌呤含量以at%=52.94%、70.59%、88.24%、100%的方式依次增加(具体由seqidno.13与seqidno.14、seqidno.15与seqidno.16、seqidno.17与seqidno.18、seqidno.19与seqidno.20分别两两反向互补形成),式a所述荧光探针:双链dna=1:1.5(当量),所用激发光为540nm。
图8为本发明实施例1式a所述荧光探针对单链dna和双链dna进行凝胶电泳检测的成像图。
图9为本发明实施例1式a所述荧光探针与市售线粒体染色探针mito-green在hela细胞内共孵育后的共聚焦荧光成像照片以及共定位情况分析,其中式a所述荧光探针所用激发光为561nm,接收600-700nm范围的荧光,线粒体染色探针所用激发光为488nm,接收500-600nm范围的荧光。
图10为本发明实施例1式a所述荧光探针对hela细胞的毒性实验。
图11为本发明实施例2式b所述荧光探针在pbs溶液中滴定不同结构类型的dna的荧光发射光谱图,其中单链dna为:seqidno.1,双链dna为:seqidno.1和seqidno.2反向互补形成,i-motifdna为:seqidno.4,平行g-四链体为:seqidno.7,反平行g-四链体为:seqidno.11,混合平行g-四链体为:seqidno.12,式b所述荧光探针:dna=1:1.5(当量),所用激发光为492nm。
图12为本发明实施例2式b所述荧光探针在pbs溶液中滴定具有不同腺嘌呤含量的双链dna的荧光发射光谱图,其中使用的双链dna的腺嘌呤含量以at%=52.94%、70.59%、88.24%、100%的方式依次增加(具体由seqidno.13与seqidno.14、seqidno.15与seqidno.16、seqidno.17与seqidno.18、seqidno.19与seqidno.20分别两两反向互补形成),式b所述荧光探针:dna=1:1.5(当量),所用激发光为492nm。
图13为本发明实施例2式b所述荧光探针与市售溶酶体染色探针ltr-red在hela细胞内共孵育后的共聚焦荧光成像照片以及共定位情况分析,式b所述荧光探针所用激发光为488nm,接收500-600nm范围的荧光。溶酶体染色探针所用激发光为561nm,接收600-700nm范围的荧光。
图14为本发明实施例3式c所述荧光探针在不同溶剂中的紫外吸收光谱图;其中图14中1-13的溶剂分别为1.十二烷基磺酸钠水溶液、2.十二烷基苯磺酸钠水溶液、3.十六烷基三甲基溴化铵水溶液、4.聚乙二醇辛基苯基醚水溶液、5.水、6.生理盐水pbs、7.二甲基亚砜、8.乙腈、9.乙醇、10.甲醇、11.乙酸乙酯、12.二氯甲烷、13.n,n’-二甲基甲酰胺。
图15为本发明实施例3式c所述荧光探针在不同溶剂中的荧光发射光谱图。所用激发光为484nm;其中图15中1-13的溶剂分别为1.十二烷基磺酸钠水溶液、2.十二烷基苯磺酸钠水溶液、3.十六烷基三甲基溴化铵水溶液、4.聚乙二醇辛基苯基醚水溶液、5.水、6.生理盐水pbs、7.二甲基亚砜、8.乙腈、9.乙醇、10.甲醇、11.乙酸乙酯、12.二氯甲烷、13.n,n’-二甲基甲酰胺。
图16为本发明实施例3式c所述荧光探针在pbs溶液中滴定不同g-四链体及i-motif-dna的荧光发射光谱图,其中i-motifdna为seqidno.4,平行g-四链体为seqidno.7,反平行g-四链体为seqidno.11,混合平行g-四链体为seqidno.12,式c所述荧光探针:g-四链体=1:1.3(当量)。所用激发光为484nm。
图17为本发明实施例3式c所述荧光探针在pbs溶液中滴定不同平行g-四链体的荧光光谱,其中平行g-四链体为seqidno.6、seqidno.7、seqidno.8、seqidno.9、seqidno.10,式c所述荧光探针:g-四链体=1:1.3(当量),所用激发光为484nm。
图18为本发明实施例3式c所述荧光探针与市售溶酶体染色探针ltr-red和市售线粒体染色探针mitotrackertmdeepred在hela细胞内共孵育后的共聚焦荧光成像照片以及共定位情况分析,其中图(a)为荧光探针c与溶酶体染色探针ltr-red在活细胞中的荧光照片;图(b)为荧光探针c线粒体染色探针mito-deepred在活细胞中的荧光照片,式c所述荧光探针所用激发光为488nm,接收500-600nm范围的荧光,溶酶体染色探针所用激发光为561nm,接收600-700nm范围的荧光,线粒体染色探针所用激发光为640nm,接收660-750nm范围的荧光。
图19为本发明实施例4式d所述荧光探针在pbs溶液中滴定不同结构类型的dna的荧光发射光谱图,其中单链dna为:seqidno.1,双链dna为:seqidno.1和seqidno.2反向互补形成,i-motifdna为:seqidno.4,平行g-四链体为seqidno.7,反平行g-四链体为seqidno.11,混合平行g-四链体为seqidno.12,式d所述荧光探针:dna=1:1.3(当量),所用激发光为482nm。
图20为本发明实施例4式d所述荧光探针在pbs溶液中滴定不同平行g-四链体的荧光光谱,其中平行g-四链体为:seqidno.5、seqidno.7、seqidno.8、seqidno.9、seqidno.10,式d所述荧光探针:dna=1:1.3(当量),所用激发光为482nm。
图21为本发明实施例4式d所述荧光探针与市售溶酶体染色探针、细胞核染色探针在hela细胞活细胞和固定细胞中共孵育后的共聚焦荧光成像照片以及共定位情况分析,其中图(a)为荧光探针d与溶酶体染色探针ltr-red在活细胞中的荧光照片,图(b)为荧光探针d与核酸染料探针dapi在固定细胞中的荧光照片,其中荧光探针d所用激发光为488nm,接收500-600nm范围的荧光。溶酶体染色探针ltr-red所用激发光为561nm,接收600-700nm范围的荧光。核酸染色探针dapi所用激发光为405nm,接收430-500nm范围的荧光。
图22为本发明实施例5式e所述荧光探针在pbs溶液中滴定不同结构类型的dna的荧光发射光谱图,其中单链dna为:seqidno.1,双链dna为:seqidno.1和seqidno.2反向互补形成,i-motifdna为:seqidno.4,平行g-四链体为seqidno.7,反平行g-四链体为seqidno.11,混合平行g-四链体为seqidno.12。式e所述荧光探针:dna=1:1.5(当量),所用激发光为445nm。
图23为本发明实施例5式e所述荧光探针与市售溶酶体染色探针ltr-red在hela细胞内共孵育后的共聚焦荧光成像照片以及共定位情况分析,式e所述荧光探针所用激发光为445nm,接收470-600nm范围的荧光,溶酶体染色探针所用激发光为561nm,接收600-700nm范围的荧光。
具体实施方式
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
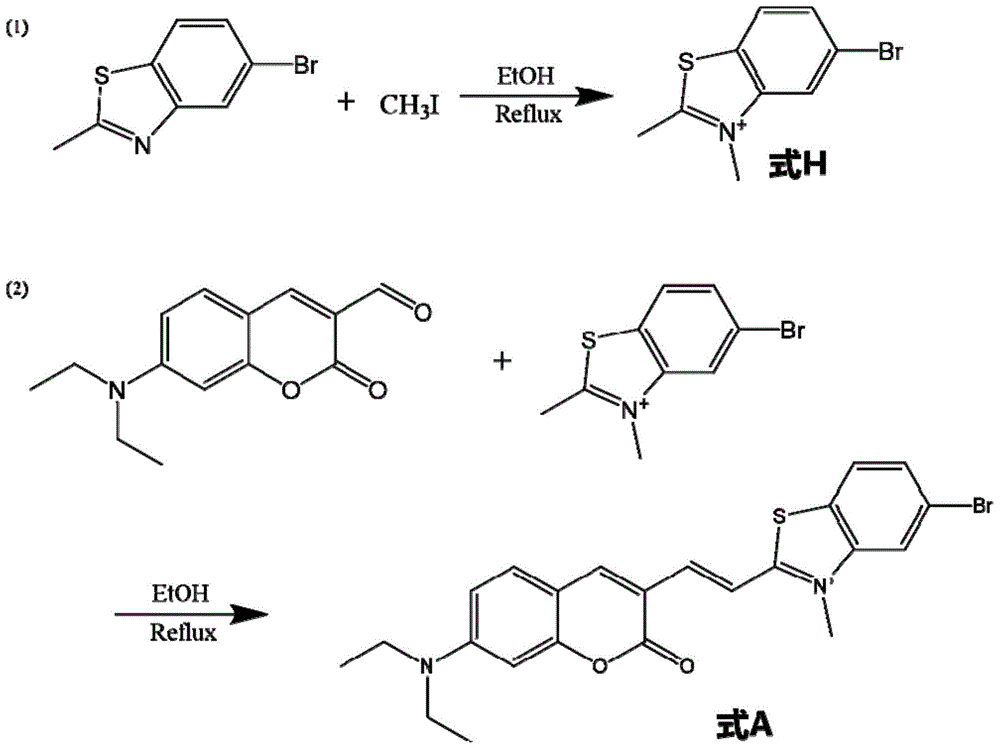
实施例1、式a所示化合物的制备及荧光探针特异性识别核酸双链结构
一、式a所述探针的合成
如图1所示,按照如下步骤合成:
1、将227mg(1.0mmol)的5-溴-2-甲基苯并噻唑加入到装有10ml乙醇的25ml的单颈圆底烧瓶中。在78-85℃预热5min后加入124.5μl(2.0mmol)碘甲烷,继续加热回流12h,溶液从淡黄色透明变成橙黄色时停止。冷至室温后减压蒸馏,即得到式h分子。
2、将36.3mg(0.15mmol)式h分子加入到装有2ml乙醇的10ml的单颈圆底烧瓶中。在78-85℃预热5min后加入24.5mg(0.1mmol)香豆素衍生物(下式ⅳ所示化合物),继续加热回流12h,溶液从浅黄色变成黑紫色后停止,冷至室温后减压蒸馏,得到式a粗产物。
将粗产物a溶于二氯甲烷中,并通过硅胶色谱法(ch2cl2/meoh,v/v,30:1)纯化,得到化合物为紫黑色固体式a分子(42mg,89.4%收率)。然后,通过高效液相色谱进一步纯化化合物。高效液相色谱分离纯化步骤为色谱柱为promisil-c18柱(250mm×4.6mm,20μm),流动相为甲醇-水,梯度洗脱,洗脱程序:0-25min,甲醇30%-95%;25-30min,甲醇95%;检测波长为561nm;柱温为25℃;体积流量为1.0ml·min-1;进样量为100μl,高效液相色谱仪(hplc)为spd-20a检测器和lc-20at双泵(岛津,日本)。
利用核磁共振谱(氢谱和碳谱,以式a分子为例,分别如图2和图3所示)验证数据如下:1hnmr(500mhz,dmso-d6)δ8.60(s,1h),8.56(s,1h),8.31(d,j=8.6hz,1h),8.03(s,2h),7.93(d,j=8.7hz,1h),7.59(d,j=9.2hz,1h),6.89(d,j=6.9hz,1h),6.70(s,1h),4.20(s,3h),3.59–3.52(m,4h),1.18(t,j=7.0hz,7h).13cnmr(151mhz,dmso-d6)δ173.29,159.96,157.76,153.94,149.16,145.61,143.70,132.41,131.25,130.11,127.23,126.19,122.80,119.77,112.39,111.48,109.48,96.98,69.76,65.96,63.11,14.41,12.92.ms(maldi-tof):exactmasscalcd.forc23h22brn2o2s+(m+)requires469.06m/z,found469.06(100.0%)m/z,471.06(97.3%)m/zm+。
二、式a所述探针在不同溶剂中的紫外-可见吸收光谱(图4)和荧光发射光谱图(图5)
将上述步骤制备得到的式a所述分子溶解于二甲基亚砜dmso中,配制得到浓度为20mm的母液。
将式a所述荧光分子母液溶解在不同溶剂里(甲醇、乙醇、乙腈、乙酸乙酯、生理盐水pbs、二氯甲烷、水、二甲基亚砜、n,n’-二甲基甲酰胺、十二烷基磺酸钠水溶液、十二烷基苯磺酸钠水溶液、十六烷基三甲基溴化铵水溶液、聚乙二醇辛基苯基醚(tritonx-100)水溶液),溶液终体积为500μl,终浓度为20μm,将探针溶液放置于石英皿中,在hitachiu-2550型紫外可见吸收光谱仪(日本京都)上测其在350nm和650nm之间的紫外-可见(uv-vis)吸收光谱,如图4所示,在不同有机溶剂中式a所述探针的最大吸收波长略有不同,在二氯甲烷、乙腈和乙酸乙酯中最大吸收波长为585nm,在甲醇、乙醇、二甲基亚砜、n,n-二甲基甲酰胺中最大吸收波长为562nm,而在水中最大吸收波长为540nm。
将式a所述荧光分子母液溶解在不同溶剂里(甲醇、乙醇、乙腈、乙酸乙酯、生理盐水pbs、二氯甲烷、水、二甲基亚砜、n,n’-二甲基甲酰胺、十二烷基磺酸钠水溶液、十二烷基苯磺酸钠水溶液、十六烷基三甲基溴化铵水溶液、聚乙二醇辛基苯基醚(tritonx-100)水溶液),溶液终体积为200μl,终浓度为3μm,将探针溶液放置于石英皿中,在hitachif-4600荧光光谱仪(日本京都)上用561nm的激发光测其在600-700nm的荧光发射光谱,如图5所示,式a所述荧光分子在不同溶剂中的荧光强度从强到弱排列为:二氯甲烷>十二烷基苯磺酸钠水溶液>十二烷基磺酸钠水溶液>聚乙二醇辛基苯基醚(tritonx-100)水溶液>二甲基亚砜>乙醇>甲醇=乙酸乙酯=乙腈>十六烷基三甲基溴化铵水溶液>n,n’-二甲基甲酰胺>水>生理盐水pbs。
三、式a所述探针滴定不同dna结构(包括单链dna、双链dna、具有不同腺嘌呤含量的双链dna等)的荧光发射光谱图(图6)和(图7)
将式a所述分子溶解于二甲基亚砜dmso中,配制得到浓度为20mm的母液。将dna溶解于生理盐水pbs中,配成浓度为100μm的母液。
将式a所述荧光分子母液溶解在生理盐水pbs里,分别加入单链dna(如seqidno.1或seqidno.2所示),双链dna(由seqidno.1与seqidno.2所示的两条单链dna反向互补形成),具有不同腺嘌呤含量的双链dna(at%=52.94%、70.59%、88.24%、100%,具体由seqidno.13与seqidno.14、seqidno.15与seqidno.16、seqidno.17与seqidno.18、seqidno.19与seqidno.20所示单链dna分别两两反向互补形成),溶液终体积为200μl,式a所述荧光分子终浓度为3μm,所用dna终浓度为4.5μm,将探针溶液放置于石英皿中,在hitachif-4600荧光光谱仪(日本京都)上用561nm的激发光测其在600-700nm的荧光发射光谱。如图6所示,式a分子仅对双链dna有荧光强度响应。如图7所示,随着双链dna的腺嘌呤含量的增加,式a分子的荧光增强越强。
四、式a所述探针对单链dna和双链dna进行凝胶电泳检测的荧光成像图(图8)
将式a所述分子溶解于二甲基亚砜dmso中,配制成20mm的母液。将dna溶解于生理盐水pbs中,配成浓度为100μm的母液。
将式a所述荧光分子母液溶解在生理盐水pbs里,单链dna(如seqidno.1或seqidno.2所示),双链dna(分子间双链dna:由seqidno.1与seqidno.2所示的两条单链dna反向互补后形成),混合型双链dna(既存在分子间双链又存在分子内双链):如seqidno.3所示),并加入3μl溴酚蓝溶液,溶液终体积为18μl,式a所述荧光分子终浓度为3μm,所用dna终浓度为4.5μm;制备3%琼脂糖水平凝胶,将准备好的试样依次滴入琼脂糖凝胶上样口,电压120v,电流50ma,电泳30min。如图8所示,单链dna组试样没有荧光显影,仅形成分子间双链dna组和混合型双链dna组的条带可清晰可辨。
五、式a所述探针与细胞亚显微结构探针的细胞共定位实验以及共定位情况分析(图9)
将式a所述探针用二甲基亚砜dmso配制成10mm母液,加入无血清培养基中分别配制1μm工作液。
hela(人宫颈癌细胞),购自中国科学院上海生物科学中心细胞库,hela细胞在rpmi-1640细胞培养基(gibco公司,美国)中培养,培养基中都含10%胎牛血清(gibco公司,美国)和1%青链霉素(gibco公司,美国)。所有细胞在培养箱中37℃,5%co2条件下常规培养。
线粒体染色探针(mito-trackergreen),购自碧云天生物技术公司(中国上海),为绿色荧光,488nm激发。
线粒体染色探针用无血清培养基按照1:1000的比例稀释成线粒体染色探针工作液。hela细胞(密度为3×105个细胞/皿)接种在玻璃底共聚焦细胞培养皿(nestbiotechnologyco.ltd)中,培养24小时。将细胞与线粒体染色探针工作液于37℃孵育30min,用pbs生理盐水洗两次,然后该细胞与1μm的式a所述探针在培养基中于37℃孵育30min,孵育后细胞用pbs生理盐水洗三次,随后加入1ml无血清的培养基待成像用。荧光成像通过olympusfv3000共聚焦激光扫描显微镜观察。通过561nm橙红色泵浦激光器激发,收集600-700nm波段的式a所述探针分子的荧光,通过488nm绿色泵浦激光器激发,收集510-600nm波段的线粒体染色探针的荧光,使用100×油物镜获取图像(800×800像素)并由olympusfv31s-swviewer软件处理,如图9所示,式a所述探针在hela细胞内有明亮的荧光信号,且如plotprofile分析荧光共定位图中可看到同一划线distance区域的式a探针分子与线粒体染色探针的荧光的灰度值近似相同。说明式a探针分子与线粒体染色探针共定位非常好,表明式a探针分子高特异性定位于细胞内线粒体。
六、式a所述探针对细胞的毒性实验(图10)
本发明使用cck-8方法及hela细胞测定式a所述探针的细胞毒性,具体步骤如下:
hela细胞以每孔8×103个细胞种在96孔板中,每孔100μl细胞培养基。培养24h后,将式a所述探针分子母液用无血清培养基稀释成终浓度分别为0μm、0.63μm、1.3μm、2.5μm、5.0μm、10μm、20μm和40μm的工作液,加到相应的孔中,每个浓度平行做3个样品,并以加入1μl的dmso溶液组作为空白对照,继续培养48h。然后去除培养基,用pbs洗2遍,每孔加入100μl10%cck-8试剂,在37℃环境孵育0.5h。利用多功能酶标仪测定450nm波长的吸收值,按公式(1)计算得到细胞存活率。
细胞存活率=(an-a0)/(ac-a0)×100%(1)
公式(1)中,ac表示未加染料细胞组在450nm处的吸收值,an表示加染料处理细胞组在450nm处的吸收值;a0指不含细胞的空白培养基组450nm的吸收值。
实验结果如图10所示,0.6-40μm式a所述探针与hela细胞孵育48小时,没有表现出明显的细胞毒性,表明式a所述探针在可成像浓度范围内对细胞正常生理活动无影响。
实施例2、式b所述荧光探针特异性识别核酸双链结构
一、式b所述探针的合成
将36.3mg(0.15mmol)式h分子加入到装有2ml乙醇的10ml的单颈圆底烧瓶中。在78-85℃预热5min后加入27.3mg(0.1mmol)5-溴-2,2'-联噻吩-5'-甲醛,继续加热回流12h,溶液从浅黄色变成深红色后停止,冷至室温后减压蒸馏,得到式b粗产物。
将粗产物b溶于二氯甲烷中,并通过硅胶色谱法(ch2cl2/meoh,v/v,30:1)纯化,得到化合物为橙红色固体式b分子(32mg,64.4%收率)。然后,通过高效液相色谱进一步纯化化合物。高效液相色谱分离纯化步骤为色谱柱为promisil-c18柱(250mm×4.6mm,20μm),流动相为甲醇-水,梯度洗脱,洗脱程序:0-25min,甲醇30%-95%,25-30min,甲醇95%;检测波长为490nm;柱温为25℃;体积流量为1.0ml·min-1;进样量为100μl,高效液相色谱仪(hplc)为spd-20a检测器和lc-20at双泵(岛津,日本)。
二、式b所述探针滴定不同dna结构的荧光发射光谱图(图11)和(图12)
将式b所述分子溶解于二甲基亚砜dmso中,配制得到浓度为20mm的母液。将dna溶解于生理盐水pbs中,配成浓度为100μm的母液。
将式b所述荧光分子母液溶解在生理盐水pbs里,分别加入单链dna(如seqidno.1所示),双链dna(由seqidno.1与seqidno.2所示的两条单链dna反向互补后形成),i-motifdna(如seqidno.4所示),平行g-四链体(如seqidno.7所示),反平行g-四链体(如seqidno.11所示),混合平行g-四链体(如seqidno.12所示),具有不同腺嘌呤含量的双链dna(at%=52.94%、70.59%、88.24%、100%,,具体由seqidno.13与seqidno.14、seqidno.15与seqidno.16、seqidno.17与seqidno.18、seqidno.19与seqidno.20所示单链dna分别两两反向互补后形成),溶液终体积为200μl,式b所述探针分子终浓度为3μm,dna终浓度为4.5μm,将探针溶液放置于石英皿中,在hitachif-4600荧光光谱仪(日本京都)上用492nm的激发光测其在500-700nm的荧光发射光谱。如图11所示,式b所述探针分子仅对双链dna有荧光强度响应。如图12所示,随着双链dna的腺嘌呤含量的增加,式b所述探针分子的荧光增强越强。
三、式b所述探针与活细胞亚显微结构探针的细胞共定位实验以及共定位情况分析(图13)
将式b所述探针用二甲基亚砜dmso配制成10mm母液,加入无血清培养基中分别配制1μm工作液。
hela(人宫颈癌细胞),购自中国科学院上海生物科学中心细胞库,hela细胞在rpmi-1640细胞培养基(gibco公司,美国)中培养,培养基中都含10%胎牛血清(gibco公司,美国)和1%青链霉素(gibco公司,美国)。所有细胞在培养箱中37℃,5%co2条件下常规培养。
溶酶体染色探针(lyso-trackerred,简称ltr-red),购自碧云天生物技术公司(中国上海),为红色荧光,561nm激发。
溶酶体染色探针用无血清培养基按照1:2000的比例稀释成溶酶体染色探针工作液。hela细胞(密度为3×105个细胞/皿)接种在玻璃底共聚焦细胞培养皿(nestbiotechnologyco.ltd)中,培养24小时。将细胞与溶酶体染色探针工作液于37℃孵育30min,用pbs生理盐水洗两次,然后该细胞与1μm的式b所述探针在培养基中于37℃孵育30min,孵育后细胞用pbs生理盐水洗三次,随后加入1ml无血清的培养基待成像用。荧光成像通过olympusfv3000共聚焦激光扫描显微镜观察。通过561nm橙红色泵浦激光器激发,收集600-700nm波段的溶酶体染色探针的荧光,通过488nm绿色泵浦激光器激发,收集510-600nm波段的式b所述探针分子的荧光,使用100×油物镜获取图像(800×800像素)并由olympusfv31s-swviewer软件处理,如图13所示,式b所述探针在hela细胞内有明亮的荧光信号,且如plotprofile分析荧光共定位图中可看到同一划线distance区域的式b探针分子与溶酶体染色探针的荧光的灰度值近似相同。说明式b探针分子与溶酶体染色探针共定位非常好,表明式b探针分子高特异性定位于细胞内溶酶体。
实施例3、式c所述荧光探针特异性识别核酸g-四链体结构
一、式c所述探针的合成
将36.3mg(0.15mmol)式h分子加入到装有2ml乙醇的10ml的单颈圆底烧瓶中。在78-85℃预热5min后加入22.3mg(0.1mmol)n-乙基咔唑-3-甲醛,继续加热回流12h,溶液从浅黄色变成橙红色后停止,冷至室温后减压蒸馏,得到式c粗产物。
将粗产物c溶于二氯甲烷中,并通过硅胶色谱法(ch2cl2/meoh,v/v,30:1)纯化,得到化合物为橙红色固体式c分子(39mg,87.1%收率)。然后,通过高效液相色谱进一步纯化化合物。高效液相色谱分离纯化步骤为色谱柱为promisil-c18柱(250mm×4.6mm,20μm),流动相为甲醇-水,梯度洗脱,洗脱程序:0-25min,甲醇30%-95%,25-30min,甲醇95%;检测波长为484nm;柱温为25℃;体积流量为1.0ml·min-1;进样量为100μl,高效液相色谱仪(hplc)为spd-20a检测器和lc-20at双泵(岛津,日本)。
二、式c所述探针在不同溶剂中的紫外-可见吸收光谱(图14)和荧光发射光谱图(图15)
将上述步骤一制备得到的式c所述分子溶解于二甲基亚砜dmso中,配制得到浓度为20mm的母液。
将式c所述荧光分子母液溶解在不同溶剂里(甲醇、乙醇、乙腈、乙酸乙酯、生理盐水pbs、二氯甲烷、水、二甲基亚砜、n,n’-二甲基甲酰胺、十二烷基磺酸钠水溶液、十二烷基苯磺酸钠水溶液、十六烷基三甲基溴化铵水溶液、聚乙二醇辛基苯基醚(tritonx-100)水溶液),溶液终体积为500μl,终浓度为20μm,将探针溶液放置于石英皿中,在hitachiu-2550型紫外可见吸收光谱仪(日本京都)上测其在350nm和650nm之间的紫外-可见(uv-vis)吸收光谱,如图14所示,在不同有机溶剂中式c所述探针的最大吸收波长略有不同,在二氯甲烷、乙腈和乙酸乙酯中最大吸收波长为528nm,在甲醇、乙醇、二甲基亚砜、n,n-二甲基甲酰胺中最大吸收波长为500nm,而在十二烷基苯磺酸钠水溶液中最大吸收波长为428nm。
将式c所述荧光分子母液溶解在不同溶剂里(甲醇、乙醇、乙腈、乙酸乙酯、生理盐水pbs、二氯甲烷、水、二甲基亚砜、n,n’-二甲基甲酰胺、十二烷基磺酸钠水溶液、十二烷基苯磺酸钠水溶液、十六烷基三甲基溴化铵水溶液、聚乙二醇辛基苯基醚(tritonx-100)水溶液),溶液终体积为200μl,终浓度为2μm,将探针溶液放置于石英皿中,在hitachif-4600荧光光谱仪(日本京都)上用484nm的激发光测其在500-700nm的荧光发射光谱,如图15所示,式c所述荧光分子在不同溶剂中的荧光强度从强到弱排列为:聚乙二醇辛基苯基醚(tritonx-100)水溶液>二氯甲烷>二甲基亚砜>n,n’-二甲基甲酰胺>乙醇>甲醇=乙腈>十六烷基三甲基溴化铵水溶液>乙酸乙酯>水>十二烷基苯磺酸钠水溶液>十二烷基磺酸钠水溶液=生理盐水pbs。
三、式c所述探针滴定不同四链体结构dna结构的荧光发射光谱图(图16)和(图17)
将式c所述分子溶解于二甲基亚砜dmso中,配制得到浓度为20mm的母液。将dna溶解于生理盐水pbs中,配成浓度为100μm的母液。
将式c所述荧光分子母液溶解在生理盐水pbs里,分别加入不同四链体结构dna:i-motifdna(如seqidno.4所示),平行g-四链体(如seqidno.6、seqidno.7、seqidno.8、seqidno.9、seqidno.10所示),反平行g-四链体(如seqidno.11所示),混合平行g-四链体(如seqidno.12所示),溶液终体积为200μl,式c所述荧光分子终浓度为3μm,dna终浓度为4μm,将探针溶液放置于石英皿中,在hitachif-4600荧光光谱仪(日本京都)上用484nm的激发光测其在500-700nm的荧光发射光谱。如图16所示,式c分子仅对平行g-四链体有荧光强度响应。如图17所示,式c所述荧光分子对平行g-四链体具有强烈的荧光增强响应。
四、式c所述探针与活细胞亚显微结构探针的细胞共定位实验以及共定位情况分析(图18)
将式c所述探针用二甲基亚砜dmso配制成10mm母液,加入无血清培养基中分别配制1μm工作液。
hela(人宫颈癌细胞),购自中国科学院上海生物科学中心细胞库,hela细胞在rpmi-1640细胞培养基(gibco公司,美国)中培养,培养基中都含10%胎牛血清(gibco公司,美国)和1%青链霉素(gibco公司,美国)。所有细胞在培养箱中37℃,5%co2条件下常规培养。
溶酶体染色探针(lyso-trackerred,简称ltr-red),购自碧云天生物技术公司(中国上海),为红色荧光,561nm激发。线粒体染色探针(mitotrackertmdeepred),购自碧云天生物技术公司(中国上海),为紫红色荧光,640nm激发。
(a)溶酶体染色探针用无血清培养基按照1:2000的比例稀释成溶酶体染色探针工作液。hela细胞(密度为3×105个细胞/皿)接种在玻璃底共聚焦细胞培养皿(nestbiotechnologyco.ltd)中,培养24小时。将细胞与溶酶体染色探针工作液于37℃孵育30min,用pbs生理盐水洗两次,然后该细胞与1μm的式c所述探针在培养基中于37℃孵育30min,孵育后细胞用pbs生理盐水洗三次,随后加入1ml无血清的培养基待成像用。荧光成像通过olympusfv3000共聚焦激光扫描显微镜观察。通过561nm橙红色泵浦激光器激发,收集600-700nm波段的溶酶体染色探针的荧光,通过488nm绿色泵浦激光器激发,收集510-600nm波段的式c所述探针分子的荧光,使用100×油物镜获取图像(800×800像素)并由olympusfv31s-swviewer软件处理。(b)线粒体体染色探针用无血清培养基按照1:1000的比例稀释成线粒体染色探针工作液。hela细胞(密度为3×105个细胞/皿)接种在玻璃底共聚焦细胞培养皿(nestbiotechnologyco.ltd)中,培养24小时。将细胞与线粒体染色探针工作液于37℃孵育30min,用pbs生理盐水洗两次,然后该细胞与1μm的式c所述探针在培养基中于37℃孵育30min,孵育后细胞用pbs生理盐水洗三次,随后加入1ml无血清的培养基待成像用。荧光成像通过olympusfv3000共聚焦激光扫描显微镜观察。通过640nm红色泵浦激光器激发,收集660-750nm波段的线粒体染色探针的荧光,通过488nm绿色泵浦激光器激发,收集510-600nm波段的式c所述探针分子的荧光,使用100×油物镜获取图像(800×800像素)并由olympusfv31s-swviewer软件处理。如图18-(a)所示,式c所述探针在hela细胞内溶酶体处有明亮的荧光信号,如图18-(b)所示,式c所述探针在hela细胞内线粒体处有荧光信号。
实施例4、式d所述荧光探针特异性识别核酸g-四链体结构
一、式d所述探针的合成
将36.3mg(0.15mmol)式h分子加入到装有2ml乙醇的10ml的单颈圆底烧瓶中。在78-85℃预热5min后加入14.5mg(0.1mmol)吲哚-3-甲醛,继续加热回流12h,溶液从浅黄色变成橙黄色后停止,冷至室温后减压蒸馏,得到式d粗产物。
将粗产物d溶于二氯甲烷中,并通过硅胶色谱法(ch2cl2/meoh,v/v,30:1)纯化,得到化合物为黄色固体式d分子(30mg,81.3%收率)。然后,通过高效液相色谱进一步纯化化合物。高效液相色谱分离纯化步骤为色谱柱为promisil-c18柱(250mm×4.6mm,20μm),流动相为甲醇-水,梯度洗脱,洗脱程序:0-25min,甲醇30%-95%,25-30min,甲醇95%;检测波长为482nm;柱温为25℃;体积流量为1.0ml·min-1;进样量为100μl,高效液相色谱仪(hplc)为spd-20a检测器和lc-20at双泵(岛津,日本)。
二、式d所述探针滴定不同四链体结构dna结构的荧光发射光谱图(图19)和(图20)
将式d所述探针分子溶解于二甲基亚砜dmso中,配制得到浓度为20mm的母液。将dna溶解于生理盐水pbs中,配成浓度为100μm的母液。
将式d所述荧光分子母液溶解在生理盐水pbs里,分别加入不同结构dna(单链dna(如seqidno.1所示),双链dna(由seqidno.1与seqidno.2所示两条单链dna反向互补后形成),i-motifdna(如seqidno.4所示),平行g-四链体(如seqidno.5、seqidno.6、seqidno.7、seqidno.8、seqidno.9、seqidno.10所示),反平行g-四链体(如seqidno.11所示),混合平行g-四链体(如seqidno.12所示)),溶液终体积为200μl,式d所述探针分子终浓度为3μm,dna终浓度为4μm,将探针溶液放置于石英皿中,在hitachif-4600荧光光谱仪(日本京都)上用482nm的激发光测其在500-650nm的荧光发射光谱。如图19所示,式d所述探针分子仅对平行g-四链体有荧光强度响应。如图20所示,式d所述探针分子对平行g-四链体具有强烈的荧光增强响应。
三、式d所述探针与活细胞亚显微结构探针的细胞共定位实验以及共定位情况分析
将式d所述探针用二甲基亚砜dmso配制成10mm母液,加入无血清培养基中分别配制1μm工作液。
hela(人宫颈癌细胞),购自中国科学院上海生物科学中心细胞库,hela细胞在rpmi-1640细胞培养基(gibco公司,美国)中培养,培养基中都含10%胎牛血清(gibco公司,美国)和1%青链霉素(gibco公司,美国)。所有细胞在培养箱中37℃,5%co2条件下常规培养。
溶酶体染色探针(lyso-trackerred,简称ltr-red),购自碧云天生物技术公司(中国上海),为红色荧光,561nm激发。
溶酶体染色探针用无血清培养基按照1:2000的比例稀释成溶酶体染色探针工作液。hela细胞(密度为3×105个细胞/皿)接种在玻璃底共聚焦细胞培养皿(nestbiotechnologyco.ltd)中,培养24小时。将细胞与溶酶体染色探针工作液于37℃孵育30min,用pbs生理盐水洗两次,然后该细胞与1μm的式d所述探针在培养基中于37℃孵育30min,孵育后细胞用pbs生理盐水洗三次,随后加入1ml无血清的培养基待成像用。荧光成像通过olympusfv3000共聚焦激光扫描显微镜观察。通过561nm橙红色泵浦激光器激发,收集600-700nm波段的溶酶体染色探针的荧光,通过488nm绿色泵浦激光器激发,收集510-600nm波段的式d所述探针分子的荧光,使用100×油物镜获取图像(800×800像素)并由olympusfv31s-swviewer软件处理,如图21-(a)所示,式d所述探针在hela细胞内有明亮的荧光信号,且如plotprofile分析荧光共定位图中可看到同一划线distance区域的式d探针分子与溶酶体染色探针的荧光的灰度值近似相同。说明式d探针分子与溶酶体染色探针共定位非常好,表明式d探针分子高特异性定位于细胞内溶酶体。
四、式d所述探针与固定细胞亚显微结构探针的细胞共定位实验以及共定位情况分析
将式d所述探针用二甲基亚砜dmso配制成10mm母液,加入pbs生理盐水中分别配制1μm工作液。
细胞核染色探针dapi用pbs生理盐水按照1:4000的比例稀释成工作液。hela细胞(密度为3×105个细胞/皿)接种在玻璃底共聚焦细胞培养皿(nestbiotechnologyco.ltd)中,培养24小时。用甲醇在-20℃固定细胞12min,用pbs生理盐水洗三次,tritonx100(0.5%)溶液在室温给细胞打孔5min,用pbs生理盐水洗四次。将细胞与细胞核染色探针工作液于室温孵育30min,用pbs生理盐水洗两次,然后该细胞与1μm的式d所述探针在培养基中于室温孵育30min,孵育后细胞用pbs生理盐水洗两次,随后加入1mlpbs生理盐水待成像用。荧光成像通过olympusfv3000共聚焦激光扫描显微镜观察。通过405nm蓝色泵浦激光器激发,收集430-500nm波段的细胞核染色探针dapi的荧光,通过488nm绿色泵浦激光器激发,收集510-600nm波段的式d所述探针分子的荧光,使用100×油物镜获取图像(800×800像素)并由olympusfv31s-swviewer软件处理,如图21-(b)所示,式d所述探针在hela固定细胞内核仁组织区有明亮的荧光信号,且如plotprofile分析荧光共定位图中可看到同一划线distance区域的式d探针分子与dapi探针的荧光的灰度值毫不相同。说明式d探针分子在固定细胞中有高特异性定位于核仁组织区的性质。
实施例5、式e所述荧光探针特异性识别核酸双链结构
一、式e所述探针的合成
将36.3mg(0.15mmol)式h分子加入到装有2ml乙醇的10ml的单颈圆底烧瓶中。在78-85℃预热5min后加入22.5mg(0.1mmol)6-溴-4-氮杂吲哚-3-甲醛,继续加热回流12h,溶液从浅黄色变成深红色后停止,冷至室温后减压蒸馏,得到式e粗产物。
将粗产物e溶于二氯甲烷中,并通过硅胶色谱法(ch2cl2/meoh,v/v,30:1)纯化,得到化合物为黄色固体式e分子(32mg,64.4%收率)。然后,通过高效液相色谱进一步纯化化合物。高效液相色谱分离纯化步骤为色谱柱为promisil-c18柱(250mm×4.6mm,20μm),流动相为甲醇-水,梯度洗脱,洗脱程序:0-25min,甲醇30%-95%,25-30min,甲醇95%;检测波长为445nm;柱温为25℃;体积流量为1.0ml·min-1;进样量为100μl,高效液相色谱仪(hplc)为spd-20a检测器和lc-20at双泵(岛津,日本)。
二、式e所述探针滴定不同dna结构的荧光发射光谱图(图22)
将式e所述分子溶解于二甲基亚砜dmso中,配制得到浓度为20mm的母液。将dna溶解于生理盐水pbs中,配成浓度为100μm的母液。
将式e所述荧光分子母液溶解在生理盐水pbs里,分别加入单链dna(如seqidno.1所示),双链dna(由seqidno.1与seqidno.2所示的两条单链dna反向互补后形成),i-motifdna(如seqidno.4所示),平行g-四链体(如seqidno.7所示),反平行g-四链体(如seqidno.11所示),混合平行g-四链体(如seqidno.12所示),溶液终体积为200μl,式e所述探针分子终浓度为3μm,dna终浓度为4.5μm,将探针溶液放置于石英皿中,在hitachif-4600荧光光谱仪(日本京都)上用445nm的激发光测其在470-600nm的荧光发射光谱。如图14所示,式e所述探针分子仅对双链dna有荧光强度响应。
三、式e所述探针与活细胞亚显微结构探针的细胞共定位实验以及共定位情况分析(图23)
将式e所述探针用二甲基亚砜dmso配制成10mm母液,加入无血清培养基中分别配制1μm工作液。
hela(人宫颈癌细胞),购自中国科学院上海生物科学中心细胞库,hela细胞在rpmi-1640细胞培养基(gibco公司,美国)中培养,培养基中都含10%胎牛血清(gibco公司,美国)和1%青链霉素(gibco公司,美国)。所有细胞在培养箱中37℃,5%co2条件下常规培养。
溶酶体染色探针(lyso-trackerred,简称ltr-red),购自碧云天生物技术公司(中国上海),为红色荧光,561nm激发。
溶酶体染色探针用无血清培养基按照1:2000的比例稀释成溶酶体染色探针工作液。hela细胞(密度为3×105个细胞/皿)接种在玻璃底共聚焦细胞培养皿(nestbiotechnologyco.ltd)中,培养24小时。将细胞与溶酶体染色探针工作液于37℃孵育30min,用pbs生理盐水洗两次,然后该细胞与1μm的式e所述探针在培养基中于37℃孵育30min,孵育后细胞用pbs生理盐水洗三次,随后加入1ml无血清的培养基待成像用。荧光成像通过olympusfv3000共聚焦激光扫描显微镜观察。通过561nm橙红色泵浦激光器激发,收集600-700nm波段的溶酶体染色探针的荧光,通过445nm蓝色泵浦激光器激发,收集470-600nm波段的式e所述探针分子的荧光,使用100×油物镜获取图像(800×800像素)并由olympusfv31s-swviewer软件处理,如图15所示,式e所述探针在hela细胞内有明亮的荧光信号,且如plotprofile分析荧光共定位图中可看到同一划线distance区域的式e探针分子与溶酶体染色探针的荧光的灰度值近似相同。说明式e探针分子与溶酶体染色探针共定位非常好,表明式e探针分子高特异性定位于细胞内溶酶体。
<110>中国科学院化学研究所
<120>一种基于苯并噻唑的半花菁类化合物的荧光探针及其制备方法与应用
<130>gnclw200118
<160>20
<170>patentinversion3.5
<210>1
<211>17
<212>dna
<213>人工序列(artificialsequence)
<400>1
ccagttcgtagtaaccc17
<210>2
<211>17
<212>dna
<213>人工序列(artificialsequence)
<400>2
gggttactacgaactgg17
<210>3
<211>34
<212>dna
<213>人工序列(artificialsequence)
<400>3
ccagttcgtagtaacccgggttactacgaactgg34
<210>4
<211>23
<212>dna
<213>人工序列(artificialsequence)
<400>4
cttccccaccctccccaccctcc23
<210>5
<211>23
<212>dna
<213>人工序列(artificialsequence)
<400>5
tttcgggcgggcgcgagggaggg23
<210>6
<211>32
<212>dna
<213>人工序列(artificialsequence)
<400>6
agggcggtgtgggaagagggaagagggggagg32
<210>7
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>7
tgagggtgggtagggtgggtaa22
<210>8
<211>26
<212>dna
<213>人工序列(artificialsequence)
<400>8
tttgggcgcgggaggaagggggcggg26
<210>9
<211>17
<212>dna
<213>人工序列(artificialsequence)
<400>9
gggcgggcgcgggcggg17
<210>10
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>10
tgagggtggggagggtggggaa22
<210>11
<211>15
<212>dna
<213>人工序列(artificialsequence)
<400>11
ggttggtgtggttgg15
<210>12
<211>22
<212>dna
<213>人工序列(artificialsequence)
<400>12
agggttagggttagggttaggg22
<210>13
<211>17
<212>dna
<213>人工序列(artificialsequence)
<400>13
agacaaggacaagcaca17
<210>14
<211>17
<212>dna
<213>人工序列(artificialsequence)
<400>14
tgtgcttgtccttgtct17
<210>15
<211>17
<212>dna
<213>人工序列(artificialsequence)
<400>15
caagaaacaagaaacaa17
<210>16
<211>17
<212>dna
<213>人工序列(artificialsequence)
<400>16
ttgtttcttgtttcttg17
<210>17
<211>17
<212>dna
<213>人工序列(artificialsequence)
<400>17
aaaaagaaaaagaaaaa17
<210>18
<211>17
<212>dna
<213>人工序列(artificialsequence)
<400>18
tttttctttttcttttt17
<210>19
<211>17
<212>dna
<213>人工序列(artificialsequence)
<400>19
aaaaaaaaaaaaaaaaa17
<210>20
<211>17
<212>dna
<213>人工序列(artificialsequence)
<400>20
ttttttttttttttttt17
- 还没有人留言评论。精彩留言会获得点赞!