一种在甲醇酵母中高效分泌融合表达以及重组制备灵杆菌核酸酶的方法与流程
本发明涉及生物工程技术领域,具体涉及一种在甲醇酵母中高效分泌融合表达以及重组制备灵杆菌核酸酶的方法。
背景技术:
能够将聚核苷酸链的磷酸二酯键切断的酶,称为核酸酶(nuclease,简称nuc),它属于水解酶,作用于磷酸二酯键的p-o位置。灵杆菌核酸酶是来源于粘质沙雷氏菌(serratiamarcescens,又称灵杆菌)的非限制性广谱核酸酶,可在核酸链内的任意核苷酸间进行切割,并可切割任意形式的核酸(单链、双链、线状、环状或超螺旋形式的dna或rna)。灵杆菌核酸酶酶切效率远高于其它核酸酶,活性是牛胰dnasei的34倍、金黄葡萄球菌核酸酶的6倍。该酶已广泛用于去除疫苗和蛋白、多糖类药物的核酸污染,可将产品中的核酸污染降低至皮克级,具有广阔的应用市场。
然而,灵杆菌是一种致病菌,对其大规模培养存在较大风险。目前商品化的灵杆菌核酸酶主要利用大肠杆菌系统重组制备。迄今为止,市场上的主导产品为merck公司生产的商品名为benzonase的灵杆菌核酸酶,该产品已通过美国fda的使用许可,广泛用于除去生物制品中的核酸。但因其对宿主菌大肠杆菌有毒性且纯化方法复杂,故产量低价格昂贵。国外产品(sigma及merck)100万单位(约为1mg)售价约为3万元至8万元人民币,国内生产厂家较少。目前公开报道灵杆菌核酸主要为单体、非融合制备,表达后即具有降解核酸的活性,对宿主菌毒性较大,培养过程菌体死亡率高、无法高效制备。医药工业急需一种高效重组制备灵杆菌核酸酶的方法,降低其生产成本,扩大应用范围。
利用大肠杆菌原核表达系统对目的蛋白进行非活性形式包涵体制备,是制备毒性蛋白的通用做法,但包涵体蛋白纯化复性困难,回收率较低,工业化制备成本较高;同时,是否形成包涵体与蛋白本身的结构特点有关,并非所有蛋白均可进行包涵体制备。
重组融合表达是指通过基因重组手段串联表达含有多个蛋白多肽编码基因的生物技术。对某些稳定性差、常规重组表达难制备的蛋白多肽,将其与另一可高效表达的蛋白进行融合表达,可克服上述缺陷并实现目的蛋白的高效重组制备。目前,该技术已普遍应用于大肠杆菌原核表达系统。将目的蛋白与金黄色葡萄球菌蛋白a、谷胱甘肽-s-转移酶、大肠杆菌麦芽糖结合蛋白、大肠杆菌硫氧还蛋白等构建原核融合表达体系。然而,上述表达系统设计初衷为借助融合伴侣蛋白溶解性好、表达效率高等特性,使目的蛋白亦获得高效可溶性表达,融合蛋白可促进活性目的蛋白构建表达,但并不能有效封闭目的蛋白生物活性。同时,因大肠杆菌缺少胞外分泌系统,重组蛋白无法分泌至细胞外,多数积累于细胞质中。对于毒性较大蛋白,活性形式表达量越高,对宿主细胞的毒性越大,无法用于毒性大蛋白的高效表达制备。
甲醇酵母是可利用甲醇作为唯一碳源的酵母,主要包含毕赤酵母(pichiapastoris)、汉逊酵母(hansenulapolymopha)和假丝酵母(candidabodinii)。甲醇酵母表达系统是近年来发展迅速的重组表达系统,不仅具有原核生物生长快、操作简便的特点,还可将外源蛋白通过一定的途径高效分泌至细胞外,胞内累积量较少,大幅降低了外源蛋白的细胞内毒性,同时可简化分离纯化步骤,降低制备成本。
水蛭素是源于水蛭头部唾液腺的一类由64-69个氨基酸组成的活性多肽,可作为凝血酶特异性抑制剂,用于血栓性疾病的治疗,目前已上市的重组水蛭素类多肽药物包括lepirudin和desirudin。天然水蛭素含有10种变异体,其中研究最多的是三种水蛭素变异体(hirudinvariants,hv),即hv1、hv2和hv3。水蛭素含有3对二硫键,无法利用大肠杆菌高效表达制备,但可在酵母系统中高效分泌表达,其中活性hv1在毕赤酵母中的表达量可达到2.0g/l。另一方面,水蛭素蛋白结构刚性较强,具有封闭与之融合表达蛋白的生物活性的潜在特性,可降低目的蛋白毒性,具有作为融合表达体系制备毒性较大蛋白的可能。
技术实现要素:
本发明的目的是提供一种在甲醇酵母中高效分泌融合表达以及重组制备灵杆菌核酸酶(nuc)的方法。其融合表达特征为:水蛭素位于融合蛋白的n末端,nuc位于融合蛋白的c末端,中间为肠激酶酶切位点(ddddk),具体结构如下所示:
hirudin-ddddk-nuc。
本发明所述水蛭素指天然水蛭素-1(hv1,如seqidno:1所示)、天然水蛭素-2(hv2,如seqidno:2所示),以及具有相同生物活性的水蛭素突变体中的一种以上。水蛭素突变体是指经过个别氨基酸的取代、缺失或增加而得到的水蛭素多肽,生物活性与天然水蛭素基本相同。优选的,所述水蛭素突变体如seqidno:3所示。
本发明中的灵杆菌核酸酶,包括但不限于灵杆菌核酸酶全长结构(如seqidno:4所示)以及具有相同生物活性的灵杆菌核酸酶突变体。
本发明所述甲醇酵母包括毕赤酵母(pichiapastoris)、汉逊酵母(hansenulapolymopha)和假丝酵母(candidabodinii)等能够利用甲醇作为唯一碳源的酵母。优选的,所述甲醇酵母为毕赤酵母。
为了实现上述的目的,本发明的技术方案如下:
一种在甲醇酵母中高效分泌融合表达以及重组制备灵杆菌核酸酶的方法,包括如下步骤:
(1)构建含水蛭素和灵杆菌核酸酶融合基因的酵母分泌型载体;
(2)转化甲醇酵母宿主菌,筛选高效分泌表达菌株;
(3)发酵和重组融合蛋白的分离纯化;
(4)重组融合蛋白的单一蛋白酶酶切;
(5)灵杆菌核酸酶蛋白的分离纯化。
优选的:所述步骤(1)中分泌型载体ppic9、ppic9k、ppiczα、pgapzα等。优选的,分泌型载体是ppic9k和ppiczα。
优选的:所述步骤(2)中宿主菌毕赤酵母宿主菌:gs115、x-33、km71和smd1163等。
优选的,所述步骤(2)中甲醇酵母宿主菌是gs115和x-33。
优选的:所述步骤(2)中转化为通过电转化或原生质体转化等方法将载体转入宿主菌;所述筛选高效分泌表达菌株为采用抗性加压等合适条件筛选重组子,通过测定诱导表达融合蛋白量确定优选表达菌株。
优选的:所述步骤(3)中发酵为将筛选的工程菌经活化、种子液培养及发酵罐高密度培养后,加入诱导剂(如甲醇)诱导融合蛋白分泌表达。所述融合蛋白的分离纯化方法可以为超滤、沉淀、离子交换层析、亲和层析、疏水作用层析、反相层析以及分子排阻层析的一种以上。
优选的:所述步骤(4)中单一蛋白酶酶切为采用肠激酶将灵杆菌核酸酶与水蛭素有效酶切分离,且在目的蛋白多肽n末端不包含任何多余氨基酸残基。
优选的:所述步骤(5)中目的多肽的分离纯化选自超滤、沉淀、离子交换层析、亲和层析、疏水作用层析、反相层析以及分子排阻层析的一种以上。
与现有技术相比,本发明的有益效果是:
本发明将水蛭素作为伴侣蛋白与生物毒性较大的灵杆菌核酸酶构建融合蛋白并采用甲醇酵母分泌表达系统,借助水蛭素表达效率高及刚性强、可封闭核酸酶活性等特性,使目的蛋白获得高效表达。本发明提供了一个高效甲醇酵母分泌融合表达方法,提高了灵杆菌核酸酶的重组制备效率,降低生产成本。
本发明首次利用水蛭素封闭活性并利用水蛭素的高表达以获得了高产量、高比活、低成本灵杆菌核酸酶。
本发明解决了现有技术中直接以非融合的形式在酵母中重组表达灵杆菌核酸酶,但在发酵过程发酵,甲醇诱导后,随灵杆菌核酸酶的分泌增加,宿主菌生长停滞,密度不再增加,且逐渐出现菌体死亡和菌体密度下降的问题。本发明创造性的将某一种蛋白或多肽与灵杆菌核酸酶进行串联以封闭其活性,以无活性的形式在酵母中进行表达,再在体外切除串联蛋白获得活性形式蛋白,有效的避免了宿主菌死亡。
本发明创造性的将水蛭素串联在灵杆菌核酸酶n端,并在两者之间设置特异的蛋白酶切位点,分泌后再体外切除水蛭素获得活性灵杆菌核酸酶,该方法一方面可有效封闭灵杆菌核酸酶活性,诱导后未出现宿主菌的死亡,且菌体密度随诱导时间逐步增加;另一方面,水蛭素的高表达带动串联在其c端的灵杆菌核酸酶获得了高表达。
附图说明
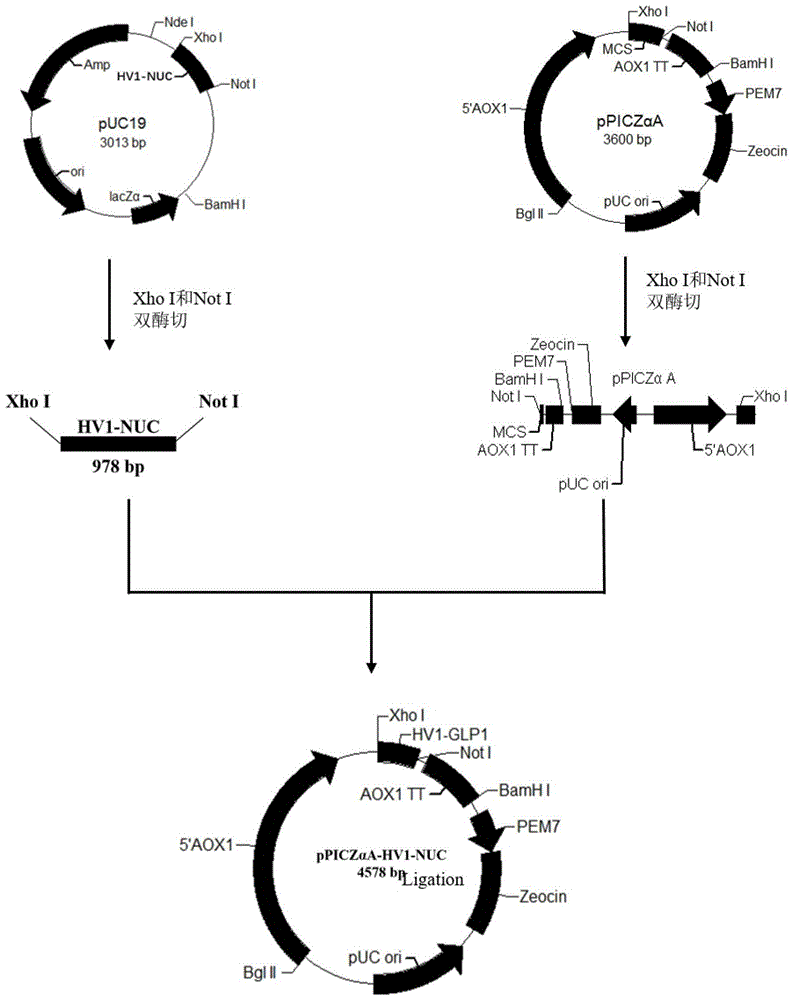
图1为ppiczαa-hv1-nuc质粒构建示意图;
图2为纯化后nuc蛋白rp-hplc测定图谱,其中:保留时间为13.793min是纯化后的nu;
图3为纯化后nuc蛋白sds-page测定图谱。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1.基于hv1融合蛋白的灵杆菌核酸酶制备
(1)融合载体ppiczαa-hv1-nuc的构建
①融合蛋白序列设计
在本实施例中,所涉及的融合蛋白n端为hv1序列(seqidno:1),中间为肠激酶酶切位点序列(ddddk),c端为灵杆菌核酸酶(seqidno:4)。融合蛋白完整序列(seqidno:5)为:
vvytdctesgqnlclcegsnvcgqgnkcilgsdgeknqcvtgegtpkpqshndgdfeeip
其中下划直线部分为hv1突变体氨基酸序列,双下划直线部分为肠激酶酶切位点氨基酸序列,下划虚线部分为nuc氨基酸序列。
②融合基因设计及合成
根据上述氨基酸序列,按照毕赤酵母密码子偏爱性,设计核苷酸序列。在表达序列后面设计终止密码子序列,并在序列n端和c端分别设计xhoi和noti限制性酶切位点,委托进行全基因合成。其核苷酸序列(seqidno:6)为:
ctcgagaagagagttgtttacactgattgtactgaatctggtcaaaatttgtgcttgtgtgagggatctaatgtttgtggtcaaggtaataagtgcatcttgggttctgatggagaaaagaaccaatgtgtcactggtgaaggtactccaaagcctcaatctcataacgatggtgatttcgaagaaattccagaagaatacttgcaagatgatgatgataagggttctgatactttggaatctatcgataactgtgctgttggttgtccaactggtggttcttctaacgtttctattgttagacatgcttacactttgaacaacaactctactactaagttcgctaactgggttgcttatcacattactaaagatactcctgcttctggtaaaactagaaattggaaaactgatccagctttgaaccctgctgatactttggctccagctgattacactggtgctaatgctgctttgaaggttgatagaggtcatcaagctcctttggcttctttggctggtgtttctgattgggaatctttgaactatttgtctaacatcactccacaaaagtctgatttgaaccaaggtgcttgggctagattggaagatcaagagagaaagttgatcgatagagctgatatttcttctgtttacactgttactggtcctttgtatgagagagatatgggtaaattgccaggtactcaaaaagctcatactattccttctgcttactggaaggttattttcattaacaactctccagctgttaatcactatgctgctttcttgttcgatcaaaacactcctaagggtgctgatttttgtcaattcagagttactgttgatgaaatcgagaaaagaactggtttgatcatctgggctggtttgccagatgatgttcaagcttctttgaagtctaaaccaggtgttttgcctgagttgatgggttgtaaaaactgataagcggccgc
③将全基因合成的hv1-nuc序列经xhoi和noti双酶切(购自大连宝生物公司)后插入经相同酶切的ppiczαa载体并转化大肠杆菌dh5α或top10克隆宿主菌,挑取阳性克隆,用dna电泳和序列分析检定重组质粒,获得正确的ppiczαa-hv1-nuc融合载体(附图1)。
(2)重组甲醇酵母宿主菌gs115的转化及筛选
①将ppiczαa-hv1-nuc融合载体经saci线性化后,转化毕赤酵母gs115感受态细胞,构建含表达载体ppiczαa-hv1-nuc/gs115的工程菌。
②用含50-500μg/ml博莱霉素(zeocin)的ypd固体培养基对阳性克隆进行抗性压力筛选,30℃培养3天,得到酵母转化子。
③接种转化子至bmgy培养基中30℃培养24h后转换至bmmy培养基继续培养,并每隔12h补加0.5%(v/v)甲醇。诱导72h后离心(8000rpm,15min)获取上清,利用电泳法测定融合蛋白表达量,筛选高表达工程菌ppiczαa-hv1-nuc/gs115。
(3)hv1-nuc融合蛋白的发酵及纯化
①将ppiczαa-hv1-nuc/gs115高表达工程菌接种于bmgy培养基30℃培养24h后,作为种子液接种于发酵罐。发酵培养基为加入了微量元素的基础培养基,发酵温度30℃,ph5.0,溶氧不低于30%。菌体生长24h后开始补加甘油,当菌体od达到200时加入甲醇诱导表达。甲醇添加量控制在1-10ml/h,通过调节转速和通气量保持溶氧值大于20%,诱导发酵48-72h。
②发酵结束后,利用陶瓷膜超滤系统进行固液分离和脱盐浓缩,收集浓缩液依次使用离子交换层析和疏水层析进行纯化,得到hv1-nuc融合蛋白。
(4)肠激酶酶切除目的蛋白纯化
①将融合蛋白hv1-nuc浓度调节至4.0-6.0mg/ml,按质量比1:1000-1:5000加入肠激酶,ph8.0,25℃酶切14-18h,调节ph至2.0终止反应。
②将酶切液进行反相层析纯化,并利用rp-hplc和sds-page检测纯度(如纯度<95.0%则再次进行反相层析纯化),获得高纯度nuc类似肽(附图2)。发酵表达及纯化回收情况见表1。
实施例2.基于hv2融合蛋白的灵杆菌核酸酶制备
(1)融合载体ppic9k-hv2-nuc的构建
①融合蛋白序列设计
在本实施例中,所涉及的融合蛋白n端为hv2序列(seqidno:2),中间为肠激酶酶切位点序列(ddddk),c端为灵杆菌核酸酶(seqidno:4)。融合蛋白完整序列(seqidno:7)为:
vvytdctesgqnlclcegsnvcgqgnkcilgsdgeknqcvtgegtpkpqshndgdfeeip
其中下划直线部分为hv2突变体氨基酸序列,双下划直线部分为肠激酶酶切位点氨基酸序列,下划虚线部分为nuc氨基酸序列。
②融合基因设计及合成
根据上述氨基酸序列,按照毕赤酵母密码子偏爱性,设计核苷酸序列。在表达序列后面设计终止密码子序列,并在序列n端和c端分别设计xhoi和noti限制性酶切位点,委托进行全基因合成。其核苷酸序列(seqidno:8)为:
ctcgagaagagagttgtttacactgattgtactgaatctggtcaaaatttgtgcttgtgtgagggatctaatgtttgtggtcaaggtaataagtgcatcttgggttctgatggagaaaagaaccaatgtgtcactggtgaaggtactccaaagcctcaatctcataacgatggtgatttcgaagaaattccagaagaatacttgcaagatgatgatgataagggttctgatactttggaatctatcgataactgtgctgttggttgtccaactggtggttcttctaacgtttctattgttagacatgcttacactttgaacaacaactctactactaagttcgctaactgggttgcttatcacattactaaagatactcctgcttctggtaaaactagaaattggaaaactgatccagctttgaaccctgctgatactttggctccagctgattacactggtgctaatgctgctttgaaggttgatagaggtcatcaagctcctttggcttctttggctggtgtttctgattgggaatctttgaactatttgtctaacatcactccacaaaagtctgatttgaaccaaggtgcttgggctagattggaagatcaagagagaaagttgatcgatagagctgatatttcttctgtttacactgttactggtcctttgtatgagagagatatgggtaaattgccaggtactcaaaaagctcatactattccttctgcttactggaaggttattttcattaacaactctccagctgttaatcactatgctgctttcttgttcgatcaaaacactcctaagggtgctgatttttgtcaattcagagttactgttgatgaaatcgagaaaagaactggtttgatcatctgggctggtttgccagatgatgttcaagcttctttgaagtctaaaccaggtgttttgcctgagttgatgggttgtaaaaactgataagcggccgc
③将全基因合成的hv2-nuc序列经xhoi和noti双酶切后插入经相同酶切的ppiczαa载体并转化大肠杆菌dh5α或top10克隆宿主菌,挑取阳性克隆,用dna电泳和序列分析检定重组质粒,获得正确的ppiczαa-hv1-nuc融合载体(附图1)。
(2)重组甲醇酵母宿主菌的转化及筛选
①将ppic9k-hv2-nuc融合载体经saci线性化后,转化毕赤酵母gs115感受态细胞,构建含表达载体ppic9k-hv2-nuc的工程菌。
②用含50-500μg/ml博莱霉素(zeocin)的ypd固体培养基对阳性克隆进行压力筛选,30℃培养3天,得到酵母转化子。
③接种转化子至bmgy培养基中30℃培养24h后转换至bmmy培养基继续培养,并每隔12h补加0.5%甲醇。诱导72h后离心获取上清,利用电泳法测定融合蛋白表达量,筛选高表达工程菌。
(3)hv2-nuc融合蛋白的发酵及纯化
①将ppic9k-hv2-nuc/gs115高表达工程菌接种于bmgy培养基30℃培养24h后,作为种子液接种于发酵罐。发酵培养基为加入了微量元素的基础培养基,发酵温度30℃,ph5.0,溶氧不低于30%。菌体生长24h后开始补加甘油,当菌体od达到200时加入甲醇诱导表达。甲醇添加量控制在1-10ml/h,通过调节转速和通气量保持溶氧值大于20%,诱导发酵48-72h。
②发酵结束后,利用陶瓷膜超滤系统进行固液分离和脱盐浓缩,收集浓缩液依次使用离子交换层析和疏水层析进行纯化,得到hv2-nuc融合蛋白。
(4)肠激酶酶切及目的蛋白纯化
①将融合蛋白浓度调节至4.0-6.0mg/ml,按质量比1:1000-1:5000加入肠激酶,ph8.0,25℃酶切14-18h,调节ph至2.0终止反应。
②将酶切液进行反相层析纯化,并利用rp-hplc检测纯度(如纯度<95.0%则再次进行反相层析纯化),获得高纯度nuc类似肽(附图2)。发酵表达及纯化回收情况见表1。
实施例3.非水蛭素融合蛋白的灵杆菌核酸酶制备
(1)载体ppiczαa-nuc的构建
①蛋白序列设计
在本实施例中,灵杆菌核酸酶nuc(seqidno:4)氨基酸序列为:
②基因设计及合成
根据上述氨基酸序列,按照毕赤酵母密码子偏爱性,设计核苷酸序列。在表达序列后面设计终止密码子序列,并在序列n端和c端分别设计xhoi和noti限制性酶切位点,委托进行全基因合成。
③将全基因合成的nuc序列经xhoi和noti双酶切后插入经相同酶切的ppiczαa载体并转化大肠杆菌dh5α或top10克隆宿主菌,挑取阳性克隆,用dna电泳和序列分析检定重组质粒,获得正确的ppiczαa-nuc重组载体。
(2)重组甲醇酵母宿主菌gs115的转化及筛选
①将ppiczαa-nuc重组载体经saci线性化后,转化毕赤酵母gs115感受态细胞,构建含表达载体ppiczαa-nuc/gs115的工程菌。
②用含50-500μg/ml博莱霉素(zeocin)的ypd固体培养基对阳性克隆进行压力筛选,30℃培养3天,得到酵母转化子。
③接种转化子至bmgy培养基中30℃培养24h后转换至bmmy培养基继续培养,并每隔12h补加0.5%甲醇。诱导72h后离心获取上清,利用电泳法测定融合蛋白表达量,筛选高表达工程菌。
(3)非融合nuc蛋白的发酵及纯化
①将ppiczαa-nuc/gs115高表达工程菌接种于bmgy培养基30℃培养24h后,作为种子液接种于发酵罐。发酵培养基为加入了微量元素的基础培养基,发酵温度30℃,ph5.0,溶氧不低于30%。菌体生长24h后开始补加甘油,当菌体od达到200时加入甲醇诱导表达。甲醇添加量控制在1-10ml/h,通过调节转速和通气量保持溶氧值大于20%,诱导发酵48-72h。
②发酵结束后,利用陶瓷膜超滤系统进行固液分离和脱盐浓缩,收集浓缩液依次使用离子交换层析和疏水层析进行纯化,得到纯化后的nuc蛋白。
发酵表达及纯化回收情况见表1。
表1本发明的核酸酶制备方法情况比较
从表1可以看出,按本发明方法,经融合hv1或hv2制备,纯化后nuc蛋白的比活性基本与非融合nuc蛋白一致,但表达量是后者的6-8倍,明显高于后者。且按本发明方法制备的nuc其比活性明显高于商购的benzonase,约是其2倍。本发明的纯化制备方法步骤简单、成本低廉,可大规模、低成本地制备灵杆菌核酸酶,一方面可大幅度降低该酶的工业使用成本,另一方面低廉的生产成本又可拓宽其工业应用范围。因此,本发明具有较大的实际应用价值。
尽管已经示出和描述了本发明的实施例,对于本领域的普通技术人员而言,可以理解在不脱离本发明的原理和精神的情况下可以对这些实施例进行多种变化、修改、替换和变型,本发明的范围由所附权利要求及其等同物限定。
序列表
<110>山东仁瑞生物科技有限公司
临沂大学
<120>一种在甲醇酵母中高效分泌融合表达以及重组制备灵杆菌核酸酶的方法
<160>8
<170>siposequencelisting1.0
<210>1
<211>65
<212>prt
<213>hirudomedicinalis
<400>1
valvaltyrthraspcysthrgluserglyglnasnleucysleucys
151015
gluglyserasnvalcysglyglnglyasnlyscysileleuglyser
202530
aspglyglulysasnglncysvalthrglygluglythrprolyspro
354045
glnserhisasnaspglyasppheglugluileprogluglutyrleu
505560
gln
65
<210>2
<211>65
<212>prt
<213>hirudomedicinalis
<400>2
ilethrtyrthraspcysthrgluserglyglnaspleucysleucys
151015
gluglyserasnvalcysglylysglyasnlyscysileleuglyser
202530
asnglyglugluasnglncysvalthrglygluglythrprolyspro
354045
glnserhisasnaspglyasppheglugluileprogluglutyrleu
505560
gln
65
<210>3
<211>65
<212>prt
<213>人工序列(artificialsequence)
<400>3
leuthrtyrthraspcysthrgluserglyglnasnleucysleucys
151015
gluglyserasnvalcysglyglnglyasnlyscysileleuglyser
202530
aspglyglulysasnglncysvalthrglygluglythrprolyspro
354045
glnserhisasnaspglyasppheglugluileprogluglutyrleu
505560
gln
65
<210>4
<211>247
<212>prt
<213>人工序列(artificialsequence)
<400>4
glyseraspthrleugluserileaspasncysalavalglycyspro
151015
thrglyglyserserasnvalserilevalarghisalatyrthrleu
202530
asnasnasnserthrthrlysphealaasntrpvalalatyrhisile
354045
thrlysaspthrproalaserglylysthrargasntrplysthrasp
505560
proalaleuasnproalaaspthrleualaproalaasptyrthrgly
65707580
alaasnalaalaleulysvalaspargglyhisglnalaproleuala
859095
serleualaglyvalserasptrpgluserleuasntyrleuserasn
100105110
ilethrproglnlysseraspleuasnglnglyalatrpalaargleu
115120125
gluaspglngluarglysleuileaspargalaaspileserserval
130135140
tyrthrvalthrglyproleutyrgluargaspmetglylysleupro
145150155160
glythrglnlysalahisthrileproseralatyrtrplysvalile
165170175
pheileasnasnserproalavalasnhistyralaalapheleuphe
180185190
aspglnasnthrprolysglyalaaspphecysglnpheargvalthr
195200205
valaspgluileglulysargthrglyleuileiletrpalaglyleu
210215220
proaspaspvalglnalaserleulysserlysproglyvalleupro
225230235240
gluleumetglycyslysasn
245
<210>5
<211>317
<212>prt
<213>人工序列(artificialsequence)
<400>5
valvaltyrthraspcysthrgluserglyglnasnleucysleucys
151015
gluglyserasnvalcysglyglnglyasnlyscysileleuglyser
202530
aspglyglulysasnglncysvalthrglygluglythrprolyspro
354045
glnserhisasnaspglyasppheglugluileprogluglutyrleu
505560
glnaspaspaspasplysglyseraspthrleugluserileaspasn
65707580
cysalavalglycysprothrglyglyserserasnvalserileval
859095
arghisalatyrthrleuasnasnasnserthrthrlysphealaasn
100105110
trpvalalatyrhisilethrlysaspthrproalaserglylysthr
115120125
argasntrplysthraspproalaleuasnproalaaspthrleuala
130135140
proalaasptyrthrglyalaasnalaalaleulysvalasparggly
145150155160
hisglnalaproleualaserleualaglyvalserasptrpgluser
165170175
leuasntyrleuserasnilethrproglnlysseraspleuasngln
180185190
glyalatrpalaargleugluaspglngluarglysleuileasparg
195200205
alaaspileserservaltyrthrvalthrglyproleutyrgluarg
210215220
aspmetglylysleuproglythrglnlysalahisthrileproser
225230235240
alatyrtrplysvalilepheileasnasnserproalavalasnhis
245250255
tyralaalapheleupheaspglnasnthrprolysglyalaaspphe
260265270
cysglnpheargvalthrvalaspgluileglulysargthrglyleu
275280285
ileiletrpalaglyleuproaspaspvalglnalaserleulysser
290295300
lysproglyvalleuprogluleumetglycyslysasn
305310315
<210>6
<211>977
<212>dna
<213>人工序列(artificialsequence)
<400>6
ctcgagaagagagttgtttacactgattgtactgaatctggtcaaaatttgtgcttgtgt60
gagggatctaatgtttgtggtcaaggtaataagtgcatcttgggttctgatggagaaaag120
aaccaatgtgtcactggtgaaggtactccaaagcctcaatctcataacgatggtgatttc180
gaagaaattccagaagaatacttgcaagatgatgatgataagggttctgatactttggaa240
tctatcgataactgtgctgttggttgtccaactggtggttcttctaacgtttctattgtt300
agacatgcttacactttgaacaacaactctactactaagttcgctaactgggttgcttat360
cacattactaaagatactcctgcttctggtaaaactagaaattggaaaactgatccagct420
ttgaaccctgctgatactttggctccagctgattacactggtgctaatgctgctttgaag480
gttgatagaggtcatcaagctcctttggcttctttggctggtgtttctgattgggaatct540
ttgaactatttgtctaacatcactccacaaaagtctgatttgaaccaaggtgcttgggct600
agattggaagatcaagagagaaagttgatcgatagagctgatatttcttctgtttacact660
gttactggtcctttgtatgagagagatatgggtaaattgccaggtactcaaaaagctcat720
actattccttctgcttactggaaggttattttcattaacaactctccagctgttaatcac780
tatgctgctttcttgttcgatcaaaacactcctaagggtgctgatttttgtcaattcaga840
gttactgttgatgaaatcgagaaaagaactggtttgatcatctgggctggtttgccagat900
gatgttcaagcttctttgaagtctaaaccaggtgttttgcctgagttgatgggttgtaaa960
aactgataagcggccgc977
<210>7
<211>317
<212>prt
<213>人工序列(artificialsequence)
<400>7
valvaltyrthraspcysthrgluserglyglnasnleucysleucys
151015
gluglyserasnvalcysglyglnglyasnlyscysileleuglyser
202530
aspglyglulysasnglncysvalthrglygluglythrprolyspro
354045
glnserhisasnaspglyasppheglugluileprogluglutyrleu
505560
glnaspaspaspasplysglyseraspthrleugluserileaspasn
65707580
cysalavalglycysprothrglyglyserserasnvalserileval
859095
arghisalatyrthrleuasnasnasnserthrthrlysphealaasn
100105110
trpvalalatyrhisilethrlysaspthrproalaserglylysthr
115120125
argasntrplysthraspproalaleuasnproalaaspthrleuala
130135140
proalaasptyrthrglyalaasnalaalaleulysvalasparggly
145150155160
hisglnalaproleualaserleualaglyvalserasptrpgluser
165170175
leuasntyrleuserasnilethrproglnlysseraspleuasngln
180185190
glyalatrpalaargleugluaspglngluarglysleuileasparg
195200205
alaaspileserservaltyrthrvalthrglyproleutyrgluarg
210215220
aspmetglylysleuproglythrglnlysalahisthrileproser
225230235240
alatyrtrplysvalilepheileasnasnserproalavalasnhis
245250255
tyralaalapheleupheaspglnasnthrprolysglyalaaspphe
260265270
cysglnpheargvalthrvalaspgluileglulysargthrglyleu
275280285
ileiletrpalaglyleuproaspaspvalglnalaserleulysser
290295300
lysproglyvalleuprogluleumetglycyslysasn
305310315
<210>8
<211>977
<212>dna
<213>人工序列(artificialsequence)
<400>8
ctcgagaagagagttgtttacactgattgtactgaatctggtcaaaatttgtgcttgtgt60
gagggatctaatgtttgtggtcaaggtaataagtgcatcttgggttctgatggagaaaag120
aaccaatgtgtcactggtgaaggtactccaaagcctcaatctcataacgatggtgatttc180
gaagaaattccagaagaatacttgcaagatgatgatgataagggttctgatactttggaa240
tctatcgataactgtgctgttggttgtccaactggtggttcttctaacgtttctattgtt300
agacatgcttacactttgaacaacaactctactactaagttcgctaactgggttgcttat360
cacattactaaagatactcctgcttctggtaaaactagaaattggaaaactgatccagct420
ttgaaccctgctgatactttggctccagctgattacactggtgctaatgctgctttgaag480
gttgatagaggtcatcaagctcctttggcttctttggctggtgtttctgattgggaatct540
ttgaactatttgtctaacatcactccacaaaagtctgatttgaaccaaggtgcttgggct600
agattggaagatcaagagagaaagttgatcgatagagctgatatttcttctgtttacact660
gttactggtcctttgtatgagagagatatgggtaaattgccaggtactcaaaaagctcat720
actattccttctgcttactggaaggttattttcattaacaactctccagctgttaatcac780
tatgctgctttcttgttcgatcaaaacactcctaagggtgctgatttttgtcaattcaga840
gttactgttgatgaaatcgagaaaagaactggtttgatcatctgggctggtttgccagat900
gatgttcaagcttctttgaagtctaaaccaggtgttttgcctgagttgatgggttgtaaa960
aactgataagcggccgc977
- 还没有人留言评论。精彩留言会获得点赞!