东莨菪素苯磺酰基呋咱氮氧化物类衍生物及其制备方法与用途与流程
本发明属于生物医药领域,具体涉及一种东莨菪素苯磺酰基呋咱氮氧化物类衍生物及其制备方法与应用。
技术背景
癌症又称恶性肿瘤,其形成和发展的内在机制十分复杂。据世界卫生组织(wto)统计,全世界每年约有690万人死于癌症,预计到2035年全球癌症死亡人数将达到2400万。同时,全球每年因癌症带来的损失高达数千亿美元。因此,肿瘤已经对人类的健康和社会的进步构成了严重的危害。
目前,肿瘤的治疗方法主要有三种:手术治疗、放射治疗和化学治疗。化学治疗最为常见。尽管已有多种抗癌药物用于临床,但由于肿瘤细胞极易产生耐药性以及化疗药物毒副作用大等缺点,使得现有化疗药物难以满足临床治疗的需求。因此,寻求高效、低毒、靶向性强、生物利用度高的新型抗肿瘤药物具有重要的意义。
东莨菪素(scopoletin)为香豆素类天然产物,可从多种药用植物如颠茄科东莨菪、颠茄以及伞形科白芷、防风等中提取分离获得,具有抗肿瘤、抗氧化、抗炎等多种活性。东莨菪素对多种肿瘤细胞表现出较佳的增殖抑制作用,且对正常细胞无毒性,引起众多科研工作者的关注。作用机制研究表明,东莨菪素能够通过诱导细胞凋亡和周期阻滞途径杀伤肿瘤细胞[1]。尽管东莨菪素具有较明确的抗肿瘤活性,但其活性有待继续提高。
一氧化氮(no)能够调节多种细胞信号转导通路,已被证实是癌症治疗中有效的损伤介质。通常高浓度的no能够显著抑制肿瘤细胞的增殖甚至诱导其死亡。药理研究表明,细胞内高浓度的no可以通过上调p53,parp,dna-pk等相关蛋白的表达,从而抑制dna修复[2]。现阶段,已经开发了许多化学no供体以提供外源性no。其中,苯磺酰基呋咱氮氧化物是一种重要的no供体,可以释放高水平的细胞内no进而抑制细胞的生长。
参考文献:
1、c.l.li,x.c.han,h.zhang,j.s.wu,b.li,effectofscopoletinonapoptosisandcellcyclearrestinhumanprostatecancercellsinvitro.trop.j.pharm.res,2015,14,611–617.
2、w.m.xu,l.z.liu,m.loizidou,m.ahmed,i.g.charles,theroleofnitricoxideincancer.cellres.2002,12,311–320.
技术实现要素:
本发明的目的是采用骈合原理,以东莨菪素为先导化合物,通过不同链接臂在其c-7位引入苯磺酰基呋咱氮氧化物结构单元,同时在其c-3位引入不同取代基,旨在寻找抗肿瘤活性更强的东莨菪素苯磺酰基呋咱氮氧化物类衍生物。
本发明的目的是通过以下技术方案实现的:
如结构式i所示的东莨菪素苯磺酰基呋咱氮氧化物类衍生物:
其中,r选自h、乙酰氨基、氨基;
x选自–(ch2)n–,n=2~6的整数。
具体地讲,通式i所示的东莨菪素苯磺酰基呋咱氮氧化物类衍生物优选自下列化合物i-1到i-15:
本发明的另一个目的是提供所述的东莨菪素苯磺酰基呋咱氮氧化物类衍生物的制备方法,包括:以n,n-二甲基甲酰胺为反应溶剂,以碳酸钾为缚酸剂,式ⅱ所示化合物与溴醇反应生成式ⅲ所示化合物;以二氯甲烷为反应溶剂,在催化剂1,8-二氮杂二环十一碳-7-烯(dbu)作用下,式ⅲ所示化合物与3,4-二苯环酰基-1,2,5-噁二唑-2-氧化物反应得到东莨菪素苯磺酰基呋咱氮氧化物类衍生物。
其中,r选自h、乙酰氨基、氨基;
x选自–(ch2)n–,n=2~6的整数。
制备化合物iii时,所述的碳酸钾和式ⅱ所示化合物的摩尔比为1~3:1;所述的溴醇和式ⅱ所示化合物的摩尔比为1~2:1;反应温度为50~60℃。
制备化合物i时,所述的3,4-二苯环酰基-1,2,5-噁二唑-2-氧化物和式iii所示化合物的摩尔比为1~2:1;所述的1,8-二氮杂二环十一碳-7-烯和式iii所示化合物的摩尔比为1.5~3:1;反应温度为–15~0℃。
本发明的另一个目的是提供一种药物组合物,它以本发明所述的东莨菪素苯磺酰基呋咱氮氧化物类衍生物类为有效成分,辅以药学上可接受的载体,制成任何药学上可接受的剂型。
所述的剂型选自片剂、胶囊、滴丸、颗粒、粉剂、锭剂、水性或油性悬浮剂、注射剂。
本发明的另一个目的是提供所述的莨菪素苯磺酰基呋咱氮氧化物类衍生物或以所述的东莨菪素苯磺酰基呋咱氮氧化物类衍生物类为有效成分的药物组合物在制备抗肿瘤药物中的用途。
所述的肿瘤为乳腺癌、肝癌、肺癌。
本发明的有益效果:
本发明莨菪素苯磺酰基呋咱氮氧化物类衍生物的制备方法反应条件温和,所用试剂低毒,原料易得,后处理方便,产率较高。药理实验研究表明,本发明化合物对肿瘤细胞的增殖抑制作用显著优于东莨菪素,具有优良的抗肿瘤活性,初步研究表明能够激活细胞线粒体凋亡途径,诱导肿瘤细胞死亡。因此,本发明化合物可以制备抗肿瘤药物。
附图说明
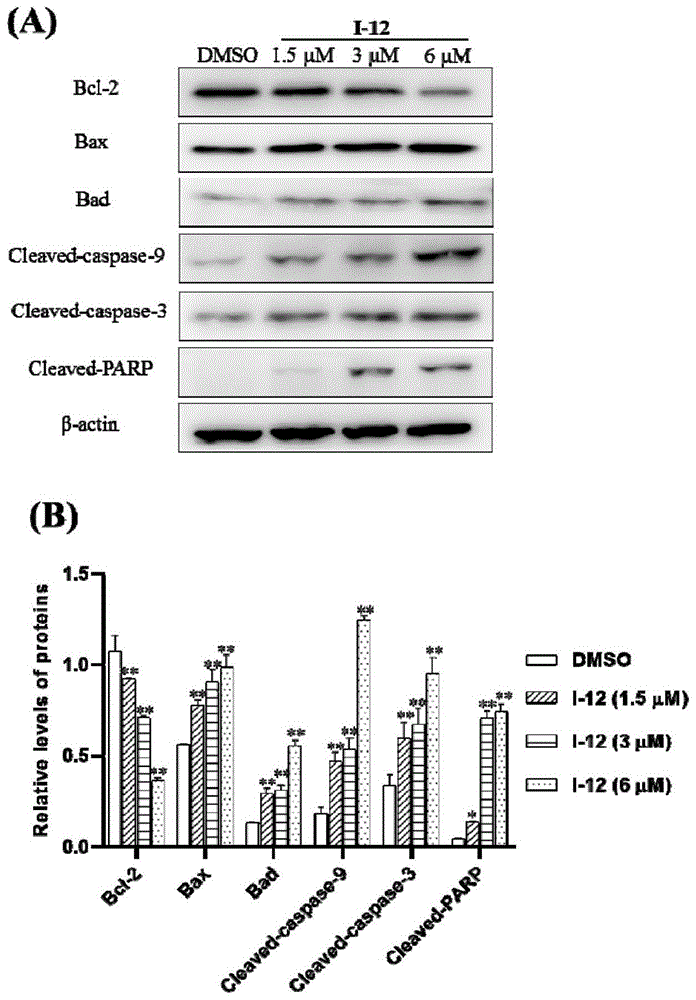
图1为化合物i-12免疫蛋白印记实验结果;其中,图1a为不同浓度化合物i-12作用8h后,细胞内bcl-2、bax、bad、cleaved-caspase-9、cleaved-caspase-3、cleaved-parp蛋白表达水平的westernblot灰度显影;图1b为细胞内bcl-2、bax、bad、cleaved-caspase-9、cleaved-caspase-3、cleaved-parp蛋白相对浓度。
具体实施方案
为进一步阐明本发明的技术方案,下面列举一系列实施例。这些实施例是例证性的,不应当理解为对本发明的限制。
实施例1:3,4-二苯环酰基-1,2,5-噁二唑-2-氧化物(化合物2)的制备
反应瓶内加入苯硫酚(22.0g,0.2mol)、氢氧化钠(8.0g,0.2mol)、95%乙醇(90ml),搅拌备用,缓慢滴加182ml含氯乙酸(20.3g,0.22mol)和碳酸钠(15.2g,0.11mol)的水溶液,室温搅拌3h,回流1h,冷却至室温,减压蒸馏除去乙醇,5%盐酸调节ph值为6,过滤,得苯硫乙酸26g。
反应瓶中加入苯硫乙酸(16.8g,0.1mol)、乙酸(75ml),双氧水(6.8g,0.2mol)缓慢滴加至反应瓶中,室温搅拌3h,缓慢滴加硝酸(12.6g,0.2mol),滴加完升温至100℃反应4h,过滤,干燥得白色结晶(化合物2)13.3g,产率44.1%。化合物2鉴定为3,4-二苯环酰基-1,2,5-噁二唑-2-氧化物。
esi-ms(m/z):389[m+na]+。
1hnmr(300mhz,dmso-d6,tms),δppm:7.76–7.73(m,2h),7.81–7.77(m,2h),7.97–7.89(m,4h),8.13–8.10(m,2h).
实施例2:7-羟基-6-甲氧基香豆素(化合物6)的制备
2,4-二羟基-5-甲氧基苯甲醛(化合物3)的制备
在两颈瓶内加入三氯化铝(80g,0.6mol)及催化剂量的十六烷基三甲基溴化铵(ctab,1g,2.7mmol)、无水二氯甲烷(400ml);将2,4,5-三甲氧基苯甲醛(20g,0.1mol)溶于无水二氯甲烷(100ml)中,缓慢滴加至两颈瓶中,滴加完后,加热回流4h。tlc检测反应结束,反应液倒入预冷至0℃的500ml10%盐酸中,搅拌0.5h,分取有机层,饱和氯化钠溶液洗涤三次,无水硫酸钠干燥,过滤,滤液浓缩,甲苯重结晶,得淡黄色针状结晶(化合物3)12.1g,产率72.2%。化合物3鉴定为2,4-二羟基-5-甲氧基苯甲醛。
esi-ms(m/z):167[m-h]-。
1h-nmr(300mhz,cdcl3,tms),δppm:3.90(3h,s),6.40(1h,s),6.51(1h,s),6.87(1h,s),9.66(1h,s),11.31(1h,s).
3-羧基-7-羟基-6-甲氧基香豆素(化合物4)的制备
在反应瓶内加入化合物3(6.07g,36mmol)、丙二酸(7.49g,72mmol)、苯胺(0.14g,1.44mmol)和吡啶(40ml),室温搅拌24h,tlc检测反应结束,5%盐酸调节ph值为4,过滤,滤饼干燥,乙醇重结晶,得黄色固体(化合物4)6.65g,产率78.7%。化合物4鉴定为3-羧基-7-羟基-6-甲氧基香豆素。
esi-ms(m/z):234[m-h]-。
1hnmr(300mhz,dmso-d6,tms),δppm:3.82(3h,s),6.81(1h,s),7.44(1h,s),8.67(1h,s),10.91(1h,s),12.84(1h,s).
7-羟基-6-甲氧基香豆素(化合物6)的制备
在反应瓶内加入化合物4(5g,21.3mmol)、吡啶(50ml),加热回流5h,冷却至室温,5%盐酸调节ph值为4,加入二氯甲烷(150ml)稀释,分取有机层,饱和氯化钠溶液洗涤三次,无水硫酸钠干燥,滤液浓缩,乙酸乙酯/石油醚(v:v=1:1)重结晶,得黄色固体(化合物6)2.06g,产率51.1%。化合物6鉴定为7-羟基-6-甲氧基香豆素。
esi-ms(m/z):191[m-h]-。
1hnmr(300mhz,dmso-d6,tms),δppm:3.98(3h,s),6.25(1h,d,j=9.6hz),6.84(1h,s),6.92(1h,s),7.58(1h,d,j=9.6hz).
实施例3:7-羟基-6-甲氧基-3-乙酰氨基香豆素(化合物7)的制备
6-甲氧基-3-乙酰氨基-7-乙酰氧基香豆素(化合物5)的制备
在反应瓶内加入化合物3(6.07g,36mmol)、甘氨酸(5.43g,72.5mmol)、乙酸钠(11.86g,145mmol)、乙酸酐(250ml),加热回流4h,tlc检测反应结束,冷却至室温,过滤,滤饼用乙醇(50ml)洗涤,干燥,乙酸重结晶得黄白色固体(化合物5)1.57g,产率15.0%。化合物5鉴定为6-甲氧基-3-乙酰氨基-7-乙酰氧基香豆素。
esi-ms(m/z):314[m+na]+。
1hnmr(300mhz,dmso-d6,tms),δppm:2.17(3h,s),2.28(3h,s),3.82(3h,s),7.28(1h,s),7.49(1h,s),8.64(1h,s),9.72(1h,s).
7-羟基-6-甲氧基-3-乙酰氨基香豆素(化合物7)的制备
在反应瓶内加入化合物5(1.5g,5.15mmol),碳酸钾(782mg,5.67mmol),甲醇(50ml),加热回流1h,tlc检测反应结束,冷却至室温,5%盐酸调节ph值为6,抽滤,滤饼干燥,乙醇重结晶,得黄白色固体(化合物7)831.8mg,产率64.8%。化合物7鉴定为7-羟基-6-甲氧基-3-乙酰氨基香豆素。
esi-ms(m/z):248[m-h]-。
1hnmr(300mhz,dmso-d6,tms),δppm:1.98(3h,s),3.81(3h,s),6.78(1h,s),7.24(1h,s),8.54(1h,s),9.56(1h,s),10.05(1h,s).
实施例4:中间体3-氨基-7-羟基-6-甲氧基香豆素(化合物8)的制备
在反应瓶内加入化合物5(1.5g,5.15mmol)、36%盐酸(30ml)、乙醇(15ml),80℃回流2h,tlc检测反应结束,冷却至室温,10%naoh溶液调节ph值为6,过滤,滤饼干燥,乙醇重结晶,得白色固体(化合物8)673.0mg,产率63.1%。化合物8鉴定为3-氨基-7-羟基-6-甲氧基香豆素。
esi-ms(m/z):206[m-h]+。
1hnmr(300mhz,dmso-d6,tms),δppm:3.74(3h,s),5.28(2h,s),6.70(1h,s),6.71(1h,s),6.96(1h,s),9.47(1h,s).
实施例5:6-甲氧基-7-(2-(3-苯磺酰基-1,2,5-噁二唑-2-氧化物)乙氧基)香豆素(化合物i-1)的制备
在反应瓶内加入化合物6(100.0mg,0.52mmol)、2-溴乙醇(78.1mg,0.63mmol)、碳酸钾(107.6mg,0.78mmol)、n,n-二甲基甲酰胺(dmf,15ml),50~60℃回流8h,冷却至室温,加入10%氢氧化钠溶液(30ml),0~5℃搅拌0.5h,过滤,得6-甲氧基-7-(2-羟基乙氧基)-香豆素94.2mg。
反应瓶内加入6-甲氧基-7-(2-羟基乙氧基)-香豆素(60.0mg,0.205mmol)、化合物2(89.9mg,0.246mmol)、1,8-二氮杂二环十一碳-7-烯(dbu,77.9mg,0.512mmol)、二氯甲烷(15ml),-15~0℃反应5h,tlc检测反应结束,反应体系加入二氯甲烷(50ml),有机层用5%稀盐酸洗涤三次,无水硫酸钠干燥,滤液浓缩,硅胶柱层析(二氯甲烷/甲醇=200:1,v:v),得白色固体(化合物i-1)69.2mg,产率58.9%。化合物i-1鉴定为6-甲氧基-7-(2-(3-苯磺酰基-1,2,5-噁二唑-2-氧化物)乙氧基)香豆素。
posi-hrms(m/z):461.06527[m+h]+。
1hnmr(300mhz,dmso-d6,tms),δppm:3.79(3h,s),4.50(2h,t,j=3.9hz),4.84(2h,t,j=3.9hz),6.36(1h,d,j=9.3hz),7.18(1h,s),7.29(1h,s),7.59–7.64(2h,m),7.77–7.82(1h,m),7.99(1h,d,j=9.3hz),7.99–8.02(2h,m).
实施例6:6-甲氧基-7-(2-(3-苯磺酰基-1,2,5-噁二唑-2-氧化物)丙氧基)香豆素(化合物i-2)的制备
参照化合物i-1的制法,以化合物3-溴-1-丙醇(87.6mg,0.63mmol)替换化合物2-溴乙醇,其他条件不变,制得白色固体(化合物i-2)51.3mg,产率45.1%。化合物i-2鉴定为6-甲氧基-7-(2-(3-苯磺酰基-1,2,5-噁二唑-2-氧化物)丙氧基)香豆素。
posi-hrms(m/z):497.06244[m+na]+。
1hnmr(300mhz,dmso-d6,tms),δppm:2.28–2.36(2h,m),3.81(3h,s),4.23(2h,t,j=6.0hz),4.60(2h,t,j=6.3hz),6.35(1h,d,j=9.6hz),7.12(1h,s),7.29(1h,s),7.69–7.75(2h,m),7.84–7.90(1h,m),8.00(1h,d,j=9.6hz),8.02–8.05(2h,m).
实施例7:6-甲氧基-7-(2-(3-苯磺酰基-1,2,5-噁二唑-2-氧化物)丁氧基)香豆素(化合物i-3)制备
参照化合物i-1的制法,以化合物4-溴-1-丁醇(96.4mg,0.63mmol)替换化合物2-溴乙醇,其他条件不变,制得白色固体(化合物i-3)28.7mg,产率25.9%。化合为i-3鉴定6-甲氧基-7-(2-(3-苯磺酰基-1,2,5-噁二唑-2-氧化物)丁氧基)香豆素。
posi-hrms(m/z):511.46607[m+na]+。
1hnmr(300mhz,cdcl3,tms),δppm:2.41–2.49(4h,m),3.87(3h,s),4.26(2h,t,j=6.0hz),4.67(2h,t,j=6.0hz),6.30(1h,d,j=9.6hz),6.86(1h,s),6.87(1h,s),7.56–7.61(2h,m),7.62(1h,d,j=9.6hz),7.71–7.76(1h,m),8.01–8.04(2h,m).
实施例8:6-甲氧基-7-(2-(3-苯磺酰基-1,2,5-噁二唑-2-氧化物)戊氧基)香豆素(化合物i-4)的制备
参照化合物i-1的制法,以化合物5-溴-1-戊醇(96.4mg,0.63mmol)替换化合物2-溴乙醇,其他条件不变,制得白色固体(化合物i-4)40.2mg,产率37.1%。化合物i-4鉴定为6-甲氧基-7-(2-(3-苯磺酰基-1,2,5-噁二唑-2-氧化物)戊氧基)香豆素。
posi-hrms(m/z):525.09275[m+na]+。
1hnmr(300mhz,dmso-d6,tms),δppm:1.51–1.61(2h,m),1.80–1.91(4h,m),3.82(3h,s),4.13(2h,t,j=6.3hz),4.44(2h,t,j=6.3hz),6.32(1h,d,j=9.6hz),7.12(1h,s),7.27(1h,s),7.73–7.75(2h,m),7.87–7.93(1h,m),7.98(1h,d,j=9.6hz),8.03–8.06(2h,m).
实施例9:6-甲氧基-7-(2-(3-苯磺酰基-1,2,5-噁二唑-2-氧化物)己氧基)香豆素(化合物i-5)的制备
参照化合物i-1的制法,以化合物6-溴-1-己醇(96.4mg,0.63mmol)替换化合物2-溴乙醇,其他条件不变,制得白色固体(化合物i-5)45.4mg,产率42.8%。化合物i-5鉴定为6-甲氧基-7-(2-(3-苯磺酰基-1,2,5-噁二唑-2-氧化物)己氧基)香豆素。
posi-hrms(m/z):539.10953[m+na]+。
1h-nmr(300mhz,dmso-d6,tms),δppm:1.55–1.40(4h,m),1.76–1.85(4h,m),3.83(3h,s),4.11(1h,t,j=6.3hz),4.42(1h,t,j=6.3hz),6.31(1h,d,j=9.3hz),7.08(1h,s),7.27(1h,s),7.74–7.79(2h,m),7.89–7.93(1h,m),7.97(1h,d,j=9.3hz),8.02–8.05(2h,m).
实施例10:6-甲氧基-7-(2-(3-苯磺酰基-1,2,5-噁二唑-2-氧化物)乙氧基)-3-乙酰氨基香豆素(化合物i-6)的制备
参照化合物i-1的制法,以化合物7(129.5mg,0.52mmol)替换化合物6,其他条件不变,制得白色固体(化合物i-6)43.7mg,产率41.3%。化合物i-6鉴定为6-甲氧基-7-(2-(3-苯磺酰基-1,2,5-噁二唑-2-氧化物)乙氧基)-3-乙酰氨基香豆素。
posi-hrms(m/z):539.10953[m+nh4]+。
1h-nmr(300mhz,dmso-d6,tms),δppm:2.19(3h,s),3.78(1h,s),4.48(2h,t,j=6.0hz),4.84(2h,t,j=6.0hz),7.17(1h,s),7.33(1h,s),7.59–7.65(2h,m),7.78–7.83(1h,m),7.97–8.00(2h,m),8.63(1h,s),9.67(1h,s).
实施例11:6-甲氧基-7-(2-(3-苯磺酰基-1,2,5-噁二唑-2-氧化物)丙氧基)-3-乙酰氨基香豆素(化合物i-7)的制备
参照化合物i-1的制法,以化合物7(129.5mg,0.52mmol)替换化合物6,3-溴-1-丙醇(87.6mg,0.63mmol)替换化合物2-溴乙醇,其他条件不变,制得白色固体(化合物i-7)48.5mg,产率46.7%。化合物i-7鉴定为6-甲氧基-7-(2-(3-苯磺酰基-1,2,5-噁二唑-2-氧化物)丙氧基)-3-乙酰氨基香豆素。
posi-hrms(m/z):532.10229[m+h]+。
1h-nmr(300mhz,dmso-d6,tms),δppm:2.18(3h,s),2.29–2.32(2h,m),3.80(3h,s),4.20(2h,t,j=5.7hz),4.59(2h,t,j=6.0hz),7.11(1h,s),7.32(1h,s),7.69–7.74(2h,m),7.84–7.89(1h,m),8.01–8.04(2h,m),8.61(1h,s),9.66(1h,s).
实施例12:6-甲氧基-7-(2-(3-苯磺酰基-1,2,5-噁二唑-2-氧化物)丁氧基)-3-乙酰氨基香豆素(化合物i-8)的制备
参照化合物i-1的制法,以化合物7(129.5mg,0.52mmol)替换化合物6,化合物4-溴-1-丁醇(96.4mg,0.63mmol)替换化合物2-溴乙醇,其他条件不变,制得白色固体(化合物i-8)29.1mg,产率28.6%。化合物i-8鉴定为6-甲氧基-7-(2-(3-苯磺酰基-1,2,5-噁二唑-2-氧化物)丁氧基)-3-乙酰氨基香豆素。
posi-hrms(m/z):568.09998[m+na]+。
1h-nmr(300mhz,dmso-d6,tms),δppm:1.86–2.01(4h,m),2.17(3h,s),3.81(3h,s),4.16(2h,t,j=6.0hz),4.52(2h,t,j=5.7hz),7.11(1h,s),7.31(1h,s),7.72–7.77(2h,m),7.88–7.93(1h,m),8.02–8.05(2h,m),8.60(1h,s),9.64(1h,s).
实施例13:6-甲氧基-7-(2-(3-苯磺酰基-1,2,5-噁二唑-2-氧化物)戊氧基)-3-乙酰氨基香豆素(化合物i-9)的制备
参照化合物i-1的制法,以化合物7(129.5mg,0.52mmol)替换化合物6,化合物5-溴-1-戊醇(96.4mg,0.63mmol)替换化合物2-溴乙醇,其他条件不变,制得白色固体(化合物i-9)35.4mg,产率35.4%。化合物i-9鉴定为6-甲氧基-7-(2-(3-苯磺酰基-1,2,5-噁二唑-2-氧化物)戊氧基)-3-乙酰氨基香豆素。
posi-hrms(m/z):582.11527[m+na]+。
1h-nmr(300mhz,dmso-d6,tms),δppm:1.62–1.69(2h,m),1.91–1.95(4h,m),2.27(3h,s),3.91(3h,s),4.19(2h,t,j=6.0hz),4.54(2h,t,j=6.0hz),7.20(1h,s),7.39(1h,s),7.82–7.87(2h,m),7.97–8.02(1h,m),8.12–8.15(2h,m),8.69(1h,s),9.73(1h,s).
实施例14:6-甲氧基-7-(2-(3-苯磺酰基-1,2,5-噁二唑-2-氧化物)己氧基)-3-乙酰氨基香豆素(化合物i-10)的制备
参照化合物i-1的制法,以化合物7(129.5mg,0.52mmol)替换化合物6,化合物6-溴-1-己醇(96.4mg,0.63mmol)替换化合物2-溴乙醇,其他条件不变,制得棕色固体(化合物i-10)53.3mg,产率54.1%。化合物i-10鉴定为6-甲氧基-7-(2-(3-苯磺酰基-1,2,5-噁二唑-2-氧化物)己氧基)-3-乙酰氨基香豆素。
posi-hrms(m/z):596.13049[m+na]+。
1h-nmr(300mhz,dmso-d6,tms),δppm:1.45–1.55(4h,m),1.78–1.82(4h,m),2.18(3h,s),3.83(3h,s),4.08(2h,t,j=6.3hz),4.42(2h,t,j=6.3hz),7.07(1h,s),7.30(1h,s),7.74–7.80(1h,m),7.89–7.94(1h,m),8.02–8.05(2h,m),8.60(1h,s),9.63(1h,s).
实施例15:6-甲氧基-7-(2-(3-苯磺酰基-1,2,5-噁二唑-2-氧化物)乙氧基)-3-氨基香豆素(化合物i-11)的制备
参照化合物i-1的制法,以化合物8(107.7mg,0.52mmol)替换化合物6,其他条件不变,制得棕色固体(化合物i-11)39.2mg,产率34.5%。化合物i-11鉴定为6-甲氧基-7-(2-(3-苯磺酰基-1,2,5-噁二唑-2-氧化物)乙氧基)-3-氨基香豆素。
posi-hrms(m/z):498.05770[m+na]+。
1h-nmr(300mhz,dmso-d6,tms),δppm:3.76(3h,s),4.41(2h,t,j=2.4hz),4.80(2h,t,j=2.4hz),5.78(2h,s),6.75(1h,s),7.04(1h,s),7.08(1h,s),7.61–7.66(2h,m),7.79–7.84(1h,m),7.98–8.01(2h,m).
实施例16:6-甲氧基-7-(2-(3-苯磺酰基-1,2,5-噁二唑-2-氧化物)丙氧基)-3-氨基香豆素(化合物i-12)的制备
参照化合物i-1的制法,以化合物8(107.7mg,0.52mmol)替换化合物6,3-溴-1-丙醇(87.6mg,0.63mmol)替换化合物2-溴乙醇,其他条件不变,制得棕色固体(化合物i-12)31.1mg,产率28.1%。化合物i-12鉴定为6-甲氧基-7-(2-(3-苯磺酰基-1,2,5-噁二唑-2-氧化物)丙氧基)-3-氨基香豆素。
posi-hrms(m/z):512.07329[m+na]+。
1h-nmr(300mhz,dmso-d6,tms),δppm:2.24–2.32(2h,m),3.78(3h,s),4.12–4.16(2h,t,j=6.0hz),4.59(2h,t,j=6.0hz),5.78(2h,s),6.75(1h,s),7.02(1h,s),7.03(1h,s),7.69-7.74(2h,m),7.84-7.90(1h,m),8.01-8.04(2h,m).
实施例17:6-甲氧基-7-(2-(3-苯磺酰基-1,2,5-噁二唑-2-氧化物)丁氧基)-3-氨基香豆素(化合物i-13)的制备
参照化合物i-1的制法,以化合物8(107.7mg,0.52mmol)替换化合物6,化合物4-溴-1-丁醇(96.4mg,0.63mmol)替换化合物2-溴乙醇,其他条件不变,制得棕色固体(化合物i-13)14.8mg,产率13.7%。化合物i-13鉴定为6-甲氧基-7-(2-(3-苯磺酰基-1,2,5-噁二唑-2-氧化物)丁氧基)-3-氨基香豆素。
posi-hrms(m/z):504.10771[m+h]+。
1h-nmr(300mhz,dmso-d6,tms),δppm:1.88–1.96(4h,m),3.79(3h,s),4.09(2h,t,j=6.3hz),4.51(2h,t,j=6.0hz),5.79(2h,s),6.74(1h,s),7.03(2h,s),7.72–7.78(2h,m),7.88–7.93(1h,m),8.02–8.05(2h,m).
实施例18:6-甲氧基-7-(2-(3-苯磺酰基-1,2,5-噁二唑-2-氧化物)戊氧基)-3-氨基香豆素(化合物i-14)的制备
参照化合物i-1的制法,以化合物8(107.7mg,0.52mmol)替换化合物6,化合物5-溴-1-戊醇(96.4mg,0.63mmol)替换化合物2-溴乙醇,其他条件不变,制得棕色固体(化合物i-14)35.7mg,产率33.7%。化合物i-14鉴定为6-甲氧基-7-(2-(3-苯磺酰基-1,2,5-噁二唑-2-氧化物)戊氧基)-3-氨基香豆素。
posi-hrms(m/z):540.10562[m+na]+。
1h-nmr(300mhz,dmso-d6,tms),δppm:1.54–1.57(2h,m),1.77–1.89(4h,m),3.79(3h,s),4.03(2h,t,j=6.0hz),4.44(2h,t,j=6.3hz),5.78(2h,s),6.75(1h,s),7.01(1h,s),7.02(1h,s),7.72–7.78(2h,m),7.87–7.92(1h,m),8.03–8.05(2h,m).
实施例19:6-甲氧基-7-(2-(3-苯磺酰基-1,2,5-噁二唑-2-氧化物)己氧基)-3-氨基香豆素(化合物i-15)的制备
参照化合物i-1的制法,以化合物8(107.7mg,0.52mmol)替换化合物6,化合物6-溴-1-己醇(96.4mg,0.63mmol)替换化合物2-溴乙醇,其他条件不变,制得棕色固体(化合物i-15)42.8mg,产率41.2%。化合物i-15鉴定为6-甲氧基-7-(2-(3-苯磺酰基-1,2,5-噁二唑-2-氧化物)己氧基)-3-氨基香豆素。
posi-hrms(m/z):554.12027[m+na]+。
1h-nmr(300mhz,dmso-d6,tms),δppm:1.38–1.54(4h,m),1.75–1.82(4h,m),3.80(3h,s),4.02(2h,t,j=6.3hz),4.42(2h,t,j=6.3hz),5.79(2h,s),6.75(1h,s),6.99(1h,s),7.02(1h,s),7.74–7.79(2h,m),7.89–7.94(1h,m),8.02–8.05(2h,m).
实施例20:体外肿瘤细胞增殖抑制能力测试
采用四甲基氮唑蓝比色法(mtt法)对本发明化合物进行抗肿瘤活性测试,选取阿霉素(doxorubicin)、东莨菪素(scopoletin)作为阳性对照药。
仪器:超净工作台(sw-cj-1fd,airtech,苏净安泰)、恒温co2培养箱(3111,thermo,美国)、倒置生物显微镜(ix71,olympus,日本)、酶联免疫检测仪(model680,bio-rad,美国)、平板摇床(kylin-belllabinstruments)、高压灭菌锅(yxo.sg41.280,上海华线),离心机(sigma)。
试剂:dmem培养基(gibco)、胎牛血清(gibco)、胰蛋白酶(sigma),dmso(sigma)。
细胞株:人乳腺癌细胞株mda-mb-231,人乳腺癌细胞株mcf-7,人肝癌细胞株hepg2,人非小细胞肺癌细胞株a549(均由江苏凯基生物技术股份有限公司提供)。
方法:复苏冻存的细胞株,置于恒温37℃、co2培养箱中培养,每天更换培养基一次,待其处于指数生长期且状态良好时,加入1ml0.25%胰蛋白酶消化液,消化1~2min,显微镜下观察贴壁细胞变圆皱缩时停止消化,收集细胞,加入5ml含10%胎牛血清的dmem培养基制备单细胞悬液,细胞计数,以每孔5×104个细胞数及总孔数计算所需细胞悬液的量,将细胞悬液接种于96孔细胞培养板,100μl/孔,96孔板周围用pbs液封,置于37℃、co2培养箱内培养24h。
用完全培养基配制待测化合物,细胞培养24h后,受试化合物加入96孔板中,使其终浓度为10μm/孔,设立3个复孔,继续培养48h。培养结束,将mtt试剂加入到96孔板中,终浓度为10μl/孔,继续孵育4h。吸除孔内培养基,每孔加入100μldmso,平板摇床振摇10min。酶联免疫检测仪在波长570nm处检测每孔的吸光值,并按下列公式计算化合物对细胞的抑制率,3次初筛结果平均值为其最终抑制率。受试化合物进一步浓度梯度筛选,计算其ic50值(graphpad软件计算),3次重复实验结果为所测化合物的最终ic50值。
细胞抑制率%=[(空白对照od值-给药组od值)/空白对照组od值]×100%
首先对所有受试化合物进行初步体外抗增殖活性筛选。采用人乳腺癌mcf-7细胞株进行抑制率测试,所得结果如表1所示。
表1.受试化合物对mcf-7细胞株的抑制作用
注:a:受试化合物的浓度为10μm,最终抑制率为三次独立平行实验的平均值。
由表1可知,除i-8、scopoletin外,其他受试化合物对mcf-7细胞的抑制率均大于50%,进一步对所有目标化合物进行ic50值的测定。
表2.受试化合物对mda-mb-231、mcf-7、hepg2、a549细胞株的抑制作用
由表2可知,所有目标化合物对mda-mb-231、mcf-7、hepg2、a549细胞存在良好的增殖抑制作用,其中以化合物i-12对人乳腺癌细胞株mda-mb-231抑制作用最佳(ic50=1.23μm)。东莨菪素c-3位为氨基取代时(i-11~i-15)对肿瘤细胞的抑制作用优于c-3位为氢原子(i-1~i-5)或乙酰氨基(i-6~i-10)取代的化合物,表明c-3位氨基取代时对抗肿瘤活性较为有利。同时,东莨菪素c-7位不同链长的连接臂对抗肿瘤作用有不同程度的影响,当链长为3或4个碳原子时,化合物的抗肿瘤作用较佳。
综上所述,所有受试化合物较于东莨菪素对mda-mb-231、mcf-7、hepg2、a549细胞株均具有较强的增殖抑制作用。其中以化合物i-12活性最佳,对肿瘤细胞株的ic50值分别为1.23±0.10μm、1.91±0.14μm、3.06±0.29μm、4.81±0.35μm,有望成为新的抗肿瘤药物,值得深入研究。
实施例21:化合物i-12免疫蛋白印记实验
已知细胞凋亡主要分为三种途径:(1)线粒体凋亡途径,亦称内源性凋亡;(2)死亡受体途径,亦称外源性凋亡;(3)内质网途径。本实验主要对线粒体凋亡途径进行初步研究,选取线粒体凋亡途径相关蛋白进行检测。促凋亡蛋白bad和bax驻留在细胞质中,在接受凋亡信号后转位到线粒体中,抗凋亡蛋白bcl-2驻留在线粒体外膜中;半胱氨酸(caspase)蛋白家族负责凋亡信号的激活,在凋亡通路中扮演重要角色。bcl-2表达水平降低,bad与bax表达水平升高,能够增加细胞线粒体膜通透性,进而剪切caspase-9;剪切后的caspase-9能够促进caspase-3蛋白酶的切割而激活。parp,即聚腺苷二磷酸核糖聚合酶,它是细胞凋亡核心成员caspase-3的切割底物,是细胞凋亡的一个标志。
采用免疫蛋白印记法(westernblot法)评价化合物i-12对线粒体凋亡途径相关蛋白的影响,dmso为阴性对照。
仪器:超净工作台(sw-cj-1fd,airtech,苏净安泰)、恒温co2培养箱(3111,thermo,美国)、平板摇床(kylin-belllabinstruments)、离心机(sigma)、高速冷冻离心机(eppendorf5430r,德国)、湿转转印槽(bio-radminitrans-blot,美国)、恒温金属浴(es1000)、天能凝胶成像系统(tanon-5200multi)。
试剂:dmem培养基(gibco)、胎牛血清(bsa,gibco)、胰蛋白酶(sigma),dmso(sigma)、雀巢脱脂奶粉、western及ip裂解液(keygen)、bca蛋白定量测定试剂盒(keygen)、sds凝胶配制试剂盒(keygen)、sds-page电泳液(keygen)、sds-page转膜液(keygen)、pmsf、sds-page5×loadingbuffer(keygen)、pagerulerprestproteinladder(10-170kd,thermo)、10×tbs(keygen)、ecl检测试剂盒(keygen)、吐温20(500ml,罗恩)。
抗体:bcl-2、bad、bax、cleavedcaspase-9、cleavedcaspase-3、cleavedparp(由abcam提供)。
细胞株:乳腺癌细胞株mda-mb-231(由江苏凯基生物技术股份有限公司提供)。
方法:
1.总蛋白提取:dmem培养基培养细胞,待其处于指数生长期且状态良好时,以1×106个/皿的密度接种于6cm培养皿中,培养24h,加入待测化合物i-12,继续培养8h,弃去上清,预冷的pbs洗1次,加入60μl细胞裂解液(每1mlwestern裂解液中加入10μl浓度为100mm的pmsf),置于冰上裂解1h,每隔5min涡旋一次,裂解结束,4℃、10000g离心5min,取上清,置于冰上备用。
2.bca法测定蛋白浓度:使用去离子水将储备浓度为5mg/ml的bsa稀释至0.05、0.1、0.2、0.3、0.4、0.6、0.8、1.0mg/ml,以去离子水作为对照。根据bca蛋白定量测定试剂盒测定不同浓度bsa及样本蛋白溶液的吸光值。利用标准品bsa的吸光值做回归曲线标定样本蛋白溶液浓度。按照每份样品3μg/μl的相同蛋白浓度,用裂解液和5×loadingbuffer补至相同的体积,于100℃变性8min,置于-80℃冰箱储藏待测。
3.蛋白质免疫印记实验步骤:将变性后的蛋白样品以每份10μl上样,80v进行sds-page聚丙烯酰胺凝胶电泳,直至loadingbuffer到达胶底部时,停止电泳。湿法转膜(300ma,1h)将蛋白转移到pvdf膜上。5%脱脂奶粉的tbst溶液(10×tbs;纯水:吐温20=9:1,v:v)封闭1h,用含tbst溶液洗三次(5min/次)。将pvdf膜置于一抗稀释液中(1ml一抗稀释液中含1μl一抗),4℃孵育过夜,用tbst溶液冲洗(5min×3次),然后放入二抗稀释液(1ml二抗稀释液中含1μl二抗)中,室温孵育1h,用tbst溶液冲洗(5min×3次)。根据ecl检测试剂盒操作说明、天能凝胶成像系统进行显影。imagej软件进行灰度分析。
结果分析:由图1可知,随着化合物i-12作用浓度的升高,bcl-2的表达水平浓度依赖性降低,bax、bad、cleavedcaspase-9与cleavedcaspase-3、cleaved-parp的表达水平浓度依赖性升高。基于上述实验结果可知,化合物i-12能够激活mda-mb-231细胞线粒体凋亡途径,诱导肿瘤细胞死亡。
- 还没有人留言评论。精彩留言会获得点赞!
- 新型磺酰亚胺盐化合物、其制造方法和包含其的光产酸剂以及感光性树脂组合物与制造工艺
- (R)‑3,5‑双(三氟甲基)苯乙醇的生物制备方法与制造工艺
- 一种五氟磺草胺和丙炔噁草酮复配可分散油悬浮剂及其制备方法与制造工艺
- 多孔性酰亚胺系树脂膜制造系统、隔膜、及多孔性酰亚胺系树脂膜制造方法与制造工艺
- 含酰亚胺结构的环三磷腈无卤阻燃剂、制备方法及用途与制造工艺
- 一种苝酰亚胺类化合物及其制备方法和应用与制造工艺
- 双芘修饰苝酰亚胺衍生物荧光探针及其合成方法和应用与制造工艺
- 一种耐高温表面自润滑的聚酰胺酰亚胺绝缘漆的制造方法与工艺
- 一种耐高温表面自润滑的聚酰胺酰亚胺绝缘漆的制造方法与工艺
- 一种无溶剂研磨法制备双苯磺酰亚胺的方法与制造工艺