本发明涉及植物生物化学技术领域,具体涉及一种同时分离提取玉米细胞核和叶绿体的方法。
背景技术:
细胞核含有几乎所有的遗传信息,对基因表达和调控极其重要。随着基因组测序的发展,dna纤维荧光原位杂交及大片段基因组文库的构建,对植物全基因组测序具有重要推动作用。而提取纯化的细胞核是制作dna纤维和构建大片段基因组文库的基础。
而叶绿体是质体的一种,其是高等植物和一些藻类所特有的能量转换器;双层膜结构使其与胞质分开,因其含叶绿素,故名为叶绿体,对叶绿体进行研究将有助于我们揭示其次生代谢物的合成机理,并进一步从分子水平对其叶绿体进行遗传改良以提高其次生代谢物的产量提供基础。
目前细胞核提取方法多数采用研磨植物组织或是先通过酶解法提取原生质体,然后再经绸布过滤、离心分离而获得细胞核。而目前植物叶绿体提取的方法也多是用离心分离的方法,但是不同来源的植物材料所需要的离心条件和提取介质则各不相同。
本发明人在长期的实践研究中发现,现有的玉米细胞核和叶绿体分离方法是两套互不兼容的分离体系,并且多采用蔗糖密度梯度离心,其主要缺陷为成本高、操作时间长,而残留的蔗糖成分会严重干扰到下游核酸、蛋白等相关的提取实验,而且纯化得到的是质量不佳的细胞核或叶绿体,特别是针对特殊且罕见的植株突变体,无法同时获得大量高纯度且有活性的细胞核和叶绿体,造成研究材料的极大的浪费。
因此,研究开发出一种可以兼顾提取分离细胞核和叶绿体,以提高分离细胞核和叶绿体的工作效率是十分必要的。
技术实现要素:
本发明要解决的技术问题是提供一种同时分离提取玉米细胞核和叶绿体的方法,以解决当前无法同时获得大量高纯度、且可保持活性的细胞核和叶绿体的技术难题。
本发明创新了破碎工艺,采用对细胞无毒害作用的percoll溶液构作为离介质,并建立了与之相匹配的可同时高效分离提取玉米细胞核和叶绿体的缓冲分离体系,不仅解决了分离所得细胞核和叶绿体相互污染的技术问题,而且可以显著提高分离效率和保持细胞器的完整性。
为解决上述技术问题,本发明采用如下技术方案:
设计一种同时分离提取玉米细胞核和叶绿体的方法,包括如下步骤:
(1)取玉米植株幼苗或叶片,剪碎后加入破碎缓冲液,研磨破碎后过滤得匀浆液,再经离心分离,弃上清液得沉淀物;
(2)向步骤(1)所得沉淀物中加入分离缓冲液混匀得到重悬液,再将所述重悬液加至percoll密度梯度分离液的上面,进行梯度离心分离;
(3)分别抽取分离液梯度交界面处的叶绿体和底部沉淀物,再分别加入纯化缓冲液进行离心纯化分离,去上清液得对应的叶绿体和细胞核。
优选的,在所述步骤(1)中,以重量份计,所述破碎缓冲液的配制试剂包括:
mops40~45份、nacl28~30份、kcl55~65份、edta6~8份、山梨醇180~185份。
所述破碎缓冲液还包括:在即将使用时加入的精胺0.3~0.5份、亚精胺0.6~0.8份和蔗糖850~860份。
优选的,在所述步骤(1)中,每研磨破碎3~5s后停顿5~10s,重复3~5次。
优选的,在所述步骤(2)中,以重量份计,所述分离缓冲液的配制试剂包括:
hepes115~120份、nacl20~25份、kcl55~65份、edta6~8份,抗坏血酸8~10份、精胺0.3~0.5份、亚精胺0.6~0.8份。
优选的,在所述步骤(2)中,所述percoll密度梯度分离液包括:
位于底层的体积分数35%的percoll分离液和位于上层的体积分数20%的percoll分离液,所述percoll分离液是由对应体积比的percoll和分离缓冲液配制而成。
优选的,在所述步骤(2)或/和步骤(3)中,离心分离的条件为:0~4℃,2000~3000g,离心6~10分钟。
优选的,在所述步骤(3)中,以重量份计,所述纯化缓冲液的配制试剂:
mops40~45份、nacl26~30份、kcl55~65份、edta6~8份。
优选的,所述破碎缓冲液、分离缓冲液、percoll密度梯度分离液以及纯化缓冲液使用前均在冰上预冷。
优选的,在所述步骤(1)中,研磨破碎采用榨汁机于0~4℃下间隔研磨破碎。
与现有技术相比,本发明的主要有益技术效果包括:
1.本发明综合考虑了细胞核和叶绿体在密度沉降、速率及大小上的差异,通过合理设置不同密度梯度percoll缓冲分离体系,将置于介质顶部的细胞匀浆液分层,使不同的细胞器停留在不同的密度,从而实现细胞核和叶绿体的分离;相比于传统的蔗糖密度梯度,本发明percoll密度梯度分离体系具有渗透性低、不穿透细胞、粘度低、密度高和无毒害等优点。
2.本发明所采用的研磨缓冲液能使研磨过程中的细胞器(叶绿体、细胞核)保持稳定,保护其不被破坏,可以同时得到活性高的细胞核和叶绿体,纯化后的细胞核提取率≥80%,叶绿体的提取率≥90%。
3.本发明通过合理设置相匹配的研磨缓冲体系、分离缓冲体系及纯化缓冲体系,以协同接续提高分离效率和保持细胞器的完整性;比如,研磨缓冲液中的亚精胺、精胺以及蔗糖成分协同作用可以稳定细胞核,而山梨醇可以调节研磨缓冲液的渗透势,稳定叶绿体结构;研磨缓冲液能保证在研磨过程中细胞器稳定,不被破坏;纯化缓冲液和percoll密度梯度分离液兼容性良好,同时保证纯化提取过程中的细胞器稳定,而且纯化缓冲液在保证细胞器稳定的同时不会干扰下游实验,能最大限度的保留细胞核和叶绿体的生物活性。
4.本发明方法尤其适用于有限样品量(如一些特殊少见的玉米突变体等)的细胞器提取试验,其可有效提高细胞核和叶绿体的提取数量,为科研提供相当数量的高质量的科研用细胞器,并节省植物材料,简化后续试验操作。
附图说明
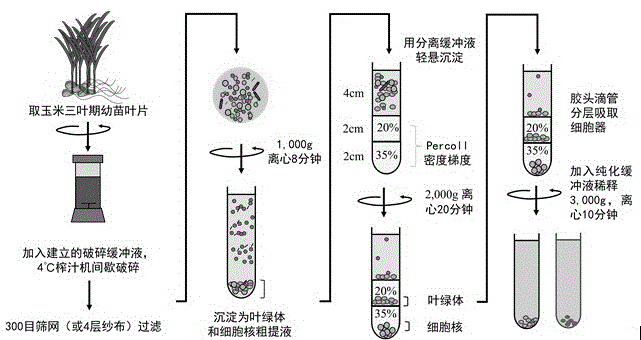
图1为本发明的工艺流程示意图。
图2为本发明分离提取到的玉米细胞核和叶绿体后的照片;其中,a为常规的蔗糖密度梯度法分离所得叶绿体镜检照片,b为本发明所得叶绿体镜检照片,c为本发明所得细胞核经dapi染色的镜检照片,d为本发明中经percoll密度梯度分离体系进行梯度离心分层后的照片。
具体实施方式
下面结合附图和实施例来说明本发明的具体实施方式,但以下实施例只是用来详细说明本发明,并不以任何方式限制本发明的范围。
在以下实施例中所涉及的仪器设备如无特别说明,均为常规仪器设备;所涉及的原料和试剂,如无特别说明,均为市售常规原料和试剂;所涉及的检测、测试、制备方法等,如无特别说明,均为常规方法。
实施例1
同时分离提取玉米叶片细胞核和叶绿体的方法,参见图1,包括如下步骤:
(1)取在16h光/8h暗,28℃/25℃(光/暗)及相对湿度60%的条件下水培至三叶期的玉米幼苗叶片,取4g玉米幼苗顶部4cm,将玉米幼苗叶片粗剪成5×5mm的小块,放入榨汁机中,加入75ml破碎缓冲液,置冰箱中4℃下间隔研磨破碎,每5s停顿6s,重复4次,再用300目的筛网过滤匀浆液于150ml锥形瓶中,置低温离心机中于4℃、1000g下离心5分钟,弃上清,所得沉淀物为含叶绿体和细胞核的粗提取物;
(2)向步骤(1)中所得沉淀物中加入0.5ml分离缓冲液得到重悬液,再将其加至percoll密度梯度分离液(上层为2ml的20%的percoll分离液,下层为2ml的35%的percoll分离液)上面,在4℃、2000g条件下离心分离10分钟,使其分层(参见图2中d);
(3)用胶头吸管从percoll密度梯度分离液上、下层交界部位收集叶绿体,加入0.5ml纯化缓冲液稀释,于4℃,3000g条件下离心10分钟,弃上清,所得沉淀即为纯化后的叶绿体,显微镜下观察形态及纯度(参见图2中b);用胶头吸管将离心管底部沉淀物吸取,加入0.5ml纯化缓冲液,轻弹离心管使沉淀松散后,4℃,3000g离心10分钟,弃上清,沉淀即为纯化后的细胞核,dapi染色观察后,显微镜下观察形态及纯度(参见图2中c)。
所述破碎缓冲液是由mops、nacl、kcl、edta、山梨醇及使用前即时加入的精胺、亚精胺和蔗糖溶于水配制而成,且溶液中的各组分的终浓度分别为:20mmmops、50mmnacl、80mmkcl、2.5mmedta、100mm山梨醇、0.2mm精胺和0.5mm亚精胺,缓冲液终ph值为7.5。
所述分离缓冲液是由hepes、nacl、kcl、edta,抗坏血酸、精胺、亚精胺溶于水配制而成,各成分的终浓度为:50mmhepes、40mmnacl、80mmkcl、2.5mmedta,5mm抗坏血酸、0.2mm精胺、0.5mm亚精胺,缓冲液终ph值为7.5。
所述纯化缓冲液是由mops、nacl、kcl、edta溶于水配制而成,各成分的终浓度为:20mmmops、50mmnacl、80mmkcl、2.5mmedta,缓冲液终ph值为7.5。
在配制以上各缓冲溶液时,可先将需要用到mops(3-吗啉丙磺酸)配制成相应的母溶液,再用稀naoh调节mops溶液ph值至7.5,以使mops能充分溶解,再与其它试剂混配;同样的,将edta(乙二胺四乙酸)配制成相应的母溶液,再用稀naoh调节edta溶液ph值至8.0,以使edta能充分溶解,方便使用;而同样的,取hepes(4-羟乙基哌嗪乙磺酸)配制成相应的母溶液,再用稀naoh调节hepes溶液ph值至8.0,以使其充分溶解,方便添加使用。
20%的percoll分离液:由0.4ml的percoll与1.6ml的分离缓冲液混合制成;
35%的percoll分离液:由0.7ml的percoll与1.3ml的分离缓冲液混合制成。
以上破碎缓冲液、分离缓冲液、percoll分离液以及纯化缓冲液使用前均在冰上预冷;离心机使用前预冷至4℃左右。
对比例
在实施实施例1中所述操作的同时,设置对照试验1(常规细胞核提取)和对照试验2(常规叶绿体提取法),其中对照试验1和对照试验2在提取纯化过程中仅采用了下表1中的缓冲液。纯化的细胞核先经过dapi染色后,转移至细胞计数板上并在荧光显微镜下,并统计细胞计数板上5个固定面积区域中形态完整的细胞核数目与总细胞核数目的比值,随后求这5个比值的平均值评估提取完成细胞核的百分比;纯化后的叶绿体直接转移至细胞计数板上并在显微镜下,统计计数板上5个固定面积的区域中形态完整、大小适中的叶绿体与总叶绿体数目的比值,随后求求这5个比值的平均值评估提取完成叶绿体的效率;其它主要操作顺序步骤与实施例1基本相同。相关的试验统计结果参见表1。
。
从附图2a中可以看出,传统方法提取的叶绿体中混杂有细胞核,且叶绿体破碎者居多,完整性差;从附图2b中可以看出,本实施例所提取到的叶绿体分布稠密,个体形态完整且少有杂质;从附图2c中可以看出,本实施例所提取到的细胞核分布稠密,个体形态完整且少有杂质;从附图2d中可以看出,本实例的密度体系分层清晰明确。
结合表1中所得到的数据指标可知,本发明所建立的研磨-分离-纯化体系可以同时有效的分离出高纯度的细胞核和叶绿体,且分离得到的细胞器完整性好,生物活性好。
上面结合附图和实施例对本发明作了详细的说明,但是,所属技术领域的技术人员能够理解,在不脱离本发明宗旨的前提下,还可以对上述实施例中的各个具体参数进行变更,或者是步骤方法的等同替代,从而形成多个具体的实施例,均为本发明的常见变化范围,在此不再一一详述。