半胱天冬酶生物传感器及应用、半胱天冬酶活性的检测方法与流程
本发明属于生物分析技术领域,涉及半胱天冬酶生物传感器及应用、半胱天冬酶活性的检测方法。
背景技术:
公开该背景技术部分的信息仅仅旨在增加对本发明的总体背景的理解,而不必然被视为承认或以任何形式暗示该信息构成已经成为本领域一般技术人员所公知的现有技术。
细胞凋亡是重要的程序性细胞死亡过程,通过消除机体不需要的细胞来调节一系列重要的生理过程和应激反应。半胱氨酸天冬氨酰特异性蛋白酶(半胱天冬酶)被认为是细胞凋亡的主要执行者,可以通过有效裂解特定的细胞底物(例如聚adp-核糖聚合酶和核纤溶酶)导致细胞凋亡。半胱天冬酶的活性异常可能会影响正常的细胞凋亡调节系统,并导致许多人类疾病如阿尔茨海默氏病、肝胆疾病、获得性免疫缺陷综合征(aids)以及多种癌症的发生。
据本发明的发明人所知,检测半胱天冬酶活性的方法有质谱法、高效液相色谱法、免疫组化分析法和免疫印迹法,但是这些方法存在步骤繁琐、测定时间较长、测定程序复杂以及抗体昂贵的问题,这可能会极大地限制它们的广泛应用。目前,已经开发出了多种基于电化学测定、表面增强拉曼散射测定、比色测定、生物发光测定或荧光测定的新策略,可以有效地检测半胱天冬酶的活性。其中,荧光方法因操作简便、灵敏度高和具多路复用能力的突出优点而最受欢迎。然而,经过本发明的发明人研究发现,这些荧光检测方法经常使用荧光标记(包括荧光蛋白和有机染料等)和淬灭标记的肽作为酶的底物来检测半胱天冬酶的活性,不仅增加了测定成本和探针合成的复杂程度,还可能因为荧光的不完全淬灭导致假阳性信号;同时,目前荧光法对于半胱天冬酶活性的检测灵敏度仍然较低。
技术实现要素:
为了解决现有技术的不足,本发明的目的是提供半胱天冬酶生物传感器及应用、半胱天冬酶活性的检测方法,不仅能够避免荧光标记,而且能够大大提高检测半胱天冬酶活性的灵敏度。
为了实现上述目的,本发明的技术方案为:
一方面,一种半胱天冬酶生物传感器,包括磁珠、检测探针、环形模板、dna聚合酶、二级引物;所述磁珠表面包覆链霉亲和素;所述环形模板为环形单链dna序列,所述二级引物为单链dna序列;
所述检测探针包括连接的肽底物结构域和dna引物结构域,所述肽底物结构域为氨基酸序列,所述dna引物结构域为单链dna序列;肽底物结构域含有特异位点,所述特异位点能够被半胱天冬酶识别并切割,所述特异位点与连接位点距离n个氨基酸,所述连接位点是肽底物结构域和dna引物结构域的连接处,所述肽底物结构域连接生物素,特异位点位于生物素与连接位点之间,所述n为小于10的自然数;
所述dna引物结构域能够与环形模板、dna聚合酶、二级引物配合进行分支滚环扩增反应。
核酸扩增技术是最直接、最有效的靶信号扩增方法,一系列扩增策略如聚合酶依赖性扩增策略(如聚合酶链式反应、链置换扩增反应和依赖解旋酶dna等温扩增)、连接酶信号扩增策略、核酸酶(核酸内切酶、核酸外切酶和其他核酸酶)辅助的信号放大策略和无酶信号放大策略等已成功应用于高灵敏生物传感领域。然而,半胱天冬酶的活性信号或其切割产物的信号不能像核酸一样被直接扩增,因而半胱天冬酶无法采用核酸扩增进行检测。
本发明将含有能够被半胱天冬酶识别并切割的特异位点的肽底物结构域与dna引物结构域连接,通过半胱天冬酶对肽底物结构域的切割,释放dna引物结构域,利用释放的dna引物结构域进行分支滚环扩增反应,从而实现利用核酸扩增对半胱天冬酶的活性进行检测。通过磁珠能够避免未释放的dna引物结构域与环形模板结合,从而避免影响检测半胱天冬酶的灵敏度。
另一方面,一种上述半胱天冬酶生物传感器在制备检测半胱天冬酶活性药剂中的应用。
第三方面,一种检测半胱天冬酶活性的试剂盒,包括上述半胱天冬酶生物传感器、缓冲液、脱氧核糖核苷三磷酸。
第四方面,一种半胱天冬酶活性的检测方法,提供上述半胱天冬酶生物传感器或试剂盒,通过链霉亲和素和生物素的相互作用使检测探针与磁珠连接,半胱天冬酶识别检测探针的特异位点并切割,释放dna引物结构域,释放的dna引物结构域与环形模板、dna聚合酶、二级引物进行分支滚环扩增反应,然后添加荧光染料进行荧光检测。
第五方面,一种上述半胱天冬酶生物传感器或检测半胱天冬酶活性的试剂盒在筛选抑制剂中的应用。
本发明的半胱天冬酶生物传感器可以将检测探针中的肽底物结构域改成其他氨基酸序列,以便其他内源性蛋白酶对肽底物结构域的特异性位点进行切割并释放dna引物结构域。因而第六方面,一种上述半胱天冬酶生物传感器在制备内源性蛋白酶活性检测药剂中的应用,所述特异位点能够被内源性蛋白酶识别并切割。
本发明的有益效果为:
1.本发明首次利用靶标半胱天冬酶催化肽-dna检测探针的裂解,将酶活性信号转化为dna信号,然后通过分支滚环扩增反应对dna信号进行指数式的扩增,以免荧光标记的方式对酶的活性进行检测。
2.本发明利用半胱天冬酶生物传感器对半胱天冬酶的活性检测具有超高的灵敏度,检出限为1.56×10-4单位每毫升(大约3.12×10-2纳克每毫升或6.95×10-2皮摩尔每升),线性动态范围为0.0005至0.4单位每毫升,即使在单细胞水平上也能定量检测出内源性半胱天冬酶-8的活性。灵敏度相比基于共轭聚合物的荧光测定法(0.2单位每毫升)提高了1282倍,相比基于点击反应的荧光分析(10皮摩尔每升)提高了143.9倍,相比基于金-硒键纳米探针的荧光分析(0.326纳克每毫升)提高了84.68倍。
3.本发明除了能对半胱天冬酶-8的活性进行定量检测,通过更改探针的肽序列(氨基酸序列),还能轻松实现对其他蛋白酶的灵敏检测;此外,本发明在成分复杂的实际样品中也能很好地对酶活性进行灵敏测定。同时,本发明能在单细胞水平上高灵敏地检测内源性蛋白酶的活性,还可以进一步用于酶的动力学分析和抑制剂筛选,应用范围广泛。
附图说明
构成本发明的一部分的说明书附图用来提供对本发明的进一步理解,本发明的示意性实施例及其说明用于解释本发明,并不构成对本发明的不当限定。
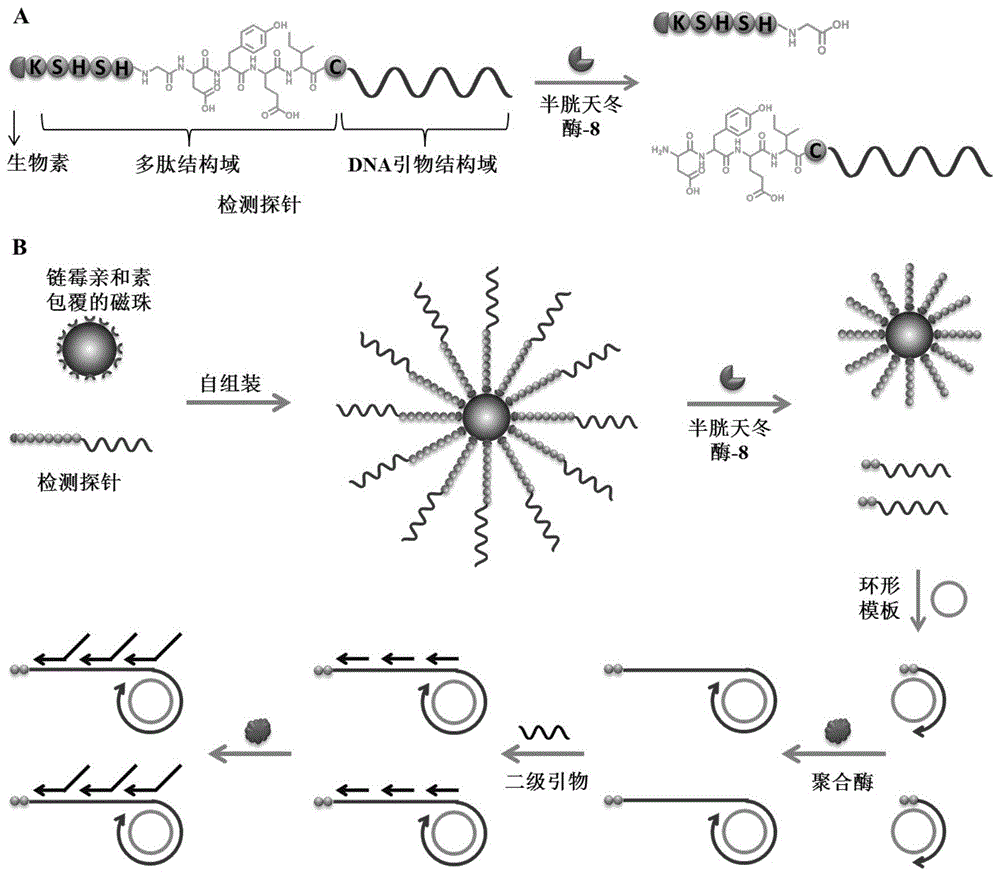
图1为本发明实施例1检测半胱天冬酶-8的原理图;a为检测探针释放dna引物的过程原理图,b为检测半胱天冬酶-8的过程原理图。
图2为本发明实施例1原理验证结果图;a为半胱天冬酶-8消化反应的12%非变性凝胶电泳分析图,泳道m:20bpdnaladdermarker(标准对照条带),泳道1:检测探针,泳道2:合成的裂解产物肽-dna,泳道3:含有25单位每毫升的半胱天冬酶-8的实验组,泳道4:不含半胱天冬酶-8的对照组;b为分支滚环扩增反应产物的1%琼脂糖凝胶电泳分析图,泳道m:dl10,000dnamarker(标准对照条带),泳道1:含有15单位每毫升的半胱天冬酶-8的实验组,泳道2:无半胱天冬酶-8的对照组;c为对分支滚环扩增反应的实时荧光监测。
图3为本发明实施例1的灵敏度检测实验结果图;a为不同浓度的半胱天冬酶-8在0.0005至50单位每毫升时的荧光发射光谱,曲线由下至上浓度分别为0.0005u/ml、0.001u/ml、0.005u/ml、0.02u/ml、0.05u/ml、0.1u/ml、0.4u/ml、1u/ml、2.5u/ml、5u/ml、10u/ml、15u/ml、25u/ml、50u/ml;b为在0.0005至50单位每毫升范围内,随着半胱天冬酶-8浓度的增加,524纳米处荧光强度的变化;c为在0.0005单位每毫升至0.4单位每毫升范围内,荧光强度与半胱天冬酶-8浓度的对数呈现线性关系。误差棒表示三次重复实验的标准偏差。
图4为本发明实施例1检测不同酶的荧光强度柱状图;半胱天冬酶-3、半胱天冬酶-9和半胱天冬酶-8的浓度均为25单位每毫升;误差棒表示三次重复实验的标准偏差。
图5为本发明实施例1用初速度法分析酶的动力学参数曲线;误差棒表示三次重复实验的标准偏差。
图6为本发明实施例1检测的半胱天冬酶-8在不同浓度z-ietd-fmk存在时相对活性的变化曲线;误差棒表示三次重复实验的标准偏差。
图7为本发明实施例1检测实际样品的结果图;a为不同细胞裂解液的荧光强度柱状图;b为与丝裂霉素c孵育2小时后,524纳米处的荧光强度与hela细胞的数量的对数呈线性关系;误差棒表示三次重复实验的标准偏差。
具体实施方式
应该指出,以下详细说明都是示例性的,旨在对本发明提供进一步的说明。除非另有指明,本文使用的所有技术和科学术语具有与本发明所属技术领域的普通技术人员通常理解的相同含义。
需要注意的是,这里所使用的术语仅是为了描述具体实施方式,而非意图限制根据本发明的示例性实施方式。如在这里所使用的,除非上下文另外明确指出,否则单数形式也意图包括复数形式,此外,还应当理解的是,当在本说明书中使用术语“包含”和/或“包括”时,其指明存在特征、步骤、操作、器件、组件和/或它们的组合。
鉴于现有检测半胱天冬酶活性的方法存在检测复杂、成本高、荧光难以完全淬灭、灵敏度低等缺陷,本发明提出了半胱天冬酶生物传感器及应用、半胱天冬酶活性的检测方法。
本发明的一种典型实施方式,提供了一种半胱天冬酶生物传感器,包括磁珠、检测探针、环形模板、dna聚合酶、二级引物;所述磁珠表面包覆链霉亲和素;所述环形模板为环形单链dna序列,所述二级引物为单链dna序列;
所述检测探针包括连接的肽底物结构域和dna引物结构域,所述肽底物结构域为氨基酸序列,所述dna引物结构域为单链dna序列;肽底物结构域含有特异位点,所述特异位点能够被半胱天冬酶识别并切割,所述特异位点与连接位点距离n个氨基酸,所述连接位点是肽底物结构域和dna引物结构域的连接处,所述肽底物结构域连接生物素,特异位点位于生物素与连接位点之间,所述n为小于10的自然数;
所述dna引物结构域能够与环形模板、dna聚合酶、二级引物配合进行分支滚环扩增反应。
本发明将含有能够被半胱天冬酶识别并切割的特异位点的肽底物结构域与dna引物结构域连接,通过半胱天冬酶对肽底物结构域的切割,释放dna引物结构域,利用释放的dna引物结构域进行分支滚环扩增反应,从而实现利用核酸扩增对半胱天冬酶的活性进行检测。通过磁珠能够避免未释放的dna引物结构域与环形模板结合,从而避免影响检测半胱天冬酶的灵敏度。
该实施方式的一种或多种实施例中,所述特异位点为天冬氨酸和甘氨酸之间的肽键。
该实施方式的一种或多种实施例中,n为5。
该实施方式的一种或多种实施例中,dna聚合酶为phi29dna聚合酶。
该实施方式的一种或多种实施例中,所述检测探针的序列为:
lys-ser-his-ser-his-gly-asp-thr-glu-ile-cys-cattcggtagtaggttgtatagttg
所述环形模板的序列为:caactatacaacctactaccgaatgaatatgaacacattctaagtctctatgtctggcaacagtgt
所述二级引物的序列为:cattctaagtctctatgtctg。
本发明的另一种实施方式,提供了一种上述半胱天冬酶生物传感器在制备检测半胱天冬酶活性药剂中的应用。
本发明的第三种实施方式,提供了一种检测半胱天冬酶活性的试剂盒,包括上述半胱天冬酶生物传感器、缓冲液、脱氧核糖核苷三磷酸。
本发明的第四种实施方式,提供了一种半胱天冬酶活性的检测方法,提供上述半胱天冬酶生物传感器或试剂盒,通过链霉亲和素和生物素的相互作用使检测探针与磁珠连接,半胱天冬酶识别检测探针的特异位点并切割,释放dna引物结构域,释放的dna引物结构域与环形模板、dna聚合酶、二级引物进行分支滚环扩增反应,然后添加荧光染料进行荧光检测。
本发明所述的半胱天冬酶活性的检测方法优选以非疾病的诊断与治疗为目的。
该实施方式的一种或多种实施例中,将磁珠与检测探针在室温下进行第一次孵育,然后洗涤去除未与磁珠连接的检测探针。本发明所述的室温是指室内环境的温度,一般为20~30℃。该系列实施例中,孵育时间为25~35min。
该实施方式的一种或多种实施例中,将半胱天冬酶添加至检测溶液中,所述检测溶液中含有连接检测探针的磁珠,在人体温度下进行第二次孵育,将孵育后中磁珠分离去除,获得清液,向清液中添加环形模板、二级引物、dna聚合酶、脱氧核糖核苷三磷酸进行第三次孵育,再向第三次孵育后的产物添加荧光染料,然后进行荧光检测。所述人体温度为人体正常温度,一般为36.2~37.2℃。
该系列实施例中,第二次孵育的时间25~35min。
该系列实施例中,向清液中添加环形模板、二级引物加热至90~100℃处理,冷却后加入dna聚合酶、脱氧核糖核苷三磷酸进行第三次孵育。
该系列实施例中,第三次孵育的温度为25~35℃,孵育时间为55~65min。
该系列实施例中,第三次孵育后在64~66℃的温度条件下处理。终止分支滚环扩增反应。
该实施方式的一种或多种实施例中,荧光检测的激发波长为495nm。
本发明的第五种实施方式,提供了一种上述半胱天冬酶生物传感器或检测半胱天冬酶活性的试剂盒在筛选抑制剂中的应用。
本发明的第六种实施方式,提供了一种上述半胱天冬酶生物传感器在制备内源性蛋白酶活性检测药剂中的应用,所述特异位点能够被内源性蛋白酶识别并切割。
为了使得本领域技术人员能够更加清楚地了解本发明的技术方案,以下将结合具体的实施例详细说明本发明的技术方案。
实施例1
材料的制备与检测:
细胞培养和细胞提取物的制备:将人宫颈癌细胞(hela)和人乳腺癌细胞(mcf-7)分别用含有10%胎牛血清和1%青霉素-链霉素双抗的达尔伯克改良伊格尔培养基(dmem)在37摄氏度、含5%二氧化碳的培养箱中进行培养。对于实际样品分析,通过胰蛋白酶消化收集处于指数生长期的细胞,并使用countstar生物技术有限公司的自动细胞计数器ic1000进行活细胞计数,用冰冷的1倍工作浓度的pbs洗涤两次后以800转每分钟的速度离心5分钟。然后将细胞重悬于100微升裂解缓冲液(含有150毫摩尔每升的氯化钠、1%的np-40、0.25毫摩尔每升的脱氧胆酸钠、1.0%的甘油、0.1毫摩尔每升的4-(2-氨基乙基)苯磺酰氟盐酸盐和10毫摩尔每升ph为8.0的三羟甲基氨基甲烷-盐酸)中,在冰上孵育30分钟,同时每5分钟涡旋30秒,然后在4摄氏度下以12000转每分钟的速度离心20分钟;对于丝裂霉素c(mmc)诱导的凋亡分析,在细胞裂解之前,先将细胞在含有100微克每毫升丝裂霉素c的5毫升dmem中预孵育2小时。将离心收集到的上清液转移到新管中并立即使用。使用nanodrop2000c分光光度计测量细胞提取物中的蛋白质浓度。
用检测探针组装链霉亲和素包覆的磁珠:根据制造商提供的操作手册进行检测探针-磁珠(mbs)的组装。用1倍工作浓度的磷酸盐缓冲溶液(pbs)将100微升的10毫克每毫升链霉亲和素包被的磁珠溶液洗涤两次。用190微升1倍工作浓度的pbs重悬后,加入10微升10微摩尔每升的检测探针,在室温下30分钟通过生物素-链霉亲和素相互作用形成检测探针-磁珠纳米结构。然后将检测探针-磁珠用1倍工作浓度的pbs洗涤五次,以通过磁分离除去未偶联的探针,并重悬于50微升1倍工作浓度的pbs中。
半胱天冬酶-8的活性检测:半胱天冬酶-8的活性分析包括两个步骤:(1)半胱天冬酶-8对探针的消化反应和(2)分支滚环扩增反应。以20微升的体积进行半胱天冬酶-8的消化反应:将13微升的1倍工作浓度的pbs、4微升的检测探针-磁珠和3微升不同浓度的重组半胱天冬酶-8混合,并在37摄氏度下孵育30分钟。磁分离后,将含有消化产物的上清液用于下一步。对于分支滚环扩增反应,分别制备混合液a和b:混合液a包含10纳摩尔每升的环形模板、10纳摩尔每升的二级引物、1倍工作浓度的phi29dna聚合酶反应缓冲液(含50毫摩尔每升的三羟甲基氨基甲烷-盐酸、10毫摩尔每升的氯化镁、10毫摩尔每升的硫酸铵、4毫摩尔每升的二硫苏糖醇,ph=7.5)和2微升的上步反应液;混合液b包含600微摩尔每升的脱氧核糖核苷三磷酸(dntp)、200微克每毫升的牛血清白蛋白(bsa)和2个单位的phi29dna聚合酶。首先将混合液a在95摄氏度下变性5分钟后缓慢冷却至室温;然后将混合液a和b充分混合后在30摄氏度下孵育1小时以进行分支滚环扩增反应,通过在65摄氏度下加热20分钟来终止该反应。
其中,检测探针的序列为:biotin-lys-ser-his-ser-his-gly-asp-thr-glu-ile-cys-cattcggtagtaggttgtatagttg。
检测探针的多肽部分(肽底物结构域)是由中肽生化有限公司定制合成的,所有dna引物(dna引物结构域)的合成工作及多肽部分(肽底物结构域)与dna引物(dna引物结构域)的连接均由宝日医生物技术(北京)有限公司(takara)完成。
其中,多肽部分(肽底物结构域)的序列为:lys-ser-his-ser-his-gly-asp-thr-glu-ile-cys,见seqidno.1,dna引物(dna引物结构域)的序列为:cattcggtagtaggttgtatagttg,见seqidno.2。
环形模板的序列为:caactatacaacctactaccgaatgaatatgaacacattctaagtctctatgtctggcaacagtgt,见seqidno.3。
二级引物的序列:cattctaagtctctatgtctg,见seqidno.4。
荧光测量:用超纯水和1倍工作浓度的sybrgold染料将40微升的扩增反应产物稀释至60微升。使用微量石英比色皿在日立f-7000荧光分光光度计上以495纳米的激发波长测量荧光光谱。记录在510至610纳米波长范围内的发射光谱,激发和发射的狭缝宽度均为5纳米,采集524纳米处的荧光强度用于数据分析。实时荧光测量在cfx联合实时系统中进行,每30秒监测一次荧光强度。
凝胶电泳:室温下,使用110伏的恒定电压,在1倍工作浓度的tbe缓冲液(含9毫摩尔每升的三羟甲基氨基甲烷-盐酸、9毫摩尔每升的硼酸和0.2毫摩尔每升ph=7.9的乙二胺四乙酸)中通过12%的非变性聚丙烯酰胺凝胶电泳(page)分析半胱天冬酶-8的消化产物,电泳时间为50分钟。在室温和120伏的恒定电压下,通过1%的琼脂糖凝胶电泳分析分支滚环扩增反应的扩增产物,使用1倍工作浓度的tae缓冲液(40毫摩尔每升的三羟基氨甲烷-乙酸、2毫摩尔每升ph=8.0的乙二胺四乙酸),电泳时间为60分钟。凝胶电泳中使用的染料为sybrgold,通过伯乐chemidocmp成像系统对胶图进行拍摄和分析。
酶动力学分析:为了评估半胱天冬酶-8的酶动力学参数,我们测量了在15单位每毫升的半胱天冬酶-8存在时不同浓度的检测探针-磁珠在37摄氏度下反应5分钟时的初始速度。
酶抑制剂分析:为了评估苄氧羰基-异亮氨酸-葡萄糖-苏氨酸-天冬氨酸-氟甲基酮(z-ietd-fmk)对半胱天冬酶-8活性的影响,我们将不同浓度的z-ietd-fmk与15单位每毫升的半胱天冬酶-8分别在室温下孵育10分钟后,将4微升的检测探针-磁珠和6微升1倍工作浓度的pbs添加到混合物中。接下来的检测过程与半胱天冬酶-8的活性检测相同。
回收率测定:将总体积为20微升的反应混合物(含掺入1%胎牛血清fbs的不同浓度半胱天冬酶-8、4微升检测探针-磁珠和1倍工作浓度的pbs)在37摄氏度下孵育30分钟,接下来的检测过程与上述半胱天冬酶-8的活性检测相同。
实验原理(如图1):如图1a所示,生物素化的检测探针包含两个功能结构域(即用于检测半胱天冬酶-8活性的肽底物结构域和用于触发滚环扩增反应的dna引物结构域),通过半胱天冬酶-8在天冬氨酸和甘氨酸残基之间肽键的消化裂解可以释放dna引物。对于半胱天冬酶-8的检测(图1b),检测探针通过特异性的链霉亲和素-生物素相互作用,在链霉亲和素包覆的磁珠表面完成自组装。加入半胱天冬酶-8后,肽底物被消化切割,dna引物可通过磁性分离与未切割的检测探针区分开。此后,释放的dna引物可与环形模板结合,在phi29dna聚合酶的作用下触发滚环扩增反应,生成长的单链dna产物。另外,加入的二级引物可进一步与滚环扩增反应的产物结合以引发额外的扩增反应,形成分支滚环扩增,从而实现指数式的信号放大。分支滚环扩增反应产生了许多dna链,通过使用sybrgold作为荧光染料就可以免标记的方式对半胱天冬酶-8的活性进行检测。相反,在靶标半胱天冬酶-8不存在的情况下,检测探针保持完整因此没有dna引物被释放,无法发生分支滚环扩增反应以产生放大的荧光信号。由于使用磁分离导致的低背景信号和利用分支滚环扩增反应实现的指数式信号放大,即使在单细胞水平,也能高灵敏、免标记地检测凋亡相关半胱天冬酶的活性。
检测结果:
1.原理的实验验证
半胱天冬酶-8对检测探针的消化切割是本实施例记载的技术方案的关键步骤,已通过12%的非变性聚丙烯酰胺凝胶电泳(page)分析证实。如图2a所示,在半胱天冬酶-8存在的情况下(图2a,泳道3),观察到类似于商业合成的裂解产物肽-dna的条带(图2a,泳道2),表明半胱天冬酶-8确实消化切割了检测探针。相反,在半胱天冬酶-8不存在的情况下,观察到更高分子量的条带(图2a,泳道4),它与完整的检测探针位置相同(图2a,泳道1),这说明没有半胱天冬酶-8时,检测探针不会发生断裂。以上这些结果清楚地表明,本实施例构建的肽-dna检测探针可用于半胱天冬酶-8的活性检测。
此后,使用1%的琼脂糖凝胶电泳研究了半胱天冬酶-8触发的分支滚环扩增反应(图2b)。在没有半胱天冬酶-8的对照组中(图2b,泳道2),未观察到明显的dna产物,表明没有滚环扩增反应发生。相反,在存在半胱天冬酶-8时观察到明显的扩增特征分散带(图2b,泳道1),表明半胱天冬酶-8触发了分支滚环扩增反应。同时,采用实时荧光测量的方式监测了分支滚环扩增反应的发生(图2c)。在半胱天冬酶-8存在的情况下,rfu(相对荧光单位)呈s形升高,并在60分钟内达到平台(图2c,实线),表明分支滚环扩增反应引起的指数式信号放大已发生。在没有半胱天冬酶-8的对照组中(图2c,虚线),未观察到明显的rfu增加,表明没有分支滚环扩增反应发生。这些结果表明,分支滚环扩增反应可用于半胱天冬酶-8活性的定量检测。
2.灵敏度实验
为了研究本实施例记载的方案的检测灵敏度,在优化的实验条件下测量了不同浓度的半胱天冬酶-8对荧光强度的影响(图3)。如图3a、b所示,随着半胱天冬酶-8的浓度从0.0005增加到50单位每毫升,524纳米处的荧光强度也逐渐增强。此外,在对数尺度上,在0.0005至0.4单位每毫升的浓度范围内荧光强度与半胱天冬酶-8的浓度呈线性相关,线性相关系数(r2)为0.9979(图3c)。线性回归方程为f=588.5+97.44log10c,其中f为524纳米的荧光强度,c为半胱天冬酶-8的浓度(单位每毫升)。检出限(lod)经过计算为1.56×10-4单位每毫升(约3.12×10-2纳克每毫升或6.95×10-2皮摩尔每升)。与基于共轭聚合物的荧光测定法(0.2单位每毫升)、基于点击反应的荧光分析方法(10皮摩尔每升)和基于金-硒键纳米探针的荧光分析方法(0.326纳克每毫升)相比,本技术方案的灵敏度分别提高了1282倍、143.9倍和84.68倍。本实施例记载的技术方案灵敏度的显著提高可归因于:(1)通过对肽-dna检测探针的切割可将半胱天冬酶-8的活性信号有效地转化为dna信号;(2)通过高扩增效率的分支滚环扩增反应实现的指数式的信号放大。此外,本实施例记载的技术方案的选择性较好,可以区分不同的半胱天冬酶家族成员(图4)。
3.动力学分析
为了验证本实施例记载的技术方案用于酶的动力学分析的可行性,本实施例测量了响应于不同浓度检测探针的酶促反应初始速度(v)。如图5所示,初始速度随着检测探针浓度1到15微摩尔每升的增加而逐渐增加。确定的初始速度最大值为4.937每秒,米氏常数(km)计算为1.025微摩尔每升。这个km值与通过基于商业荧光底物的方法得到的km值(大约4微摩尔每升)相似。表明本实施例记载的技术方案可用于半胱天冬酶-8的动力学分析。
4.抑制剂实验
半胱天冬酶的活性抑制剂是潜在的疾病治疗药物。使用z-ietd-fmk作为模型抑制剂测试了本实施例记载的技术方案在半胱天冬酶-8活性抑制测定方面的能力。z-ietd-fmk是一种具有细胞透过性并能不可逆地抑制半胱天冬酶-8活性的四肽型抑制剂。如图6所示,半胱天冬酶-8的相对活性随着z-ietd-fmk浓度从0增加到10微摩尔每升而逐渐降低。使半胱天冬酶-8的活性降低50%(ic50)所需的抑制剂浓度为0.9656微摩尔每升。这些结果表明,本实施例记载的技术方案可用于半胱天冬酶-8抑制剂的筛选,在药物开发和疾病治疗中具有巨大的潜力。
5.实际样品分析
为了验证本实施例记载的技术方案用于实际样品分析的可行性,本实施例检测了人宫颈癌细胞系(hela)和人乳腺癌细胞系(mcf-7)中内源性半胱天冬酶-8的活性。如图7a所示,与没有任何细胞提取物的对照组的低背景信号相比,在存在mcf-7和hela提取物的情况下,检测到明显的高荧光信号。此外,凋亡激活剂丝裂霉素c(mmc)用于进一步测试本技术方案检测半胱天冬酶诱导细胞凋亡的能力。与丝裂霉素c共孵育2小时后,制备细胞提取物并测量其中半胱天冬酶-8的活性。与未经丝裂霉素c处理的细胞相比,丝裂霉素c导致了mcf-7细胞和hela细胞中荧光信号的显著增加,这表明半胱天冬酶-8的激活可能与丝裂霉素c诱导的细胞凋亡有关。此外,在对数尺度下,在1-10000个细胞范围内,荧光强度与丝裂霉素c孵育的hela细胞数量呈线性相关。回归方程为f=280.64+140.97log10n,线性相关系数(r2)为0.991,其中f为524纳米处的荧光强度,n为细胞数,如图7b所示。这些结果表明,即使在单细胞水平,本实施例记载的技术方案也可用于内源性半胱天冬酶-8活性的准确和高灵敏度检测。
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
sequencelisting
<110>山东师范大学
<120>半胱天冬酶生物传感器及应用、半胱天冬酶的检测方法
<130>
<160>4
<170>patentinversion3.3
<210>1
<211>11
<212>prt
<213>人工序列
<400>1
lysserhisserhisglyaspthrgluilecys
1510
<210>2
<211>25
<212>dna
<213>人工序列
<400>2
cattcggtagtaggttgtatagttg25
<210>3
<211>66
<212>dna
<213>人工序列
<400>3
caactatacaacctactaccgaatgaatatgaacacattctaagtctctatgtctggcaa60
cagtgt66
<210>4
<211>21
<212>dna
<213>人工序列
<400>4
cattctaagtctctatgtctg21
- 还没有人留言评论。精彩留言会获得点赞!