一种丝状真菌抑制剂及其应用的制作方法
本发明涉及一种丝状真菌抑制剂及其应用,属于生物
技术领域:
。
背景技术:
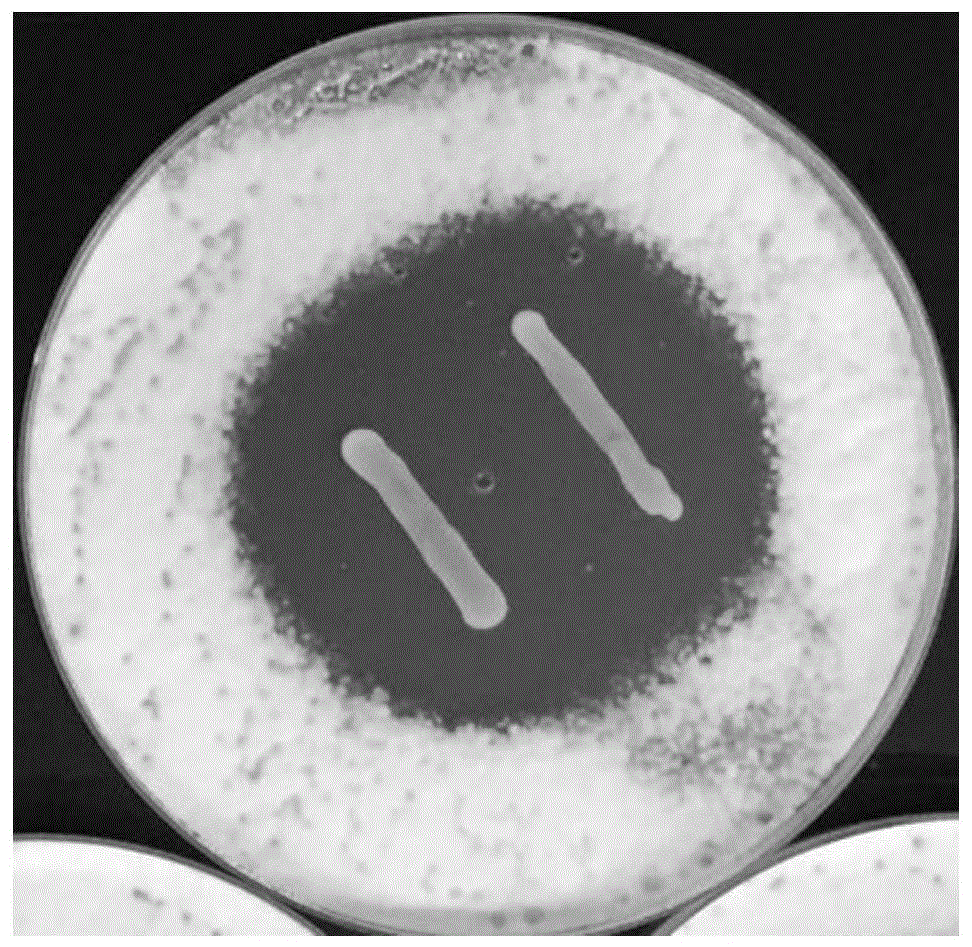
:果蔬腐败会导致果蔬的外观缺陷和营养缺失。在冷藏和运输设施不完善的发展中国家,果蔬腐败的问题尤为突出,其对果蔬行业造成的损失也尤为严重。扩展青霉、黑曲霉、娄地青霉、指状青霉等丝状真菌是造成果蔬腐败的元凶之一,它们主要通过侵蚀果蔬的叶片、果实等造成果蔬腐败,进而引起果蔬的贮藏病害,并且,它们会产生毒素(例如,展青霉素和桔霉素)(具体可见参考文献:hammamiw,althanir,etal.patulinandpatulinproducingpenicilliumspp.occurrenceinapplesandapple-basedproductsincludingbabyfood[j].journalofinfectionindevelopingcountries,2017,11(4):343-349、s.bandoh,m.takeuchi,etal.patulindistributionindecayedappleanditsreduction[j].internationalbiodeteriorationandbiodegradation,2009,63(4):379-382和fiorellaneri,irenedonati,etal.evaluationofpenicilliumexpansumisolatesforaggressiveness,growthandpatulinaccumulationinusualandlesscommonfruithosts,2010,143(3):109-117),这些毒素会残留在果蔬中,进而通过食物链进入人体,具有潜在的危害性。因此,抑制扩展青霉、黑曲霉、娄地青霉、指状青霉等丝状真菌对防止果蔬腐败,进而减少果蔬行业的损失来说也十分重要。目前,丝状真菌导致的果蔬腐败问题主要通过化学杀菌剂来控制,但是,考虑到丝状真菌抗药性的出现以及化学杀菌剂残留量对人体造成的潜在健康威胁,人们趋于开发生态友好的方法来控制水果采后腐烂。与化学杀菌剂相比,物理防治法和生物防治法均在生态友好方面具有一定优势。其中,物理防治法主要是通过将果蔬进行微波加热和冷藏来抑制丝状真菌感染,但是,由于微波加热和冷藏等物理手段在果蔬表面停留之间很短,物理防治法不具有持续性。生物防治法则主要是通过拮抗微生物来抑制丝状真菌感染,此方法与物理防治法相比持续性比较好,但是,生物防治法存在效果较差的缺陷,这主要是因为很多拮抗微生物本身也属于真菌,也会导致水果表面真菌性腐败。因此,急需找到一种抑制扩展青霉等丝状真菌能力强的非真菌类拮抗微生物以解决现有生物防治法存在的缺陷。技术实现要素:[技术问题]本发明要解决的技术问题是提供一种丝状真菌抑制剂。[技术方案]为解决上述技术问题,本发明提供了一种丝状真菌抑制剂,所述抑制剂的成分包含植物乳杆菌cgmccno.5494和/或植物乳杆菌cgmccno.5494的发酵上清液。所述植物乳杆菌cgmccno.5494的发酵上清液是通过将植物乳杆菌cgmccno.5494接种至培养基中进行发酵获得的。在本发明的一种实施方式中,所述抑制剂的成分还包含载体。在本发明的一种实施方式中,所述载体为药学上可接受的载体。在本发明的一种实施方式中,所述载体为填充剂、粘合剂、润湿剂、崩解剂、润滑剂和/或矫味剂。在本发明的一种实施方式中,所述抑制剂的剂型为粉剂、乳剂、颗粒剂或微粒剂。在本发明的一种实施方式中,所述植物乳杆菌cgmccno.5494的发酵上清液经过加热;或者,所述植物乳杆菌cgmccno.5494的发酵上清液经过蛋白酶处理。本发明还提供了一种抑制丝状真菌的方法,所述方法为将上述丝状真菌抑制剂与丝状真菌进行共培养。在本发明的一种实施方式中,所述抑制丝状真菌包括降低丝状真菌孢子的萌发率、破坏丝状真菌细胞膜通透性和/或抑制丝状真菌菌丝体的生长。本发明还提供了植物乳杆菌cgmccno.5494或cgmccno.5494的发酵上清液或上述丝状真菌抑制剂或上述法在抑制丝状真菌方面不以疾病的诊断和治疗为目的的应用。本发明还提供了植物乳杆菌cgmccno.5494或cgmccno.5494的发酵上清液或上述丝状真菌抑制剂或上述在防止果蔬腐败中的应用。[有益效果](1)本发明提供了一种丝状真菌抑制剂,此丝状真菌抑制剂的成分包含植物乳杆菌cgmccno.5494和/或植物乳杆菌cgmccno.5494的发酵上清液,其中,将植物乳杆菌cgmccno.5494分别与扩展青霉孢子、黑曲霉孢子、娄地青霉孢子或指状青霉孢子共培养后,可在7天内显著抑制扩展青霉、黑曲霉、娄地青霉或指状青霉孢子的萌发率;将植物乳杆菌cgmccno.5494的发酵上清液分别与扩展青霉孢子、黑曲霉孢子、娄地青霉孢子或指状青霉孢子共培养后,可显著抑制扩展青霉孢子、黑曲霉孢子、娄地青霉孢子或指状青霉孢子的萌发且孢子萌发抑制率分别可高达99.68±0.97%、98.45±0.13%、96.35±0.35%、96.26±0.54%;将植物乳杆菌cgmccno.5494的发酵上清液与扩展青霉孢子共培养后,可显著破坏扩展青霉菌丝体的细胞膜通透性;将扩展青霉孢子接种至含有此植物乳杆菌cgmccno.5494发酵上清液的培养基上进行培养后,扩展青霉菌丝体的生长被显著抑制且抑制率可高达35.8%,因此,本发明的植物乳杆菌cgmccno.5494在抑制扩展青霉、防止果蔬腐败中具有极高的应用前景。(2)本发明提供了一种扩展青霉抑制剂,此扩展青霉抑制剂的成分包含植物乳杆菌cgmccno.5494和/或植物乳杆菌cgmccno.5494的发酵上清液,其中,植物乳杆菌cgmccno.5494的发酵上清液经加热处理后对扩展青霉菌丝体生长的抑制能力较未经加热处理的植物乳杆菌cgmccno.5494发酵上清液有所提高,可见,植物乳杆菌cgmccno.5494的发酵上清液可抑制扩展青霉且具有良好的热稳定性。(3)本发明提供了一种扩展青霉抑制剂,此扩展青霉抑制剂的成分包含植物乳杆菌cgmccno.5494和/或植物乳杆菌cgmccno.5494的发酵上清液,其中,植物乳杆菌cgmccno.5494发酵上清液的ph为4,此时,其对扩展青霉菌丝体生长的抑制能力较强,可见,植物乳杆菌cgmccno.5494的发酵上清液可抑制扩展青霉且具有良好的酸稳定性。(4)本发明提供了一种扩展青霉抑制剂,此扩展青霉抑制剂的成分包含植物乳杆菌cgmccno.5494和/或植物乳杆菌cgmccno.5494的发酵上清液,其中,植物乳杆菌cgmccno.5494的发酵上清液经蛋白酶处理后对扩展青霉菌丝体生长的抑制能力较未经蛋白酶处理的植物乳杆菌cgmccno.5494发酵上清液无显著变化,可见,植物乳杆菌cgmccno.5494的发酵上清液可抑制扩展青霉且具有良好的蛋白酶稳定性。附图说明图1:植物乳杆菌cgmccno.5494对扩展青霉菌丝体生长的影响。图2:不同浓度植物乳杆菌cgmccno.5494发酵上清液对菌丝体细胞膜通透性的影响。图3:经不同方式处理后的植物乳杆菌cgmccno.5494发酵上清液对扩展青霉菌丝体生长的影响。具体实施方式下面结合具体实施例和附图对本发明进行进一步的阐述。下述实施例中涉及的扩展青霉购自中国工业微生物菌种保藏管理中心,产品编号为cicc40658;下述实施例中涉及的黑曲霉购自中国工业微生物菌种保藏管理中心,产品编号为cicc2089;下述实施例中涉及的娄地青霉购自中国工业微生物菌种保藏管理中心,产品编号为cicc40663;下述实施例中涉及的指状青霉购自北纳生物,产品编号为bncc336887;下述实施例中涉及的植物乳杆菌cgmccno.5494(公开于公开号为cn102586148a的专利申请文本中)已保藏于中国微生物菌种保藏管理委员会普通微生物中心,无需再次进行专利程序上的保藏。下述实施例中涉及的培养基如下:mrs固体培养基:在1l蒸馏水中加入10g蛋白胨、10g牛肉膏、20g葡萄糖、5g酵母浸膏、2g无水乙酸钠、0.25g一水硫酸锰、1ml吐温80、2.6g三水合磷酸氢二钾、0.5g七水硫酸镁、2g柠檬酸二铵、18g琼脂粉,ph6.2~6.5。mrs液体培养基:在1l蒸馏水中加入10g蛋白胨、10g牛肉膏、20g葡萄糖、5g酵母浸膏、2g无水乙酸钠、0.25g一水硫酸锰、1ml吐温80、2.6g三水合磷酸氢二钾、0.5g七水硫酸镁、2g柠檬酸二铵,ph6.2~6.5。pda培养基:在1l马铃薯汁中加入20g葡萄糖和18g琼脂,自然ph。实施例1:植物乳杆菌cgmccno.5494及其发酵上清液对丝状真菌孢子萌发率的影响1、植物乳杆菌cgmccno.5494对丝状真菌孢子萌发率的影响(双层平板-生长抑制法)用接种环蘸取甘油管中的植物乳杆菌cgmccno.5494在mrs固体培养基上划线,厌氧环境下37℃培养48h,得到单菌落;挑取单菌落接种于mrs液体培养基中,厌氧环境下37℃培养48h进行培养,重复此操作3次,得到培养至第三代的菌液。用接种环蘸取安瓿管中的扩展青霉菌液接种到pda培养基上,28℃、200rpm培养7d,得到菌丝体及孢子;挑取孢子接种于pda斜面上,28℃、200rpm培养7d,重复此操作2次,得到培养至第三代的扩展青霉;在生长有培养至第三代的扩展青霉的pda培养基中加入5ml无菌水,用接种环刮取孢子,再用4层无菌纱布过滤得到扩展青霉孢子悬液;将扩展青霉孢子悬液用无菌水稀释至浓度为1×104cfu/ml。用接种环蘸取菌悬液mrs固体培养基上划两条两厘米的平行线,37℃培养48h后,mrs固体培养基上添加8ml浓度为1×104cfu/ml的扩展青霉孢子悬液,28℃分别培养2d、7d后,观察抑制区域(即mrs固体培养基上的划线区域),以抑制区域的植物乳杆菌cgmccno.5494菌落及菌落周围无孢子萌发的面积占mrs固体培养基总面积的百分比作为指标,检测植物乳杆菌cgmccno.5494对扩展青霉孢子萌发率的抑制能力,检测结果见表1和图1。参照同样的方法分别检测植物乳杆菌cgmccno.5494对黑曲霉、娄地青霉和指状青霉孢子萌发率的抑制能力,检测结果见表1。由表1和图1可知,检测植物乳杆菌cgmccno.5494对扩展青霉、黑曲霉、娄地青霉和指状青霉孢子萌发率的抑制能力时,培养2d,抑制区域的植物乳杆菌cgmccno.5494菌落及菌落周围不小于mrs固体培养基70%面积的区域均无孢子萌发,培养7d,抑制区域的植物乳杆菌cgmccno.5494菌落及菌落周围不小于mrs固体培养基30%面积的区域均无孢子萌发。可见,植物乳杆菌cgmccno.5494对扩展青霉、黑曲霉、娄地青霉和指状青霉孢子萌发率的抑制能力较强。表1植物乳杆菌cgmccno.5494对不同丝状真菌孢子萌发率的抑制能力注:双歧杆菌菌落及菌落周围不小于平板30%面积的区域均无孢子萌发,+++;双歧杆菌菌落区域及菌落周围低于30%平板面积的区域无孢子萌发,++;仅双歧杆菌菌落区域无孢子萌发,+;无孢子萌发抑制区域,-。2、植物乳杆菌cgmccno.5494发酵上清液对丝状真菌孢子萌发率的影响(96孔板-孢子萌发抑制法)用接种环蘸取甘油管中的植物乳杆菌cgmccno.5494在mrs固体培养基上划线,在mrs固体培养基上划线,厌氧环境下37℃培养48h,得到单菌落;挑取单菌落接种于mrs液体培养基中,厌氧环境下37℃培养48h进行培养,得到种子液;将种子液以2%(v/v)的接种量接种至mrs液体培养基中,厌氧环境下37℃培养48h进行培养,重复此操作2次,获得发酵液;将发酵液8000rpm离心10min后通过0.2μm滤器过滤,获得发酵上清液。用接种环蘸取安瓿管中的扩展青霉菌液接种到pda培养基上,28℃、200rpm培养7d,得到菌丝体及孢子;挑取孢子接种于pda斜面上,28℃、200rpm培养7d,重复此操作2次,得到培养至第三代的扩展青霉;在生长有培养至第三代的扩展青霉的pda培养基中加入5ml无菌水,用接种环刮取孢子,再用4层无菌纱布过滤得到扩展青霉孢子悬液;将扩展青霉孢子悬液用无菌水稀释至浓度为1×104cfu/ml。在无菌96孔板中加入190μl发酵上清液以及10μl浓度为1×104cfu/ml的扩展青霉孢子悬液,28℃培养48h,得到培养液;以mrs液体培养基作为对照,通过测量培养液和mrs液体培养基的od580,计算植物乳杆菌cgmccno.5494发酵上清液对扩展青霉的孢子萌发抑制率,计算结果见表2;其中,孢子萌发抑制率(%)=(1-(△od发酵上清液-△odmrs)/△odmrs)×100%。参照同样的方法分别检测植物乳杆菌cgmccno.5494发酵上清液对黑曲霉、娄地青霉和指状青霉的孢子萌发抑制率,检测结果见表2。由表2可知,植物乳杆菌cgmccno.5494发酵上清液对扩展青霉、黑曲霉、娄地青霉和指状青霉的孢子萌发抑制率分别可高达99.68±0.97%、98.45±0.13%、96.35±0.35%、96.26±0.54%,可见,植物乳杆菌cgmccno.5494发酵上清液对扩展青霉、黑曲霉、娄地青霉和指状青霉孢子萌发率的抑制能力较强。表2植物乳杆菌cgmccno.5494对不同丝状真菌孢子萌发的抑制能力菌株孢子萌发抑制率(%)扩展青霉99.68±0.97黑曲霉98.45±0.13娄地青霉96.35±0.35指状青霉96.26±0.54实施例2:植物乳杆菌cgmccno.5494发酵上清液扩展青霉菌丝体细胞膜通透性的影响将mrs液体培养基分别以1:9、1.5:8.5、2:8、2.5:7.5、3:7、3.5:6.5、4:6(mrs液体培养基:pda培养基)的体积比与pda培养基混合,得到mrs液体培养基浓度分别为10、15、20、25、30、35、45%(v/v)的对照组混合液;将实施例1获得的植物乳杆菌cgmccno.5494的发酵上清液分别以1:9、1.5:8.5、2:8、2.5:7.5、3:7、3.5:6.5、4:6(发酵上清液:pda培养基)的体积比与pda培养基混合,得到发酵上清液浓度分别为10、15、20、25、30、35、45%(v/v)的实验组混合液;将对照组和实验组的混合液分别倾倒平板;在平板中央滴加10μl实施例2获得的扩展青霉孢子悬液,28℃、200rpm培养1d,1d后,刮取平板上的扩展青霉菌丝体1,用pbs缓冲液洗涤两次后,8000rpm离心10min,收集菌丝体2;在菌丝体2中加入浓度为1μm的pi染料(购自上海建成生物有限公司),室温(25℃)下孵育30min后,8000rpm离心10min,收集菌丝体3;将菌丝体3用pbs缓冲液洗涤两次后,8000rpm离心10min,收集菌丝体4;用荧光显微镜观察菌丝体4的染色情况并采集图片,图片见图2。如图2所示,对照组的菌丝体4无红色荧光信号,说明未经植物乳杆菌cgmccno.5494的发酵上清液处理的扩展青霉菌丝体细胞膜完整性并未受到破坏;实验组的菌丝体4中,从植物乳杆菌cgmccno.5494的发酵上清液浓度为10%开始,可观察到红色荧光,但此处理下的荧光信号较弱,而植物乳杆菌cgmccno.5494的发酵上清液浓度为25%时,可观察到较强的荧光信号,这说明植物乳杆菌cgmccno.5494的发酵上清液处理可破坏扩展青霉菌丝体的细胞膜并导致其通透性增加,此外,植物乳杆菌cgmccno.5494发酵上清液的浓度与细胞膜通透性改变情况以及荧光信号强度呈现正相关。实施例3:植物乳杆菌cgmccno.5494发酵上清液对扩展青霉菌丝体生长的影响将mrs液体培养基以1.5:8.5(mrs液体培养基:pda培养基)的体积比与pda培养基混合,得到mrs液体培养基浓度为15(v/v)的对照组混合液;将实施例1获得的发酵上清液以1.5:8.5(发酵上清液:pda培养基)的体积比与pda培养基混合,得到发酵上清液浓度分别为15%(v/v)的实验组混合液;将对照组和实验组的混合液分别倾倒平板;在平板中央滴加10μl实施例2获得的扩展青霉孢子悬液,28℃培养6d,培养期间,通过每2d测量每一个平板上的菌丝体直径,检测植物乳杆菌cgmccno.5494的发酵上清液对扩展青霉菌丝体生长的影响,检测结果见图3;其中,菌丝体生长抑制率(%)=(1-(d对照组-d处理组)/d对照组)×100%,式中,d:菌丝体直径。如图3所示,通过测量培养第6d时平板上的菌丝体直径可知,植物乳杆菌cgmccno.5494的发酵上清液可显著抑制扩展青霉菌丝体的生长且抑制率可高达35.8%(菌丝体直径9.8mm)。实施例4:温度对植物乳杆菌cgmccno.5494发酵上清液抑制扩展青霉菌丝体生长的能力的影响将实施例1获得的发酵上清液以1.5:8.5(发酵上清液:pda培养基)的体积比与pda培养基混合,得到发酵上清液浓度为15%(v/v)的的对照组混合液;将实施例1获得的发酵上清液121℃加热20min后以1.5:8.5(发酵上清液:pda培养基)的体积比与pda培养基混合,得到发酵上清液浓度为15%(v/v)的实验组混合液;将对照组和实验组的混合液分别倾倒平板;在平板中央滴加10μl实施例2获得的扩展青霉孢子悬液,28℃培养6d,培养期间,通过每2d测量每一个平板上的菌丝体直径,检测植物乳杆菌cgmccno.5494的发酵上清液对扩展青霉菌丝体生长的影响,检测结果见图3。如图3所示,通过测量培养第6d时平板上的菌丝体直径可知,经加热处理后,植物乳杆菌cgmccno.5494发酵上清液(菌丝体直径9.4mm)对扩展青霉菌丝体生长的抑制能力较未经加热处理的植物乳杆菌cgmccno.5494发酵上清液(菌丝体直径9.8mm)略有提高。实施例5:ph对植物乳杆菌cgmccno.5494发酵上清液抑制扩展青霉菌丝体生长的能力的影响将实施例1获得的发酵上清液(ph为4)以1.5:8.5(发酵上清液:pda培养基)的体积比与pda培养基混合,得到发酵上清液浓度为15%(v/v)的的对照组混合液;将实施例1获得的发酵上清液调节至ph为7后(用1mol/l的naoh和1mol/l的hcl调节)以1.5:8.5(发酵上清液:pda培养基)的体积比与pda培养基混合,得到发酵上清液浓度为15%(v/v)的实验组混合液;将对照组和实验组的混合液分别倾倒平板;在平板中央滴加10μl实施例2获得的扩展青霉孢子悬液,28℃培养6d,培养期间,通过每2d测量每一个平板上的菌丝体直径,检测ph对植物乳杆菌cgmccno.5494发酵上清液抑制扩展青霉菌丝体生长的能力的影响,检测结果见图3。如图3所示,通过测量培养第6d时平板上的菌丝体直径可知,植物乳杆菌cgmccno.5494发酵上清液的ph为4,此时,其对扩展青霉菌丝体生长的抑制能力较强(菌丝体直径9.4mm);ph为7时,植物乳杆菌cgmccno.5494发酵上清液对扩展青霉菌丝体生长的抑制能力(菌丝体直径15.3mm)与未经ph调节的植物乳杆菌cgmccno.5494发酵上清液相比显著降低。实施例6:蛋白酶处理对植物乳杆菌(lactobacillusplantarum)发酵上清液抑制扩展青霉菌丝体生长的能力的影响先将实施例1获得的发酵上清液调节至ph为7(用1mol/l的naoh和1mol/l的hcl调节),然后在发酵上清液中添加1mg/ml蛋白酶(购自sigma公司,产品编号为p3910),37℃水浴2h,接着将发酵上清液100℃煮沸灭酶3min,得到经蛋白酶处理的发酵上清液;将实施例1获得的发酵上清液以1.5:8.5(发酵上清液:pda培养基)的体积比与pda培养基混合,得到发酵上清液浓度为15%(v/v)的的对照组混合液;以1.5:8.5(发酵上清液:pda培养基)的体积比与pda培养基混合,得到发酵上清液浓度为15%(v/v)的实验组混合液;将对照组和实验组的混合液分别倾倒平板;在平板中央滴加10μl实施例2获得的扩展青霉孢子悬液,28℃培养6d,培养期间,通过每2d测量每一个平板上的菌丝体直径,检测蛋白酶处理对植物乳杆菌cgmccno.5494发酵上清液抑制扩展青霉菌丝体生长的能力的影响,检测结果见图3。如图3所示,通过测量培养第6d时平板上的菌丝体直径可知,经蛋白酶处理后,植物乳杆菌cgmccno.5494发酵上清液对扩展青霉菌丝体生长的抑制能力(菌丝体直径9.7mm)较未经蛋白酶处理的植物乳杆菌cgmccno.5494发酵上清液有所降低(菌丝体直径9.4mm)。虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1