一种基于疏水界面的体外无细胞蛋白合成方法、D2P试剂盒及相关应用与流程
一种基于疏水界面的体外无细胞蛋白合成方法、d2p试剂盒及相关应用
技术领域
1.本发明涉及蛋白质合成技术领域,特别涉及体外无细胞蛋白合成技术领域,具体涉及一种基于疏水界面的体外无细胞蛋白合成方法、d2p试剂盒(dna-to-protein试剂盒)及相关应用。
背景技术:
2.蛋白质是细胞中的重要分子,几乎参与了细胞所有功能的执行。蛋白质合成主要包括传统的细胞内合成技术和新一代的体外合成技术。传统的蛋白表达系统是指通过模式生物如细菌、真菌、植物细胞、昆虫细胞或动物细胞等表达外源基因的一种分子生物学技术。体外蛋白质合成系统,也称为无细胞表达体系,在1960年代应运而生,其以外源的mrna或dna为蛋白质合成模板,通过人为控制添加蛋白质合成所需的底物、能量、以及转录和翻译相关蛋白因子等物质,实现目标蛋白质的合成。体外蛋白合成系统一般是指在细菌、真菌、植物细胞、昆虫细胞或动物细胞的裂解物/提取物中,加入核酸模板(mrna模板或者dna模板)、rna聚合酶、氨基酸、atp等组分,完成外源蛋白的快速高效翻译。体外蛋白合成系统无需进行质粒构建、转化、细胞培养、细胞收集和破碎步骤,是一种相对快速、省时、便捷的蛋白质表达方式,是蛋白质领域的重要工具(―garcia ra,riley mr.applied biochemistry and biotechnology.humana press.1981,263-264”;―fromm hj,hargrove m.essentials of biochemistry.2012”;cn109988801a;―assenberg r,wan pt,geisse s,mayr lm.advances in recombinant protein expression for use in pharmaceutical research[j].current opinion in structural biology.2013,23(3):393-402”;―anne zemella,lena thoring,christian hoffmeister,and stefankubick.cell-free protein synthesis:pros and cons of prokaryotic and eukaryotic systems[j].chembiochem.2015,16:2420-2431”)。体外蛋白合成系统还可表达对细胞具有毒害作用或者含有非天然氨基酸(如
d-氨基酸)的特殊蛋白质,能够同时平行合成多种蛋白质便于开展高通量药物筛选和蛋白质组学的研究(spirin as,swartz jr.chapter 1.cell-free protein synthesis systems:historical landmarks,classification,and general methods.wiley-vch verlag gmbh&co.kgaa,2008:1-34.)。利用体外合成体系生产的蛋白质产品,可广泛应用于医药、食品、营养品、膳食补充剂、化妆品等各领域,包括但不限于申请人的proteinn
tm
、普罗敦
tm
、普敦
tm
等蛋白质产品。
[0003]
蛋白合成能力是决定体外蛋白合成体系是否能实现产业化的关键指标之一,主要包括蛋白合成效率、蛋白合成量(蛋白表达量)。为了提高蛋白合成量,较多地从细胞提取物、能量系统、遗传模板(核酸模板)、反应器及操作形式等方面进行改造(张绪.无细胞体系高效合成复杂膜蛋白的关键技术及工业应用探索[d].浙江大学,2014)。其中,关于反应器的改造,比如kim等人开发的连续交换式无细胞反应(biotechnol.prog.,1996,12(5):645-649),利用一层具有选择透过性的半透膜将反应体系分隔为反应区和补充区两个部分;由
反应区负责对模板分子进行转录与反应,表达目标蛋白分子;由补充区负责补充消耗的能量和底物;补充区的能量和底物小分子可以透过半透膜进入反应区(维持反应进行),反应区的无机磷等小分子副产物也能够透过半透膜扩散到补充区(降低抑制作用),而表达的目标蛋白作为单分子物质则不能够透过半透膜扩散到补充区;无细胞反应的持续时间从数十分钟甚至数分钟延长到了二十小时以上。sawasaki等人还通过相界面扩散分隔反应区和补充区,不需要半透膜(febs lett.,2002,514(1):102-105)。biyani等人开发了固相无细胞反应体系,促使局部底物浓度增大,增加模板稳定性(nucleic acids res.,2006,34:e140)。park等人还利用dna水凝胶进行体外蛋白合成,显著提高了反应效率(nat.mater.,2009,8:432-437)。上述对反应器的改造方法普遍需要借助经特殊设计或者专门制备的反应器材(选择性半透膜、水凝胶、固相体系等),或成本高昂,或步骤繁琐,而且也不适用于大规模生产。
[0004]
综上所述,目前仍迫切需要对反应容器进行改进,实现高效低成本的体外无细胞蛋白合成。
技术实现要素:
[0005]
针对上述技术问题,本发明公开一种简单、便捷、更高效、更高通量的外源蛋白的体外无细胞合成方法,通过提供疏水界面,并利用与水相的体外无细胞蛋白合成体系进行面接触的疏水界面,能够实现显著提高蛋白合成能力。
[0006]
本发明第一方面提供一种外源蛋白的体外无细胞合成方法,所述外源蛋白的体外无细胞合成方法包括:
[0007]
步骤一、将组分ii加入到组分i中,进行混合;
[0008]
其中,组分i为体外无细胞蛋白合成体系;所述体外无细胞蛋白合成体系为水相的体系,简称为水相合成体系、水相体系、水相的合成体系或合成体系;
[0009]
其中,组分ii为编码外源蛋白的核酸模板;
[0010]
组分i和组分ii共同提供合成外源蛋白所需的翻译相关元件;
[0011]
步骤二、在疏水界面iii辅助下,进行孵育反应,合成所述外源蛋白;
[0012]
其中,所述疏水界面iii与水相的体外无细胞蛋白合成体系进行面接触。
[0013]
还可选地包括步骤三:分离或/和检测所述外源蛋白。
[0014]
所述疏水界面是由疏水相与所述水相合成体系进行面接触形成的界面。
[0015]
疏水相:本发明中的疏水相,其与所述水相合成体系进行面接触的表面或界面为疏水的。对于构成疏水相的物质或装置,其不与所述水相合成体系相接触的部分的亲疏水性没有特别限制。
[0016]
根据疏水相的物理状态,所述疏水界面可选自:固相疏水界面、液相疏水界面、或者其组合。当疏水相为液相时,优选该液相的整体(包括内部和外部表面/界面)均为疏水的。
[0017]
优选地,所述疏水界面由下述疏水表面提供:反应器内表面、疏水内置固体物的疏水外表面、油相体系的液态界面、或者其组合。所述反应器内表面,比如反应器的侧壁内表面、底部内表面。所述疏水内置固体物指外表面疏水的固体物,其所处的位置没有特别限制,可沉积于水相合成体系下方,也可悬浮于水相合成体系之中,还可漂浮在水相合成体系
上方;优选地,疏水内置固体物沉积于水相合成体系下方、或漂浮在水相合成体系上方。
[0018]
优选地,所述疏水相由烃物质提供,主要成分为烃;所述烃物质为膏状(半固体)、固态(如蜡状、颗粒、粉末等)、液态、或者其混合形态。
[0019]
优选地,所述烃物质中含有的烃为直链结构、支链结构、环状结构、或者其组合。
[0020]
优选地,所述烃物质的碳原子数至少为6,更优选地,所述烃物质的碳原子数为6~44。
[0021]
优选地,所述烃物质选自脂肪烃。
[0022]
优选地,所述烃物质选自烷烃。
[0023]
优选地,所述烷烃为直链结构、支链结构、环状结构、或者其组合。
[0024]
优选地,所述烃物质选自凡士林、矿物油、或者其组合。
[0025]
优选地,所述烷烃的碳原子数至少为6,更优选地,所述烷烃的碳原子数为6~44。更优选地,所述烷烃选自:环己烷、异辛烷、癸烷、十四烷、十五烷基环己烷、四十四烷、凡士林、或者其组合。
[0026]
优选地,所述疏水相由烷烃提供,所述烷烃为膏状、固态(如蜡状、颗粒、粉末等)、液态、或者其混合形态。更优选地,所述烷烃选自:环己烷、异辛烷、癸烷、十四烷、十五烷基环己烷、四十四烷、凡士林、或者其组合。
[0027]
所述能够提高外源蛋白合成量的烷烃用量选自y
prt
(c
hc
)曲线中外源蛋白表达量大于y0时的烷烃用量区间。上述可选的用量区间可以为连续的,也可以为不连续的。
[0028]
本发明中,
[0029]
q
hc
,指本发明涵盖的能够提高外源蛋白合成量的烷烃用量。
[0030]
c
hc
,指烷烃用量。
[0031]
y
prt
,指外源蛋白表达量;
[0032]
y
prt
(c
hc
)曲线,指以烷烃用量为自变量、外源蛋白表达为因变量、其它反应参数确定时的曲线,本发明中还记为y
prt
~c
hc
曲线。所述“其它反应参数”包括但不限于:其它体系组分、反应原料的添加方式、反应温度程序、反应时间长度、反应容器的性质、反应体系体积,等等。一个组分i体系可对应多个y
prt
~c
hc
曲线。一个组分i体系可以在不同的反应温度程序下反应,还可以反应不同的时间长度,由此可以产生若干不同的y
prt
~c
hc
曲线。
[0033]
y
max
,指y
prt
(c
hc
)曲线中外源蛋白的最高表达量。
[0034]
c
max
,指y
prt
(c
hc
)曲线中外源蛋白最高表达量时的烷烃用量。
[0035]
y
min
,指y
prt
(c
hc
)浓度曲线中,y
prt
>y0的区间范围内外源蛋白的最低表达量。
[0036]
y0,指所述c
hc
为0时对应的外源蛋白表达量。
[0037]
y
δ
,为y
max
与y0的差值,数值上,y
δ
=y
max-y0。
[0038]
优选地,所述q
hc
选自外源蛋白表达量至少为y0+50%y
δ
时的烷烃用量区间;
[0039]
更优选地,所述q
hc
选自外源蛋白表达量至少为y0+60%y
δ
时的烷烃用量区间;
[0040]
更优选地,所述q
hc
选自外源蛋白表达量至少为y0+70%y
δ
时的烷烃用量区间;
[0041]
更优选地,所述q
hc
选自外源蛋白表达量至少为y0+80%y
δ
时的烷烃用量区间;
[0042]
更优选地,所述q
hc
选自外源蛋白表达量至少为y0+90%y
δ
时的烷烃用量区间;
[0043]
更优选地,所述q
hc
选自外源蛋白表达量至少为y0+95%y
δ
时的烷烃用量区间;
[0044]
更优选地,所述q
hc
为外源蛋白最高表达量时的烷烃用量c
max
。
[0045]
所述体外无细胞蛋白合成体系的组分,优选地,包括细胞提取物。
[0046]
优选地,所述体外无细胞蛋白合成体系含有能够识别核酸模板上的启动子元件的体系组分,使得所述体外无细胞蛋白合成体系能够识别编码外源蛋白的核酸模板的启动子元件,例如所述体外无细胞蛋白合成体系含有与启动子元件相应的rna聚合酶。
[0047]
所述能够识别核酸模板上的启动子元件的体系组分(例如相应的rna聚合酶),可以由所述细胞提取物提供,也可以通过其他外源组分提供,还可以通过两种或两种以上方式的组合方式提供。
[0048]
优选地,外源蛋白的基因转录过程由核酸模板上的启动子启动,所述细胞提取物包括识别核酸模板上的启动子的内源性表达的rna聚合酶。
[0049]
优选地,所述体外无细胞蛋白合成体系还包括rna聚合酶。所述rna聚合酶的来源包括但不限于:含内源性表达的rna聚合酶的细胞提取物、外源rna聚合酶、编码rna聚合酶的外源核酸模板的翻译产物、或者其组合。上述各技术方案,各自独立地优选所述rna聚合酶为t7 rna聚合酶。所述编码rna聚合酶的外源核酸模板,经体系的体外蛋白合成反应,可翻译为rna聚合酶。优选方式之一,所述体外无细胞蛋白合成体系还包括dna聚合酶。所述dna聚合酶的来源包括但不限于:含内源性表达的dna聚合酶的细胞提取物、外源dna聚合酶、编码dna聚合酶的外源核酸模板的翻译产物、或者其组合。上述各技术方案,各自独立地优选所述dna聚合酶为phi29 dna聚合酶。所述编码dna聚合酶的外源核酸模板,经体系的体外蛋白合成反应,可翻译为dna聚合酶。所述rna聚合酶、dna聚合酶各自独立地,可以通过外源方式直接添加,或者以反应产物或中间产物的方式提供(如添加编码rna聚合酶或/和编码dna聚合酶的外源核酸模板)。
[0050]
优选方式之一,所述细胞提取物中含有内源性表达的rna聚合酶。更优选地,所述细胞提取物中含有内源性表达的t7 rna聚合酶。
[0051]
优选方式之一,所述细胞提取物中含有内源性表达的rna聚合酶。更优选地,通过对来源细胞进行内源性菌株改造后制备细胞提取物实现,包括但不限于以下内源性菌株改造方式:将rna聚合酶的编码序列插入到细胞内游离质粒、或者将rna聚合酶的编码基因整合到细胞基因组、或者采用前述两种方式的组合方式。需要说明的是,在进行上述内源性菌株改造时,除整合入上述编码序列/编码基因外,还允许插入其它核苷酸序列,比如非编码序列、增强子序列、kozak序列、前导序列、信号肽序列、标签序列、密码子序列等等。通过上述内源性菌株改造,使改造菌株可以内源性表达rna聚合酶。所述rna聚合酶优选t7 rna聚合酶。
[0052]
优选方式之一,所述体外无细胞蛋白合成体系包括外源添加的t7 rna聚合酶。
[0053]
优选方式之一,所述体外无细胞蛋白合成体系包括以下至少一种组分:外源性rna聚合酶、外源性dna聚合酶。
[0054]
所述细胞提取物选自:原核细胞提取物、真核细胞提取物、或者其组合。
[0055]
优选方式之一,所述细胞提取物选自以下任一种来源:原核细胞、酵母细胞、哺乳动物细胞、植物细胞、昆虫细胞、或者其组合。所述原核细胞优选为大肠杆菌。
[0056]
所述酵母细胞,优选选自克鲁维酵母、酿酒酵母、毕氏酵母、或者其组合。
[0057]
所述克鲁维酵母进一步优选为乳酸克鲁维酵母、马克斯克鲁维酵母、多布克鲁维酵母、海泥克鲁维酵母、威克海姆克鲁维酵母、脆壁克鲁维酵母、湖北克鲁维酵母、多孢克鲁
维酵母、暹罗克鲁维酵母、亚罗克鲁维酵母、或者其组合。
[0058]
优选方式之一,所述细胞提取物选自以下任一种来源:大肠杆菌、乳酸克鲁维酵母、麦胚细胞、spodoptera frugiperda细胞(草地贪夜蛾细胞,一种昆虫细胞)、leishmania tarentolae细胞(蜥蜴利什曼原虫细胞)、兔网织红细胞、中国仓鼠卵巢细胞(cho细胞)、非洲绿猴肾cos细胞、非洲绿猴肾vero细胞、幼地鼠肾细胞(bhk细胞)、人hela细胞、人hybridoma细胞(人杂交瘤细胞)、人纤维肉瘤ht1080细胞、或者其组合。
[0059]
优选地,所述编码外源蛋白的核酸模板含有能够被组分i所识别的启动子元件;所述体系组分指水相的体外无细胞蛋白合成体系的组分。
[0060]
优选地,所述编码外源蛋白的核酸模板中含有t7启动子,所述体外无细胞蛋白合成体系包括t7 rna聚合酶;
[0061]
优选之一,外源蛋白的基因转录过程由核酸模板上的t7启动子启动,所述体外无细胞蛋白合成体系包括t7 rna聚合酶;
[0062]
优选之一,所述编码外源蛋白的核酸模板中含有t7启动子,所述体外无细胞蛋白合成体系包括所细胞提取物,由所述细胞提取物提供内源性表达的t7 rna聚合酶。
[0063]
优选方式之一,所述体外无细胞蛋白合成体系还包括能量系统;所述能量系统优选选自:糖(如,单糖、二糖、寡糖、多糖)与磷酸盐能量体系、糖与磷酸肌酸能量体系、磷酸肌酸与磷酸肌酸酶体系、磷酸肌酸与磷酸肌酸激酶体系、糖酵解途径及其中间产物能量体系(例如,单糖及其酵解中间产物能量体系、糖原及其酵解中间产物)、或者其组合。
[0064]
优选方式之一,所述体外无细胞蛋白合成体系还包括合成蛋白的底物;所述合成蛋白的底物优选为氨基酸混合物,至少包括合成外源蛋白所需的氨基酸混合物。优选地,所述氨基酸混合物为天然氨基酸的混合物。
[0065]
优选方式之一,所述体外无细胞蛋白合成体系还包括合成rna的底物;所述合成rna的底物优选为核苷酸混合物,选自:核苷单磷酸、核苷三磷酸、或者其组合。
[0066]
优选方式之一,所述体外无细胞蛋白合成体系还包括合成dna的底物;所述合成dna的底物优选脱氧核苷酸混合物,更优选脱氧核苷三磷酸混合物。
[0067]
优选方式之一,所述体外无细胞蛋白合成体系中还包括以下至少一种组分:拥挤剂、镁离子、钾离子、抗氧化剂或还原剂、海藻糖、反应促进剂、缓冲剂、水性溶剂;
[0068]
所述拥挤剂优选聚乙二醇、聚乙烯醇、聚丙乙烯、葡聚糖、蔗糖聚合物(包括ficoll蔗糖聚合物,如试剂,一种非离子型合成蔗糖聚合物)、聚乙烯(乙烯吡咯烷酮)、白蛋白、等、或者其组合;
[0069]
镁离子源优选选自:天门冬氨酸镁、醋酸镁、谷氨酸镁、氯化镁、磷酸镁、硫酸镁、柠檬酸镁、磷酸氢镁、碘化镁、乳酸镁、硝酸镁、草酸镁、或者其组合;
[0070]
钾离子源优选选自:醋酸钾、谷氨酸钾、氯化钾、磷酸钾、硫酸钾、柠檬酸钾、磷酸氢钾、碘化钾、乳酸钾、硝酸钾、草酸钾、或者其组合;
[0071]
所述抗氧化剂或还原剂优选为二硫苏糖醇、2-巯基乙磺酸、2-巯基乙醇、还原型谷胱甘肽、三羧甲基磷酸、3-巯基-1,2-丙二醇、或者其组合;
[0072]
所述反应促进剂优选为氧化铝;
[0073]
所述缓冲剂优选选自:tris-hcl、tris碱、hepes、或者其组合;
[0074]
所述水性溶剂优选为缓冲剂。
[0075]
所述体外无细胞蛋白合成体系能够与编码外源蛋白的dna模板或mrna模板进行反应,合成外源蛋白。
[0076]
上述各优选方式可以以任意合适的方式结合。
[0077]
本发明第二方面提供一种体外蛋白合成试剂盒,所述试体外蛋白合成剂盒包括:
[0078]
(i)第一方面所述外源蛋白的体外无细胞合成方法中的体外无细胞蛋白合成体系;所述体外无细胞蛋白合成体系的组分以干粉、液体、乳液、悬浊液、或者其组合形式置于一个或多个容器中;
[0079]
(ii)可选地包括编码外源蛋白的核酸模板;
[0080]
(iii)可选地包括反应容器;
[0081]
(iv)疏水相;可以包括构建疏水界面的物质或装置;
[0082]
所述疏水相能够与所述水相合成体系进行面接触构建疏水界面;
[0083]
所述疏水界面选自第一方面所提供的外源蛋白的体外无细胞合成方法中的任一疏水界面;
[0084]
(v)标签或说明书。
[0085]
所述(i)和(ii)共同提供合成外源蛋白所需的翻译相关元件。
[0086]
利用所述体外蛋白合成试剂盒,可以进行体外蛋白合成反应,合成外源蛋白。
[0087]
所述试剂盒的各部分与第一方面所述外源蛋白的体外无细胞合成方法的各组分相对应。
[0088]
优选地,所述编码外源蛋白的核酸模板含有能够被(i)所识别的启动子元件。
[0089]
优选方式之一,所述编码外源蛋白的核酸模板含有所述细胞提取物能够识别的启动子元件。例如,细胞提取物中含有内源性表达的、与核酸模板上启动子元件相对应的rna聚合酶。
[0090]
优选方式之一,所述编码外源蛋白的核酸模板中含有t7启动子,所述体外无细胞蛋白合成体系包括t7 rna聚合酶。
[0091]
优选方式之一,所述编码外源蛋白的核酸模板中含有t7启动子,所述细胞提取物包括内源性表达的t7 rna聚合酶。
[0092]
优选地,外源蛋白的基因转录过程由核酸模板上的t7启动子启动。
[0093]
优选方式之一,外源蛋白的基因转录过程由核酸模板上的t7启动子启动,所述体外无细胞蛋白合成体系包括t7 rna聚合酶。
[0094]
优选方式之一,t7启动子位于核酸模板中外源蛋白的编码序列的上游,由t7启动子启动外源蛋白的转录程序,所述体外无细胞蛋白合成体系包括细胞提取物,由所述细胞提取物提供内源性表达的t7 rna聚合酶。
[0095]
所述编码外源蛋白的核酸模板为dna模板、mrna模板、或者其组合;所述编码外源蛋白的核酸模板优选为dna模板。
[0096]
本发明第三方面提供烷烃在第一方面所述外源蛋白的体外无细胞合成方法中的应用,或者在第二方面所述体外蛋白合成试剂盒中的应用,或者在体外蛋白合成方面的应用;其中,所述烷烃用于构建疏水界面。
[0097]
优选地,所述在体外蛋白合成方面的应用,包括但不限于,应用于蛋白制造,或者应用于基于蛋白合成的检测等方面。
[0098]
有益效果:
[0099]
本发明提供的外源蛋白的体外无细胞合成方法,提供水相的体外无细胞蛋白合成体系和编码外源蛋白的核酸模板,并引入与水相的体外无细胞蛋白合成体系进行面接触的疏水界面,进行孵育反应,合成外源蛋白,提高了无细胞体系的蛋白合成能力(至少包括蛋白合成效率和蛋白合成量),提高程度能够达到90%。
[0100]
所述疏水界面,利用亲疏水相互作用,一方面,促进疏水成分在界面处富集,增加局部浓度,提高反应效率和原料利用率,提高反应效率和蛋白合成量;另一方面,对于非水溶性的蛋白产物,所述疏水界面还起到界面固定作用,使得蛋白产物的疏水侧通过亲疏水相互作用附着在界面处,亲水端溶解于水相的体外无细胞蛋白合成体系,起到界面增溶作用。
[0101]
本发明通过添加烷烃的简单方式构建疏水界面,相较于现有的对反应器的复杂改造(如构建结构复杂、成本高昂、更换繁琐的选择性半透膜),相较于需先行聚合反应构建凝胶交联体系,相较于共价固定方式的固相反应体系,操作简单便捷,原料便宜易得,成本低廉。
[0102]
进一步提供的体外蛋白合成试剂盒,具有更高效、更高通量的优点。
附图说明
[0103]
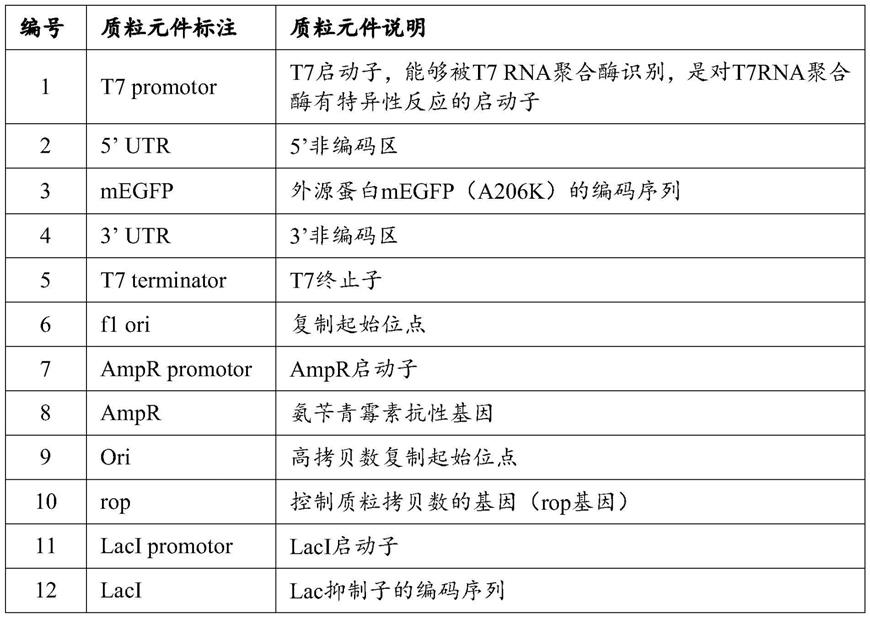
图1、编码外源蛋白megfp的质粒dna的结构示意图,共6384bp,记为质粒d2p-megfp(简记为pd2p-megfp)。所述megfp为增强型绿色荧光蛋白的突变体。该质粒dna包括以下元件:t7启动子(能够被t7 rna聚合酶识别)、5’端非编码区(5
’-
utr)、kozak序列(位于5’端非编码区下游,为可选元件)、前导序列(可选元件)、纯化标签(可选元件)、外源蛋白megfp的编码序列、3’端非编码区(3
’-
utr)、t7终止子、复制起始位点(f1 ori)、ampr启动子、氨苄青霉素抗性基因(ampr基因)、高拷贝数复制起始位点(ori)、控制质粒拷贝数的基因(rop基因)、lac抑制子(laci)的编码基因、laci启动子。
[0104]
图2、外源核酸模板的示例结构。图中的外源核酸模板为编码外源蛋白的质粒dna。
[0105]
图3、外源核酸模板的示例结构。图中的外源核酸模板为编码外源蛋白的质粒dna。
[0106]
图4、环己烷对体外蛋白合成反应的影响。环己烷为液态,用量为0~20%(v/v)。其中,3h、18h分别表示反应时间为3h、18h。其中,浓度“0”对应空白对照(bc组)。烷烃在水相的体外蛋白合成体系上方形成油状疏水界面。在48孔细胞培养板中进行反应(实施例s3)。
[0107]
图5、异辛烷对体外蛋白合成反应的影响。异辛烷为液态,用量为0~5%(v/v)。其中,3h、18h分别表示反应时间为3h、18h。其中,浓度“0”对应空白对照(bc组)。烷烃在水相的体外蛋白合成体系上方形成油状疏水界面。在48孔细胞培养孔板中进行反应。
[0108]
图6、癸烷对体外蛋白合成反应的影响。其中,癸烷为正癸烷结构,物理状态为液态,用量为0~5%(v/v)。其中,3h、18h分别表示反应时间为3h、18h。其中,浓度“0”对应空白对照(bc组)。烷烃在水相的体外蛋白合成体系上方形成油状疏水界面。在48孔细胞培养孔板中进行反应。
[0109]
图7、十四烷对体外蛋白合成反应的影响。其中,十四烷为直链状结构(正十四烷),物理状态为液态,用量为0~2%(v/v)。其中,3h、18h分别表示反应时间3h、18h。其中,浓度“0”对应空白对照(bc组)。烷烃在水相的体外蛋白合成体系上方形成油状疏水界面。在48孔
细胞培养孔板中进行反应。
[0110]
图8、十四烷对体外蛋白合成反应的影响。其中,十四烷为直链状结构(正十四烷),物理状态为液态,用量为2~20%(v/v)。其中,3h、18h分别表示反应时间为3h、18h。其中,浓度“0”对应空白对照(bc组)。烷烃在水相的体外蛋白合成体系上方形成油状疏水界面。在48孔细胞培养孔板中进行反应。
[0111]
图9、十五烷基环己烷对体外蛋白合成反应的影响。其中,十五烷基环己烷为液态,用量为0~20%(v/v)。其中,3h、18h分别表示反应时间为3h、18h。其中,浓度“0”对应空白对照(bc组),nc为阴性对照。烷烃在水相的体外蛋白合成体系上方形成油状疏水界面。在48孔培养孔板中进行反应。
[0112]
图10、四十四烷对体外蛋白合成反应的影响。其中,四十四烷为固态,用量为0~500μg/μl。其中,3h、18h分别表示反应时间为3h、18h。其中,浓度“0”对应空白对照(bc组),nc为阴性对照。在体外蛋白合成过程中,烷烃存在水相的合成体系上方的油状分层中。在48孔细胞培养板中进行反应。
[0113]
图11、凡士林对体外蛋白合成反应的影响。其中,凡士林为膏状的烷烃混合物,用量为0~0.09g/well,涂抹于孔侧壁和孔底内壁,构建疏水界面;其中,体外蛋白合成体系体积为300μl,在48孔细胞培养板中进行反应,实施例s10。其中,bc组为空白对照组。
[0114]
图12、凡士林对体外蛋白合成反应的影响。体外蛋白合成体系体积为300μl,在48孔板中进行反应,实施例s11。其中zs01092为制造细胞提取物的改造菌株的编号,该菌株为改造的乳酸克鲁维酵母,内源性整合了t7 rna聚合酶的编码基因,可以内源性表达t7 rna聚合酶。其中,vas表示使用凡士林涂抹于孔侧壁和孔底内壁,构建疏水界面;ac表示加入活性炭;ac+vas表示既涂抹凡士林,也加入活性炭;bc组为空白对照组,既不涂抹凡士林,也不加入活性炭,但加入编码外源蛋白的dna模板;nc为阴性对照组,既不涂抹凡士林,也不加入活性炭,且不加入编码外源蛋白的dna模板。其中,3h、6h、21h分别表示反应时间为3h、6h、反应过夜(21h)。
[0115]
图13、凡士林对体外蛋白合成反应的影响。体外蛋白合成体系体积为300μl,在48孔板中进行反应,实施例s12。其中,vas表示使用凡士林涂抹于孔侧壁和孔底内壁,构建疏水界面;ac表示加入活性炭;ssdna表示体外蛋白合成体系中加入鲑鱼精dna;amp表示体外蛋白合成体系中加入氨苄青霉素。其中,ac+ssdna+amp,表示加入活性炭、鲑鱼精dna、氨苄青霉素,是不使用凡士林的空白对照组;vas+ac+ssdna+amp,表示在ac+ssdna+amp空白对照组基础上,还涂抹凡士林构建疏水界面;nc为阴性对照组,既不涂抹凡士林,也不加入编码外源蛋白的dna模板。其中,3h、6h、21h分别表示反应时间3h、6h、反应过夜(21h)。
[0116]
核苷酸和/或氨基酸序列表
[0117]
seq id no.:1,为外源蛋白megfp的基因序列,长度为717个碱基。
[0118]
seq id no.:2,为外源蛋白megfp的氨基酸序列,共239个氨基酸。
具体实施方式
[0119]
本发明术语、名词、短语的含义。本部分的含义解释适用于本发明的全文,既适用于下文,也适用于上文。本发明中涉及引用文献的,相关术语、名词、短语在引用文献中的定义也一并被引用,但是,与本发明中的定义相冲突的,以本发明中的定义为准。在引用文献
中的定义与本发明中的定义出现冲突时,并不影响所引用的成分、物质、组合物、材料、体系、配方、种类、方法、设备等以引用文献中确定的内容为准。
[0120]
本发明中,水相合成体系,指水相的体外无细胞蛋白合成体系。
[0121]
本发明中,“合成体系”、“水相体系”、“水相合成体系”与“水相的合成体系”具有相同含义,可互换使用。
[0122]
界面:物质相与物质相的分界面。
[0123]
疏水界面:是由疏水相与所述水相合成体系进行面接触形成的界面。
[0124]
疏水相:本发明中的疏水相,其与所述水相合成体系进行面接触的表面或界面为疏水的。所述疏水相的疏水性,指相对于所述水相合成体系而言是疏水的。所述疏水相的疏水性,指其外表面或外部界面的疏水性。对于构成疏水相的物质或装置,其不与所述水相合成体系相接触的部分的亲疏水性没有特别限制。所述疏水相可以为外表面或外部界面具有疏水性的物质相或装置。根据疏水相的物理状态,所述疏水界面可选自:固相疏水界面、液相疏水界面、或者其组合。当疏水相为液相时,优选该液相的整体(包括内部和外部表面/界面)均为疏水的。
[0125]
本发明中,“蛋白合成量”、“蛋白表达量”与“蛋白表达产量”具有相同含义,可互换使用。
[0126]
d2p,dna-to-protein,从dna模板到蛋白质产物。比如,d2p技术、d2p体系、d2p方法、d2p试剂盒等等。
[0127]
ivtt,in vitro transcription translation,体外转录翻译。
[0128]
rfu,相对荧光单位值(relative fluorescence unit)。
[0129]
egfp:增强型绿色荧光蛋白(enhanced green fluorescence protein)。
[0130]
megfp:egfp的a206k突变体。
[0131]
wt%或%(wt):为质量浓度单位,均表示质量百分比。
[0132]
(v/v)%或%(v/v):均表示体积百分比。
[0133]
%(w/v):质量体积浓度单位,对应于g/100ml。
[0134]
g/well,表示克每孔。
[0135]
蔗糖聚合物:指含有至少2个蔗糖单元的聚合物。包括但不限于聚蔗糖。
[0136]
ficoll蔗糖聚合物:如无特别说明,特指试剂,一种非离子型合成蔗糖聚合物,是由蔗糖和环氧氯丙烷共聚而成的一种高度分支化的聚合物,可选自市售产品。举例如ficoll-400(聚蔗糖400,cas:26873-85-8)、ficoll-70(聚蔗糖70,cas:72146-89-5)。其中,pm 400(sigma aldrich)是由蔗糖和环氧氯丙烷共聚而成的一种高度分支化的聚合物,平均分子量400kg/mol;ficoll pm 70(sigma aldrich)的平均分子量为70kg/mol。
[0137]
烃物质,主要成分为烃,杂质是随制备过程而产生的,并非添加引入。举例如凡士林、矿物油。
[0138]
烃,碳氢化合物,仅包括碳原子和氢原子。按不饱和度,烃分为饱和烃、不饱和烃。按芳香性,烃分为芳香烃和脂肪烃。
[0139]
脂肪烃,不含芳香环的烃。
[0140]
烷烃,也即饱和烃,可以为开链状,也可以为含环状的结构。所述开链状包括但不限于直链状、支链状;所述支链状包括但不限于支化度较低的普通支化结构,也包括特殊结
构的梳状、树状,还包括支化度较高的超支化结构。所述含环状的结构,包括但不限于环状结构、环状结构与开链结构的组合结构。适用于本发明的烷烃碳原子数至少为6,以便形成液态、膏状、固态(如蜡状、颗粒、粉末等)、或者其混合形态,进而构建疏水界面。当含有环状结构时,环状结构的数量可以为1个、2个或更多个。
[0141]
不饱和烃,包括但不限于烯烃、二烯烃、炔烃等,各自独立地可以为开链结构,也可以含有环状结构(例如,所述烯烃包括但不限于开链烯烃、环烯烃)。所述烯烃仅包括一个碳碳双键。所述二烯烃,包括且仅包括两个碳碳双键,可以为共轭二烯烃,也可以为非共轭结构。
[0142]
环状结构,所有的碳原子均参与构成环状骨架。包括但不限于单环、双环、多环、桥环、螺环、嵌套的环状结构等。所述桥环,相邻环共享两个碳原子,被共享的碳原子称为桥头碳原子;两个桥头碳原子可以通过化学键直接键合,也可以间隔其它碳原子而不直接相连。所述螺环,相邻环共享一个碳原子。
[0143]
开链烃,不含环状结构的烃,包括直链烃、支链烃。
[0144]
直链烃,所有的碳原子均位于主链的开链烃,依次相连形成链式结构,举例如正己烷、正癸烷、正十四烷。
[0145]
支链烃,至少1个碳原子位于侧链的开链烃,其中,至少一个碳原子同时与至少三个碳原子键合相连。举例如异辛烷。
[0146]
环烃,含有环状结构的烃,举例如环己烷(仅含环状结构)、十五烷基环己烷(环状结构与开链结构的组合结构)等。所述环烃可以为饱和烃,也可以为不饱和烃。
[0147]“本发明的表达系统”、“本发明的体外表达系统”、“体外无细胞表达系统”、“体外无细胞表达体系”可互换使用,指本发明的体外蛋白表达体系,也可采用其它描述方式,如:蛋白质体外合成系统、体外蛋白合成体系、无细胞系统、无细胞体系、无细胞蛋白合成体系、无细胞体外蛋白合成体系、体外无细胞蛋白合成体系、体外无细胞合成体系、cfs体系(cell-free system)、cfps体系(cell-free protein synthesis system)等描述方式。包括体外翻译体系、体外转录翻译体系(ivtt体系)等。本发明中,优选ivtt体系。我们还将体外蛋白合成系统称为“蛋白质合成工厂”(“protein factory”或“proteinfactory”)。本发明提供的体外蛋白合成系统,其组分是开放式描述的。
[0148]“无细胞体系”,是指进行体外蛋白合成时,并非通过完整细胞分泌表达的方式。需要说明的是,本发明的体外无细胞蛋白合成体系中,也允许添加细胞组分以促进反应,但所添加的细胞不以分泌表达外源靶蛋白(exogeneous target protein,外源目的蛋白)为主要目的。此外,在本发明指导下构建的无完整细胞的cfps体系中,有意地添加少量完整细胞(例如,其提供的蛋白含量与细胞提取物提供的蛋白含量相比,不超过30wt%),这样的“规避”方式,也囊括在本发明的保护范围之内。
[0149]
体外蛋白合成反应,是指在体外无细胞合成体系中合成蛋白的反应,至少包括翻译过程。包括但不限于ivtt反应(体外转录翻译反应)。本发明中,优选ivtt反应。ivtt反应,对应ivtt体系,是在体外将dna转录翻译为蛋白质(protein)的过程,因此,我们还将这类的体外蛋白合成体系称为d2p体系、d-to-p体系、d_to_p体系、dna-to-protein体系;相应的体外蛋白合成方法,还称为d2p方法、d-to-p方法、d_to_p方法、dna-to-protein方法。
[0150]
翻译后修饰:也称翻译后加工,post-translational modification,ptm。ptm系统
对于蛋白质的正常折叠、活性和稳定性具有重大作用。
[0151]
本发明中,“翻译相关元件”,指从核酸模板到蛋白质产物合成过程中所需的相关功能元件,不局限于翻译过程需要的功能元件;当核酸模板为dna时,还广义地包括转录过程中需要的功能元件。所述翻译相关元件,可通过细胞提取物(各种内源性因子)、体外蛋白合成体系的其它外源组分(如外源rna聚合酶、辅助因子等)、核酸模板上的功能元件(如控制外源蛋白转录/翻译的功能元件、抗性基因翻译系统、lac抑制子翻译系统、控制质粒拷贝数的翻译系统等)等方式提供。所述控制外源蛋白转录/翻译的功能元件,举例如启动子、终止子、增强子、ires元件、kozak序列、其它调节翻译水平的元件、信号序列、前导序列、功能标签(如筛选标记标签、增强翻译水平的标签)等。
[0152]
基因:包括编码区和非编码区。
[0153]
核苷酸序列:由核苷酸单元构成的序列。
[0154]
核酸序列:核酸物质的序列,包括dna序列、rna序列。
[0155]
编码序列:coding sequence,缩写为cds。与蛋白质的密码子完全对应的核苷酸序列,该序列中间不含其它非该蛋白质对应的序列(不考虑mrna加工等过程中的序列变化)。
[0156]
编码基因:编码蛋白质的有效基因片段,可以为连续的,也可以为不连续的。编码基因中必然包括编码序列。
[0157]
核酸模板:也称为遗传模板,指作为蛋白合成模板的核酸序列,包括dna模板和mrna模板。本发明的任一个实施方式中,所述核酸模板各自独立地可以为dna模板、mrna模板或其组合。本发明的任一个实施方式中,所述核酸模板可各自独立地优选为dna模板。本发明中,如无特别说明,编码外源蛋白的核酸模板优选为dna模板。
[0158]“编码x蛋白的核酸模板”指核酸模板中含有该x蛋白的编码序列,以该核酸模板为基础可以经翻译过程或者经转录翻译过程合成x蛋白,而且允许该核酸模板中含有非编码区,还允许含有除x蛋白以外的其它多肽或蛋白的编码序列。例如“编码rna聚合酶的核酸模板”,至少包括rna聚合酶的编码序列,此外还允许包括非编码区、融合标签等其它核酸序列;相应的表达产物至少含有rna聚合酶结构,可以为rna聚合酶分子或其融合蛋白,还可以为包括rna聚合酶分子或/和其融合蛋白的混合组分。
[0159]
增强元件:如无特别说明,本发明中指核酸序列中,位于启动子和目标蛋白的编码序列之间的,起到促进转录或/和翻译过程作用的序列,举例如ω序列、kozak序列、ires序列等。包括转录增强元件、翻译增强元件。
[0160]
内源/内源性:依赖于活性细胞代谢活动。内源性表达的蛋白由细胞培养时内源性分泌,可经处理后存在于本发明的细胞提取物中。
[0161]
外源/外源性:不依赖活性细胞代谢活动。外源组分直接添加到体外蛋白合成体系中,而非通过加入细胞或细胞提取物的方式添加。如:外源性rna聚合酶可通过加入前体(比如,无活性的前体,可经酶切或其他方式激活后生成rna聚合酶)、核酸模板(可经体系翻译合成蛋白)、融合蛋白、纯净物或混合物的外源方式添加到反应体系中。再如:外源性dna聚合酶也可通过上述的外源方式添加到反应体系中。
[0162]
外源蛋白:本发明的体外蛋白合成体系的目的表达产物,并非由宿主细胞分泌合成。可以为蛋白、融合蛋白、含蛋白或融合蛋白的混合物;还广义地包括多肽。基于编码外源蛋白的核酸模板进行体外蛋白合成反应后所得产物,可以为单一物质,也可以为混合物。
[0163]
外源rna聚合酶:与外源性rna聚合酶具有相同含义。
[0164]
外源dna聚合酶:与外源性dna聚合酶具有相同含义。
[0165]“编码rna聚合酶的核酸模板(或编码dna聚合酶的核酸模板)”,至少包括rna聚合酶(或dna聚合酶)的编码序列,此外还允许包括非编码区、融合标签等其它核酸序列;相应地表达产物至少含有rna聚合酶结构(或dna聚合酶结构)。以rna聚合酶为例,可以为rna聚合酶分子或其融合蛋白,还可以为包括rna聚合酶分子或/和其融合蛋白的混合组分。
[0166]
肽,是两个或两个以上氨基酸以肽键相连的化合物。本发明中,肽与肽段具有同等含义,可互换使用。
[0167]
多肽,10~50个氨基酸组成的肽。
[0168]
蛋白,50个以上的氨基酸组成的肽。融合蛋白也是一种蛋白。
[0169]
多肽的衍生物、蛋白的衍生物:本发明涉及的任一种多肽或蛋白,如无特别说明(例如指定具体序列),应理解还包括其衍生物。所述多肽的衍生物、蛋白的衍生物,至少包括含有c端标签、含有n端标签、含有c端及n端标签。其中,c端指cooh-端,n端指nh
2-端,本领域技术人员理解其含义。所述标签可以为多肽标签,也可以为蛋白标签。一些标签举例包括但不限于,6-组氨酸(6
×-
his,hhhhhh)、glu-glu、c-myc表位(eqkliseedl)、八肽(dykddddk)、蛋白c(edqvdprlidgk)、tag-100(eetarfqpgyrs)、v5表位标记(v5 epitope,gkpipnpllgldst)、vsv-g(ytdiemnrlgk)、xpress(dlyddddk)、血凝素(hemagglutinin,ypydvpdya)、β-半乳糖苷酶(β-galactosidase)、硫氧还原蛋白(thioredoxin)、组氨酸位点硫氧还原蛋白(his-patch thioredoxin)、igg结合域(igg-binding domain)、内含肽-几丁质结合域(intein-chitin binding domain)、t7基因10(t7 gene 10)、谷胱甘肽s-转移酶(glutathione-s-transferase,gst)、绿色荧光蛋白(gfp)、麦芽糖结合蛋白(maltose binding protein,mbp)等。
[0170]
同源性(homology),如没有特别说明,指至少50%同源性;优选至少60%同源性,更优选至少70%同源度,更优选至少75%同源性,更优选至少80%同源性,更优选至少85%同源性,更优选至少90%同源性;还比如至少91%、至少92%、至少93%、至少94%、至少95%、至少96%、至少97%、至少98%、至少99%、100%的同源性。比如本发明书提及的ω序列的同源序列。
[0171]“变体”,variant,指具有不同结构(包括但不限于进行微小变异),但仍能保持或基本保持原有功能或性能的物质。所述变体包括但不限于核酸变体、多肽变体、蛋白变体。获得相关变体的方式包括但不限于结构单元的重组、删除或缺失、插入、移位、置换等。所述变体包括但不限于经修饰的产物、基因改造产物、融合产物等。为获得基因改造产物,进行基因改造的方式包括但不限于基因重组(对应基因重组产物)、基因删除或缺失、插入、移码、碱基置换等。基因突变产物,也称为基因突变体,属于基因改造产物的一种类型。
[0172]
经修饰的产物:包括但不限于化学修饰产物、氨基酸修饰物、多肽修饰物、蛋白修饰物、等。所述化学修饰产物指采用有机化学、无机化学、高分子化学等化学合成方法的改造产物,举例如离子化、盐化、脱盐化、络合、解络合、螯合、解螯合、加成反应、取代反应、消除反应等化学修饰方法,具体举例如氧化、还原化、甲基化、去甲基化、氨基化、羧基化、硫化等修饰方法。
[0173]“突变体”,mutant,本发明中如无特别说明,指仍能保持或基本保持原有功能或性
能的突变产物,对突变位点的数量没有特别限制。所述突变体包括但不限于基因突变体、多肽的突变体、蛋白的突变体。突变体是变体的一种类型。获得相关突变体的方式包括但不限于结构单元的重组、删除或缺失、插入、移位、置换等。基因的结构单位为碱基,多肽和蛋白的结构单元为氨基酸。基因突变的类型包括但不限于基因删除或缺失、插入、移码、碱基置换等。
[0174]
本发明中,细胞提取物、细胞提取液、细胞裂解物、细胞破碎物、细胞溶解产物的含义相同,可以互换使用,英文可采用cell extract、cell lysate等描述方式。
[0175]
本发明中,能量体系、能量系统、能量供应体系具有同等含义,可互换使用。能量再生体系、能量再生系统具有同等含义,可互换使用。能量再生系统是能量系统的优选实施方式或者组成部分。
[0176]
氨基酸混合物,指含有至少两种以上氨基酸的混合物。
[0177]
本发明中,如无特别说明,所述氨基酸可以为天然氨基酸,也可以为非天然氨基酸,可以为
l-氨基酸、
d-氨基酸或者其组合,还可以为放射性同位素标记的氨基酸、经修饰的氨基酸等结构。所述经修饰的氨基酸,指连接有化学修饰基团的氨基酸,其结构没有特别限制,包括但不限于通过氨基酸侧基进行修饰。上述氨基酸的定义范围涵盖本发明中任一种包括氨基酸单元的物质,包括但不限于:多肽及其衍生物、蛋白及其衍生物、多肽标签、蛋白标签、多肽序列、蛋白序列、氨基酸修饰物、多肽修饰物、蛋白修饰物、前述任一种的部分结构域、前述任一种的亚基或片段、前述任一种的变体(包括前述任一种的结构域、亚基、片段的变体)。所述“前述任一种的变体”包括但不限于“前述任一种的突变体”。本发明中,对于表示手性类型的“l
-”
、“d
-”
,下标形式与非下标形式具有相同含义。
[0178]
拥挤剂,crowding agent,用于在体外模拟细胞内拥挤的大分子环境的试剂。参考文献“x ge,d luo and j xu.cell-free protein expression under macromolecular crowding conditions[j].plos one,2011,6(12):e28707”及其引用文献等。
[0179]
磷酸化合物,包括有机物和无机物。
[0180]
磷酸盐,如无特别说明,指无机磷酸盐。
[0181]
本发明中,“常温”优选室温至37℃,具体地,优选20℃~37℃,更优选25℃~37℃。
[0182]
本发明中,“优选”、“较佳”、“更佳”、“最优选”等优选实施方式,并非用于限定本发明的实施方式,仅用于提供技术效果更好的实施方式的举例。
[0183]
本发明的描述中,对于“优选方式之一”、“优选实施方式之一”、“优选例之一”、“优选例”、“在一优选的实施方式中”、“优选为”、“优选”、“优选地”、“更优选”、“更优地”、“进一步优选”、“最优选”等优选方式,以及“实施方式之一”、“方式之一”、“示例”、“具体示例”、“举例如”、“作为举例”、“例如”、“比如”、“如”等示意的列举方式,各方式所描述的具体特征包含于本发明的至少一个具体实施方式中。本发明中,各方式所描述的具体特征可以在任何的一个或者多个具体实施方式中以合适的方式结合。本发明中,各优选方式对应的技术方案也可以以任意合适的方式结合;举例如,可以同时加入外源rna聚合酶、外源dna聚合酶,参考专利类文献cn108642076a。
[0184]
本发明中,“可选地”,表示可以有,也可以无。
[0185]
本发明中,“其任意组合”,在数量上表示“等于1或大于1”,在范围上表示以下情形构成的组:“任选其中一个,或者任选其中至少两个构成的组合”。
[0186]
本发明中,“一个或多个”、“一种或多种”等“一或多”的描述,与“至少一个”、“至少一种”、“任意组合”等具有相同含义,可以互换使用,表示数量上表示“等于1或大于1”。
[0187]
本发明中,采用“或/和”、“和/或”表示“任选其一或者任选其组合”,也表示至少其一。举例如“包括合成rna的底物和/或合成蛋白的底物”,表示可以仅包括合成rna的底物,可以仅包括合成蛋白的底物,还可以同时包括合成rna的底物和合成蛋白的底物。
[0188]
本发明所述的“通常”、“常规”、“一般”、“经常”、“往往”等方式描述的现有技术手段,也都被引用作为本发明内容的参考,如无特别说明,可视为本发明的优选方式之一。
[0189]
在本发明提及的所有文献及这些文献直接引用或者间接引用的文献,都在本技术中引用作为参考,就如同每一篇文献被单独引用作为参考那样。
[0190]
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(包括但不限于实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案,只要能够体外合成外源蛋白或者优选地高效合成外源蛋白即可。限于篇幅,在此不再一一累述。
[0191]
本发明第一方面提供一种外源蛋白的体外无细胞合成方法,所述外源蛋白的体外无细胞合成方法包括:
[0192]
步骤一、将组分ii加入到组分i中,进行混合;
[0193]
其中,组分i为体外无细胞蛋白合成体系;所述体外无细胞蛋白合成体系为水相体系;
[0194]
其中,组分ii为编码外源蛋白的核酸模板;
[0195]
步骤二、在疏水界面iii辅助下,进行孵育反应,合成所述外源蛋白;
[0196]
其中,所述疏水界面iii与水相的体外无细胞蛋白合成体系进行面接触。
[0197]
还可选地包括分离或/和检测所述外源蛋白的步骤。
[0198]
所述组分i与组分ii能够共同提供合成外源蛋白所需的翻译相关元件。优选地,所述编码外源蛋白的核酸模板含有能够被组分i所识别的启动子元件。
[0199]
通过能够实现“表达外源蛋白”的技术功能的限定,本发明仅涵盖那些能够实现上述功能的技术特征的组合方式,不能实现上述功能的技术特征的组合方式当然地被排除在本发明范畴之外。也即,所述体外无细胞蛋白合成体系(组分i体系)首先应当是一个可工作的体系,是一个能够表达外源蛋白的体系。
[0200]
疏水界面
[0201]
所述疏水界面是由疏水相与所述水相合成体系进行面接触形成的界面。
[0202]
所述疏水界面通过亲疏水相互作用提供原料局部富集作用,还可对非水溶性蛋白产物提供界面增溶作用。此外,从mrna到蛋白质的翻译过程就是在核糖体进行的,核糖体的内质网(er)的膜表面具有疏水结构和疏水性质;所述疏水界面提供仿核糖体的疏水结构,推测本发明构建的疏水界面可能还对于新合成蛋白的折叠具有促进作用。
[0203]
根据疏水相的物理状态,所述疏水界面可选自:固相疏水界面、液相疏水界面、或者其组合。当疏水相为液相时,优选该液相的整体(包括内部和外部表面/界面)均为疏水的。优选地,所述疏水界面由下述疏水表面提供:反应器内表面、疏水内置固体物的疏水外表面、油相体系的液态界面、或者其组合。所述反应器内表面,比如反应器的侧壁内表面、底部内表面。所述疏水内置固体物指外表面疏水的固体物,其所处的位置没有特别限制,可沉
积于水相合成体系下方,也可悬浮于水相合成体系之中,还可漂浮在水相合成体系上方;优选地,疏水内置固体物沉积于水相合成体系下方、或漂浮在水相合成体系上方。
[0204]
优选地,所述疏水相由烃物质提供。所述烃物质的主要成分为烃,物理状态为膏状、固态(如蜡状、颗粒、粉末等)、液态、或者其混合形态。所述烃物质中含有的烃的碳原子数至少为6,优选方式之一为6~44。所述烃物质中含有的烃可以为饱和烃,也可以为不饱和烃。根据不饱和度,所述烃物质中含有的烃包括但不限于烷烃、烯烃、二烯烃、炔烃;根据结构类型,所述烃物质中含有的烃包括但不限于开链烃、环烃。
[0205]
所述烃物质,优选地选自脂肪烃。
[0206]
优选地,所述烃物质选自烷烃。
[0207]
优选地,所述疏水相由烷烃提供。
[0208]
优选地,所述烷烃为膏状、固态(如蜡状、颗粒、粉末等)、液态、或者其混合形态。
[0209]
优选地,所述烷烃的碳原子数至少为6。
[0210]
优选地,所述烷烃为直链结构、支链结构、环状结构、或者其组合。所述直链和支链结构的分子通式为c
n
h
2n+2
,所述环状结构的分子通式典型地为c
n
h
2n
(单环)。
[0211]
优选地,所述烷烃的碳原子数为6~44。
[0212]
更优选地,所述烷烃选自:环己烷、异辛烷、癸烷、十四烷、十五烷基环己烷、四十四烷、凡士林、或者其组合。
[0213]
优选地,所述烃物质选自凡士林、矿物油、或者其组合。
[0214]
所述能够提高外源蛋白合成量的烷烃用量(q
hc
),根据y
prt
(c
hc
)曲线中的外源蛋白表达量确定,选自y
prt
(c
hc
)曲线中外源蛋白表达量大于y0时的用量区间。
[0215]
优选地,所述q
hc
选自外源蛋白表达量至少为y0+50%y
δ
时的烷烃用量区间;
[0216]
更优选地,所述q
hc
选自外源蛋白表达量至少为y0+60%y
δ
时的烷烃用量区间;
[0217]
更优选地,所述q
hc
选自外源蛋白表达量至少为y0+70%y
δ
时的烷烃用量区间;
[0218]
更优选地,所述q
hc
选自外源蛋白表达量至少为y0+80%y
δ
时的烷烃用量区间;
[0219]
更优选地,所述q
hc
选自外源蛋白表达量至少为y0+90%y
δ
时的烷烃用量区间;
[0220]
更优选地,所述q
hc
选自外源蛋白表达量至少为y0+95%y
δ
时的烷烃用量区间;
[0221]
更优选地,所述q
hc
为外源蛋白最高表达量时的烷烃用量c
max
。
[0222]
优选方式之一,所述烷烃用量的确定方法为:所述体外无细胞蛋白合成体系的体系组分的种类和含量均确定时,在较宽泛的浓度范围内调整烷烃用量,在指定的反应条件下(反应温度、反应时间等),外源蛋白表达量最高时的烷烃用量c
max
,即为该技术方案下烷烃的最适用量。
[0223]
所述y
prt
(c
hc
)曲线,q
hc
,c
hc
,y
prt
,y
max
,c
max
,y0,y
δ
的定义与上述一致。
[0224]
本发明的保护范围仅涵盖那些能够提高外源蛋白表达量的烷烃用量所对应的技术方案。本发明中,对于所述的体外无细胞蛋白合成体系的任一个组分i体系,仅要求存在至少一个烷烃用量值能够提高外源蛋白表达量,而不要求所有的烷烃用量值均起到提升作用。
[0225]
体外无细胞蛋白合成反应与体外无细胞蛋白合成体系
[0226]
本发明的体外蛋白合成反应,在水相的体外无细胞蛋白合成体系中进行。
[0227]
所述体外无细胞蛋白合成体系能够提供体外合成蛋白过程所需的各种因子。可通
过细胞提取物的方式集成式地提供,也可通过分别添加的方式提供。
[0228]
所述体外无细胞蛋白合成体系的各组分的种类和含量,没有特别限制,只要所构成的体系能够与编码外源蛋白的核酸模板进行反应合成外源蛋白即可,并且优选那些能够高效表达外源蛋白的组合方式。而那些因为某些组分浓度过低或过高,而导致不能表达外源蛋白的组合方式,当然地被排除在本发明范畴之外。
[0229]
所述体外无细胞蛋白合成体系的各组分的加入顺序没有特别限制。
[0230]
优选地,所述体外无细胞蛋白合成体系含有能够识别核酸模板上的启动子元件的体系组分,例如与启动子元件相应的rna聚合酶。
[0231]
所述能够识别核酸模板上启动子元件的体系组分(例如相应的rna聚合酶),可以由所述细胞提取物提供,也可以通过外源添加方式提供,还可以通过前述两种方式的组合方式提供。
[0232]
优选方式之一,所述体外无细胞蛋白合成体系,至少包括细胞提取物。所述细胞提取物旨在提供用于蛋白转录翻译的结构或生物因子。所述细胞提取物的选取标准为:能够以编码外源蛋白的核酸模板为基础,经体外蛋白合成反应合成外源蛋白。本发明的细胞提取物来源可以为野生型,也可以为非野生型。非野生型的改造方式包括但不限于基因改造型。本发明的细胞提取物优选来源于真核细胞,更优选来源于酵母细胞,更优选来源于乳酸克鲁维酵母细胞。
[0233]
所述体外无细胞蛋白合成体系的组分,优选地,包括细胞提取物。更优选地,细胞提取物中含有内源性表达的、与核酸模板上启动子元件相对应的rna聚合酶。具体地例如,乳酸克鲁维酵母细胞提取物中含有内源性表达的t7 rna聚合酶,能够识别核酸模板上的t7启动子。
[0234]
优选方式之一,采用日本科学家开发的pure系统(protein synthesis using recombinant elements(pure)system)提供体外合成蛋白过程所需的各种因子。参考“lu,y.advances in cell-free biosynthetic technology.current developments in biotechnology and bioengineering,2019,chapter 2,23-45.”、“y shimizu,a inoue,y tomari,et al.cell-free translation reconstituted with purified components[j].nature biotechnology,2001,19(8):751-755”等文献及其引用文献中有关pure系统的介绍。
[0235]
体外合成蛋白的过程至少包括翻译过程,还可选地包括转录过程。
[0236]
将dna转化为mrna的转录过程离不开rna聚合酶。所述体外无细胞蛋白合成体系,优选地还包括rna聚合酶。所述rna聚合酶可以选自:内源性表达的rna聚合酶(经由细胞提取物提供)、外源添加的rna聚合酶、或者其组合。
[0237]
所述内源性表达的rna聚合酶不独立添加而是存在于细胞提取物中。
[0238]
为了实现所述细胞提取物中含有内源性表达的rna聚合酶,优选地将rna聚合酶的编码序列/编码基因整合入制备细胞提取物的宿主细胞内,具体地优选通过以下方式实现:将rna聚合酶的编码序列插入到细胞内游离质粒、或者将rna聚合酶的编码基因整合到细胞基因组、或者采用前述两种方式的组合方式进行菌株改造,然后制备细胞提取物。所述将rna聚合酶的编码序列/编码基因整合到细胞基因组的方式包括但不限于:插入细胞基因组、原位替换基因组的部分基因、或者其组合方式。
[0239]
所述外源添加或内源性表达的rna聚合酶各自独立地优选t7 rna聚合酶。
[0240]
所述体外无细胞蛋白合成体系,优选地包括dna聚合酶,所述dna聚合酶可以选自:内源性表达的dna聚合酶(经由细胞提取物提供)、外源添加的dna聚合酶、或者其组合。
[0241]
所述体外无细胞蛋白合成体系,可选地包括外源性rna聚合酶或/和编码rna聚合酶的核酸模板。
[0242]
所述体外无细胞蛋白合成体系,可选地包括外源性dna聚合酶或/和编码dna聚合酶的核酸模板。
[0243]
优选方式之一,所述体外无细胞蛋白合成体系,包括外源性rna聚合酶、外源性dna聚合酶。参考文献cn108642076a、wo2018171747a1(cn201710176691.4)。
[0244]
优选方式之一,所述体外无细胞蛋白合成体系包括能量系统。
[0245]
优选方式之一,所述体外无细胞蛋白合成体系包括合成rna的底物。
[0246]
优选方式之一,所述体外无细胞蛋白合成体系包括合成蛋白的底物。
[0247]
优选方式之一,所述体外无细胞蛋白合成体系包括dna聚合酶、合成dna的底物。
[0248]
优选方式之一,所述体外无细胞蛋白合成体系,包括细胞提取物、能量系统、合成蛋白的底物、rna聚合酶(包含于细胞提取物,或者独立外源添加)、合成rna的底物。
[0249]
优选方式之一,所述体外无细胞蛋白合成体系,包括细胞提取物、能量系统、合成蛋白的底物、rna聚合酶(包含于细胞提取物,或者独立外源添加)、合成rna的底物、dna聚合酶(包含于细胞提取物,或者独立外源添加)、合成dna的底物。
[0250]
优选方式之一,所述体外无细胞蛋白合成体系,包括乳酸克鲁维酵母细胞提取物(含内源性表达的rna聚合酶)、能量系统、合成rna的底物、合成蛋白的底物。
[0251]
所述体外无细胞蛋白合成体系中可选地包括以下至少一种组分:拥挤剂、镁离子、钾离子、抗氧化剂或还原剂、海藻糖、反应促进剂、缓冲剂、水性溶剂。
[0252]
细胞提取物
[0253]
所述细胞提取物应当能够表达所述体外无细胞蛋白合成体系中编码外源蛋白的核酸模板,也即能够以该核酸模板为基础合成其编码的外源蛋白。
[0254]
所述细胞提取物旨在提供用于蛋白转录翻译的结构因子或/和生物因子。
[0255]
细胞提取物可以提供合成外源蛋白所需的许多关键的翻译相关元件;这是内源性的提供方式。
[0256]
所述细胞提取物典型地用于提供核糖体、转运rna(trna)、氨酰trna合成酶、蛋白质合成所需的起始因子和延伸因子以及终止释放因子等物质,还可以经菌株改造后内源性地提供聚合酶(rna聚合酶和/或dna聚合酶)等其它酶物质。
[0257]
所述细胞提取物原则上不含有完整的细胞,这是因为细胞提取物的制备方法含有破碎细胞的步骤(也称为破细胞处理、裂解步骤等)。相较于传统的由完整细胞分泌表达蛋白的合成方式,由此构建的体外蛋白合成体系被称为无细胞体系。细胞提取物中还可以含有一些源自细胞的细胞质中的其它蛋白,尤其是可溶性蛋白。
[0258]
优选地,所述细胞提取物含有蛋白合成所需的各种因子。
[0259]
上述细胞提取物提供的各种蛋白类因子,相关的编码基因可以天然存在于细胞基因组中,也可以将相关编码基因整合到细胞的基因组中(整合到染色体),还可以将相关的基因或基因片段或编码序列插入到细胞内游离质粒中。以rna聚合酶、dna聚合酶为例进行
说明,优选方式之一,所述细胞提取物中含有内源性表达的rna聚合酶和/或dna聚合酶。
[0260]
针对细胞提取物的来源细胞,将异源蛋白的编码序列或编码基因进行内源性整合,可以使其内源性表达异源蛋白,所述异源蛋白可以包括但不限于:rna聚合酶、dna聚合酶等。将异源蛋白的编码序列或编码基因进行内源性整合的方法可以参考包括但不限于专利申请文献cn109423496a、cn10697843a、cn2018116198190、“molecular and cellular biology,1990,10(1):353-360”等现有文献及其引用文献提供的方法,具体地,包括但不限于:将编码序列插入到游离型细胞质粒内、将编码基因插入到细胞基因组、用编码基因原位替代细胞基因组的部分基因等方式、或者其组合方式。
[0261]
优选方式之一,所述细胞提取物的来源细胞内源性整合有rna聚合酶的编码基因,可以内源性表达rna聚合酶,能够在不添加外源性rna聚合酶的情形下,进行体外无细胞蛋白合成。所述内源性整合rna聚合酶的实现方式包括但不限于:将rna聚合酶的编码基因插入到细胞质粒或者插入到细胞基因组、用rna聚合酶的编码基因原位替换基因组的部分基因或序列(也即包括敲除原有部分基因或序列的步骤)、敲除原有部分基因并插入rna聚合酶的编码基因、或者其组合。实施例s2中,将t7 rna聚合酶的编码基因整合到了乳酸克鲁维酵母细胞的基因组中,该乳酸克鲁维酵母细胞内源性表达t7 rna聚合酶,以此制备的细胞提取物含有内源性表达的t7 rna聚合酶,体外无细胞蛋白合成体系没有额外添加rna聚合酶。另外的一些具体实施方式中,还将rna聚合酶的编码序列插入到乳酸克鲁维酵母的细胞内游离质粒中,进而制备细胞提取物。具体参照cn109423496a的制备方法。
[0262]
还可以采用其他的基因改造方法对来源细胞进行改造,以促进细胞提取物促进体外蛋白合成的活力,如cn2018116083534、cn2019107298813、cn108949801a的基因敲除方法,如2018112862093的基因改造方法等。
[0263]
所述细胞提取物的制备方法可以采用已报道的技术手段。简要概括而言,通常可包括以下步骤:用液氮将细胞速冻,将细胞打碎,离心收集上清液,即获得细胞提取物。参考cn106978349a、cn108535489a、cn108642076a、cn109593656a、cn109971783a等文献。可对种子细胞进行发酵培养,离心,去除培养液,收集到细胞,进而制备细胞提取物。
[0264]
采用本发明提供的方法制备的细胞提取物可以使体外蛋白合成反应正常进行,含有具备氨基酸转运功能的trna、氨酰trna合成酶等蛋白合成所需的必要组分。在一些实施例中,所述细胞提取物为酵母细胞提取物,采用包括以下步骤的方法制备:(i)提供来源细胞;(ii)对酵母细胞进行洗涤处理,获得经洗涤的酵母细胞;(iii)对经洗涤的酵母细胞进行破细胞处理,从而获得酵母粗提物;和(iv)对所述酵母粗提物进行固液分离,收集的上清液部分即为细胞提取物。所述酵母细胞提取物,优选地为乳酸克鲁维酵母细胞提取物。
[0265]
在本发明中,所述细胞提取物所含蛋白含量优选方式之一为20mg/ml~100mg/ml。另优选方式之一为20mg/ml~50mg/ml。另优选方式之一为50mg/ml~100mg/ml。另优选方式之一为25mg/ml、30mg/ml、35mg/ml、40mg/ml、45mg/ml、50mg/ml、60mg/ml、70mg/ml、80mg/ml、90mg/ml中任一种浓度,或者任两种浓度之间的浓度范围(包括两个端点)。所述的测定蛋白含量方法可以采用考马斯亮蓝测定方法。
[0266]
所述细胞提取物在体外蛋白合成体系中的浓度没有特别限制。优选实施方式之一,细胞提取物的浓度为20%-80%(v/v);另一优选实施方式,细胞提取物的浓度为20%-70%(v/v);另一优选实施方式,细胞提取物的浓度为30%-60%(v/v);另一优选实施方式,
var.lactis、马克斯克鲁维酵母(kluyveromyces marxianus)、kluyveromyces marxianus var.lactis、kluyveromyces marxianus var.marxianus、kluyveromyces marxianus var.vanudenii、多布克鲁维酵母(kluyveromyces dobzhanskii)、海泥克鲁维酵母(kluyveromyces aestuarii)、非发酵克鲁维酵母(kluyveromyces nonfermentans)、威克海姆克鲁维酵母(kluyveromyces wickerhamii)、耐热克鲁维酵母(kluyveromyces thermotolerans)、脆壁克鲁维酵母(kluyveromyces fragilis)、湖北克鲁维酵母(kluyveromyces hubeiensis)、多孢克鲁维酵母(kluyveromyces polysporus)、暹罗克鲁维酵母(kluyveromyces siamensis)、亚罗克鲁维酵母(kluyveromyces yarrowii)等、或者其组合;参考文献包括但不限于以下文献:ep1197560a1、“marc-andr
é
lachance.the yeasts(fifth edition),chapter 35,kluyveromyces van der walt (1971).2011,pages 471-481”、“jl souciet,b dujon,c gaillardin,m johnston et al.comparative genomics of protoploid saccharomycetaceae[j].genome res.2009,19:1696-1709”。
[0274]
克鲁维酵母(kluyveromyces)是一种子囊孢子酵母,其中,马克斯克鲁维酵母(kluyveromyces marxianus)和乳酸克鲁维酵母(kluyveromyces lactis)是工业上广泛使用的酵母。与其它酵母相比,乳酸克鲁维酵母具有许多优点,如超强的分泌能力,更好的大规模发酵特性、食品安全的级别、还具有蛋白翻译后修饰的能力等。乳酸克鲁维酵母的野生菌株的基因组中不含有t7 rna聚合酶的编码基因。
[0275]
优选方式之一,所述细胞提取物的来源是乳酸克鲁维酵母,且内源性整合有以下任一种基因序列或其组合:rna聚合酶的编码基因、dna聚合酶的编码基因。优选地,内源性整合方式为整合入细胞质粒中或整合入细胞基因组中。
[0276]
优选方式之一,所述细胞提取物的来源是乳酸克鲁维酵母,且内源性整合有以下任一种或其组合:t7 rna聚合酶的编码基因、phi29 dna聚合酶的编码基因。优选地,内源性整合方式为整合入细胞质粒中或整合入细胞基因组中。
[0277]
本发明所述细胞提取物的优选实施方式之一,所述细胞提取物可选自以下任一种来源:大肠杆菌、酵母细胞、哺乳动物细胞、植物细胞、昆虫细胞、或者其组合。所述酵母细胞更优选选自克鲁维酵母、酿酒酵母、毕氏酵母、或者其组合;所述克鲁维酵母进一步优选为乳酸克鲁维酵母、kluyveromyces lactis var.drosophilarum、kluyveromyces lactis var.lactis、马克斯克鲁维酵母、kluyveromyces marxianus var.lactis、kluyveromyces marxianus var.marxianus、kluyveromyces marxianus var.vanudenii、多布克鲁维酵母、非发酵克鲁维酵母、海泥克鲁维酵母、威克海姆克鲁维酵母、耐热克鲁维酵母、脆壁克鲁维酵母、湖北克鲁维酵母、多孢克鲁维酵母、暹罗克鲁维酵母、亚罗克鲁维酵母、或者其组合。
[0278]
另一优选实施方式,所述细胞提取物为酵母细胞提取物,更优选克鲁维酵母细胞提取物,更优选马克斯克鲁维酵母细胞提取物或乳酸克鲁维酵母细胞提取物。
[0279]
另一优选实施方式,所述细胞提取物可选自以下任一种来源:大肠杆菌、乳酸克鲁维酵母、麦胚细胞、spodoptera frugiperda细胞(sf细胞,一种昆虫细胞)、蜥蜴利什曼原虫细胞、兔网织红细胞、中国仓鼠卵巢细胞(cho细胞)、非洲绿猴肾cos细胞、非洲绿猴肾vero细胞、幼地鼠肾细胞(bhk细胞)、人hela细胞、人hybridoma细胞(人杂交瘤细胞)、人纤维肉瘤ht1080细胞、或者其组合。
[0280]
外源rna聚合酶、外源dna聚合酶
[0281]
当作为细胞提取物来源的细胞基因组中不含有rna聚合酶的基因,也没有内源性整合rna聚合酶的编码序列/编码基因的情况下,通常需要额外加入外源性rna聚合酶以促进反应进行。比如采用野生型乳酸克鲁维酵母的细胞提取物时。
[0282]
向体外蛋白合成体系中添加外源rna聚合酶是传统的技术手段。现有技术中报道的添加外源rna聚合酶的体外蛋白合成体系,均纳入到本发明中,作为本发明的组分i体系的可选方式。例如,cn108535489a中添加外源rna聚合酶(如t7 rna聚合酶)的乳酸克鲁维酵母体外蛋白合成体系,均作为组分i体系的可选方式纳入到本发明中。
[0283]
所述体外无细胞蛋白合成体系中还可以包括以下至少一种组分,以优化反应体系:外源rna聚合酶、编码外源rna聚合酶的核酸模板、外源dna聚合酶、编码外源dna聚合酶的核酸模板。
[0284]
可以直接添加外源性rna聚合酶,也可以添加编码rna聚合酶的外源核酸模板,或者添加其组合。rna聚合酶的编码序列,可以一并构建于编码外源蛋白的核酸模板中,也可以另外构建在独立的外源核酸模板中。
[0285]
同样地,dna聚合酶也可以直接添加,或者添加含有其编码序列的外源核酸模板,或者添加其组合。可以是编码外源蛋白的核酸模板,也可以是独立的外源核酸模板。
[0286]
所述编码外源蛋白的核酸模板为dna模板时,可以包括dna的扩增过程,也可以不包括dna扩增过程;如果体外蛋白合成反应中还包括dna扩增过程,则需要体系中含有内源表达的或/和外源添加的dna聚合酶,例如cn108642076a中加入外源性phi29 dna聚合酶。本发明的实施例s1-s2中,对编码外源蛋白megfp的dna进行体外扩增后,将扩增产物加入反应体系中,作为外源dna模板,体外蛋白合成反应再需要包括dna扩增过程。体系中添加dna聚合酶时,也即当包括dna的扩增过程时,还需添加合成dna的底物。
[0287]
dna聚合酶可以是源自真核生物或原核生物的聚合酶。真核生物聚合酶的举例如下述任一种或其任意组合:pol-α,pol-β,pol-δ,pol-ε、等、前述任一种片段、前述任一种的变体(包括前述任一种片段的变体)。原核生物聚合酶举例如下述任一种或其任意组合:大肠杆菌(e.coli)dna聚合酶i(如klenow片段)、大肠杆菌dna聚合酶ii、大肠杆菌dna聚合酶iii、大肠杆菌dna聚合酶iv、大肠杆菌dna聚合酶v、噬菌体t4 dna聚合酶、嗜热脂肪芽孢杆菌(bacillus stearothermophilus)聚合酶i、phi29 dna聚合酶、t7 dna聚合酶、枯草芽孢杆菌(bacillus subtilis)pol i,金黄葡萄球菌(staphylococcus aureus)pol i,等,前述任一种的部分结构域,前述任一种的亚基或片段,前述任一种的变体(包括前述任一种结构域、亚基、片段的变体)。所述变体包括但不限于突变体。
[0288]
所述聚合酶(外源性rna聚合酶、外源性dna聚合酶)优选可进行常温扩增的聚合酶,所述常温优选室温至37℃,具体地,优选20℃~37℃,更优选25℃~37℃。所述可进行常温扩增的聚合酶可根据外源核酸模板进行选取,可用于体外无细胞体系的常温扩增聚合酶均作为参考纳入本发明的范围,包括但不限于phi29 dna聚合酶、t4 dna聚合酶、t7 dna聚合酶、exo-klenow dna聚合酶、bsu dna聚合酶、pol iii dna聚合酶、t7 rna聚合酶、t3 rna聚合酶、t4 rna聚合酶、t5 rna聚合酶等,上述任一种聚合酶的部分结构域,前述任一种的亚基或片段,前述任一种的变体,及前述聚合酶及其部分结构域、亚基、片段、变体(包括但不限于突变体)的任意组合。本发明还可采用taq dna聚合酶、pfu dna聚合酶、pol i dna聚合酶、pol ii dna聚合酶等其它dna聚合酶。
[0289]
在一些优选例中,dna聚合酶具有链置换功能。
[0290]
在一些优选例中,dna聚合酶缺失3
’-5’
核酸外切酶活性。
[0291]
本发明可采用的扩增技术,特别是常温扩增方法没有特别限制,体外无细胞体系可采用的常温扩增技术均作为参考纳入本发明的范围。
[0292]
能量系统/能量再生系统
[0293]
能量系统/能量再生系统用于提供蛋白合成过程所需能量。
[0294]
已报道的用于无细胞体外蛋白合成系统的能量系统/能量再生系统均可为本发明的体外蛋白合成体系提供能量。包括但不限于:文献cn109988801a、cn2018116198186、cn2018116198190、us20130316397a、us20150376673a、“mj anderson,jc stark,ce hodgman and mc jewett.energizing eukaryotic cell-free protein synthesis with glucose metabolism[j].febs letters,2015,589(15):1723-1727”、“y lu.advances in cell-free biosynthetic technology[j].current developments in biotechnology and bioengineering,2019,chapter 2,23-45”、“p shrestha,mt smith and bc bundy.cell-free unnatural amino acid incorporation with alternative energy systems and linear expression templates[j].new biotechnology,2014,31(1):28-34”等文献及其直接引用或间接引用文献中报道的能量系统/能量再生系统,均作为参考纳入本发明。
[0295]
优选实施方式之一,所述能量系统为糖(单糖、二糖、寡糖或多糖)与磷酸盐能量体系、糖与磷酸肌酸能量体系、磷酸肌酸与磷酸肌酸酶体系、磷酸肌酸与磷酸肌酸激酶体系、糖酵解途径及其中间产物能量体系(单糖及其酵解中间产物能量体系、糖原及其酵解中间产物能量体系)、或者其组合。具体地,所述磷酸盐,指无机磷酸盐,优选选自正磷酸盐、磷酸二氢盐、磷酸氢二盐、偏磷酸盐、焦磷酸盐或者其组合。所述多糖可选自包括但不限于淀粉、麦芽糊精、玉米糊精等多糖。所述二糖,举例如蔗糖、麦芽糖等。所述糖酵解途径及其中间产物能量体系包括但不限于基于葡萄糖的能量体系。
[0296]
能量系统中各组分的浓度没有特别限制,包括但不限于采用现有已报道的技术方案及其等同技术方案。实施例s3采用的能量系统单糖(葡萄糖)、多糖(麦芽糊精)与磷酸盐能量体系;实施例s11、s12中采用多糖与磷酸盐能量体系,其中,多糖选用麦芽糊精,磷酸盐选用磷酸三钾(磷酸钾等同于磷酸三钾)。
[0297]
合成rna的底物
[0298]
所述合成rna的底物为核苷酸混合物,实施方式之一,选自:核苷单磷酸、核苷三磷酸、或者其组合。优选为核苷三磷酸混合物(ntp)。所述核苷三磷酸混合物优选为腺嘌呤核苷三磷酸、鸟嘌呤核苷三磷酸、胞嘧啶核苷三磷酸和尿嘧啶核苷三磷酸的混合物。在本发明中,各种单核苷酸的浓度没有特别限制,以合成蛋白所需核苷酸进行计量,通常的优选实施方式之一,每种单核苷酸的浓度为0.5mm~5mm,另一优选实施方式之一为1.0mm~2.0mm。每种单核苷酸的浓度各自独立地举例如下述任一种浓度,或者下述任两个浓度值之间的浓度范围(所述范围包括两个端点):0.5mm、1.0mm、1.5mm、2.0mm、2.5mm、3.0mm、3.5mm、4.0mm、4.5mm、5.0mm、5.5mm、6.0mm。
[0299]
合成dna的底物
[0300]
进行dna扩增或者体外蛋白合成反应过程中含有dna复制的步骤过程时,需要添加
合成dna的底物。所述合成dna的底物优选脱氧核苷酸混合物,进一步优选脱氧核苷三磷酸混合物(dntp)。
[0301]
所述体外无细胞蛋白合成体系中含有dna聚合酶时,优选地也含有合成dna的底物。
[0302]
合成蛋白的底物
[0303]
所述合成蛋白的底物为氨基酸混合物。以合成蛋白所需核苷酸进行计量。每种氨基酸的浓度通常的优选实施方式之一为0.01mm~5mm,另一优选实施方式之一为0.1mm~1mm。每种氨基酸的浓度各自独立地举例如下述任一种浓度,或者下述任两个浓度值之间的浓度范围(所述范围包括两个端点):0.1mm、0.2mm、0.4mm、0.5mm、1.0mm、1.2mm、1.5mm、1.8mm、2.0mm、2.5mm、3.0mm、3.5mm、4.0mm、4.5mm、5.0mm、5.5mm、6.0mm。
[0304]
所述氨基酸混合物至少包括合成外源蛋白过程所需的氨基酸混合物,选自包括但不限于:甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、苯丙氨酸、脯氨酸、色氨酸、丝氨酸、酪氨酸、半胱氨酸、蛋氨酸、天冬酰胺、谷氨酰胺、苏氨酸、天冬氨酸、谷氨酸、赖氨酸、精氨酸和组氨酸。所述合成外源蛋白过程所需的氨基酸混合物,不仅包括组成外源蛋白一级序列的氨基酸,还可以包括合成过程中涉及的其它氨基酸。
[0305]
所述氨基酸混合物可以包括天然氨基酸、非天然氨基酸。
[0306]
所述氨基酸混合物可以包括
l-氨基酸、
d-氨基酸、或其组合。
[0307]
除天然氨基酸外,所述氨基酸混合物还可以包括非天然氨基酸、
d-氨基酸、放射性同位素标记的氨基酸、经修饰的氨基酸等组分。所述非天然氨基酸没有特别限制,可以选自:包括但不限于“y lu.cell-free synthetic biology:engineering in an open world[j].synthetic and systems biotechnology,2017,2,23-27”、“w gao,e cho,y liu and y lu.advances and challenges in cell-free incorporation of unnatural amino acids into proteins[j].frontiers in pharmacology,2019,10:611”等文献及其直接引用或间接引用文献中报道或引用的非天然氨基酸。所述放射性同位素标记的氨基酸没有特别限制,包括但不限于已报道的蛋白合成领域中采用的同位素标记。所述经修饰的氨基酸没有特别限制,包括但不限于通过氨基酸侧基进行修饰。
[0308]
优选地,所述氨基酸混合物为天然氨基酸的混合物。
[0309]
其它添加剂组分
[0310]
所述体外无细胞蛋白质合成体系中还可以包括以下至少一种组分:聚乙二醇和/或其类似物、镁离子、钾离子、抗氧化剂或还原剂、海藻糖、反应促进剂、缓冲剂、水性溶剂。可以参考文献wo2016005982a1、us20060211083a1、“l kai,vr kaldenhoff and f bernhard.artificial environments for the co-translational stabilization of cell-free expressed proteins[j].plos one,2013,8(2):e56637”、us20030119091a1、us20180245087a1、us5665563、wo2019033095a1、us9410170b2、us9528137b2等文献及其直接或间接引用的文献。
[0311]
在一些优选例中,所述体外无细胞蛋白质合成体系还含有拥挤剂(crowding agents),用于模拟细胞内的拥挤的大分子环境。所述拥挤剂的结构没有特别限制,可以为线性的,也可以为非线性,所述非线性结构包括但不限于支化、多臂、环状、梳状、树状、星形等结构类型。在一些优选例中,所述拥挤剂可以选自以下组:聚乙二醇、聚乙烯醇
(polyvinylalcohol,pva)、聚丙乙烯、葡聚糖(dextran)、聚蔗糖、蔗糖聚合物(如ficoll蔗糖聚合物)、聚乙烯(乙烯吡咯烷酮)(pvp)、白蛋白、等、其任意组合。所述白蛋白的来源包括但不限于:人血清白蛋白、牛血清白蛋白、猪血清白蛋白;优选地,所述白蛋白为人血清白蛋白(human serum albumin)。所述拥挤剂还可参考文献“x ge,d luo and j xu.cell-free protein expression under macromolecular crowding conditions[j].plos one,2011,6(12):e28707”及其引用文献所公开的拥挤剂。在一些优选例中,拥挤剂在所述体外蛋白合成反应混合物中的浓度足以提高蛋白合成量。
[0312]
在一些优选例中,拥挤剂的分子量不超过400kda。在一些优选例中,拥挤剂的分子量不超过200kda。通常,分子量规格优选分子量分布为
±
10%或更窄。优选方式之一,拥挤剂的用量,以拥挤剂在所述体外蛋白合成反应混合物中的重量百分比(wt%)或体积百分比(%(v/v))或质量体积浓度(%(w/v))为单位,选自0.5%~15%,进一步优选选自1%-12%;举例如下述浓度值中的任一种浓度,或下述任意两个浓度值之间的浓度范围:1.0%、1.5%、2.0%、2.5%、3.0%、3.5%、4.0%、4.5%、5.0%、5.5%、6.0%、6.5%、7.0%、7.5%、8.0%、8.5%、9.0%、9.5%、10.0%、10.5%、11.0%、11.5%、12.0%、12.5%、13.0%、13.5%、14.0%、14.5%、15.0%。
[0313]
优选方式之一,所述体外无细胞蛋白质合成体系还含有聚乙二醇和/或其类似物,用作拥挤剂和/或稳定mrna(参考文献yin g,swartz j r.enhancing multiple disulfide bonded protein folding in a cell-free system[j].biotechnology and bioengineering,2004,86(2):188-195.)。其中如聚乙二醇,还可以调节体系粘度。聚乙二醇,具有ch2ch2o的重复单元(eo单元),通常记为peg(polyethylene glycol)、peo(poly(ethylene oxide))、poe(polyoxyethylene)。所述聚乙二醇的类似物包括但不限于富含eo单元的共聚物、聚乙二醇衍生物、可起到拥挤剂作用的其它聚氧化烯烃(举例如聚氧丙烯,pop)、所述其它聚氧化烯烃的衍生物、等;所述衍生物,以聚乙二醇衍生物为例,举例如,包括但不限于化学修饰物(举例如甲氧基聚乙二醇、氨基修饰物、羧基修饰物等)、氨基酸修饰物、多肽修饰物、蛋白修饰物、含聚乙二醇嵌段的嵌段聚合物、含聚乙二醇侧链的聚合物等。聚乙二醇或其类似物的浓度没有特别限制,通常,聚乙二醇或其类似物的浓度为0.1%-10%,优选0.1%-8%,更优选0.5%-4%,更优选1%-2%,以所述蛋白合成体系的质量体积浓度计(%(w/v))或者以总重量计(wt%);如无特别说明,本发明中均指质量体积浓度,单位为%(w/v),如2%,指2%(w/v),对应2g/100ml、20mg/ml。一些优选例中,聚乙二醇和/或其类似物的分子量不超过40000da,代表性的分子量举例如:200、400、500、600、800、1000、1200、1400、1450、1500、1600、1800、2000、2500、3000、3350、4000、4500、5000、5500、6000、6500、7000、7500、8000、8500、9000、9500、10000、12000、14000、15000、16000、18000、20000、25000、30000、35000、40000、其组合;单位da;上述各数字在数值上等于重均分子量或数均分子量。通常,分子量规格优选分子量分布为
±
10%或更窄。所述聚乙二醇和/或其类似物优选分子量为200da~10000da,更优选分子量为3000da~10000da。另优选方式之一为200da~8000da。另优选方式之一为200da~8000da。本发明中,聚乙二醇或其类似物的分子量如无特别说明,均指重均分子量m
w
。代表性的peg选自下组:peg200、peg400、peg1000、peg1500、peg2000、peg3000、peg3350、peg5000、peg6000、peg8000、peg10000、等、其组合;其中,3350等数字在数值上等于重均分子量。
[0314]
所述镁离子来源于镁离子源,没有特别限制,所述镁离子源可以选自下组:醋酸镁、谷氨酸镁(优选l-谷氨酸镁)、天门冬氨酸镁(优选l-天门冬氨酸镁)、氯化镁、磷酸镁、硫酸镁、柠檬酸镁、磷酸氢镁、碘化镁、乳酸镁、硝酸镁、草酸镁、其组合。优选实施方式之一的浓度范围是0.1mm~50mm。另优选实施方式之一的浓度范围是0.5mm~20mm。另优选实施方式之一的浓度范围是1mm~10mm。优选方式之一,镁离子源为天门冬氨酸镁、醋酸镁、谷氨酸酶中任一种或任意组合的混合物。
[0315]
所述钾离子来源于钾离子源,没有特别限制,所述钾离子源可以选自下组:醋酸钾、谷氨酸钾(优选l-谷氨酸钾)、氯化钾、磷酸钾、硫酸钾、柠檬酸钾、磷酸氢钾、碘化钾、乳酸钾、硝酸钾、草酸钾、其组合。优选实施方式之一的浓度范围是0~500mm。另优选实施方式之一的浓度范围是1mm~250mm。另优选实施方式之一的浓度范围是5mm~200mm。另优选实施方式之一的浓度范围是10mm~100mm。
[0316]
专利文献wo2016005982a1中报道的聚乙二醇、镁离子、钾离子的优化作用及优选方式,也可作为参考纳入本发明中。
[0317]
所述抗氧化剂,也可称为还原剂。可选用包括但不限于二硫苏糖醇(dtt,dithiothreitol)、2-巯基乙磺酸、2-巯基乙醇、还原型谷胱甘肽(gsh)、三羧甲基磷酸(tcep)、3-巯基-1,2-丙二醇(mpd)等等。优选实施方式之一为二硫苏糖醇。dtt采用其常规使用浓度即可;具体实施方式之一如0.5mm~10mm;另一实施方式中采用浓度0~1.7mm。
[0318]
所述反应促进剂,包括但不限于,如cn109971783a所提供的反应促进剂(如铝盐)。
[0319]
所述缓冲剂,主要用于维持体系的ph环境。优选实施方式之一为,选自以下任一种或者其组合:tris-hcl、tris碱、hepes(4-羟乙基哌嗪乙磺酸体系)。
[0320]
所述水性溶剂,优选为缓冲剂。
[0321]
体外蛋白合成体系的具体实施方式举例
[0322]
优选实施方式之一为,所述体外蛋白合成体系含有细胞提取物、内源性表达的rna聚合酶(包含于前述细胞提取物中)或者外源添加的rna聚合酶、能量系统、合成rna的底物、合成蛋白的底物、拥挤剂、镁离子、钾离子、缓冲液,还可选地包括以下任一种组分:编码rna聚合酶的外源核酸模板(独立地优选为dna模板)、内源性表达的dna聚合酶或者外源添加的dna聚合酶、编码dna聚合酶的外源核酸模板(独立地优选为dna模板)、合成dna的底物、抗氧化剂或还原剂、海藻糖、反应促进剂、水性溶剂。所述细胞提取物优选为真核细胞提取物,更优选酵母细胞提取物,更优选方式之一为乳酸克鲁维酵母细胞提取物。
[0323]
优选实施方式之一为,所述体外蛋白合成体系含有细胞提取物(把rna聚合酶的编码基因整合到细胞基因组中或者插入到细胞内游离质粒中进行菌株改造),还含有选自以下组的一种或多种或全部组分:4-羟乙基哌嗪乙磺酸钾(hepes-k)或三羟甲基氨基甲烷(tris)、醋酸钾、醋酸镁、谷氨酸镁、天门冬氨酸镁、核苷三磷酸混合物(ntp)、氨基酸混合物、磷酸肌酸、磷酸肌酸酶、磷酸肌酸激酶、二硫苏糖醇(dtt)、rna酶抑制剂、l-阿拉伯糖、葡萄糖、蔗糖、淀粉、糊精、玉米糊精、麦芽糊精、磷酸盐(如磷酸钾)。所述细胞提取物优选为真核细胞提取物,更优选酵母细胞提取物,更优选方式之一为乳酸克鲁维酵母细胞提取物。
[0324]
优选实施方式之一为,所述体外蛋白合成体系含有细胞提取物,还含有选自以下组的一种或多种或全部组分:hepes-k或tris、醋酸钾、醋酸镁、谷氨酸镁、天门冬氨酸镁、核苷三磷酸混合物、氨基酸混合物、磷酸肌酸、磷酸肌酸酶、磷酸肌酸激酶、dtt、rna酶抑制剂、
l-阿拉伯糖、葡萄糖、蔗糖、淀粉、糊精、玉米糊精、麦芽糊精、磷酸盐(如磷酸钾)、外源性t7 rna聚合酶、外源性phi29 dna聚合酶、脱氧核苷三磷酸混合物。所述细胞提取物优选为真核细胞提取物,更优选酵母细胞提取物,更优选方式之一为乳酸克鲁维酵母细胞提取物。
[0325]
优选实施方式之一为,所述体外蛋白合成体系含有细胞提取物(可选地,把rna聚合酶的编码基因整合到细胞基因组中或者插入到细胞内游离质粒中进行菌株改造),还含有选自以下组的一种或多种或全部组分:hepes-k或三羟甲基氨基甲烷盐酸盐(tris
·
hcl)、醋酸钾、醋酸镁、谷氨酸镁(优选l-谷氨酸镁)、天门冬氨酸镁(优选l-天门冬氨酸镁)、核苷三磷酸混合物、氨基酸混合物、磷酸肌酸、磷酸肌酸酶、磷酸肌酸激酶、dtt、rna酶抑制剂、l-阿拉伯糖、葡萄糖、蔗糖、淀粉、糊精、玉米糊精、麦芽糊精、磷酸钾、聚乙二醇、葡聚糖、蔗糖聚合物、氧化铝促进剂、外源性t7 rna聚合酶、外源性phi29 dna聚合酶、编码t7 rna聚合酶的dna模板、编码phi29 dna聚合酶的dna模板、脱氧核苷三磷酸混合物。所述细胞提取物优选为真核细胞提取物,更优选酵母细胞提取物,更优选方式之一为乳酸克鲁维酵母细胞提取物。
[0326]
另一种优选实施方式为,所述体外蛋白合成的体系含有细胞提取物,还含有选自以下组的一种或多种或全部成分:tris-hcl(ph8.0)、醋酸钾、醋酸镁、谷氨酸镁、天门冬氨酸镁(优选l-天门冬氨酸镁)、二硫苏糖醇、聚乙二醇、葡聚糖、蔗糖聚合物、葡萄糖、l-阿拉伯糖、核苷三磷酸混合物(四种核苷三磷酸混合物、单一核苷三磷酸浓度相同)、氨基酸混合物(甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、苯丙氨酸、脯氨酸、色氨酸、丝氨酸、酪氨酸、半胱氨酸、蛋氨酸、天冬酰胺、谷氨酰胺、苏氨酸、天冬氨酸、谷氨酸、赖氨酸、精氨酸和组氨酸;其中,单一氨基酸浓度相同)、磷酸钾、外源性t7 rna聚合酶、外源性phi29 dna聚合酶、脱氧核苷三磷酸混合物。所述细胞提取物优选为真核细胞提取物,更优选酵母细胞提取物,更优选方式之一为乳酸克鲁维酵母细胞提取物。
[0327]
具体地,优选实施方式之一为,含有50%~80%(v/v)细胞提取物,还含有选自以下组的一种或多种或全部成分:9.78mm ph8.0的tris-hcl、20mm~80mm醋酸钾、2mm~10mm醋酸镁、1.5mm~6mm l-天门冬氨酸镁、0.4mm~5mm二硫苏糖醇(如0.44mm)、0.5%~5%(w/v)聚乙二醇(如2%(w/v))、0.5mm~5mm四种核苷三磷酸(单一核苷三磷酸浓度均相同,如1.8mm)、0.1mm~1mm的氨基酸混合物(甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、苯丙氨酸、脯氨酸、色氨酸、丝氨酸、酪氨酸、半胱氨酸、蛋氨酸、天冬酰胺、谷氨酰胺、苏氨酸、天冬氨酸、谷氨酸、赖氨酸、精氨酸和组氨酸,单一氨基酸浓度均相同,如0.5mm)、5mm~110mm l-阿拉伯糖、200mm~400mm麦芽糊精(以葡萄糖单体计量,如320mm时对应约52mg/ml)、10mm~40mm磷酸钾。所述细胞提取物优选为真核细胞提取物,更优选酵母细胞提取物,更优选方式之一为乳酸克鲁维酵母细胞提取物。
[0328]
体外蛋白合成体系的具体实施方式之一,还包括但不限于,例如wo2016005982a1所记载的基于大肠杆菌的无细胞蛋白合成体系。本发明的其它引用文献、其直接及间接引用文献中所记载的包括但不限于基于麦胚细胞、兔网织红细胞、酿酒酵母、毕赤酵母、马克斯克鲁维酵母的体外无细胞蛋白合成体系,也均作为实施方式纳入本发明。举例如,文献“lu,y.advances in cell-free biosynthetic technology.current developments in biotechnology and bioengineering,2019,chapter 2,23-45”中包括但不限于“2.1systems and advantages”部分第27-28页所引用文献中记载的体外无细胞蛋白合成
体系,均可作为实施本发明的体外无细胞蛋白合成体系。举例如,文献cn106978349a、cn108535489a、cn108690139a、cn108949801a、cn108642076a、cn109022478a、cn109423496a、cn109423497a、cn109837293a、cn109971783a、cn109988801a、cn110551700a、cn109971775a、cn110551745a、cn110551700a、cn2018116083534、cn2018116198186、cn2018116198190、cn2019102128619、cn2019102355148、cn2019107298813、cn2019112066163、cn2018108881848、cn2018109550734、cn2018111131300、cn2018111423277、cn2018112862093、cn201911418151.8、cn202010069383.3及其引用文献中记载的体外无细胞蛋白合成体系,均可作为实施本发明的体外无细胞蛋白合成体系。
[0329]
外源蛋白
[0330]
适用于本发明的体外蛋白合成体系的外源蛋白,没有特别限制,只要能够基于细胞提取物(包括原核细胞提取物、真核细胞提取物;特别地真核细胞提取物,更特别地酵母细胞提取物,更特别地乳酸克鲁维酵母细胞提取物)进行体外合成即可。现有技术已公开的适用原核细胞提取物、真核细胞提取物(优选地酵母细胞提取物、更优选地乳酸克鲁维酵母来源)的体外蛋白合成体系的外源蛋白,或者适用于细胞内合成的原核细胞体系或真核细胞体系(优选为酵母细胞体系,更优选为乳酸克鲁维酵母体系)的内源蛋白,也均可以采用本发明的体系进行合成,或者尝试用本发明提供体外蛋白合成体系进行合成。
[0331]
所述外源蛋白的应用领域包括但不限于生物医药、分子生物、医学、体外检测、医疗诊断、再生医学、生物工程、组织工程、干细胞工程、基因工程、聚合物工程、表面工程、纳米工程、化妆品、食品、食品添加剂、营养剂、农业、饲料、生活用品、洗涤、环境、化学染色、荧光标记等领域。
[0332]
外源蛋白的类型包括但不限于多肽(本发明中“外源蛋白”广义地包括多肽)、荧光类蛋白、酶及相应的酶原、抗体及其片段、抗原、免疫球蛋白、激素、胶原、聚氨基酸、疫苗等,前述任一种蛋白的部分结构域,前述任一种蛋白的亚基或片段,以及前述任一种蛋白的变体。所述“前述任一种蛋白的亚基或片段”包括“前述任一种蛋白的部分结构域”的亚基或片段。所述“前述任一种蛋白的变体”包括“前述任一种蛋白的部分结构域、前述任一种蛋白的亚基或片段”的变体。所述“前述任一种蛋白的变体”包括但不限于前述任一种蛋白的突变体。本发明中,其他位置的连续两个或两个以上“前述”的情形,含义做类似解释。
[0333]
外源蛋白的结构,既可以为完整结构,也可以选自相应的部分结构域、亚基、片段、二聚体、多聚体、融合蛋白、糖蛋白等。
[0334]
例如,本发明的体外蛋白合成体系可合成的外源蛋白,可以选自包括但不限于以下任一种蛋白、任意组合方式的融合蛋白、任意组合方式的混合物:荧光素酶(如萤火虫荧光素酶)、绿色荧光蛋白(gfp)、增强绿色荧光蛋白(egfp)、黄色荧光蛋白(yfp)、氨酰trna合成酶、甘油醛-3-磷酸脱氢酶、过氧化氢酶、肌动蛋白、抗体的可变区域、α-淀粉酶、肠道菌素a、丙型肝炎病毒e2糖蛋白、胰岛素前体、干扰素αa、白细胞介素-1β、溶菌酶素、血清白蛋白、单链抗体段(scfv)、甲状腺素运载蛋白、酪氨酸酶、木聚糖酶、大肠杆菌β-半乳糖苷酶(β-galactosidase,lacz)、人赖氨酸-trna合成酶(lysine-trna synthetase)、人亮氨酸-trna合成酶(leucine-trna synthetase)、拟南芥甘油醛3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase)、鼠过氧化氢酶(catalase)等,前述任一种蛋白的部分结构域,
前述任一种蛋白的亚基或片段,或前述任一种的变体(如前述定义,所述变体包括突变体,举例如萤光素酶突变体、egfp的突变体)。还可参考专利文献cn109423496a。所述任意组合方式的混合物,可以包括前述任一种的蛋白,也可以包括前述任意组合方式的融合蛋白。
[0335]
优选实施方式之一,采用gfp、egfp、或其突变体作为外源蛋白对体外蛋白合成体系的蛋白合成能力进行评估。
[0336]
外源核酸模板(包括编码外源蛋白的核酸模板)
[0337]
本发明的外源核酸模板,如无特别说明,特指编码外源蛋白的核酸模板。此外,本发明的外源核酸模板,在指明的情况下,还可以包括编码体外蛋白合成过程所需蛋白因子或蛋白酶的核酸模板,举例如编码rna聚合酶的外源核酸模板、编码dna聚合酶的外源核酸模板。
[0338]
离开编码外源蛋白的核酸模板,外源蛋白体外合成反应就无法进行。
[0339]
本发明的任一实施方式中的编码外源蛋白的核酸模板各自独立地可以为dna模板、mrna模板、或者其组合。
[0340]
本发明的任一实施方式中的编码外源蛋白的核酸模板可以各自独立地优选为dna模板。
[0341]
核酸模板作为合成外源蛋白的直接模板(mrna)、间接模板(dna)、或者其组合。
[0342]
所述编码外源蛋白的核酸模板允许包括非编码区。所述表达产物可以为多肽或蛋白,也可以为融合蛋白。对一个核酸模板分子完成一次翻译(或转录翻译)过程,允许合成的多肽或蛋白分子数量可以为1个、2个或更多个。
[0343]
转录翻译方式的蛋白合成过程以dna模板为间接模板,仅翻译方式的蛋白合成过程可以采用mrna模板作为直接模板。
[0344]
优选地,本发明的体外蛋白合成体系为体外转录翻译体系,也即ivtt体系,采用dna模板作为编码外源蛋白的核酸模板。
[0345]
所述编码外源蛋白的核酸模板含有合成外源蛋白所需的翻译相关元件。
[0346]
本发明的任一实施方式中,各自独立地优选,所述编码外源蛋白的核酸模板还含有所述细胞提取物能够识别的启动子元件。
[0347]
优选方式之一,所述编码外源蛋白的核酸模板含有所述细胞提取物能够识别的启动子元件。
[0348]
优选方式之一,外源蛋白的基因转录过程由核酸模板上的t7启动子启动。
[0349]
优选方式之一,t7启动子位于核酸模板外源蛋白的编码序列的上游,由t7启动子启动外源蛋白的转录程序,所述体外无细胞蛋白合成体系中的细胞提取物中含有内源性表达的t7 rna聚合酶。
[0350]
优选方式之一,所述编码外源蛋白的核酸模板包括外源蛋白翻译系统、抗性基因翻译系统、lac抑制子翻译系统;上述翻译系统中分别包括相应的启动子。
[0351]
优选方式之一,所述编码外源蛋白的核酸模板还含有控制质粒拷贝数的基因。
[0352]
优选方式之一,所述编码外源蛋白的核酸模板还含有转录增强元件,如kozak序列。
[0353]
优选方式之一,所述编码外源蛋白的核酸模板还含有翻译增强元件,如翻译增强子元件、ires元件、kozak序列等。
[0354]
外源dna模板(包括编码外源蛋白的dna模板)
[0355]
本发明的外源dna模板,如无特别说明,特指编码外源蛋白的dna模板。
[0356]
本发明的外源dna模板,可以选自dna、cdna、甲基化dna、或者其组合。其中,cdna可以由rna或mirna经逆转录获得。mirna(microrna)是一类由内源基因编码的长度约为20~25个核苷酸的非编码单链rna分子。
[0357]
所述编码外源蛋白的dna模板中含有外源蛋白的编码序列。
[0358]
优选地,所述编码外源蛋白的dna模板中含有外源蛋白的编码基因。
[0359]
所述编码外源蛋白的dna模板根据外源蛋白确定。
[0360]
所述编码外源蛋白的dna模板还可以含有选自启动子、终止子、增强子(举例如cn109423497a、cn109022478a、cn109837293a(cn201711194355.9)、cn109971775a)等文献中记载及其引用文献中记载的增强子元件,例如ω序列及其同源序列、组合的增强子元件)、kozak序列(参考cn109022478a、cn109837293a、cn109971775a等文献及其引用文献)、ires元件(内部核糖体进入序列,参考cn109022478a、cn109423497a等文献及其引用文献)、多克隆位点(mcs)、控制质粒拷贝数的基因等的其它功能元件。还可以含有编码信号肽(对应signal sequence)、前导肽(对应leader sequence)、功能标签(如纯化标签)、连接肽等其它氨基酸链的编码序列。还可以含有5’非翻译序列、3’非翻译序列。
[0361]
所述编码外源蛋白的dna模板优选地含有启动子元件。所述启动子元件要求能够被所使用的细胞提取物或者体外蛋白合成体系的其它组分所识别;可以是野生型细胞提取物能识别的启动子,也可以将细胞提取物的来源菌株改造成能识别该启动子的菌株。所述编码外源蛋白的dna模板中启动子可选自以下组:aod1、mox、aug1、aox1、gap、fld1、pex8、ypt1、lac4、pgk、adh4、amy1、gam1、xyl1、xpr2、tef、rps7、t7、或其组合。参考包括但不限于以下文献及其引用文献:“cereghino g.applications of yeast in biotechnology:protein production and genetic analysis.current opinion in biotechnology,1999,10(5),422-427”。
[0362]
实施例s3-s12中,外源dna模板采用t7启动子启动外源蛋白的转录过程;所述t7启动子是能够对t7 rna聚合酶有特异性反应的强启动子。
[0363]
优选地,由外源dna模板上的t7启动子启动外源蛋白的基因转录过程。
[0364]
关于外源dna模板的浓度选取,根据实验方案拟表达的外源蛋白量确定。优选实施方式之一为,外源dna模板的浓度采用1ng/μl~400ng/μl。另优选实施方式之一为,外源dna模板的浓度采用1ng/μl~80ng/μl。另优选实施方式之一为,外源dna模板的浓度采用5ng/μl~50ng/μl。本发明中,如无特别说明,dna模板的添加浓度为终浓度,也即体外蛋白合成反应的起始浓度。
[0365]
所述外源dna模板可以是环状dna,也可以是线性dna;可以是单链的,也可以是双链的。所述外源蛋白的编码基因可以选自包括但不限于:基因组序列、cdna序列。所述外源dna模板还可以含有启动子序列、5’非翻译序列、3’非翻译序列。
[0366]
优选实施方式之一,所述外源dna模板还包括选自下组的任一元件或其组合:启动子、终止子、poly(a)元件、转运元件、基因靶向元件、筛选标记基因、增强子、ires元件、kozak序列、抗性基因、转座酶编码基因、信号序列(signal sequence)、前导序列(leadingsequence,举例如cn109022478a中记载及其引用的前导序列)、控制质粒拷贝数的
基因(rop基因)、增强翻译水平的标签(如cn2019112066163所记载的多肽标签)等。可参考文献us20060211083a1等。
[0367]
所述外源dna模板还可构建于表达载体之中。本领域普通技术人员可以使用熟知的方法构建含有外源蛋白的编码基因的表达载体。这些方法包括体外重组dna技术、dna合成技术、体内重组技术等。
[0368]
例如,将“z1-z2”结构的核酸构建物插入到质粒载体的克隆位点,作为质粒dna;其中,z1为启动子,
“-”
为共价键或者核苷酸片段,z2为外源蛋白的编码序列。其中,z1的优选方式之一为t7启动子。
[0369]
优选实施方式之一,所述外源dna模板为环状dna,进一步优选为质粒dna。相应的dna质粒没有特别限制,只要能够与体系的细胞提取物进行反应合成外源蛋白即可。通常地,质粒中含有启动子、终止子、非翻译区(utr)等功能元件。所述质粒的优选方式之一为含有细胞提取物组分能够识别的启动子。举例如,含有t7启动子的质粒理论上都可以作为实施例s3-s12所使用的外源dna模板的表达载体。例如大肠杆菌的pet系列质粒、pgem系列质粒等均可以用之替代实施例s3-s12的乳酸克鲁维酵母提取物的质粒载体以实施本发明。所述质粒的另一优选方式为含有能够被外源添加组分所识别的启动子。
[0370]
以外源dna模板采用t7启动子启动外源蛋白的转录为例,所述t7启动子可以被细胞提取物中内源性表达的t7 rna聚合酶所识别启动,也可以被外源添加的t7 rna聚合酶所识别启动。
[0371]
线性dna可以通过体外核酸扩增技术获得。可采用的扩增技术没有特别限制,包括但不限于pcr扩增技术、恒温扩增技术、常温扩增技术、室温扩增技术等。其中,恒温扩增技术优选常温扩增技术。优选实施方式之一为,所述外源dna模板为线性dna,且为pcr线性片段。所述pcr线性片段可以通过已报道的pcr技术获得。
[0372]
另一优选实施方式为,所述外源dna模板为线性dna,且为经扩增系统得到的双链线性dna。所述扩增系统没有特别限制,可以从包括但不限于现有的商业化试剂盒、文献报道的扩增系统中选取,只要能够扩增本发明的编码外源蛋白的dna模板即可。举例如,包括但不限于biocompare、neta scientific inc、abm公司、thermo fisher scientific公司、expedeon公司、vivantis公司等企业提供的商业化dna扩增系统。
[0373]
另一优选实施方式为,采用双链dna作为外源dna模板,且构建于环状质粒载体中。所采用的质粒载体,典型地,含有t7启动子、t7终止子和/或5’和3’utr等功能元件。
[0374]
作为优选实施方式之一,实施例s3-s12中,采用双链dna作为外源dna模板,构建于环状质粒载体;这些质粒含有t7启动子,作为启动外源蛋白转录翻译的启动子;在实施例s2-s12中,改造型乳酸克鲁维酵母可内源性表达t7 rna聚合酶,由改造菌株制备细胞提取物,构建体外无细胞蛋白合成体系,该体系的t7启动子可适用于各种蛋白的体外无细胞表达。该质粒中还包含t7终止子、utr等功能元件。
[0375]
在一实施例中,质粒dna中包括以下功能元件:启动子、5’非编码区、外源蛋白的编码序列、3’非编码区、终止子、复制起始位点(f1 ori)、ampr启动子、氨苄青霉素抗性基因、高拷贝数复制起始位点(ori)、控制质粒拷贝数的基因(rop基因)、laci启动子、laci的编码序列。
[0376]
实施例之一,质粒dna至少包括表1所标示的结构元件。具体举例如图1所示的质粒
结构。
[0377]
表1图1中标示的质粒dna(pd2p-megfp)的结构元件的说明
[0378][0379]
另一实施例中,除了图1标示的功能元件,在5’utr与megfp的编码序列之间还具有纯化标签,如多聚组氨酸标签(his-tag)。举例如图2所示。
[0380]
另一实施例中,除了图1标示的功能元件,在5’utr下游存在kozak序列,用于提高翻译水平。举例如图2所示。
[0381]
另一实施例中,除了图1标示的功能元件,在5’utr与megfp的编码序列之间、5’utr的下游还具有信号肽的编码序列(信号序列)。
[0382]
另一实施例中,质粒dna中包括以下功能元件:启动子、5’非编码区、前导序列、外源蛋白的编码序列、3’非编码区、终止子、复制起始位点(f1 ori)、ampr启动子、氨苄青霉素抗性基因、高拷贝数复制起始位点(ori)、控制质粒拷贝数的基因(rop基因)、laci启动子、laci的编码序列。举例如图3所示的质粒结构。其中,rop基因未标示,其中外源蛋白翻译系统采用t7启动子和lac4终止子。
[0383]
另一实施例中,质粒dna中包括以下功能元件:启动子、5’非编码区、信号肽的编码序列、外源蛋白的编码序列、3’非编码区、终止子、f1 ori、ampr启动子、氨苄青霉素抗性基因、ori、rop基因、laci启动子、laci的编码序列。具体地举例如,质粒dna中包括以下功能元件:t7启动子、5’非编码区、信号肽的编码序列、外源蛋白megfp的编码序列、3’非编码区、t7终止子、f1 ori、ampr启动子、氨苄青霉素抗性基因、ori、rop基因、laci启动子、laci的编码序列。
[0384]
另一实施例中,质粒dna中包括以下功能元件:启动子、5’非编码区、信号肽的编码序列、纯化标签的编码序列、多克隆位点(mcs)、外源蛋白的编码序列、3’非编码区、终止子、f1 ori、ampr启动子、氨苄青霉素抗性基因、ori、rop基因、laci启动子、laci的编码序列。具
amplification,hda)、3sr技术(self-sustained sequence replication)等等。参考文献,包括但不限于:“nicole e.gregorio,max z.levine and javin p.oza.a user's guide to cell-free protein synthesis[j].methods protoc.2019,2,24”、“y lu.advances in cell-free biosynthetic technology[j].current developments in biotechnology and bioengineering,2019,chapter 2,23-45”、“y lu.cell-free synthetic biology:engineering in an open world[j].synthetic and systemsbiotechnology,2017,2,23-27”等文献及其直接引用或间接引用文献,所公开的体外核酸扩增方法(特别是常温扩增方法),均可用作本发明的技术手段,均作为参考纳入本发明。
[0395]
本发明的体外核酸扩增还可采用smart扩增法(smap)、单引物等温扩增(spia)、指数扩增反应(expar)、热稳定的hda(thda)、多重置换扩增(mda)、限制性辅助rca等扩增技术。
[0396]
本发明的体外核酸扩增反应可以持续在有利于反应的一个特定温度或温度范围内进行。本发明的任一种常温扩增技术也允许在温度有波动的条件下进行。
[0397]
孵育反应(体外蛋白合成反应)
[0398]
将编码外源蛋白的核酸模板(优选为dna模板)加入到所述体外无细胞蛋白合成体系中,孵育反应一段时间,表达合成所述外源蛋白。
[0399]
进行体外蛋白合成反应的条件,根据具体的体外无细胞蛋白合成体系确定,可参考已报道的反应条件,包括但不限于cn106978349a、cn108535489a、cn108642076a等文献记载的反应条件。体外蛋白合成反应可以持续在有利于反应的一个特定温度或温度范围内进行。优选方式之一,整个反应时间内混合液的摄氏温度的变化小于25%(举例如少于20%,少于15%,少于10%,少于5%)和/或整个反应时间内混合液的温度变化小于15℃(举例如小于10℃,小于5℃,小于2℃,或小于1℃)。优选采用常温条件进行体外蛋白合成。所述常温条件优选室温至37℃,具体地,优选20℃~37℃。优选方式之一为25℃~37℃。另优选方式之一为20℃~30℃。已报道的适于常温条件的常温蛋白合成方法或者等温蛋白合成方法均可用于实施本发明的技术方案。
[0400]
所述反应时间可根据原料使用量(如反应底物量、预期获得的蛋白含量等)、反应效率等因素综合确定。
[0401]
实施方式之一,所述反应时间为1h~72h。
[0402]
另实施方式之一,所述反应时间为3h~24h。
[0403]
另实施方式之一,所述反应时间为3h~21h。
[0404]
另实施方式之一,所述反应时间为6h~21h。
[0405]
所述反应时间还可选自下述任一个时间长度,或任两个时间长度之间的时间长度(包包括两个端点):3h、4h、5h、6h、7h、8h、9h、10h、11h、12h、13h、14h、15h、16h、17h、18h、19h、20h、21h、22h、23h、24h、36h、48h。
[0406]
分离或/和检测步骤
[0407]
所述外源蛋白的体外无细胞合成方法还可选地包括分离或/和检测所述外源蛋白的步骤。所述分离或/和检测方法,采用常规技术方法即可实现。
[0408]
本发明第二方面提供一种体外蛋白合成试剂盒,所述体外蛋白合成试剂盒包括:
[0409]
(i)第一方面所述外源蛋白的体外无细胞合成方法中的体外无细胞蛋白合成体
系;
[0410]
(ii)可选地包括编码外源蛋白的核酸模板;
[0411]
(iii)可选地包括反应容器;
[0412]
(iv)疏水相;
[0413]
所述疏水相用于构建第一方面所提供的外源蛋白的体外无细胞合成方法中的所述疏水界面;
[0414]
利用该组分可以构建能够与水相的体外无细胞蛋白合成体系进行面接触的疏水界面;
[0415]
(v)标签或说明书。
[0416]
所述(i)和(i)共同提供合成外源蛋白所需的翻译相关元件。
[0417]
所述体外无细胞蛋白合成体系的各组分以干粉、液体、乳液、悬浊液、或其组合方式置于一个或多个容器中。所述干粉的优选方式之一为冻干粉。所述液体包括纯净物、溶液。
[0418]
利用所述体外蛋白合成试剂盒,可以进行体外蛋白合成反应,合成外源蛋白。
[0419]
所述体外蛋白合成试剂盒的各部分与第一方面所述外源蛋白的体外无细胞合成方法的各组分相对应。
[0420]
所述疏水相可以为构建疏水界面的物质相或装置。
[0421]
所述编码外源蛋白的核酸模板为dna模板、mrna模板、或者其组合。
[0422]
优选地,所述编码外源蛋白的核酸模板为dna模板。
[0423]
所述反应容器的基材,举例如细胞培养板、离心管等。如,六孔板、十二孔板、二十四孔板、四十八孔板、九十六孔板等。可以为平底板,也可以为尖底板。
[0424]
优选方式之一,所述体外无细胞蛋白合成体系的各组分共同构成水性溶液。所述试剂盒包括一个盛放所述水性溶液的容器。
[0425]
优选方式之一,所述试剂盒包括分别包括以下组分的分装容器:(a)细胞提取物;(b)能量系统;(c)可选地,核酸模板;(d)缓冲液;(e)可选地,ph调节组分;(f)可选地,若干个其它固态组分;(h)可选地,若干个其它液态组分。其中,组分(a)、(b)、(c)各自独立地为干粉或水性溶液。其中,组分(c)、(e)、(f)各自独立地有或无。此处的“若干个”表示1个、2个或更多个。
[0426]
优选方式之一,各组分分装为干粉和液态试剂两个部分。所述试剂盒包括两个容器,一个盛放干粉组分,另一个盛放液态试剂组分。所述液态试剂包括一切含有液相的体系,可以为均一体系也可以为混合体系,包括但不限于纯净物、溶液、乳液、悬浊液、其组合形式。
[0427]
优选方式之一,各组分分装为干粉、缓冲液、其它液态试剂,可选地包括溶剂水。
[0428]
优选方式之一,以下各组分分别装在不同的容器中:细胞提取物(含有内源性表达rna聚合酶,可选地含有内源性表达的dna聚合酶)、能量系统、合成rna的底物、合成蛋白的底物、拥挤剂、外源镁离子、外源钾离子、缓冲液,还可选地包括以下任一种组分的分装容器:外源添加的rna聚合酶、编码rna聚合酶的外源dna模板、外源添加的dna聚合酶、编码rna聚合酶的外源dna模板、抗氧化剂或还原剂、海藻糖、反应促进剂、水性溶剂。所述rna聚合酶独立地更优选为t7 rna聚合酶。所述dna聚合酶独立地更优选为phi29 dna聚合酶。所述细
胞提取物含转运rna(trna)、核糖体(ribosome)。所述细胞提取物优选为真核细胞提取物,更优选为克鲁维酵母细胞提取物,更优选为乳酸克鲁维酵母细胞提取物。
[0429]
优选方式之一,以下各组分分别装在不同的容器中:细胞提取物(来源细胞没有内源性整合rna聚合酶的编码序列/编码基因、也没有内源性整合dna聚合酶的编码序列/编码基因)、外源添加的rna聚合酶、能量系统、合成rna的底物、合成蛋白的底物、拥挤剂、外源镁离子、外源钾离子、缓冲液,还可选地包括以下任一种组分的分装容器:编码rna聚合酶的外源dna模板、外源添加的dna聚合酶、编码dna聚合酶的外源dna模板、抗氧化剂或还原剂、海藻糖、反应促进剂、水性溶剂。所述rna聚合酶独立地更优选为t7 rna聚合酶。所述dna聚合酶独立地更优选为phi29 dna聚合酶。所述细胞提取物含转运rna、核糖体。所述细胞提取物优选为真核细胞提取物,更优选为克鲁维酵母细胞提取物,更优选为乳酸克鲁维酵母细胞提取物。
[0430]
本发明第三方面提供烷烃在第一方面所述外源蛋白的体外无细胞合成方法中的应用,或在第二方面所述体外蛋白合成试剂盒中的应用,或在体外蛋白合成方面的应用;其中,所述烷烃用于构建疏水界面。
[0431]
优选地,所述在体外蛋白合成方面的应用,包括但不限于,应用于蛋白制造,或者应用于基于蛋白合成的检测等方面。
[0432]
所述外源蛋白的体外无细胞合成方法的应用领域包括但不限于生物医药、分子生物、医学、体外检测、医疗诊断、再生医学、生物工程、组织工程、干细胞工程、基因工程、聚合物工程、表面工程、纳米工程、化妆品、食品、食品添加剂、营养剂、农业、饲料、生活用品、洗涤、环境、化学染色、荧光标记等领域。
[0433]
下面结合具体实施例和附图1-13,进一步阐述本发明。应理解,这些实施例仅用于阐述说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,例如“sambrook等人,分子克隆:实验室手册(new york:cold spring harbor laboratorypress,1989)”、《无细胞蛋白合成实验手册》“edited by alexander s.spirin and james r.swartz.cell-free protein synthesis:methods and protocols[m].2008”等文献中所述的实验条件,或者按照制造厂商所建议的条件,或者按照、参考上文所述的具体实施方式指引的条件。除非另外说明,否则本发明中提及的百分比和份数是重量百分比和重量份数。
[0434]
如无特别说明,则本发明实施例中所用的材料和试剂均为市售产品。
[0435]
实施例1~12分别与实施例s1~s12具有相同含义,可互换使用。
[0436]
本发明以乳酸克鲁维酵母(kluyveromyces lactis,简写为k.lactis或kl)作为实施例s2-s12中的细胞提取物来源。本发明的实施例s3-s12均采用乳酸克鲁维酵母的改造菌株制备细胞提取物。需要说明的是,同样的设计和分析、实验方法也适用于本文所述的其它细胞提取物来源,包括但不限于,例如原核细胞(如大肠杆菌),例如其它酵母细胞,例如植物细胞、昆虫细胞、动物细胞(如哺乳动物细胞,具体如鼠源、兔源、猴源、人源等)等其它真核细胞。
[0437]
本发明实施例中采用的质粒表达载体仅用于具体阐述本发明的实施方式,并非限定本发明的范围;其它可用于实施本发明的质粒载体包括但不限于现有商业途径可购买的常见质粒载体,举例如:pet系列质粒、pgem系列质粒等。
[0438]
以下实施例中使用的烷烃,如无特别说明,指线性链状结构(n-结构,直链结构)。比如,未特别限定的癸烷指正癸烷。下述实施例所用的各类烷烃的物理参数如下表2所示。
[0439]
表2.实施例s3-s12所用烃物质的参数说明
[0440][0441]
其中,反应容器采用24孔板或48孔板,均为平底细胞培养板。其中,24孔板的底面积为1.77cm2,48孔板的底面积为0.8cm2。
[0442]3[0443]
以下实施例中,均设置了阴性对照组(nc组),不添加烷烃,也不添加编码荧光蛋白的dna模板,其它反应条件与实施例中的实验组一致。反应3h、18~22h后,rfu值相对于空白对照组(bc组)均可忽略,rfu值不超过35,部分nc组的实验结果数据未在图表中显示。
[0444]
实施例s1制备编码外源蛋白megfp的核酸模板
[0445]
构建表达megfp的质粒载体,进行体外dna扩增,制备编码外源蛋白megfp的质粒。
[0446]
选取增强型绿色荧光蛋白(megfp)为外源蛋白,作为目的表达产物,其氨基酸序列如seq id no.2所示。
[0447]
选取质粒载体。采用针对乳酸克鲁维酵母细胞提取物设计的人工构建质粒载体,该人工构建质粒载体含有t7启动子、t7终止子,5’utr和3’utr等功能元件。该质粒载体可以联合含有内源性表达的t7 rna聚合酶的乳酸克鲁维酵母细胞提取物构建成体外无细胞蛋白合成体系,在体外表达各种外源蛋白。
[0448]
采用pcr扩增、同源片段重组方法,将含有megfp的编码基因的dna片段插入到质粒载体中,构建表达megfp的质粒载体,记为质粒d2p-megfp(简记为pd2p-megfp),共6384bp。质粒经基因测序确认正确。其中,编码megfp的基因序列如seq id no.1所示。
[0449]
所述pd2p-megfp质粒的图谱如图1所示,其结构元件组成如下表3所示。
[0450]
表3编码外源蛋白megfp的质粒(pd2p-megfp)的结构元件说明
[0451][0452]
进行dna扩增。扩增反应体系包括终浓度分别如下的各组分:1μm~5μm的随机引物(引物序列:nnnnnnn),1.14ng/μl的上述质粒(pd2p-megfp,作为模板),0.5mm~1mm脱氧核苷三磷酸混合物(dntp),0.1mg/ml~0.5mg/mlbsa,0.05mg/ml~0.1mg/ml phi29 dna聚合酶,1
×
phi29反应缓冲液(成分为200mm tris-hcl,20mm mgcl2,10mm(nh4)2so4,10mm kcl,ph7.5)。将上述的反应体系混匀后放置在30℃的环境中反应2h。获得dna模板,紫外分光光度计测定其核酸浓度,反应液冷藏备用,作为后续实施例中的核酸模板。
[0453]
实施例s2制备细胞提取物
[0454]
本发明的实施例s3-s12均采用乳酸克鲁维酵母的改造菌株制备细胞提取物。
[0455]
细胞提取物的来源采用乳酸克鲁维酵母细胞提取物(kluyveromyces lactis,k.lactis)。采用基于乳酸克鲁维酵母菌株atcc8585的改造菌株,采用cn109423496a所记载的方法,将t7 rna聚合酶的编码基因整合到乳酸克鲁维酵母的基因组中,获得改造菌株,使其可以内源性表达t7 rna聚合酶。根据对照实验比较,在不加入任何外源rna聚合酶的情况下,没有内源性整合t7 rna聚合酶的编码基因的乳酸克鲁维酵母几乎不能进行体外蛋白合成反应;经上述内源性整合改造后,在不加入任何外源rna聚合酶的情况下可以实现外源蛋白的高效表达;能够达到传统体外蛋白合成体系的蛋白合成水平(传统体外蛋白合成体系中,采用未进行t7 rna聚合酶内源性改造的菌株制备细胞提取物,并在合成体系中添加外源t7 rna聚合酶)。本发明实施例s3-s12的疏水界面优化方法,对于未进行t7 rna聚合酶内源性改造的菌株(包括但不限于乳酸克鲁维酵母菌株)的体外蛋白合成体系同样适用,能取得相同或相类似的优化效果。
[0456]
乳酸克鲁维酵母细胞提取物的制备过程采用常规技术手段,参考cn109593656a记载的方法制备。制备步骤概括而言,包括:提供经发酵培养的乳酸克鲁维酵母细胞原料,用
液氮将细胞速冻,将细胞打碎,离心收集上清液,即为细胞提取物。
[0457]
所得乳酸克鲁维酵母细胞提取物中的蛋白浓度为20~40mg/ml。
[0458]
本发明的实施例s2-s12使用以下乳酸克鲁维酵母细胞提取物(lysate)。
[0459]
表4实施例s2-s12使用的乳酸克鲁维酵母(k.lactis)细胞提取物信息说明
[0460][0461]
实施例s3环己烷(液态)对体外蛋白合成体系的蛋白合成能力的影响
[0462]
3.1体外无细胞蛋白合成体系(不添加外源rna聚合酶)
[0463]
每个体系体积均为300μl,在平底48孔板中进行反应,每孔的底面积为0.8cm2。每个样品设置3个平行样,计算均值和标准偏差(error bar)。
[0464]
体外无细胞蛋白合成体系:各组分的终浓度分别为:9.78mm三羟甲基氨基甲烷盐酸盐(tris-hcl,ph 8.0),80mm醋酸钾,5.0mm醋酸镁,1.5mm核苷三磷酸混合物(腺嘌呤核苷三磷酸、鸟嘌呤核苷三磷酸、胞嘧啶核苷三磷酸和尿嘧啶核苷三磷酸,每种核苷三磷酸的浓度均为1.5mm),0.7mm的氨基酸混合物(甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、苯丙氨酸、脯氨酸、色氨酸、丝氨酸、酪氨酸、半胱氨酸、蛋氨酸、天冬酰胺、谷氨酰胺、苏氨酸、天冬氨酸、谷氨酸、赖氨酸、精氨酸和组氨酸,各自浓度均为0.7mm),0.44mm二硫苏糖醇(dtt),2%(w/v)的聚乙二醇8000,15mm葡萄糖,52.48mg/ml麦芽糊精,24mm磷酸三钾,50%体积的乳酸克鲁维酵母细胞提取物。混合形成水相体系。
[0465]
3.2反应界面(提供疏水界面)
[0466]
实验组(环己烷的浓度曲线):向体系中分别加入0.1%(v/v)~20%(v/v)环己烷;其中,环己烷为液态。经混合后,在水相体系上方形成油相层,通过油相层和水相之间的反应界面提供疏水界面。
[0467]
空白对照组(bc组):相对于上述实验组,不加入烷烃(环己烷添加量为0)。
[0468]
阴性对照组(nc组):相对于上述实验组,不加入烷烃,后续也不加入dna模板。
[0469]
3.3进行体外蛋白合成反应:nc组不添加外源dna模板;向上述实验组、bc组的每个独立的体外无细胞蛋白合成体系中分别加入15ng/μl编码megfp的dna模板(经上述实施例s1进行体外rca扩增获得),混匀后,所有体系均放置在20~30℃的环境中,摇床反应过夜。分别在3h、18h时取样进行荧光蛋白活性测试。
[0470]
3.4荧光蛋白活性测定:将待测样品放置于envision 2120多功能酶标仪(perkinelmer),检测荧光信号强弱,以相对荧光单位值(relative fluorescence unit,
rfu)作为活性单位。rfu值的大小能够反映megfp蛋白合成量的多少,megfp的质量体积浓度x(单位μg/ml)与rfu值之间的换算关系为:在本发明的测试范围内,x与rfu之间基本符合线性关系。
[0471]
分别对各反应体系的取样进行荧光测试。样品处理:4000rpm,25℃(室温)离心1分钟。将待测样品放置于envision 2120多功能酶标仪,采用的检测波长为激发波长/发射波长(ex/em):488nm/507nm,检测获得相对荧光单位值(rfu)。
[0472]
3.5实验结果:如图4所示。反应18h后,环己烷的添加量为0.1%(v/v)~5%(v/v)时,实验组的rfu值均高于空白对照组(bc组),提高了体外蛋白合成体系的蛋白合成能力。尤其是环己烷的添加量为1.8%(v/v)时,实验组的rfu值相对于bc组提高了25.64%,外源蛋白megfp的合成量提高了25.64%。
[0473]
实施例s4异辛烷(液态)对体外蛋白合成体系的蛋白合成能力的影响
[0474]
4.1体外无细胞蛋白合成体系(不添加外源rna聚合酶)
[0475]
采用与实施例3中3.1相同的水相体外无细胞蛋白合成体系。其中,每个体系体积均为300μl,在平底48孔板中进行反应。
[0476]
4.2反应界面(提供疏水界面)
[0477]
实验组(异辛烷的浓度曲线):向体系中分别加入0.5%(v/v)~5%(v/v)异辛烷;其中,异辛烷为液态。经混合后,在水相体系上方形成油相层,通过油相层和水相之间的反应界面提供疏水界面。
[0478]
空白对照组(bc组):相对于上述实验组,不加入烷烃(异辛烷添加量为0)。
[0479]
阴性对照组(nc组):相对于上述实验组,不加入烷烃,后续也不加入dna模板。
[0480]
4.3进行体外蛋白合成反应:nc组不添加外源dna模板;向上述实验组、bc组的每个独立的体外无细胞蛋白合成体系中分别加入15ng/μl编码megfp的dna模板(经上述实施例s1进行体外rca扩增获得),混匀后,所有体系均放置在20~30℃的环境中,摇床反应过夜。分别在3h、18h时取样进行荧光蛋白活性测试。
[0481]
4.4荧光蛋白活性测定:采用实施例3中3.4的方法,测定样品中所合成的外源荧光蛋白megfp的rfu值。
[0482]
4.5实验结果:如图5所示。反应18h后,异辛烷的添加量为0.5%(v/v)~5%(v/v)时,实验组的rfu值均高于空白对照组(bc组),提高了体外蛋白合成体系的蛋白合成能力。尤其是异辛烷的添加量为0.5%(v/v)、0.8%(v/v)、1%(v/v)、1.2%(v/v)、1.4%(v/v)、4%(v/v)、5%(v/v)时,实验组的rfu值相对于bc组分别提高了89.16%、88.58%、75.29%、77.15%、70.04%、73.66%、79.49%,显著提高了外源蛋白megfp的合成量。
[0483]
实施例s5癸烷(液态)对体外蛋白合成体系的蛋白合成能力的影响
[0484]
5.1体外无细胞蛋白合成体系(不添加外源rna聚合酶)
[0485]
采用与实施例3中3.1相同的水相体外无细胞蛋白合成体系。其中,每个体系体积均为300μl,在平底48孔板中进行反应。
[0486]
5.2反应界面(提供疏水界面)
[0487]
实验组(正癸烷的浓度曲线):向体系中分别加入0.1%(v/v)~5%(v/v)癸烷(正癸烷);其中,癸烷为液态。经混合后,在水相体系上方形成油相层,通过油相层和水相之间
的反应界面提供疏水界面。
[0488]
空白对照组(bc组):相对于上述实验组,不加入烷烃(癸烷添加量为0)。
[0489]
阴性对照组(nc组):相对于上述实验组,不加入烷烃,后续也不加入dna模板。
[0490]
5.3进行体外蛋白合成反应:nc组不添加外源dna模板;向上述实验组、bc组的每个独立的体外无细胞蛋白合成体系中分别加入15ng/μl编码megfp的dna模板(经上述实施例s1进行体外rca扩增获得),混匀后,所有体系均放置在20~30℃的环境中,摇床反应过夜。分别在3h、18h时取样进行荧光蛋白活性测试。
[0491]
5.4荧光蛋白活性测定:采用实施例3中3.4的方法,测定样品中所合成的外源荧光蛋白megfp的rfu值。
[0492]
5.5实验结果:如图6所示。反应18h后,癸烷的添加量为0.1%(v/v)~1.4%(v/v)、2%(v/v)、5%(v/v)时,实验组的rfu值均高于空白对照组(bc组),提高了体外蛋白合成体系的蛋白合成能力。尤其是癸烷的添加量为1.2%(v/v)、1.4%(v/v)、5%(v/v)时,实验组的rfu值相对于bc组分别提高了28.66%、23.93%、22.18%,显著提高了外源蛋白megfp的合成量。
[0493]
实施例s6十四烷(液态)对体外蛋白合成体系的蛋白合成能力的影响
[0494]
6.1体外无细胞蛋白合成体系(不添加外源rna聚合酶)
[0495]
采用与实施例3中3.1相同的水相体外无细胞蛋白合成体系。其中,每个体系体积均为300μl,在平底48孔板中进行反应。
[0496]
6.2反应界面(提供疏水界面)
[0497]
实验组(十四烷的浓度曲线):向体系中分别加入0.1%(v/v)~2%(v/v)十四烷;其中,十四烷为液态。经混合后,在水相体系上方形成油相层,通过油相层和水相之间的反应界面提供疏水界面。
[0498]
空白对照组(bc组):相对于上述实验组,不加入烷烃(十四烷添加量为0)。
[0499]
阴性对照组(nc组):相对于上述实验组,不加入烷烃,后续也不加入dna模板。
[0500]
6.3进行体外蛋白合成反应:nc组不添加外源dna模板;向上述实验组、bc组的每个独立的体外无细胞蛋白合成体系中分别加入15ng/μl编码megfp的dna模板(经上述实施例s1进行体外rca扩增获得),混匀后,所有体系均放置在20-30℃的环境中,摇床反应过夜。分别在3h、18h时取样进行荧光蛋白活性测试。
[0501]
6.4荧光蛋白活性测定:采用实施例3中3.4的方法,测定样品中所合成的外源荧光蛋白megfp的rfu值。
[0502]
6.5实验结果:如图7所示。反应3h、18h后,十四烷的添加量为0.1%(v/v)~2%(v/v)时,实验组的rfu值均高于空白对照组(bc组)。3h时体外蛋白合成体系的蛋白合成量提高了10.24%~26.61%,18h时体外蛋白合成体系的蛋白合成量提高了11.73%~47.09%,详见下表5。反应效率和蛋白合成量均有提高。
[0503]
表5利用十四烷提供疏水界面优化体外蛋白合成体系的实验结果(参见图7)
[0504][0505][0506]
实施例s7十四烷(液态)对体外蛋白合成体系的蛋白合成能力的影响
[0507]
7.1体外无细胞蛋白合成体系(不添加外源rna聚合酶)
[0508]
采用与实施例3中3.1相同的水相体外无细胞蛋白合成体系。其中,每个体系体积均为300μl,在平底48孔板中进行反应。
[0509]
7.2反应界面(提供疏水界面)
[0510]
实验组(十四烷的浓度曲线):向体系中分别加入2%(v/v)~20%(v/v)十四烷;其中,十四烷为液态。经混合后,在水相体系上方形成油相层,通过油相层和水相之间的反应界面提供疏水界面。
[0511]
空白对照组(bc组):相对于上述实验组,不加入烷烃(十四烷添加量为0)。
[0512]
阴性对照组(nc组):相对于上述实验组,不加入烷烃,后续也不加入dna模板。
[0513]
7.3进行体外蛋白合成反应:nc组不添加外源dna模板;向上述实验组、bc组的每个独立的体外无细胞蛋白合成体系中分别加入15ng/μl编码megfp的dna模板(经上述实施例s1进行体外rca扩增获得),混匀后,所有体系均放置在20-30℃的环境中,摇床反应过夜。分别在3h、18h时取样进行荧光蛋白活性测试。
[0514]
7.4荧光蛋白活性测定:采用实施例3中3.4的方法,测定样品中所合成的外源荧光蛋白megfp的rfu值。
[0515]
7.5实验结果:如图8所示。反应3h后,2%(v/v)~20%(v/v)十四烷添加量时,实验组的rfu值均高于空白对照组(bc组),分别高出1.65%~34.12%,提高了反应效率。反应18h后,十四烷的添加量为2%(v/v)、5%(v/v)时,实验组的rfu值均高于空白对照组(bc组),体外蛋白合成体系的蛋白合成量分别提高了21.10%、11.77%,提高了蛋白合成量。
[0516]
实施例s8十五烷基环己烷(液态)对体外蛋白合成体系的蛋白合成能力的影响
[0517]
8.1体外无细胞蛋白合成体系(不添加外源rna聚合酶)
[0518]
采用与实施例3中3.1相同的水相体外无细胞蛋白合成体系。其中,每个体系体积
均为300μl,在平底48孔板中进行反应。
[0519]
8.2反应界面(提供疏水界面)
[0520]
实验组(十五烷基环己烷的浓度曲线):向体系中分别加入0.1%(v/v)~20%(v/v)十五烷基环己烷;其中,十五烷基环己烷为液态。经混合后,在水相体系上方形成油相层,通过油相层和水相之间的反应界面提供疏水界面。
[0521]
空白对照组(bc组):相对于上述实验组,不加入烷烃(十五烷基环己烷添加量为0)。
[0522]
阴性对照组(nc组):相对于上述实验组,不加入烷烃(十五烷基环己烷添加量为0),后续也不添加编码外源蛋白的dna模板。
[0523]
8.3进行体外蛋白合成反应:nc组不添加外源dna模板;向上述实验组、bc组的每个独立的体外无细胞蛋白合成体系中分别加入15ng/μl编码megfp的dna模板(经上述实施例s1进行体外rca扩增获得),混匀后,所有体系均放置在20-30℃的环境中,摇床反应过夜。分别在3h、18h时取样进行荧光蛋白活性测试。
[0524]
8.4荧光蛋白活性测定:采用实施例3中3.4的方法,测定样品中所合成的外源荧光蛋白megfp的rfu值。
[0525]
8.5实验结果:如图9所示。反应3h后,0.1%(v/v)~15%(v/v)十五烷基环己烷添加量时,实验组的rfu值均高于空白对照组(bc组),分别高出0.03%~14.97%,提高了蛋白合成效率。反应18h后,十五烷基环己烷的添加量为12%(v/v)~20%(v/v)时,实验组的rfu值均高于空白对照组(bc组),体外蛋白合成体系的蛋白合成量提高了20.35%~36.60%。十五烷基环己烷的添加量分别为12%(v/v)、15%(v/v)、18%(v/v)、20%(v/v)时,实验组的rfu值相对于bc组分别提高了20.35%、29.50%、36.60%、23.00%,显著提高了外源蛋白megfp的合成量。
[0526]
实施例s9四十四烷(固体粉末)对体外蛋白合成体系的蛋白合成能力的影响
[0527]
9.1体外无细胞蛋白合成体系(不添加外源rna聚合酶)
[0528]
采用与实施例3中3.1相同的水相体外无细胞蛋白合成体系。其中,每个体系体积均为300μl,在平底48孔板中进行反应。
[0529]
9.2反应界面(提供疏水界面)
[0530]
实验组(四十四烷的浓度曲线):向体系中分别加入0~500μg/μl四十四烷;其中,四十四烷为固态。在反应体系中加入四十四烷,混合后形成悬浊液,待充分溶解后,形成浮于反应液上方的油相层。
[0531]
空白对照组(bc组):相对于上述实验组,不加入烷烃(四十四烷添加量为0)。
[0532]
阴性对照组(nc组):相对于上述实验组,不加入烷烃(四十四烷添加量为0),后续也不添加编码外源蛋白的dna模板。
[0533]
9.3进行体外蛋白合成反应:nc组不添加外源dna模板;向上述实验组、bc组的每个独立的体外无细胞蛋白合成体系中分别加入15ng/μl编码megfp的dna模板(经上述实施例s1进行体外rca扩增获得),混匀后,所有体系均放置在20-30℃的环境中,摇床反应过夜。反应过程中,四十四烷存在于上方的油状分层中。分别在3h、18h时取样进行荧光蛋白活性测试。
[0534]
9.4荧光蛋白活性测定:采用实施例3中3.4的方法,测定样品中所合成的外源荧光
蛋白megfp的rfu值。
[0535]
9.5实验结果:如图10所示。反应18h后,四十四烷的添加量为0~500μg/μl,实验组的rfu值均高于空白对照组(bc组),体外蛋白合成体系的蛋白合成量提高了20.35%~36.60%。四十四烷的添加量为0.02%(v/v)、0.035%(v/v)、0.04%(v/v)、0.05%(v/v)时,实验组的rfu值相对于bc组分别提高了26.47%、30.90%、27.97%、26.86%,显著提高了外源蛋白megfp的合成量。
[0536]
实施例s10凡士林(膏状)对体外蛋白合成体系的蛋白合成能力的影响
[0537]
10.1体外无细胞蛋白合成体系(不添加外源rna聚合酶)
[0538]
每个体系体积均为300μl,在平底48孔板中进行反应,每孔的底面积为0.8cm2。每个样品设置3个平行样,计算均值和标准偏差(error bar)。
[0539]
体外无细胞蛋白合成体系:各组分的终浓度分别为:9.78mm tris-hcl(ph 8.0),80mm醋酸钾,5.0mm醋酸镁,1.5mm核苷三磷酸混合物(腺嘌呤核苷三磷酸、鸟嘌呤核苷三磷酸、胞嘧啶核苷三磷酸和尿嘧啶核苷三磷酸,每种核苷三磷酸的浓度均为1.5mm),0.7mm的氨基酸混合物(甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、苯丙氨酸、脯氨酸、色氨酸、丝氨酸、酪氨酸、半胱氨酸、蛋氨酸、天冬酰胺、谷氨酰胺、苏氨酸、天冬氨酸、谷氨酸、赖氨酸、精氨酸和组氨酸,各自浓度均为0.7mm),0.44mm二硫苏糖醇(dtt),2%(w/v)的聚乙二醇8000,15mm葡萄糖,52.48mg/ml麦芽糊精,24mm磷酸三钾,50%体积的乳酸克鲁维酵母细胞提取物。其中,制备细胞提取物编号为zs12181,蛋白浓度为25.16mg/ml。
[0540]
10.2反应界面(提供疏水界面)
[0541]
实验组(凡士林的浓度曲线):向体系中分别加入5μg/μl~450μg/μl凡士林(对应每200μl的反应体系添加的固体烷烃重量为1mg~90mg);其中,凡士林为膏状烷烃。涂抹于孔的底部内壁和侧壁,添加量以涂抹前后的重量差计量。通过凡士林层和水相之间的界面提供疏水界面。
[0542]
空白对照组(bc组):相对于上述实验组,不加入烷烃(凡士林涂抹量为0)。
[0543]
阴性对照组(nc组):相对于上述实验组,不加入烷烃(凡士林涂抹量为0),后续也不添加编码外源蛋白的dna模板。
[0544]
10.3进行体外蛋白合成反应:nc组不添加外源dna模板;向上述实验组、bc组的每个独立的体外无细胞蛋白合成体系中分别加入15ng/μl编码megfp的dna模板(经上述实施例s1进行体外rca扩增获得),混匀后,所有体系均放置在20-30℃的环境中,摇床反应过夜。在18h时取样进行荧光蛋白活性测试。
[0545]
10.4荧光蛋白活性测定:采用实施例3中3.4的方法,测定样品中所合成的外源荧光蛋白megfp的rfu值。
[0546]
10.5实验结果:如图11所示。反应18h后,凡士林的添加量为1mg~3.5mg/孔时),实验组的rfu值均高于空白对照组(bc组),体外蛋白合成体系的蛋白合成量提高了9.96%~39.95%。当每孔中凡士林的添加量分别为1mg、1.5mg、2.5mg、3.5mg时,实验组的rfu值相对于bc组分别提高了39.95%、21.42%、21.91%、18.99%,显著提高了外源蛋白megfp的合成量。
[0547]
实施例s11凡士林与活性炭对体外蛋白合成体系的组合优化
[0548]
11.1体外无细胞蛋白合成体系(不添加外源rna聚合酶)
[0549]
每个体系体积均为300μl,在平底48孔板中进行反应,每孔的底面积为0.8cm2。每个样品设置3个平行样,计算均值和标准偏差(error bar)。
[0550]
体外无细胞蛋白合成体系:各组分的终浓度分别为:9.78mm三(羟甲基)氨基甲烷(tris,ph 8.0,采用盐酸溶液调节ph值),80mm醋酸钾,5.0mm醋酸镁,1.5mm核苷三磷酸混合物(腺嘌呤核苷三磷酸、鸟嘌呤核苷三磷酸、胞嘧啶核苷三磷酸和尿嘧啶核苷三磷酸,每种核苷三磷酸的浓度均为1.5mm),0.7mm的氨基酸混合物(甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、苯丙氨酸、脯氨酸、色氨酸、丝氨酸、酪氨酸、半胱氨酸、蛋氨酸、天冬酰胺、谷氨酰胺、苏氨酸、天冬氨酸、谷氨酸、赖氨酸、精氨酸和组氨酸,各自终浓度均为0.7mm),0.44mm二硫苏糖醇,2%(w/v)的聚乙二醇8000,15mm葡萄糖,52.48mg/ml麦芽糊精,24mm磷酸三钾,50%体积的乳酸克鲁维酵母细胞提取物。其中,制备细胞提取物编号为zs01092,蛋白浓度为23mg/ml。
[0551]
11.2反应界面(提供疏水界面)
[0552]
bc组(空白对照组):不加入烷烃(凡士林涂抹量为0),也不加入活性炭,。
[0553]
vas组(凡士林组):反应器侧壁和底部内壁涂抹0.005g/ml凡士林(每孔涂抹量1mg)。通过凡士林层和水相之间的界面提供疏水界面。
[0554]
ac组(活性炭组):向体系中加入0.04g/ml活性炭颗粒(每孔加入12mg),沉积于底部内壁。
[0555]
ac+vas组(活性炭+凡士林组合优化组):向体系中加入0.005g/ml凡士林(每孔加入1mg),以及0.04g/ml活性炭颗粒(每孔加入12mg)。
[0556]
nc组(阴性对照组):不加入烷烃(凡士林涂抹量为0),也不加入活性炭,后续也不添加编码外源蛋白的dna模板。
[0557]
11.3进行体外蛋白合成反应:nc组不添加外源dna模板;向上述bc组、vas组、ac组、ac+vas组的每个独立的体外无细胞蛋白合成体系中分别加入15ng/μl编码megfp的dna模板(经上述实施例s1进行体外rca扩增获得),混匀后,所有体系均放置在20℃~30℃的环境中,摇床反应过夜。分别在3h、6h、21h时取样进行荧光蛋白活性测试。
[0558]
11.4荧光蛋白活性测定:采用实施例3中3.4的方法,测定样品中所合成的外源荧光蛋白megfp的rfu值。
[0559]
11.5实验结果:如图12所示。反应21h后,反应器涂抹凡士林的vas组相较于不涂抹凡士林的bc组,rfu值提高了40.38%;反应器涂抹凡士林的ac+vas组相较于不涂抹凡士林的ac组,rfu值提高了57.06%,相较于bc组提高了72.64%;凡士林与活性炭组合优化,相较于空白对照组(bc组),rfu值提高了171.13%,起到协同优化作用。此外,与空白对照组(bc组)相比,3h时vas组、ac组、ac+vas组分别提高了61.79%、56.61%、103.98%,6h时vas组、ac组、ac+vas组分别提高了48.28%、81.91%、144.56%
[0560]
实施例s12凡士林对体外蛋白合成体系的组合优化
[0561]
12.1体外无细胞蛋白合成体系(不添加外源rna聚合酶)
[0562]
每个体系体积均为300μl,在平底48孔板中进行反应,每孔的底面积为0.8cm2。每个样品设置3个平行样,计算均值和标准偏差(error bar)。
[0563]
体外无细胞蛋白合成体系:各组分的终浓度分别为:9.78mm tris-hcl(ph 8.0),80mm醋酸钾,5.0mm醋酸镁,1.5mm核苷三磷酸混合物(腺嘌呤核苷三磷酸、鸟嘌呤核苷三磷
酸、胞嘧啶核苷三磷酸和尿嘧啶核苷三磷酸,每种核苷三磷酸的浓度均为1.5mm),0.7mm的氨基酸混合物(甘氨酸、丙氨酸、缬氨酸、亮氨酸、异亮氨酸、苯丙氨酸、脯氨酸、色氨酸、丝氨酸、酪氨酸、半胱氨酸、蛋氨酸、天冬酰胺、谷氨酰胺、苏氨酸、天冬氨酸、谷氨酸、赖氨酸、精氨酸和组氨酸,各自浓度均为0.7mm),0.44mm dtt,2%(w/v)的聚乙二醇8000,15mm葡萄糖,52.48mg/ml麦芽糊精,24mm磷酸三钾,0.3mg/ml氨苄青霉素(amp),16.6μg/ml鲑鱼精dna(ssdna),50%体积的乳酸克鲁维酵母细胞提取物。其中,制备细胞提取物编号为zs12181,蛋白浓度为25.16mg/ml。
[0564]
12.2反应界面(提供疏水界面)
[0565]
ac+ssdna+amp组(bc组,空白对照组):凡士林涂抹量为0,每孔加入活性炭12mg。
[0566]
vas+ac+ssdna+amp组(凡士林组):反应器侧壁和底部内壁涂抹0.05g/ml凡士林(每孔涂抹量1mg),且每孔加入活性炭12mg。通过凡士林层和水相之间的界面提供疏水界面。
[0567]
nc组(阴性对照组):不加入烷烃(凡士林涂抹量为0),也不加入活性炭,后续也不添加编码外源蛋白的dna模板。
[0568]
12.3进行体外蛋白合成反应:nc组不添加外源dna模板;向上述bc组、凡士林组的每个独立的体外无细胞蛋白合成体系中分别加入15ng/μl编码megfp的dna模板(经上述实施例s1进行体外rca扩增获得),混匀后,所有体系均放置在20℃~30℃的环境中,摇床反应过夜。分别在3h、6h、21h时取样进行荧光蛋白活性测试。
[0569]
12.4荧光蛋白活性测定:采用实施例3中3.4的方法,测定样品中所合成的外源荧光蛋白megfp的rfu值。
[0570]
12.5实验结果:如图13所示。反应3h、6h、21h后,反应器涂抹凡士林的vas+ac+ssdna+amp组(凡士林组)相较于不涂抹凡士林的bc组,rfu值分别提高了9.06%、6.14%、20.27%。
[0571]
上述仅为本发明的部分优选实施例,本发明并不仅限于上述实施例的内容。对于本领域中的技术人员来说,在本发明技术方案的构思范围内或指导、启示下,可以有各种变化和更改,所作的任何具有等同技术效果的变化和更改,均在本发明保护范围之内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1