西松烷型大环二萜化合物及制备方法、药物组合物及用途
1.本发明涉及医药技术领域。涉及从乳香(boswellia sacra flueck)树脂中提取分离得到的一系列西松烷型大环二萜化合物及其制备方法与其在神经细胞保护药物制备中的应用。
背景技术:
2.西松烷型二萜是数量最多的二萜之一,具有4个异戊二烯单元首位连接形成的14元环母核骨架。这类化合物多见于海洋生物,尤其是软珊瑚和角珊瑚属中。陆生植物如烟草、松树和没药中发现了为数不多的西松烷型二萜化合物,近年来,从乳香中陆续分离得到了许多该类化合物,且药理活性研究表明其具有很好的抗炎、抗抑郁、抗结肠炎、抗菌和抗肿瘤等活性。
3.乳香是橄榄科(burseraceae)乳香属(boswellia)植物卡氏乳香树(boswellia carterii birdw.)及同属植物鲍达乳香树(boswellia bhawdajiana birdw)、野乳香树(boswellia neglecta m.moor)的皮部渗出或经刀割渗出的胶状树脂,主产于索马里、埃塞俄比亚、印度等地,是常用中药。乳香辛散温通,具有调气、活血、止痛、追毒之功效。主治气血凝滞、心腹疼痛、痈疮肿毒、跌打损伤、痛经、产后瘀血刺痛等;乳香中主要成分为四环三萜、五环三萜、大环二萜类化合物,现代药理研究表明上述化合物具有也具有较好的抗炎、抗肿瘤等活性。其中西松烷型大环二萜化合物的神经细胞保护活性尚未见报道。
技术实现要素:
4.本发明解决的技术问题是提供一类从乳香中分离纯化得到的西松烷型二萜化合物,其制备方法、药物组合物和该类化合物在制备神经细胞保护药物中的用途。
5.为解决本发明的技术问题,本发明提供如下技术方案:
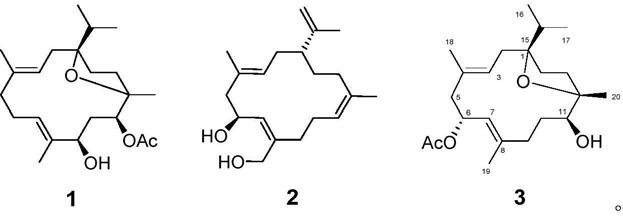
6.本发明技术方案的第一方面是提供一类西松烷型大环二萜化合物及其药学上可接受的盐,分别命名为化合物1(bossacrin e),化合物2(bossacrin j)和化合物3(bossacrin g)其结构式分别为:
[0007][0008]
本发明技术方案的第二方面是提供一种从乳香中分离纯化西松烷型二萜的方法。
[0009]
技术方案第一方面所述化合物1的制备方法步骤为:
[0010]
(1)将乳香药材粉碎后以95%乙醇进行加热回流提取,每次提取3h,共提取三次。合并提取液,去除溶剂,得到乳香粗提物。
[0011]
(2)将乳香粗提物进行硅胶柱层析,依次以石油醚两份、乙酸乙酯两份、95%乙醇两份进行洗脱,每份一个柱体积。得到粗段a-f。
[0012]
(3)取粗段a进行硅胶柱层析,以石油醚乙酸乙酯梯度进行洗脱,体积比分别为1:0、20:1、4:1、1:1、0:1,每个梯度洗脱两个柱体积。
[0013]
(4)取(3)中石油醚和乙酸乙酯体积比4:1洗脱的第一份粗份a5进行硅胶柱层析,二氯甲烷和丙酮体积比为30:1进行洗脱,合并相似组分得到流份a-5-1~a-5-12。
[0014]
(5)取流份a-5-2,采用反相c18半制备高效液相法进行制备,以甲醇和水体积比为85:15为流动相,检测波长为210nm,得到化合物1。
[0015]
所述化合物1结构式为:
[0016][0017]
技术方案第一方面所述化合物2和3的制备方法步骤为:
[0018]
(1)将乳香药材粉碎后以95%乙醇进行加热回流提取,每次提取3h,共提取三次。合并提取液,去除溶剂,得到乳香粗提物。
[0019]
(2)将乳香粗提物进行硅胶柱层析,依次以石油醚两份、乙酸乙酯两份、95%乙醇两份进行洗脱,每份一个柱体积。得到粗段a-f。
[0020]
(3)取粗段a进行硅胶柱层析,以石油醚乙酸乙酯梯度进行洗脱,体积比分别为1:0、20:1、4:1、1:1、0:1,每个梯度洗脱两个柱体积。
[0021]
(4)取(3)中石油醚和乙酸乙酯体积比4:1洗脱的第一份粗份a5进行硅胶柱层析,二氯甲烷和丙酮体积比为30:1进行洗脱,合并相似组分得到流份a-5-1~a-5-12。
[0022]
(5)取流份a-5-5,采用反相c18半制备高效液相法进行制备,以甲醇和水体积比为82:18为流动相,检测波长为210nm,得到化合物2和3。
[0023]
所述化合物2和3结构式为:
[0024][0025]
本发明技术方案的第三方面是提供一种药物组合物,所述的药物组合物包括第一方面所述西松烷型二萜化合物及其药学上可接受的盐或药学上可接受的载体或赋形剂。
[0026]
本发明技术方案的第四方面是提供第一方面所述西松烷型二萜化合物及其药学上可接受的盐在制备神经细胞保护药物的应用
[0027]
本发明中对上述化合物在体外进行了谷氨酸诱导的皮层神经元损伤的保护作用
测定和评价,结果显示化合物2在10μm浓度下对谷氨酸诱导的皮层神经元损伤显示出与阳性对照相当的保护作用。
[0028]
本发明中对上述化合物在体外还进行了氧糖剥夺的皮层神经元缺氧损伤的保护作用测定和评价,结果显示化合物1在10μm浓度下对氧糖剥夺的皮层神经元缺氧损伤显示出优于阳性对照的保护作用。
[0029]
有益技术效果
[0030]
1.本发明首次从乳香中分离纯化得到三个西松烷型二萜新化合物1,2和3。
[0031]
2.本发明采用单体化合物对谷氨酸诱导的皮层神经元细胞损伤的保护作用测定和评价的方法,证实上述化合物均在10μm浓度下对谷氨酸诱导的皮层神经元损伤显示出一定的保护作用,其中化合物2效果最优,具有良好的药用前景。
[0032]
3.本发明采用单体化合物对氧糖剥夺的皮层神经元缺氧损伤的保护作用测定和评价的方法,证实上述中化合物1在10μm浓度下对氧糖剥夺的皮层神经元缺氧损伤显示出较好的保护作用,具有良好的药用前景。
附图说明
[0033]
本技术的附图用来提供对本技术的进一步说明,本技术的示意性实施例及其说明用来解释本技术,并不构成对本技术的不当限定。
[0034]
图1.化合物1(bossacrin e)的1h nmr
[0035]
图2.化合物1(bossacrin e)的
13
c nmr
[0036]
图3.化合物1(bossacrin e)的hresims
[0037]
图4.化合物2(bossacrin j)的1h nmr
[0038]
图5.化合物2(bossacrin j)的
13
c nmr
[0039]
图6.化合物2(bossacrin j)的hresims
[0040]
图7.化合物3(bossacrin g)的1h nmr
[0041]
图8.化合物3(bossacrin g)的
13
c nmr
[0042]
图9.化合物3(bossacrin g)的hresims
具体实施方式
[0043]
为进一步阐述本发明,下面以具体实例对本发明进行详细说明,这些实施例完全是例证性的,旨在对本发明作具体描述,非意图限制根据本技术的示例性实施方式。
[0044]
药物化学实验:
[0045]
实施例1
[0046]
化合物1-3的制备,步骤如下:
[0047]
(1)取乳香药材19.0kg粉碎后以95%乙醇进行加热回流提取,固液比为1:3.5(kg/l),每次提取3h,共提取三次。合并提取液,减压旋转蒸干溶剂,得到乳香粗提物。
[0048]
(2)将乳香粗提物进行硅胶柱层析,依次以石油醚两份、乙酸乙酯两份、95%乙醇两份进行洗脱,每份接收一个柱体积,约35l。得到粗段a-f。
[0049]
(3)取粗段a进行硅胶柱层析,以石油醚乙酸乙酯梯度进行洗脱,体积比分别为1:0、20:1、4:1、1:1、0:1,每个梯度洗脱两个柱体积,每份接收一个柱体积,约5l。
[0050]
(4)取(3)中石油醚和乙酸乙酯体积比4:1洗脱的第一份粗份a5进行硅胶柱层析,二氯甲烷和丙酮体积比为30:1进行洗脱,合并相似组分得到流份a-5-1~a-5-12。
[0051]
(5)取流份a-5-2,采用反相c18半制备高效液相法进行制备,以meoh/h2o(85:15)为流动相进行制备,流速为3ml/min,检测波长为210nm,得到化合物1。
[0052]
(6)取流份a-5-5,采用反相c18半制备高效液相法进行制备,以meoh/h2o(82:18)为流动相进行制备,流速为3ml/min,检测波长为210nm,得到化合物2和3。
[0053]
结构鉴定:对分离得到的化合物通过核磁共振氢谱,核磁共振碳谱,质谱,二维核磁共振图谱等方法确定了3个新化合物的结构。见图1-9。
[0054]
化合物1:bossacrin e,无色油状物,茴香醛-硫酸显紫色。旋光值[α]20d+18.7(c 0.18,meoh);最大紫外吸收值uv(meoh)λ
max
(logε)204.0(2.92);红外波谱数据irυ
max 3415,2960,1736,1468,1436,1370,1239,1038cm-1
;1h nmr和
13
c nmr数据见表1。hresims m/z 387.25009[m+na]
+
,计算值为c
20
h
36
o4na:m/z 387.25058。
[0055]
化合物2:bossacrin j,无色油状物,茴香醛-硫酸显紫色。旋光值[α]20d-87.8(c 0.13,meoh);最大紫外吸收值uv(meoh)λ
max
(logε)204.0(3.10);红外波谱数据irυ
max 3297,2924,1643,1440,1376,1039,1005,888cm-1
;1h nmr和
13
cnmr数据见表1。hresims m/z 327.22916[m+na]
+
,计算值为c
20
h
32
o2na,327.22945。
[0056]
化合物3:bossacrin g,无色油状物,茴香醛-硫酸显紫色。旋光值[α]20d-16.2(c 0.08,meoh);最大紫外吸收值uv(meoh)λ
max
(logε)204.0(2.55);红外波谱数据irυ
max 3452,2960,2927,1731,1715,1461,1371,1244,1045cm-1
;1h nmr和
13
c nmr数据见表1。hresims m/z 387.25043[m+na]
+
,计算值为c
20
h
36
o4na:m/z 387.25058.
[0057]
表1.化合物1-3的1h nmr和
13
c nmr数据
[0058]
[0059][0060]
药理学实验:
[0061]
实验例1
[0062]
利用胎鼠原代神经元谷氨酸模型,sk-n-sh细胞三气装置氧糖剥夺模型评价送筛化合物1-3的神经保护作用。
[0063]
1.材料与试剂:怀孕17天wistar大鼠胚胎的皮层神经元(谷氨酸模型),损伤剂谷氨酸(终浓度:200μm);sk-n-sh细胞第14代(三气培养箱氧糖剥夺模型),低糖培养基,缺氧
装置;送筛化合物,阳性药phpb(终浓度10μm)。
[0064]
2.方法
[0065]
1)谷氨酸损伤模型:怀孕17天wistar大鼠胚胎的皮层神经元取皮层,培养神经元。一周后,预孵阳性工具药phpb(10μmol/l)/送筛化合物(10μmol/l)1小时。每孔加入终浓度为200μm的谷氨酸稀释液和终浓度为10um的phpb/化合物,共培养20小时后,mtt法检测细胞存活率。
[0066]
2)三气缺氧装置氧糖剥夺模型:sk-n-sh细胞铺板培养。一周后,阳性工具药phpb(10umol/l)/送筛化合物(10umol/l)分别与sk-n-sh细胞共孵育1小时。三气培养箱缺氧缺糖培养5.5h,复氧20h,mtt法检测细胞生存率。
[0067]
3)实验分组:正常对照组,模型组:谷氨酸组(终浓度:200um)/ogd组,阳性工具phpb组(终浓度10umol/l),各送筛化合物组。
[0068]
3.实验结果
[0069]
1)谷氨酸模型:
[0070]
表2.化合物1-3对胎鼠原代神经元细胞谷氨酸模型细胞生存率的影响
[0071][0072]
***p<0.001与对照组相比;#p<0.05与模型组相比,##p<0.01与模型组相比,###p<0.001与模型组相比
[0073]
2)氧糖剥夺模型:
[0074]
表3.化合物1-3对sk-n-sh细胞氧糖剥夺模型细胞生存率的影响。
[0075][0076][0077]
***p<0.001与对照组相比;#p<0.05与模型组相比,##p<0.01与模型组相比,###p<0.001与模型组相比
[0078]
4.实验讨论及结论:
[0079]
本实验应用原代神经元谷氨酸模型和sk-n-sh细胞三气氧糖剥夺模型,评价化合物是否具有神经保护作用,由实验结果可见:
[0080]
(1)谷氨酸模型:
[0081]
1)谷氨酸损伤原代神经元20h,可使模型组原代神经元细胞存活率分别降至
53.1%,说明谷氨酸模型建立成功。
[0082]
2)阳性工具药phpb(10mmol/l)具有神经保护的趋势。
[0083]
3)化合物2在谷氨酸损伤模型可提高谷氨酸损伤原代神经元细胞的生存率,在此模型中具有神经细胞保护的作用。
[0084]
(1)三气装置氧糖剥夺模型:
[0085]
1)三气装置氧糖剥夺模型复氧20h后,可明显降低sk-n-sh细胞生存率分别至65.3%,说明氧糖剥夺模型建立成功。
[0086]
2)阳性工具药phpb(10mmol/l)具有神经保护的作用。
[0087]
3)在本模型筛选中,化合物1可以明显提高氧糖剥夺sk-n-sh细胞的生存率,在此模型中具有神经细胞保护的作用。
[0088]
以上所述仅为本技术的优选示例,不用于限制本技术。在本技术的中心思想和原则内对本技术所作的任何修改、等同替换、改进等,均应包含在本技术保护范围内。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1