一种耐碱性纤维素酶的生产方法与流程
本发明涉及一株产耐碱性纤维素酶的黄杆菌用于发酵生产耐碱性纤维素酶的方法,属于微生物发酵技术领域。
背景技术:
木聚糖是植物细胞壁的主要成分之一,属于非淀粉多糖。作为半纤维素的一种,在自然界中是含量仅次于纤维素的可更新多糖,存在于各种陆生植物的几乎所有部位。木聚糖酶(endo-1,4-β-d-xylanxylanohydrolase,ec.3.2.1.8)是一类以内切方式降解木聚糖分子中的β-1,4-木聚苷键的水解酶类。包括内切β-木聚糖酶、外切β-木聚糖酶和β-木二糖苷酶。其主要水解产物为木二糖和木二糖以上的低聚木糖,还有少量木糖和阿拉伯糖[2]。他从仅由β-1,4糖苷键连接的多聚糖线形分子到以α-糖苷键形成取代基支链的高度分枝的异质多糖结构变化的范围很大[1]。木聚糖被水解后形成低木聚糖,通过微生物发酵后被广泛使用。目前木聚糖的降解方法主要有物理处理、化学处理和生物降解三种基本方法。与物理和化学降解法相比,生物酶(木聚糖酶)具有降解反应温和、水解过程能量消耗少、提高产品质量及减少环境污染等优势。
在古代人们就已经在生产过程中间接地利用木聚糖酶:如酿酒、制作奶酪、烘焙面包、修饰淀粉等。随着微生物筛选技术的进步,新研发的木聚糖酶菌株越来越多,用途范围进一步扩大。在饲料行业中,木聚糖酶可降低小麦型日粮水溶性木聚糖导致的食糜黏性增高,从而提高消化酶对底物的作用效率,同时木聚糖酶可作用于不溶性非淀粉多糖,破碎植物细胞壁,并释放出营养物质;在酿酒和食品行业中应用也非常广泛,如木聚糖酶添加到面粉中,可以改善面团的持水性、稳定性和对过度发酵的耐受性,提高入炉急涨性能,增大烘烤后面包的体积,改善面包心质地,降低面包的老化速率,延长货架寿命。伴随着人类对于可持续性发展和环境的重视,1986年,viikarri发现木聚糖酶在纸浆漂白和造纸工业中能够降低环境污染物品的用量,促使木聚糖酶在工业上用量明显增加,在1997-2002年期间,纸浆造纸业用酶由1.0亿美元增加到1.92亿元,增长率为16.2%,是所有酶制品行业中增长率最快的。
近年来,木聚糖酶由于其在造纸工业中的用途而倍受关注,目前发现多种微生物可以产生木聚糖酶,研究较多的是丝状真菌,如木霉属、曲霉属等;也有少数关于细菌产木聚糖酶的报道,真菌来源的木聚糖酶多为酸性,细菌来源的木聚糖酶多为中性或偏碱性,现有木聚糖酶多为酸性或者中性条件下活性较高,然而纸浆漂白是在高ph(碱性)条件下进行的,因而限制了现有木聚糖酶的推广应用。
技术实现要素:
为了解决上述问题,本发明提供了一种耐碱性纤维素酶的生产方法。
本发明提供的耐碱性纤维素酶的生产方法是通过以下方案实现的:
将产碱性纤维素酶的黄杆菌接种至发酵培养基中,发酵培养。
所述产碱性纤维素酶的黄杆菌为黄杆菌(flavbacteriumsp.)sx9-4,于《screeningofanalkalinecmcase-producingstrainandtheoptimizationofitsfermentationcondition(碱性cmcase生产菌的筛选及其发酵条件的优化)》中公开,出版物为currentpharmaceuticalbiotechnology(《当代药物生物技术》),刊号:21,出版日:2020-01-21,周君美等。
所述发酵培养基,其中的碳源包括cmc-na、葡萄糖、麸皮中的一种或二种以上。
所述发酵培养基,其中的氮源包括硝酸钠、蛋白胨、草酸铵中的一种或二种以上。
所述发酵培养,培养温度为30℃。
所述发酵培养,培养时间为24~48h。
所述发酵培养基,除碳源、氮源外,还包括nacl、kh2po4、mgso4·7h2o、bacl2。
在本发明的一种实施方式中,优选地,所述发酵培养基中包括cmc-na、葡萄糖、蛋白胨、草酸铵、nacl、kh2po4、mgso4·7h2o、bacl2,其中,各组分在发酵培养基中的浓度为:cmc-na10.53g/l、葡萄糖7.47g/l、蛋白胨13.47g/l、草酸铵5.27g/l、nacl5.0g/l、kh2po41.0g/l、mgso4·7h2o0.5g/l、bacl21%。
所述发酵培养,在接种后,发酵开始前,用浓度为200g/l的无水na2co3水溶液将培养液体系ph调节为8.0-9.0,作为初始ph,优选地初始ph最佳为8.5。
优选地,在本发明的一种实施方式中,在接种后,发酵开始前,可以向发酵液体系中添加ba2+或mg2+,添加浓度为:ba2+或mg2+的终浓度为1%。
所述将产碱性纤维素酶的黄杆菌接种至发酵培养基,是以种子液的形式接种至发酵培养基,接种量:接种的种子液体积占接种后总体积的10%(v/v)。
所述种子液的制备方法为:将产碱性纤维素酶的黄杆菌接种至种子培养基,在30℃培养12h。
所述种子培养基,制备方法为:取cmc-na(sodiumcarboxymethylcellulose,羧甲基纤维素钠)10g/l,酵母粉10g/l,蛋白胨10g/l,nacl5.0g/l,kh2po41.0g/l,mgso4·7h2o0.5g/l,溶于水中,配置成悬浮液培养基;另配浓度为200g/l的无水na2co3水溶液;分开灭菌后,用无水na2co3水溶液调节培养基的初始ph为8.0-8.5,即得种子培养基。
有益效果
本发明的述黄杆菌生产的耐碱性纤维素酶最适温度和最适ph分别为50℃和8.0,水解纤维素能力强,产物以葡萄糖为主,酶活力达31.67u/ml,显著优于现有技术中的耐碱性纤维素酶。且本发明通过方法优化,所制备的耐碱性纤维素酶可适应ph7-10范围内、温度40-65℃范围内,酶活力最高值可达57.3u/ml。
生物材料公开
黄杆菌(flavbacteriumsp.)sx9-4,公开于2020年01月21日,杂志currentpharmaceuticalbiotechnology(《当代药物生物技术》),文章标题为《screeningofanalkalinecmcase-producingstrainandtheoptimizationofitsfermentationcondition(碱性cmcase生产菌的筛选及其发酵条件的优化)》,周君美等,以下简称菌株sx9-4。
附图说明
图1为菌株sx9-4菌落形态及细胞显微观察结果;
图2为菌株sx9-4与其他相近菌株的16srrna基因序列构建的系统发育进化树;
图3为碳源种类对sx9-4发酵产酶的影响;图中:1、cmc-na;2、乳糖;3、可溶性淀粉;4、麦芽糖;5、玉米淀粉;6、果糖;7、蔗糖;8、麸皮;9、葡萄糖;
图4为氮源种类对sx9-4发酵产酶的影响;图中:1、硝酸钠-蛋白胨;2、硝酸钠-草酸铵;3、硝酸钠-豆饼粉;4、硝酸钠-硫酸铵;5、蛋白胨-草酸铵;6、蛋白胨-豆饼粉;7、蛋白胨-硫酸铵;8、草酸铵-豆饼粉;9、草酸铵-硫酸铵;10、豆饼粉-硫酸铵;
图5为培养基初始ph对sx9-4发酵产酶的影响;
图6为发酵温度对sx9-4生长及产酶的影响;
图7为菌株sx9-4生长及产酶曲线;
图8为耐碱性纤维素酶在不同ph下的酶活;
图9为耐碱性纤维素酶在不同温度下的酶活;
图10为不同金属离子对发酵产酶的影响;
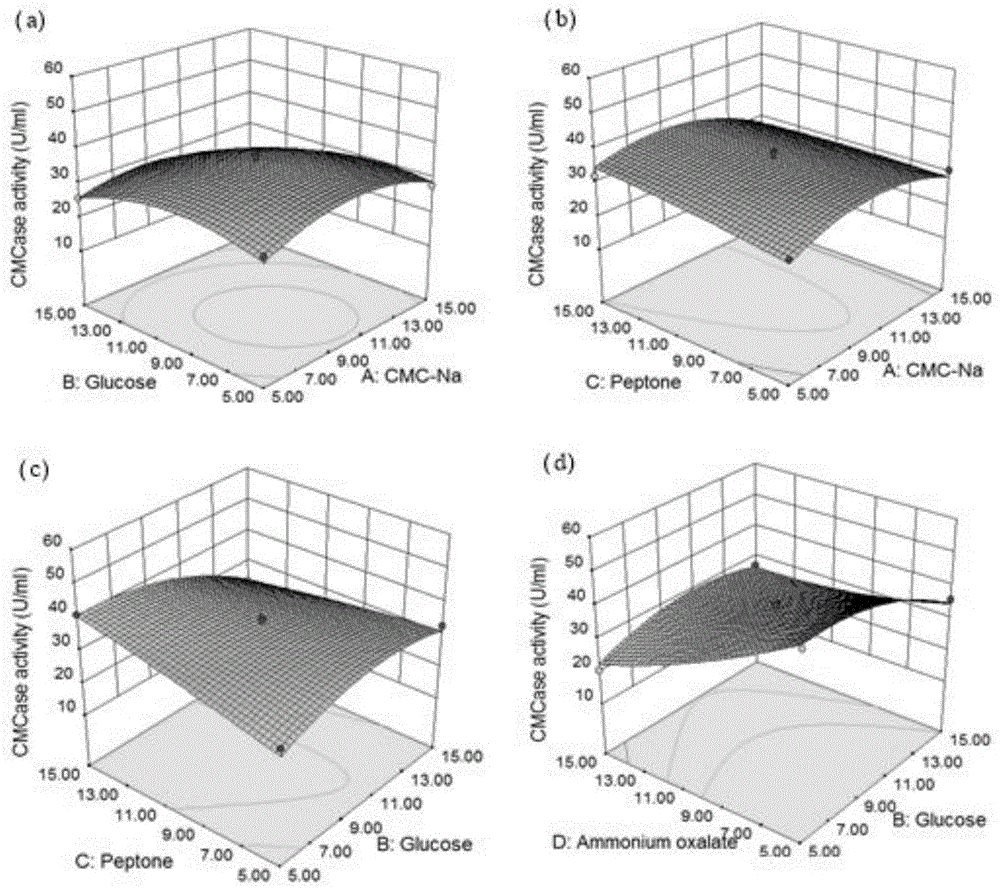
图11为响应面优化三维图;
图12为本发明具体实施方式中制作的葡萄糖标准曲线。
具体实施方式
1、培养基成分(按质量/体积分数,即g/l计):
斜面培养基:牛肉膏0.5,蛋白胨1,nacl0.5,琼脂1.5,ph值为8.5,1×105pa灭菌20min。
富集培养基:cmc-na10,(nh4)2so41,kh2po41,mgso4·7h2o0.5,调节ph至8.5左右;
平板筛选培养基:cmc-na10,蛋白胨1,酵母粉0.5,(nh4)2so41,kh2po41,mgso4·7h2o0.5,琼脂粉20,调节ph至8.5左右;
种子培养基:cmc-na(sodiumcarboxymethylcellulose,羧甲基纤维素钠)10,酵母粉10,蛋白胨10,nacl5.0,kh2po41.0,mgso4·7h2o0.5;另配200g/lnaco3溶液,分开灭菌后,与上述培养基成分按比例混合均匀,使培养基的初始ph为8.0-8.5。
基础发酵培养基:cmc-na10.0,酵母粉5.0,蛋白胨5.0,nacl5.0g/l,kh2po41.0g/l,mgso4·7h2o0.5g/l,0.5mol/lbacl21%。另配200g/l无水naco3,分开灭菌后,与上述培养基成分按比例混合均匀,使培养基的初始ph为8.5。
优化后的发酵培养基:cmc-na10.53g/l,葡萄糖7.47g/l,蛋白胨13.71g/l,草酸铵5.27g/l,nacl5.0g/l,kh2po41.0g/l,mgso4·7h2o0.5g/l,0.5mol/lbacl21%。另配200g/l无水naco3,分开灭菌后,与上述培养基成分按比例混合均匀,使培养基的初始ph为8.5。
2、酶活力测定方法
(1)葡萄糖标准曲线绘制:准确称取在105℃干燥至恒重的葡萄糖0.05g,加蒸馏水溶解后,用100ml容量瓶定容,配制得到0.5g·l-1的葡萄糖标准溶液。分别吸取葡萄糖标准溶液0,0.3,0.6,0.9,1.2,1.5,1.8和2.0ml,置于25ml具塞试管中,分别补加适量蒸馏水至2.0ml。各加入2.0mldns试剂,盖上塞子,摇匀后于沸水浴加热6min。冷却至室温,用蒸馏水定容至25ml,充分混匀,在540nm波长下比色测od值(以不加葡萄糖标准溶液的为对照组)。所得结果以葡萄糖溶液浓度为横坐标,od540值为纵坐标绘图,得出葡萄糖标准曲线,如图11所示。
(2)碱性纤维素酶活力测定参照k.horikoshi方法进行。取1%的cmc-na底物0.475ml,加粗酶液0.025ml,加缓冲溶液调节ph至8.5左右,于50℃的水浴锅中反应30min后,立即放入沸水浴5min中终止反应,再加入0.5mldns试剂,沸水浴6min,吸取0.2ml于酶标板上,于540nm波长下测od值。等量失活酶液同样处理作对照,以扣除酶液中的还原糖。在上述条件下,每毫升酶液每分钟分解底物生产1μmol葡萄糖的酶量定义为1个酶活单位。
实施例1产生淀粉酶菌株的筛选及鉴定
1、产生淀粉酶菌株的筛选
(1)富集培养:从山西、河北、安徽、宁波等多地的农田、盐碱地中采集样品,每份称取1g土样于装有10ml生理盐水的离心管中漩涡混匀匀,吸取200μl上清液转接至富集培养基中,在200rpm/min、28℃的环境条件下摇床培养3d。
(2)透明圈初筛:将富集培养后的菌液进行梯度稀释,并将稀释度为10-2、10-3、10-4的菌液各取100μl涂布在分离培养基上,28℃培养箱倒置培养。将平板上长出的单菌落点接种到两个筛选培养基相同的位置,培养一段时间后,待有明显菌落形成,测定菌落直径(d),然后经0.1%刚果红染色1h,1mol/lnacl脱色,测量透明圈直径(d)。如果菌株产生纤维素酶(cmcase),则在菌落的周围会产生清晰的透明圈,计算透明圈直径与菌落直径比值(d/d),根据其比值的大小来选择产酶菌株。挑取d/d比值较大的菌落划线分离至纯种。
(3)菌株的复筛:将分离出来的纯种接种到筛选培养基上划线,28℃培养箱倒置培养。将平板上长出的单菌落点接种到两个筛选培养基相同的位置,培养一段时间后,待有明显菌落形成,测定菌落直径(d),然后经0.1%刚果红染色1h,1mol/lnacl脱色,测量透明圈直径。如果菌株在碱性条件下产生碱性纤维素酶(cmcase),则在菌落的周围会产生清晰的透明圈,计算透明圈直径与菌落直径比值(d/d),根据其比值的大小来选择产酶菌株。挑取d/d比值较大的菌落再次划线测量透明圈直径(d)与菌落直径(d)并计算比值(d/d)。此过程重复2到3次。
(4)菌株的发酵培养:将保存的初筛菌株活化后取一环到种子培养基中,28℃、200rpm摇床振荡培养24h后,按10%的接种量转接到30ml发酵培养基中28℃、200rpm摇床培养72h后,将发酵液12000rpm,4℃,离心10min,取其上清液测定cmcase酶活大小。得到活性较高的菌株sx-9-4。
2、产生淀粉酶菌株的鉴定
(1)菌落特征及菌体形态
在固体筛选平板上的菌落大多形成圆形隆起、边缘整齐、光滑湿润、半透明乳白色、不透明乳白色菌落,有点同心环状,不透明,奶油白色,中间不透明白色菌落,直径1.5mm-4.0mm左右。
(3)16srdna序列分析
接种菌株gel-09至lb培养基中,培养过夜,提取该菌的总dna作为pcr模板。采用细菌16srdna通用引物进行pcr扩增,本研究选用的通用引物为27f和1492r。
pcr扩增条件:95℃5min,94℃30s,55℃30s,72℃90s,循环30次;72℃10min。
pcr扩增产物经过纯化、加a、胶回收后,连接pmd18-t载体,提取质粒并经琼脂糖电泳检测后送至上海生工生物技术有限公司测序,测序结果如seqidno.1所示,将测序结果提交genbank数据库中进行核苷酸序列相似度比较。发现该菌株与阿氏芽孢杆菌flavobacterium.spb8w2216srdna同源性99%。然后用clustalw2.0软件进行多重序列比对分析,最后用mega7.0软件(neighbor-joining法)构建系统发育树。
如图2所示,基于16srdna序列所构建的系统发育进化树也呈现出稳定的亲缘关系。结合菌株的形态特征、16srdna序列比对及系统发育树分析,初步将该菌株鉴定为黄杆菌属(flavobacterium)黄杆菌种(flavobacterium.sp)。
综合菌落形态特征、生理生化特征以及16srdna序列系统发育分析,将菌株sx9-4初步鉴定为黄杆菌flavobacterium.spsx9-4。
实施例2不同碳源对菌体生长及产酶的影响
本部分实验基于基础发酵培养基,在具体实施方式中所述发酵培养基基础上,去除碳源,分别用cmc-na10g/l、乳糖10g/l、可溶性淀粉10g/l、麦芽糖10g/l、玉米淀粉10g/l、果糖10g/l、蔗糖10g/l、麸皮10g/l、葡萄糖10g/l替换其中的cmc-na作为单独碳源,配制发酵培养基,按10%vol接种量接入种子液,在28℃、200r·min-1的条件下摇床振荡培养48h,观察菌体生长情况并测量发酵粗酶液的酶活,以确定各种碳源对菌株发酵的影响,结果如图3所示。
当以麸皮作为碳源时,碱性纤维素酶活力达到最大,为26.4636u·ml-1,其次为葡萄糖,酶活力达22.2706u·ml-1,cmc-na位列第三,可溶性淀粉酶活最低.
实施例3不同氮源对菌体生长及产酶的影响
在具体实施方式中所述发酵培养基基础上,以cmc-na5.0g/l与葡萄糖5.0g/l组合为碳源的前提下,本部分实验分别用浓度为5.0g/l的草酸铵、蛋白胨、硫酸铵、氯化铵、硝酸钠、酵母粉、尿素、鱼粉、豆饼粉替换基础发酵培养基中的酵母粉和蛋白胨作为单独氮源,或分别将各组分浓度为5.0g/l的硝酸钠+蛋白胨、硝酸钠+草酸铵、硝酸钠+豆饼粉、硝酸钠+硫酸铵、蛋白胨+草酸铵、蛋白胨+豆饼粉、蛋白胨+硫酸铵、草酸铵+豆饼粉、草酸铵+硫酸铵、豆饼粉+硫酸铵组合作为复合氮源,配制发酵培养基,将菌株种子液按10%vol接种量接种,在28℃、200r·min-1条件下摇床振荡培养48h,观察菌体生长情况并测量发酵粗酶液的酶活,结果如图4所示。
当以硝酸钠作为氮源时,碱性纤维素酶活力达到最大,为32.5401u·ml-1,其次为蛋白胨,酶活力达31.4294u·ml-1,而草酸铵酶活力为25.5827u·ml-1,位居第三,酵母粉酶活最低。同时通过观察发现,在以某些无机氮源或有机氮源为唯一氮源时菌株都能较好地生长,且酶活较高。
实施例4不同初始ph对菌体生长及产酶的影响
以经过实施例3和4成分优化后培养基为发酵培养基,配方为:cmc-na10.0g/l,葡萄糖5.0g/l,蛋白胨5.0g/l,草酸铵5.0g/l,nacl5.0g/l,kh2po41.0g/l,mgso4·7h2o0.5g/l。用1m盐酸或na2co3水溶液调节经优化的基础发酵培养基(自然ph为6.05),初始ph分别为4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5、10.0,按10%vol接种量接种菌株种子液,在28℃、200r·min-1的条件下摇床振荡培养48h,测量发酵粗酶液的酶活,研究培养基初始ph对发酵产酶的影响,结果如图5所示。
观察图5可得,当培养基初始ph值在4.0到7.5偏酸性范围内时,发酵液的酶活较低,对发酵产酶有抑制作用;在初始ph为8.0及以上时,酶活先显著提高后逐渐下降;在ph处于8.0~9.0的碱性环境中时,表现出良好的产酶性能,酶活力较高,且在ph8.5时,酶活力达到最大,为43.0598u·ml-1。因此选定ph8.5为进一步优化实验的培养基初始ph值。
实施例5不同发酵温度对菌体生长及产酶的影响
将菌株sx-9-4种子液按10%vol接种于优化后的发酵培养基中(实施例4中使用的配方),调节ph至8.5,分别在23℃、25℃、28℃、30℃、32℃、35℃和37℃的环境下,200r·min-1摇床振荡培养48h,测量发酵粗酶液的酶活,考察在不同培养温度下菌株发酵产酶的情况,结果如图6所示。
观察图6可得,温度变化对该菌产酶具有较大的影响,当培养温度从23℃升高到37℃时,碱性纤维素酶活力先显著升高后逐渐下降;当温度为30℃时,最有利于菌株产酶,酶活力最大,达到43.3023u·ml-1。由此可知,30℃是菌株sx-9-4发酵产酶的最佳温度。
实施例6菌株gel-09的摇瓶发酵产酶
发酵培养基配方同实施例5,控制初始ph为8.5,将菌株sx-9-4种子液按10%vol接种于优化后的发酵培养基中,于30℃发酵48h,每隔4h取样测定菌株sx-9-4的生长及产酶情况,并绘制相应发酵曲线。如图7所示,0-8h为菌株sx-9-4的生长延滞期,此后进入对数生长期;在发酵时间为28h以后,进入稳定期,酶活达到39.5u/ml;酶活力在48h达到最高值,为57.3u/ml。
实施例7金属离子和螯合剂对生淀粉酶活力的影响
发酵培养基配方同实施例5,控制初始ph为8.5,分别添加浓度为0.5mol/l的氯化钠nacl、氯化钡bacl2、硫酸镁mgso4、氯化铜cucl2、硫酸铝al2(s04)3、氯化钴cocl2、氯化钙cacl2、氯化锌zncl2、氯化铁fecl3、氯化钾kcl、氯化锰mncl2、硫酸亚铁feso4,将菌株sx-9-4种子液按10%vol接种于优化后的发酵培养基中,在28℃、200r·min-1的条件下摇床振荡培养48h,观察菌体生长情况并测量发酵粗酶液的酶活,确定各种金属离子对产碱性纤维素酶菌株发酵的影响,结果如图10所示。
观察图10可知,co2+和zn2+的存在对产酶有抑制作用;其他离子对产酶均有一定的促进作用,其中na+、ba2+和mg2+的促进作用最明显;且添加ba2+时,碱性纤维素酶活力达到最大,为48.8296u·ml-1,mg2+次之,酶活为43.0984u·ml-1,co2+酶活力最低。因此选择ba2+作为促进发酵产酶效果最优的金属离子。
实施例8响应面优化发酵培养基
对发酵培养基中的cmc-na、葡萄糖、蛋白胨及草酸铵分别取5.0、10.0、15.0g/l三个水平进行了四因素三水平响应面分析试验,试验设计与结果见表1和表2,其中菌株是在各条件下培养48h后测得的酶活力的值。
表1:响应面四因素三水平试验设计
表2:响应面分析方案与试验结果
利用design-expert8.0.6软件对表2数据进行二次多元回归拟合,得到酶活预测值y对编码自变量a、b、c和d的二次多项回归方程:
y=36.56-1.36a-2.99b+1.65c-9.10d-2.05ab-1.81ac-0.96ad-5.27bc+5.11bd-2.80cd-6.11a2-5.17b2-0.59c2+2.22d2
其中y为木聚糖酶活性(u/ml),a、b、c、d分别为cmc-na、葡萄糖、蛋白胨及草酸铵。
对上述回归模型进行方差分析,结果如表3所示。
表3:回归模型方差分析
观察表3,模型的f值为18.50,模型的p值<0.0001,这意味着模型具有很高的显著性。在这种情况下,a(p=0.1048)、b(p=0.0023)、c(p=0.0546)和d(p<0.0001)的线性项、a2(p=0.0002)和b2(p=0.0008)的二次系数对木聚糖酶的产生也有显著的交互作用(p<0.05)。“缺乏拟合f值”为6.04表明,相对于纯误差而言,缺乏拟合并不显著。回归方程表明,碱性纤维素酶产量的测定系数r2为0.9557,该模型可以解释95.57%以上的反应变异性。此外,预测的r2(0.9557)与调整后的r2(0.9040)较为接近,预测的r2和调整后的r2值较高,说明预测值与实验值高度相关,因此该模型可用于引导设计空间。
利用design-expert8.0.6软件,根据已选择的模型方程,绘制了响应面三维图,如图11所示,研究了变量之间的相互作用,确定了每个变量的最佳浓度。图11a显示了cmc-na与葡萄糖作为底物和碳源相互作用对碱性纤维素酶活性的影响。响应面向下张开表明,随着cmc-na与葡萄糖含量的增加,碱性纤维素酶活性增加,随着cmc-na与葡萄糖含量的进一步增加,碱性纤维素酶活性达到最高,当cmc-na与葡萄糖达到适当比例时(cmc-na:9.61g/l,葡萄糖:8.57g/l)。图11b说明了cmc-na和蛋白胨作为底物和氮源相互作用对碱性纤维素酶活性的影响。当添加中等浓度葡萄糖和草酸铵时,获得碱性纤维素酶活性随着cmc-na和蛋白胨增加并达到高活性,而cmc-na浓度的增加导致碱性纤维素酶活性降低。当cmc-na和蛋白胨浓度分别为9.17和12.83g/l时,达到最大碱性纤维素酶活性。图11c说明在低蛋白胨水平下,碱性纤维素酶活性随着葡萄糖水平的增加而稳定地提升,但是在更高的蛋白胨水平(15g/l)下,碱性纤维素酶的活性逐渐提升到添加5g/l葡萄糖后达到最大值。此后随着葡萄糖的进一步增加,酶活性随着蛋白胨水平的增加而缓慢降低,表明葡萄糖水平的显着增加不会进一步提高碱性纤维素酶的产率。图11d是使用同位素表面图描绘葡萄糖和草酸铵对碱性纤维素酶活性的影响。葡萄糖浓度增加至10g/l和低水平的草酸铵(5g/l)提高了碱性纤维素酶的产量。最终通过对响应面曲线的分析,确定了碱性纤维素酶生产的最佳条件为:cmc-na10.53g/l,葡萄糖7.74g/l,蛋白胨13.71g/l和草酸铵5.27g/l。最佳条件下的碱性纤维素酶活性为:54.41u/ml。
通过各种变量的最佳预测值在摇瓶培养中进行优化的培养基组分的验证,最佳培养基中的实际酶活力为57.18u/ml,与预测值54.41u/ml良好一致。
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
- 还没有人留言评论。精彩留言会获得点赞!