一种利用醛基阿拉伯胶修饰的介孔氧化硅固定化酶的方法与流程
本发明涉及一种利用醛基阿拉伯胶修饰的介孔氧化硅固定化酶的方法,属于检测技术领域。
背景技术:
固定化酶(immobilizedenzyme)是指在一定的空间范围内起催化作用,并能反复和连续使用的酶。与游离酶相比,固定化酶在保持其高效专一及温和的酶催化反应特性的同时,又克服了游离酶的不足之处,呈现贮存稳定性高、分离回收容易、可多次重复使用、操作连续可控、工艺简便等一系列优点。目前,固定化酶在化学、生物学、生物工程、医学以及生命科学等学科领域均有广泛的应用。
酶的固定化(immobilizationofenzymes)是用固体材料将酶束缚或限制于一定区域内,仍能进行其特有的催化反应、并可回收及重复利用的一类技术,主要包括吸附法、交联法、共价结合法以及包埋法等。其中,共价结合法主要通过形成共价键固定化酶,由于酶分子和载体间作用力较强,此方法可显著提高酶的稳定性,防止酶分子的脱落,因此,共价结合法在固定化酶中的应用极为广泛。
戊二醛是目前共价结合法最常用的偶联剂,以戊二醛作为偶联剂固定化酶的效果也较好,例如,feng等人采用戊二醛将氨基酰化酶固定化于3-(氨丙基)三乙氧基硅烷修饰的磁性纳米粒子上,与游离酶相比,固定化酶的热稳定性、ph稳定性、重复使用稳定性都得到显著提高(具体可见参考文献:fengj,yus,lij,etal.enhancementofthecatalyticactivityandstabilityofimmobilizedaminoacylaseusingmodifiedmagneticfe3o4nanoparticles[j].chemicalengineeringjournal,2016,286:216-222.)。
但是,戊二醛并不是适用所有的酶分子,有些酶分子,尤其是有些具有非水相催化性能的酶分子接触戊二醛活性损失较大,例如,mateo等人使用戊二醛固定化青霉素酰基转移酶,但是,使用戊二醛固定化后的青霉素酰基转移酶的活性几乎全部丧失(具体可见参考文献:mateoc,palomojm,vanlangenlm,etal.anew,mildcross-linkingmethodologytopreparecross-linkedenzymeaggregates.[j].biotechnologyandbioengineering,2004,86(3):273-276.),这大大限制了共价结合法的应用范围。此外,戊二醛对人体和生态环境有毒害作用,这也大大限制了共价结合法的应用范围。
因此,急需找到一种适用范围广且安全性高的固定化酶的方法。
技术实现要素:
[技术问题]
本发明要解决的技术问题是提供一种适用范围广且安全性高的固定化酶的方法。
[技术方案]
为解决上述技术问题,本发明提供了一种制备固定化酶载体的方法,所述方法为将含有阿拉伯胶和高碘酸钠的反应体系进行第一次反应,得到反应液a;将反应液a置于透析袋中进行透析处理,得到醛基阿拉伯胶溶液;将介孔氧化硅经脱水处理,得到脱水介孔氧化硅;将3-(氨丙基)三乙氧基硅烷和甲苯混合,得到混合液;将脱水介孔氧化硅和混合液混合后进行第二次反应,得到反应液b;.将反应液b进行第一次分离,得到3-(氨丙基)三乙氧基硅烷修饰的介孔氧化硅;将3-(氨丙基)三乙氧基硅烷修饰的介孔氧化硅与醛基阿拉伯胶溶液混合后中进行第三次反应,得到反应液c;将反应液c进行第二次分离,得到固定化酶载体。
在本发明的一种实施方式中,所述反应体系中,阿拉伯胶的浓度为0.05~0.1g/ml。
在本发明的一种实施方式中,所述反应体系中,阿拉伯胶的浓度为0.7g/ml。
在本发明的一种实施方式中,所述反应体系中,高碘酸钠的浓度为0.05~0.15mol/l。
在本发明的一种实施方式中,所述反应体系中,高碘酸钠的浓度为0.1mol/l。
在本发明的一种实施方式中,所述第一次反应的温度为20~40℃、转速为100~250rpm、时间为2~4h。
在本发明的一种实施方式中,所述第一次反应的温度为37℃、转速为200rpm、时间为3h。
在本发明的一种实施方式中,所述混合液中,3-(氨丙基)三乙氧基硅烷和甲苯的体积比为1~3:40~200。
在本发明的一种实施方式中,所述混合液中,3-(氨丙基)三乙氧基硅烷和甲苯的体积比为1:50。
在本发明的一种实施方式中,所述脱水介孔氧化硅和混合液混合而得的反应体系中,脱水介孔氧化硅的浓度为0.01~0.03g/ml。
在本发明的一种实施方式中,所述脱水介孔氧化硅和混合液混合而得的反应体系中,脱水介孔氧化硅的浓度为0.02g/ml。
在本发明的一种实施方式中,所述第二次反应的温度为40~60℃、时间为5~7h。
在本发明的一种实施方式中,所述第二次反应的温度为50℃、时间为6h。
在本发明的一种实施方式中,所述第一次分离为先将反应液b进行过滤,得到沉淀,然后将沉淀依次进行洗涤和干燥,得到3-(氨丙基)三乙氧基硅烷修饰的介孔氧化硅。
在本发明的一种实施方式中,所述3-(氨丙基)三乙氧基硅烷修饰的介孔氧化硅与醛基阿拉伯胶溶液混合而得的反应体系中,3-(氨丙基)三乙氧基硅烷修饰的介孔氧化硅的浓度为0.005~0.015g/ml。
在本发明的一种实施方式中,所述3-(氨丙基)三乙氧基硅烷修饰的介孔氧化硅与醛基阿拉伯胶溶液混合而得的反应体系中,3-(氨丙基)三乙氧基硅烷修饰的介孔氧化硅的浓度为0.01g/ml。
在本发明的一种实施方式中,所述第三次反应的温度为20~30℃、转速为150~250rpm、时间为0.5~3h。
在本发明的一种实施方式中,所述第三次反应的温度为25℃、转速为200rpm、时间为1.5h。
在本发明的一种实施方式中,所述第二次分离为先将反应液c进行过滤,得到沉淀,然后将沉淀进行洗涤,得到固定化酶载体。
本发明还提供了利用上述方法制备得到的固定化酶载体。
本发明还提供了一种固定化酶的方法,所述方法为将含有酶和上述固定化酶载体的反应体系进行第四次反应,得到反应液d;将反应液d进行第三次分离,得到固定化酶。
在本发明的一种实施方式中,所述含有酶和上述固定化酶载体的反应体系中,酶的浓度为0.001~0.002g/ml、固定化酶载体的浓度为0.005~0.015g/ml。
在本发明的一种实施方式中,所述含有酶和上述固定化酶载体的反应体系中,酶的浓度为0.0015g/ml、固定化酶载体的浓度为0.01g/ml。
在本发明的一种实施方式中,所述第三次反应的温度为20~30℃、时间为0.5~3h。
在本发明的一种实施方式中,所述第三次反应的温度为25℃、时间为1.5h。
在本发明的一种实施方式中,所述第三次分离为先将反应液c进行离心,得到沉淀,然后将沉淀依次进行洗涤和干燥,得到固定化酶。
在本发明的一种实施方式中,所述酶为脂肪酶。
本发明还提供了上述制备固定化酶载体的方法或上述固定化酶载体或上述固定化酶的方法在固定化酶中的应用。
[有益效果]
1、本发明提供了一种固定化酶载体,此固定化酶载体可用于固定化酶,尤其可用于固定化脂肪酶等具有非水相催化性能的酶;与游离脂肪酶和采用戊二醛为偶联剂制备得到的固定化脂肪酶相比,使用本发明的固定化酶载体固定化的脂肪酶的酯合成活性、热稳定性、有机溶剂耐受性均都得到显著提高,具体表现如下:
(1)游离脂肪酶calb的酯合成活性仅有1.3u/mg,采用戊二醛为偶联剂制备得到的固定化脂肪酶的酯合成活性仅有5.1u/mg,而使用本发明的固定化酶载体固定化的脂肪酶的酯合成活性高达6.4u/mg;游离脂肪酶r27rcl的酯合成活性仅有1u/mg,采用戊二醛为偶联剂制备得到的固定化脂肪酶的酯合成活性仅有3.1u/mg,而使用本发明的固定化酶载体固定化的脂肪酶的酯合成活性高达4u/mg;
(2)游离脂肪酶calb在70℃下孵育12h后的残余酶活仅有7%,采用戊二醛为偶联剂制备得到的固定化脂肪酶在70℃下孵育12h后的残余酶活仅有56%,而使用本发明的固定化酶载体固定化的脂肪酶在70℃下孵育12h后的残余酶活高达60%;游离脂肪酶r27rcl在70℃下孵育12h后的残余酶活仅有8%,采用戊二醛为偶联剂制备得到的固定化脂肪酶在70℃下孵育12h后的残余酶活仅有42%,而使用本发明的固定化酶载体固定化的脂肪酶在70℃下孵育12h后的残余酶活高达45%;
(3)游离脂肪酶calb在30%(v/v)甲醇中孵育96h后后的残余酶活仅有70%,采用戊二醛为偶联剂制备得到的固定化脂肪酶在30%(v/v)甲醇中孵育96h后后的残余酶活仅有97%,而使用本发明的固定化酶载体固定化的脂肪酶在30%(v/v)甲醇中孵育96h后的残余酶活高达99%;游离脂肪酶r27rcl在30%(v/v)甲醇中孵育2h后后的残余酶活仅有6%,采用戊二醛为偶联剂制备得到的固定化脂肪酶在30%(v/v)甲醇中孵育2h后后的残余酶活仅有31%而使用本发明的固定化酶载体固定化的脂肪酶在30%(v/v)甲醇中孵育2h后的残余酶活高达34%。
2、本发明提供了一种固定化酶载体,此固定化酶载体的原料为3-(氨丙基)三乙氧基硅烷修饰的介孔氧化硅与醛基阿拉伯胶,3-(氨丙基)三乙氧基硅烷修饰的介孔氧化硅与醛基阿拉伯胶均无毒性,因此,使用本发明的固定化酶载体固定化酶安全性较高。
3、本发明提供了一种利用醛基阿拉伯胶修饰的介孔氧化硅固定化酶的方法,此方法可用于固定化酶,尤其可用于固定化脂肪酶等具有非水相催化性能的酶;与游离脂肪酶和采用戊二醛为偶联剂制备得到的固定化脂肪酶相比,使用本发明的方法固定化的脂肪酶的酯合成活性、热稳定性、有机溶剂耐受性均都得到显著提高,具体表现如下:
(1)游离脂肪酶calb的酯合成活性仅有1.3u/mg,采用戊二醛为偶联剂制备得到的固定化脂肪酶的酯合成活性仅有5.1u/mg,而使用本发明的固定化酶载体固定化的脂肪酶的酯合成活性高达6.4u/mg;游离脂肪酶r27rcl的酯合成活性仅有1u/mg,采用戊二醛为偶联剂制备得到的固定化脂肪酶的酯合成活性仅有3.1u/mg,而使用本发明的方法固定化的脂肪酶的酯合成活性高达4u/mg;
(2)游离脂肪酶calb在70℃下孵育12h后的残余酶活仅有7%,采用戊二醛为偶联剂制备得到的固定化脂肪酶在70℃下孵育12h后的残余酶活仅有56%,而使用本发明的固定化酶载体固定化的脂肪酶在70℃下孵育12h后的残余酶活高达60%;游离脂肪酶r27rcl在70℃下孵育12h后的残余酶活仅有8%,采用戊二醛为偶联剂制备得到的固定化脂肪酶在70℃下孵育12h后的残余酶活仅有42%,而使用本发明的方法固定化的脂肪酶在70℃下孵育12h后的残余酶活高达45%;
(3)游离脂肪酶calb在30%(v/v)甲醇中孵育96h后后的残余酶活仅有70%,采用戊二醛为偶联剂制备得到的固定化脂肪酶在30%(v/v)甲醇中孵育96h后后的残余酶活仅有97%,而使用本发明的固定化酶载体固定化的脂肪酶在30%(v/v)甲醇中孵育96h后的残余酶活高达99%;游离脂肪酶r27rcl在30%(v/v)甲醇中孵育2h后后的残余酶活仅有6%,采用戊二醛为偶联剂制备得到的固定化脂肪酶在30%(v/v)甲醇中孵育2h后后的残余酶活仅有31%而使用本发明的方法固定化的脂肪酶在30%(v/v)甲醇中孵育2h后的残余酶活高达34%。
4、本发明提供了一种利用醛基阿拉伯胶修饰的介孔氧化硅固定化酶的方法,此方法所使用的固定化酶载体的原料为3-(氨丙基)三乙氧基硅烷修饰的介孔氧化硅与醛基阿拉伯胶,3-(氨丙基)三乙氧基硅烷修饰的介孔氧化硅与醛基阿拉伯胶均无毒性,因此,使用本发明的方法固定化酶安全性较高。
附图说明
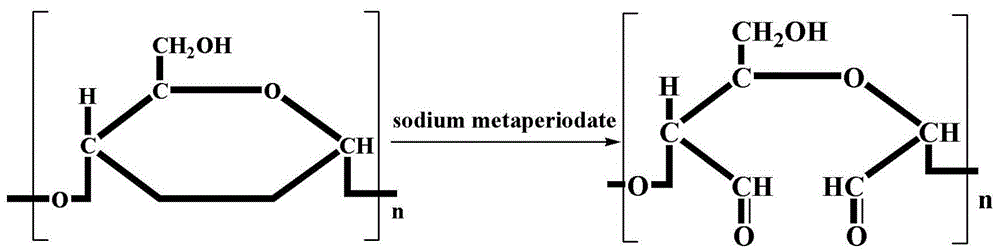
图1:醛基阿拉伯胶的制备过程示意图。
图2:mcfs和mcfs-nh2的ft-ir谱图;其中,a为mcfs,b为mcfs-nh2。
图3:mcfs和mcfs-nh2的氮吸附-脱附曲线图;其中,a为mcfs,b为mcfs-nh2。
图4:mcfs和mcfs-nh2的透射电镜图;其中,a为mcfs,b为mcfs-nh2。
图5:温度对使用不同固定化酶载体固定的脂肪酶calb的酶活的影响。
图6:甲醇对使用不同固定化酶载体固定的脂肪酶calb的酶活的影响。
具体实施方式
下述实施例中涉及的聚环氧乙烷-环氧丙烷-环氧乙烷三嵌段共聚物(p123)和3-(氨丙基)三乙氧基硅烷购自sigma-aldrich公司;下述实施例中涉及的盐酸溶液、1,3,5-三甲苯、正硅酸四乙酯、氟化铵溶液、乙醇、阿拉伯胶、高碘酸钠、透析袋和甲苯购自国药集团化学试剂有限公司;下述实施例中涉及的脂肪酶calb购自杭州创科生物科技有限公司。
下述实施例中涉及的检测方法如下:
醛基阿拉伯胶溶液中醛基含量的测定方法:
将1ml醛基阿拉伯胶溶液与15ml盐酸羟胺溶液(0.5m,ph为2.5)混合,得到混合液;将混合液室温(25℃)下反应2h,得到反应液;将反应液用氢氧化钠溶液(0.005m)调节ph至2.5,根据消耗氢氧化钠溶液的量计算出醛基阿拉伯胶溶液中醛基含量;
其中,醛基含量的计算公式如下:
式中,vnaoh代表消耗氢氧化钠溶液体积(l),nnaoh代表使用氢氧化钠溶液浓度(0.005m),v代表加入醛基阿拉伯胶溶液体积(10-3l)。
脂肪酶酯合成活性的测定方法:
以合成辛酸乙酯为模式反应测定脂肪酶的酯合成活性,具体步骤为:分别配制浓度为1.2m的乙醇和辛酸的正庚烷溶液;各取0.5ml乙醇和辛酸的正庚烷溶液置于4ml离心管中后,在离心管中继续加入脂肪酶,40℃、200r/min下反应30min,得到反应液;将反应液12000r/min下离心5min,得到上清液;取200μl上清液和50μl的内标溶液(浓度为10g/l的异戊醇的正庚烷溶液)混合,以气相色谱法测定反应液中辛酸乙酯的含量;
其中,气相色谱仪为安捷伦7890,色谱柱为db-wax(30m*0.25mm*0.25μm),氢离子火焰检测器,载气为氮气;检测条件:进样口温度为220℃,检测器温度为230℃;升温程序为:色谱柱起始温度为90℃,维持1min,50℃/min升温至200℃,维持4min;
脂肪酶酯合成活性的定义:在上述条件下,每分钟合成1μmol辛酸乙酯所需的酶量定义为1个脂肪酶酯合成酶活单位(1u);
脂肪酶酯合成活性的计算公式如下:
式中,a样为待测样品与内标峰面积之比,a标为标准样品与内标峰面积之比,s标样为标准样品的浓度(g/l),v为反应液体积(l),m为产物辛酸乙酯的分子量(172),t为反应时间(30min),m为加入的脂肪酶质量(g)。
脂肪酶热稳定性的测定方法:
将脂肪酶分别置于不同温度(30、40、50、60、70℃)的正庚烷中孵育12h后,测定其酯合成活性,以未经处理的脂肪酶的酯合成活性为100%,其余活性与之相比计算相对活性,以考察脂肪酶的热稳定性。
脂肪酶有机溶剂耐受性的测定方法:
将脂肪酶置于30%(v/v)甲醇中室温(25℃)孵育96h后,测定其酯合成活性,以未经处理的脂肪酶的酯合成活性为100%,其余活性与之相比计算相对活性,以考察脂肪酶的有机溶剂耐受性。
下述实施例中涉及的制备方法如下:
介孔氧化硅的制备方法如下(介孔氧化硅也可直接购买获得):
具体步骤如下:
取4g聚环氧乙烷-环氧丙烷-环氧乙烷三嵌段共聚物(p123)添加至75ml浓度为1.6mm的盐酸溶液中进行搅拌至聚环氧乙烷-环氧丙烷-环氧乙烷三嵌段共聚物(p123)完全溶解,得到混合液1;取3.4ml1,3,5-三甲苯添加至混合液1中,40℃下剧烈搅拌4h,得到混合液2;取9.2ml正硅酸四乙酯添加至混合液2中,搅拌5min后静置20h,得到混合液3;取5ml浓度为9mg/ml的氟化铵溶液添加至混合液3中,得到混合液4;将混合液4置于晶化釜中,100℃下处理24h进行晶化,得到混合物;将混合物进行抽滤,得到白色固体;将白色固体用水和乙醇反复洗涤去除多余的聚环氧乙烷-环氧丙烷-环氧乙烷三嵌段共聚物(p123)后进行干燥,得到的介孔氧化硅(mcfs)。
通过傅里叶红外光谱仪获得介孔氧化硅(mcfs)的ft-ir谱图(具体可见图2),通过全自动比表面积分析仪获得介孔氧化硅(mcfs)的通过氮吸附-脱附曲线(具体可见图3),通过h-7650型透射电子显微镜获得介孔氧化硅(mcfs)的透射电镜图(具体可见图4)。
脂肪酶r27rcl的制备方法如下:
脂肪酶r27rcl的制备方法可参考文献:shac,yux,zhangm,etal.efficientsecretionoflipaser27rclinpichiapastorisbyenhancingthedisulfidebondformationpathwayintheendoplasmicreticulum[j].journalofindustrialmicrobiology&biotechnology,2013,40(11):1241-1249.
实施例1:固定化酶载体mcfs-nh2的制备
具体步骤如下:
取5g阿拉伯胶添加至15ml高碘酸钠溶液(浓度为100mm)中,37℃、200r/min下反应3h,得到反应液a;将反应液a置于透析袋中于室温下(25℃)下处理24h,得到醛基阿拉伯胶溶液(醛基阿拉伯胶溶液中醛基的含量为83mm),醛基阿拉伯胶溶液需置于4℃冰箱中备用(醛基阿拉伯胶溶液的制备过程可见图1);取1g介孔氧化硅(mcfs),置于120℃的烘箱内脱水6h,得到脱水介孔氧化硅(mcfs);将1ml3-(氨丙基)三乙氧基硅烷和50ml甲苯混合,得到混合液;将脱水介孔氧化硅和混合液混合后,在50℃下反应6h,得到反应液b;将反应液b进行抽滤,得到沉淀a;将沉淀a用乙醇多次洗涤后干燥,得到3-(氨丙基)三乙氧基硅烷修饰的介孔氧化硅,记为mcfs-nh2;在10mgmcfs-nh2中加入醛基阿拉伯胶溶液至混合液中醛基的浓度为1mm后室温(25℃)、200r/min下反应1.5h,得到反应液c;将反应液c进行离心,得到沉淀b;将沉淀b用清水多次洗涤去除表面未结合的醛基阿拉伯胶,得到固定化酶载体。
通过傅里叶红外光谱仪获得介孔氧化硅(mcfs)的ft-ir谱图(具体可见图2),通过全自动比表面积分析仪获得介孔氧化硅(mcfs)的氮吸附-脱附曲线(具体可见图3),通过h-7650型透射电子显微镜获得mcfs-nh2的透射电镜图(具体可见图4)。
如图2所示,采用傅里叶红外光谱表征mcfs-nh2表面的功能基团,mcfs-nh2在1578cm-1处出现吸收峰归因于n-h的伸展振动,表明氨丙基成功修饰于mcfs表面。如图3所示,采用氮吸附脱附实验表征mcfs-nh2的孔结构参数,氨基修饰前后孔结构参数基本没有变化。如图4所示,采用透射电镜直观观察mcfs-nh2的孔结构,氨基修饰前后孔结的孔径均约为30纳米,与氮吸附脱附实验数据一致。
实施例2:酶的固定化(以脂肪酶calb为例)
以游离脂肪酶和采用戊二醛为偶联剂制备得到的固定化脂肪酶作为对照,其中,采用戊二醛为偶联剂制备得到的固定化脂肪酶记为mcfs-nh2-g-calb(采用戊二醛为偶联剂制备固定化脂肪酶的方法参考文献:gaoj,fengk,lih,etal.immobilizedlipaseonporousceramicmonolithsfortheproductionofsugar-derivedoilgellingagent[j].rscadvances,2015,5(84):68601-68609.)。
在实施例1制得的固定化酶载体中加入的脂肪酶溶液至混合液中脂肪酶的浓度为1.5mg/ml(脂肪酶浓度通过考马斯亮蓝法检测)后,25℃、200r/min下反应1.5h,得到反应液;将反应液离心,得到沉淀;将沉淀用磷酸盐缓冲液洗涤后真空干燥,得到实验组固定化脂肪酶,实验组固定化脂肪酶记为mcfs-nh2-ga-calb。
考察游离脂肪酶、mcfs-nh2-g-calb和mcfs-nh2-ga-calb的酯合成活性、热稳定性(考察结果见图5)和有机溶剂耐受性(考察结果见图6),考察结果如下:
游离脂肪酶calb的酯合成活性仅有1.3u/mg,mcfs-nh2-g-calb酯合成活性仅有5.1u/mg,而mcfs-nh2-ga-calb的酯合成活性为6.4u/mg,远高于游离脂肪酶和mcfs-nh2-g-calb;如图5所示,在70℃下孵育12h后,游离脂肪酶仅能保留7%的活性,mcfs-nh2-g-calb仅能保留56%的活性,而mcfs-nh2-ga-calb仍能保留60%的活性,高于游离脂肪酶和mcfs-nh2-g-calb;如图6所示,在30%(v/v)甲醇溶液中孵育96h后,游离脂肪酶仅能保留70%的活性,mcfs-nh2-g-calb仅能保留97%的活性,而mcfs-nh2-ga-calb仍能保留99%的活性,高于游离脂肪酶和mcfs-nh2-g-calb。
实施例3:酶的固定化(以脂肪酶r27rcl为例)
在实施例2的基础上,将脂肪酶calb替换为脂肪酶r27rcl,其中,采用戊二醛为偶联剂制备得到的固定化脂肪酶记为mcfs-nh2-g-r27rcl,实验组固定化脂肪酶记为mcfs-nh2-ga-r27rcl。
考察游离脂肪酶、mcfs-nh2-g-r27rcl和mcfs-nh2-ga-r27rcl的酯合成活性、热稳定性和有机溶剂耐受性,考察结果如下:
游离脂肪酶的酯合成活性仅有1u/mg,mcfs-nh2-g-r27rcl酯合成活性仅有3.1u/mg,而mcfs-nh2-ga-r27rcl的酯合成活性为4u/mg,远高于游离脂肪酶和mcfs-nh2-g-r27rcl;在70℃下孵育12h后,游离脂肪酶仅能保留8%的活性,mcfs-nh2-g-r27rcl仅能保留42%的活性,而mcfs-nh2-ga-r27rcl仍能保留45%的活性,高于游离脂肪酶和mcfs-nh2-g-r27rcl;在30%(v/v)甲醇溶液中孵育2h后,游离脂肪酶仅能保留6%的活性,mcfs-nh2-g-r27rcl仅能保留31%的活性,而mcfs-nh2-ga-r27rcl仍能保留34%的活性,高于游离脂肪酶和mcfs-nh2-g-r27rcl。
实施例4:醛基浓度对固定化酶载体固定化酶效果的影响(以脂肪酶calb为例)
方案一:在实施例1的基础上,将“在10mgmcfs-nh2中加入醛基阿拉伯胶溶液至混合液中醛基的浓度为1mm后室温(25℃)、200r/min下反应1.5h,得到反应液c”替换为“在10mgmcfs-nh2中加入醛基阿拉伯胶溶液至混合液中醛基的浓度为0.2mm后室温(25℃)、200r/min下反应1.5h,得到反应液c”,得到固定化酶载体-1。
方案二:在实施例1的基础上,将“在10mgmcfs-nh2中加入醛基阿拉伯胶溶液至混合液中醛基的浓度为1mm后室温(25℃)、200r/min下反应1.5h,得到反应液c”替换为“在10mgmcfs-nh2中加入醛基阿拉伯胶溶液至混合液中醛基的浓度为1.2mm后室温(25℃)、200r/min下反应1.5h,得到反应液c”,得到固定化酶载体-2。
参照实施例2的方法,分别采用固定化酶载体-1和固定化酶载体-2制备得到固定化脂肪酶,分别记为mcfs-nh2-ga-calb-1和mcfs-nh2-ga-calb-2。
考察mcfs-nh2-ga-calb-1和mcfs-nh2-ga-calb-2的酯合成活性,考察结果为:mcfs-nh2-ga-calb-1和mcfs-nh2-ga-calb-2的酯合成活性分别为4.5u/mg和5.3u/mg,较实施例2的mcfs-nh2-ga-calb有所下降,说明,醛基浓度对固定化酶载体固定化酶的效果有影响。
实施例5:反应时间对固定化酶载体固定化酶效果的影响(以脂肪酶calb为例)
方案一:在实施例1的基础上,将“在10mgmcfs-nh2中加入醛基阿拉伯胶溶液至混合液中醛基的浓度为1mm后室温(25℃)、200r/min下反应1.5h,得到反应液c”替换为“在10mgmcfs-nh2中加入醛基阿拉伯胶溶液至混合液中醛基的浓度为1mm后室温(25℃)、200r/min下反应0.5h,得到反应液c”,得到固定化酶载体-3。
方案二:在实施例1的基础上,将“在10mgmcfs-nh2中加入醛基阿拉伯胶溶液至混合液中醛基的浓度为1mm后室温(25℃)、200r/min下反应1.5h,得到反应液c”替换为“在10mgmcfs-nh2中加入醛基阿拉伯胶溶液至混合液中醛基的浓度为1mm后室温(25℃)、200r/min下反应2.5h,得到反应液c”,得到固定化酶载体-4。
参照实施例2的方法,分别采用固定化酶载体-3和固定化酶载体-4制备得到固定化脂肪酶,分别记为mcfs-nh2-ga-calb-3和mcfs-nh2-ga-calb-4。
考察mcfs-nh2-ga-calb-3和mcfs-nh2-ga-calb-4的酯合成活性,考察结果为:mcfs-nh2-ga-calb-3和mcfs-nh2-ga-calb-4的酯合成活性分别为4.1u/mg和5.6u/mg,较实施例2的mcfs-nh2-ga-calb有所下降,说明,3-(氨丙基)三乙氧基硅烷修饰的介孔氧化硅与醛基阿拉伯胶溶液的反应时间对固定化酶载体固定化酶的效果有影响。
实施例6:固定化时间对固定化酶载体固定化酶效果的影响(以脂肪酶calb为例)
方案一:在实施例2的基础上,将“在实施例1制得的固定化酶载体中加入的脂肪酶溶液至混合液中脂肪酶的浓度为1.5mg/ml(脂肪酶浓度通过考马斯亮蓝法检测)后,25℃、200r/min下反应1.5h”替换为“在实施例1制得的固定化酶载体中加入的脂肪酶溶液至混合液中脂肪酶的浓度为1.5mg/ml(脂肪酶浓度通过考马斯亮蓝法检测)后,25℃、200r/min下反应0.5h”,得到固定化酶-5。
方案二:在实施例2的基础上,将“在实施例1制得的固定化酶载体中加入的脂肪酶溶液至混合液中脂肪酶的浓度为1.5mg/ml(脂肪酶浓度通过考马斯亮蓝法检测)后,25℃、200r/min下反应1.5h”替换为“在实施例1制得的固定化酶载体中加入的脂肪酶溶液至混合液中脂肪酶的浓度为1.5mg/ml(脂肪酶浓度通过考马斯亮蓝法检测)后,25℃、200r/min下反应2.5h”,得到固定化酶-6。
考察mcfs-nh2-ga-calb-5和mcfs-nh2-ga-calb-6的酯合成活性,考察结果为:mcfs-nh2-ga-calb-5和mcfs-nh2-ga-calb-6的酯合成活性分别为4.3u/mg和5.9u/mg,较实施例2的mcfs-nh2-ga-calb有所下降,说明,固定化酶时间对固定化酶载体固定化酶的效果有影响。
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
- 还没有人留言评论。精彩留言会获得点赞!