一种多靶点粪便DNA甲基化检测大肠癌试剂盒及其检测方法与流程
本发明属于检测大肠癌技术领域,具体涉及一种多靶点粪便dna甲基化检测大肠癌试剂盒及其检测方法。
背景技术:
大肠癌虽然是“可防可治”的肿瘤,但是我们并没有明显降低大肠癌的发病率和死亡率,肿瘤分期仍然是影响预后的唯一因素,探索适合大肠肿瘤的筛查方法是一个亟待解决问题。目前大肠癌筛查技术多使用粪便隐血检查结合乙状结肠镜或结肠镜检查,由于粪便隐血检查的敏感性和特异性较差,许多人不得不反复进行“阴性”肠镜检查,增加受检者的痛苦、增加了医疗费用,因此探索大肠肿瘤的非侵入性筛查方法是目前研究的最为热点的课题。从粪便脱落细胞的分子标记筛查大肠肿瘤和血液分子标记筛查大肠肿瘤是理想的方法,但是敏感性和特异性较低,在临床应用不十分广泛;同时如何增加人们对于大肠肿瘤筛查的意识,探索适合中国人群管理的大肠肿瘤筛查模式,是研究成果能否在临床广泛应用的关键。
imperila等最近进行了一个9988人粪便甲基化检测筛查大肠癌的研究,对大肠癌敏感性达92%、对大肠息肉敏感性达42%,特异性达90%以上,说明通过粪便dna甲基化可以作为筛查大肠癌和大肠腺瘤的工具。但是dna甲基化与人种、饮食习惯、生活环境等有关,本组前期研究中,在分析国内现有单靶点粪便dna甲基化检测大肠癌试剂盒的基础上,筛选了一系列的dna甲基化标志,对其在大肠癌的筛查价值进行了研究,研究表明snca、spg20、septin9和fbn1可以作为大肠肿瘤的筛查指标,本组设计了以snca等四个分子标记为靶点的筛查体系,并建立了阳性和阴性的内控体系,以进一步提高筛查大肠肿瘤的准确性。
技术实现要素:
本部分的目的在于概述本发明的实施例的一些方面以及简要介绍一些较佳实施例。在本部分以及本申请的说明书摘要和发明名称中可能会做些简化或省略以避免使本部分、说明书摘要和发明名称的目的模糊,而这种简化或省略不能用于限制本发明的范围。
鉴于上述的技术缺陷,提出了本发明。本品用于体外定性检测人粪便中septin9,snca,spg20,fbn1基因甲基化以筛查大肠癌及其癌前病变的方法。在大肠癌病人中,基因septin9,snca,spg20,fbn1的胞嘧啶会发生甲基化,而正常人中不发生甲基化。粪便中脱落细胞中的septin9,snca,spg20,fbn1基因发生的甲基化可以用过dna的特异扩增而被检测到。在针对多个经肠镜确诊的大肠癌病例和阴性对照的研究报告中,都表明可以在大肠癌病人的粪便中通过检测septin9,snca,spg20,fbn1基因的甲基化而查到早期癌细胞的dna。
因此,作为本发明其中一个方面,本发明克服现有技术中存在的不足,提供一种多靶点粪便dna甲基化检测大肠癌试剂盒及其检测方法。
为解决上述技术问题,本发明提供了如下技术方案:一种多靶点粪便dna甲基化检测大肠癌试剂盒,其包括引物、阻断剂和探针;所述引物包括针对septin9,snca,spg20,fbn1基因不含cpg双碱基的序列区域设计的序列的一种或几种;所述阻断剂包括在没有发生甲基化而被亚硫酸盐转化后的序列区域设计的序列的一种或几种;所述探针包括针对发生甲基化的septin9,snca,spg20,fbn1基因序列设计的特异性荧光素探针的一种或几种。
作为本发明所述的多靶点粪便dna甲基化检测大肠癌试剂盒的优选方案,其中:所述引物、阻断剂、探针如序列seqidno.1~4、seqidno.6~19。
作为本发明所述的多靶点粪便dna甲基化检测大肠癌试剂盒的优选方案,其中:还包括内参基因检测体系,所述内参基因的序列如seqidno.5。
作为本发明的另一方面,本发明提供一种多靶点粪便dna甲基化检测大肠癌的方法,其包括,从粪便中收集肠粘膜细胞;用粪便dna提取试剂盒提取所述肠粘膜细胞dna,再用亚硫酸盐进行转化,获得bisdna;将所述bisdna进行多重pcr扩增获得模板基因用于检测。
作为本发明所述的多靶点粪便dna甲基化检测大肠癌的方法的优选方案,其中:所述多重pcr扩增检测,其为反应体系为,
作为本发明所述的多靶点粪便dna甲基化检测大肠癌的方法的优选方案,其中:所述检测,其为反应体系为,选择检测设备的fam通道,同时选择hex或vic通道。
作为本发明所述的多靶点粪便dna甲基化检测大肠癌的方法的优选方案,其中:控制程序温度95℃,先运行1分钟,1次;再运行15s,共45次,结束后采集荧光;再控制程序温度60℃,运行60秒。
作为本发明所述的多靶点粪便dna甲基化检测大肠癌的方法的优选方案,其中:若nc中fam、hex(或vic)通道检测均无扩增或无ct值,pc中fam、hex(或vic)通道检测均有扩增且ct值≤30,则可继续分析;否则认为实验无效,需重复实验。
作为本发明所述的多靶点粪便dna甲基化检测大肠癌的方法的优选方案,其中:若利用hex/vic通道进行内参基因检测,有扩增且ct值≤25,则可继续分析;若利用hex/vic通道进行内参基因检测,ct值较大或无扩增,但fam通道的突变位点检测有扩增且ct值≤38,则可继续分析。
作为本发明所述的多靶点粪便dna甲基化检测大肠癌的方法的优选方案,其中:若样品中某突变位点检测的fam通道有扩增且ct值≤35,则判定该样本突变结果为阳性;若ct值>38或无扩增,则判定该样本突变结果为阴性;若35<ct值≤38,需重复实验,若ct值仍在此范围内,则判定该样本突变结果为疑似阳性,所述疑似阳性的比例占总体占5%左右。
本发明的有益效果:
本发明多靶点粪便dna甲基化筛查试剂盒其敏感性和特异性达到筛查大肠肿瘤的要求,操作方便,结果稳定,具有重要的临床价值;当四个分子标志中,有一个标志为dna甲基化阳性时,就需要进行肠镜检查;随着甲基化标志增加,其诊断的特异性逐渐升高,当2个以上标志dna甲基化阳性时,患者阳性预测值达到90%以上,属于极高风险结直肠癌或者结直肠息肉患者患者,需要立即进行肠镜检查和治疗,以发现结肠息肉或结直肠癌;当四个分子标记均为阴性时,可以排除受检者有结直肠癌可能。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动性的前提下,还可以根据这些附图获得其它的附图。其中:
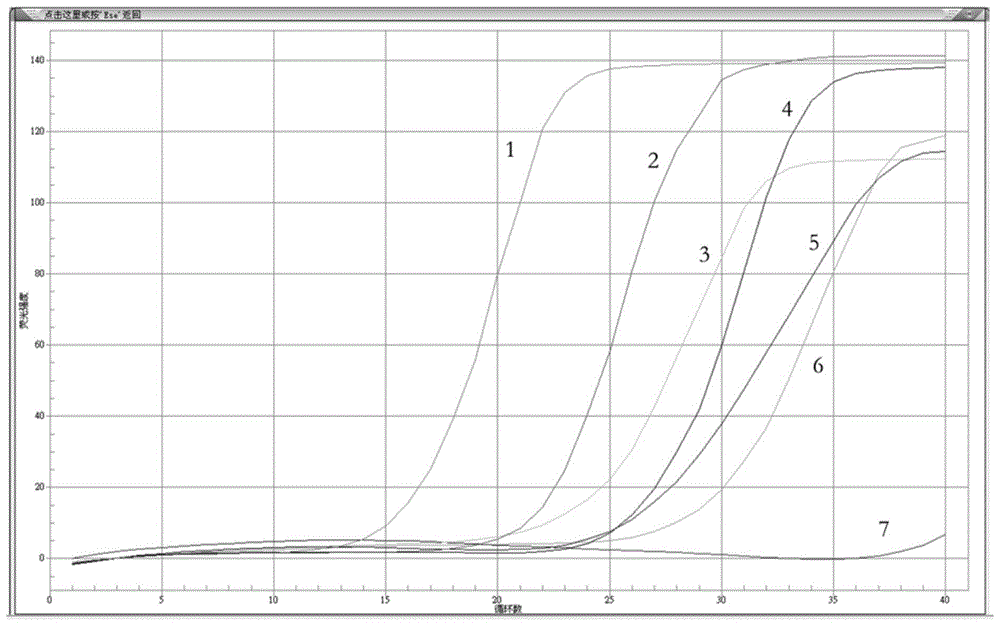
图1为典型阳性结果曲线图,其中,1表示阳性对照,为灰色,2表示actb,为深绿色,3表示sept9为浅绿色,4表示spg20为紫色,5表示scna,为深蓝色,6表示fbn1为浅蓝色,7表示阴性对照,为红色,纵坐标为荧光强度0~140,横坐标为循环数0~40,1~6各曲线从循环数13开始依次分离,对应的循环数为13、18、18、24、24、26;
图2为典型阴性结果曲线图,其中,1表示阳性对照s,为灰色,对应循环数为13;2表示actb为红色,对应的循环数为22,其余线条表示其他基因及阴性对照,不能明显分离,纵坐标为荧光强度0~160,横坐标为循环数0~40;
图3为检测流程图。
具体实施方式
为使本发明的上述目的、特征和优点能够更加明显易懂,下面结合具体实施例对本发明的具体实施方式做详细的说明。
在下面的描述中阐述了很多具体细节以便于充分理解本发明,但是本发明还可以采用其他不同于在此描述的其它方式来实施,本领域技术人员可以在不违背本发明内涵的情况下做类似推广,因此本发明不受下面公开的具体实施例的限制。
其次,此处所称的“一个实施例”或“实施例”是指可包含于本发明至少一个实现方式中的特定特征、结构或特性。在本说明书中不同地方出现的“在一个实施例中”并非均指同一个实施例,也不是单独的或选择性的与其他实施例互相排斥的实施例。
样本要求
粪便的收集和保存
粪便样品使用粪便采集器进行收集,带有保存液的粪便标本在制备脱落细胞前,保存在2~8℃,不超过24小时,不要求冰冻。
脱落细胞的制备和保存
使用专用的脱落黏膜收集装置振荡粪便样品,收集最终的上清;最后至50ml离心管,先用移液枪弃去上层液体,再用移液枪吸取中间白色粘膜富集层转移至2ml离心管;脱落细胞样本可以保存在-80℃,不超过4周。
该收集装置的组件包括,粪便采集盒、不锈钢滤网、瓷珠、中性固定液和离心瓶。滤网分为1-3层,上层为150目,中层200目,下层为300目。瓷珠为直径2-8mm,上层5-50颗,中、下层各5-30颗。
具体收集方法如下:
1、a.采集50-100g粪便后,加入300ml中性固定液,充分搅拌混匀。
b.震荡器150rpm震荡20min,打开开关将过滤液收集至250ml离心瓶。
c.250ml离心管4℃4000rpm离心20min。弃部分上清,保留50ml上清液,轻轻吹打沉淀表面,将液体移至50ml离心管中,4℃5000rpm离心20min。弃部分上清,保留20ml上清液,轻轻吹打沉淀表面,将液体移至20ml离心管中,4℃5000rpm离心20min。弃部分上清,保留5ml上清液,轻轻吹打沉淀表面,将液体移至5ml离心管中4℃12000rpm离心1min。弃上清,留沉淀。
2、标本分成两份,一份蜡块包埋,行常规病理检查;一份行dna甲基化检测。
本发明的检验原理:
第1步,先用粪便dna提取试剂盒(购买于qigen公司)把从粪便中分离的脱落细胞dna提取出来后再用亚硫酸盐进行转化;
第2步,用pcr试剂盒对亚硫酸盐转化的dna(bisdna)进行多重pcr扩增,从而检测发生甲基化的septin9,snca,spg20,fbn1基因dna片段和内对照actb(b-action),试剂盒中提供了甲基化的阳性和阴性对照,在每一次检测中都需要同时加入阳性和阴性对照。
试剂盒pcr反应中的阻断剂和探针能区分出甲基化和非甲基化的序列。septin9,snca,spg20,fbn1基因甲基化检测试剂盒检测septin9,snca,spg20,fbn1基因区域发生甲基化的cpg岛中的bisdna序列,以及内对照actb基因的那分区域中全部bisdna。
在septin9,snca,spg20,fbn1基因不含cpg双碱基的序列区域设计pcr引物;在没有发生甲基化而被亚硫酸盐转化后的序列区域设计阻断剂。
这样就让被转化的甲基化序列得到优先扩增。针对发生甲基化的septin9,snca,spg20,fbn1基因序列设计的特异性荧光素探针可以在pcr反应中专一地检测出甲基化的序列。
本试剂盒在基因各突变类型检测体系中同时设置了内参基因(internalreference,ir)检测体系,即actb(β-actin),其序列见表6。两种体系在同一pcr管中同时进行反应。内参基因也是区别于待检基因的管家基因。将识别待检基因突变模板的探针修饰为fam荧光基团,而将识别内参基因模板的探针修饰为hex荧光基团。通过检测内参基因扩增情况(hex/vic通道),可分析待检dna是否能被正常扩增,从而排除漏加试剂或样本、样本含有pcr抑制剂等造成pcr检测失败的原因。
进行本试剂盒检测结果判定时,阴性质控品nc中fam、hex(或vic)通道检测均应无扩增(不呈典型的s型曲线。注:典型的s型曲线依次表现为指数期、直线期及平台期)或无ct值,阳性质控品pc中fam、hex(或vic)通道检测均应有扩增(呈典型的s型曲线)且ct值≤35;否则认为实验无效,需重复实验。
【亚硫酸盐处理流程】
1、使用前准备
(1)加入24ml的95~100%乙醇到含有6mlme洗脱液的试剂瓶中,配制成为1xme洗脱液,涡旋混匀。
(2)纯化的dna浓度调整到200~500ng,dna溶液体积调整到20μl。
2、亚硫酸盐转化
(1)将20μldna样品加入到200μl的pcr管中。
(2)加入130μlbisulfiteme转化试剂到每个dna样品用移液器轻轻吹打混匀,短暂离心使液体保持在管底。
(3)设置pcr仪
98℃8分钟
54℃60分钟
4℃保持
(4)4℃或冰上保存不超过20小时。
3、dna脱硫及纯化
(1)待转化反应完成后,将回收柱分别放入收集管中。
(2)每个回收柱内加600μlmebindingbuffer,将转化后的反应液全部转移至回收柱中,盖上盖子,颠倒混匀。
(3)高速离心(≥10000×g)30s,弃收集管中的液体,再将回收柱放入收集管中。
(4)在每个回收柱内加入100μl1×mewashbuffer,高速离心30s。
(5)在每个回收柱内加入200μlmedesulfonationbuffer,盖上回收柱盖子,室温放置15min。
(6)高速离心30s。
(7)在每个回收柱内加入200μlmewashbuffer,高速离心30s。
(8)重复步骤7一次。
(9)将回收柱放到一个新的1.5ml离心中。
(10)在每个回收柱内加入10μlmeelutionbuffer,高速离心30s。
注意:要增加洗脱dna的产量,可以再加20μl的meelutionbuffer,高速离心洗脱一次,meelutionbuffer可以用无核酸水或者tebuffer(≥ph6.0)代替。
(11)弃回收柱,盖上盖子,4℃保存,24小时内使用,或者≤-20℃保存一周。所有样品需避光保存。
【pcr流程】
试剂准备(在试剂准备区操作)
1将试剂盒及其它所需试剂置室温解冻(pcrmix溶液应在冰上融解),完全融解后吹打混匀。
2根据当次实验标本量,取出相应试剂总的需求量于一管中(其余随即放回原温度保存),如所需要的管数为n(n=标本数+1管阴性对照+1管阳性对照),取pcr反应管,转移至样本制备区。
3.加样(在标本制备区操作)
反应体系的配制
待测基因反应体系:(共20μl体系)
阳性对照反应体系的配制
待测基因反应体系:(共20μl体系)
阴性对照反应体系的配制
待测基因反应体系:(共20μl体系)
取试剂盒中的荧光pcr管盖盖紧,轻弹混匀后短暂离心。注意:取、盖管盖时应更换新的pe或橡胶手套;混匀时不要使用漩涡振荡仪;短暂离心后使试剂保持在管底。
4将各反应管带入pcr仪。
5.荧光pcr仪检测通道设定:
(1)bioerlinegenek、stratagenemx3000p、rochelc480、bioradcfx-96需同时选择fam、hex通道(参比染料设置为“无”);
(2)abi7500、abbottm2000rt需同时选择fam、vic通道(参比染料设置为“无”)。
反应程序设置如下:
【检测结果的解释】
1.ct值确定:
(1)stratagenemx3000p荧光pcr仪:首先设定基线,选择“适合基线(adaptivebaseline)”设定时的荧光信号,阈值(threshold)设定原则以阈值线刚好超过正常阴性质控品nc扩增曲线(无规则的噪音线)的最高点,即令阴性质控品nc扩增曲线显示“noct”为准。从软件中读取各样本在各位点检测的ct值。
(2)abi7500荧光pcr仪:首先设定基线,选择“自动基线(automaticbaseline)”设定时的荧光信号,阈值(threshold)设定原则以阈值线刚好超过正常阴性质控品nc扩增曲线(无规则的噪音线)的最高点,即令阴性质控品nc扩增
曲线显示“undetermined”为准。从软件中读取各样本在各位点检测的ct值。
(3)rochelc480荧光pcr仪:选择“absquant/2ndderivativemax”模式,从软件中读取各样本在各位点检测的cp值。
(4)abbottm2000rt荧光pcr仪:首先设定基线,选择“自动基线(automaticbaseline)”设定时的荧光信号,阈值(threshold)设定原则以阈值线刚好超过正常阴性质控品nc扩增曲线(无规则的噪音线)的最高点,即令阴性质
控品nc扩增曲线显示“-1”为准。从软件中读取各样本在各位点检测的ct值。
(5)bioradcfx-96荧光pcr仪:首先设定基线,选择“默认基线(autocalculated)”设定时的荧光信号,阈值(threshold)设定原则以阈值线刚好超过正常阴性质控品nc扩增曲线(无规则的噪音线)的最高点,即令阴性质
控品nc扩增曲线显示“n/a”为准。从软件中读取各样本在各位点检测的cp值。
注:在下述内容中,将cp值、ct值统称为ct值。
2.定性分析:
(1)实验质量评判:若nc中fam、hex(或vic)通道检测均无扩增(不呈典型的s型曲线。注:典型的s型曲线依次表现为指数期、直线期及平台期)或无ct值,pc中fam、hex(或vic)通道检测均有扩增(呈典型的s型曲线)且ct值≤30,则可继续分析;否则认为实验无效,需重复实验。
(2)待检dna样品中内控基因检测情况评判:若内参基因检测(hex/vic通道)有扩增且ct值≤25,则可继续分析;若内参基因检测(hex/vic通道)ct值较大或无扩增,但突变位点检测(fam通道)有扩增且ct值≤38,则可继续分析(可能由于突变位点扩增对内控基因扩增产生抑制);若内控基因检测(hex/vic通道)ct值较大或无扩增,而突变位点检测(fam通道)无扩增或有扩增但ct值>38,则无法继续分析,需重复实验(可能由于dna样品发生降解、其中含有pcr抑制剂或未加样品)。
(4)待检dna样品中基因突变情况评判:若样品中某突变位点检测(fam通道)有扩增且ct值≤35,则判定该样本突变结果为阳性;若ct值>38或无扩增,则判定该样本突变结果为阴性;若35<ct值≤38,可重复实验,若ct值仍在此范围内,则判定该样本突变结果为疑似阳性(可能由于突变含量低造成ct值波动)。疑似阳性的比例占总体的5%左右。
多靶点粪便dna甲基化检测在大肠癌的临床验证
1、病例资料
2016.5-2017.2南京中医药大学第二附属医院和第三附属医院收治的38例肠癌患者、27例结肠息肉患者和59例肠镜检查正常患者纳入临床研究,所有患者签署知情同意书,研究得到南京中医药大学第二附属医院伦理委员会批准(ky2014018)。参加者临床资料见表1.
表1:病例资料临床病理特征
2、结果
(1)snca,spg20,fbn1和sept9在三组患者肠粘膜中的甲基化与其临床特征的关系
共124例患者的甲基化pcr均符合内控要求,结果可以分析。年龄分为50岁以上及50岁以下二组,根据术后病例分期分为i-ii和iii-iv.息肉大小分为<0.5cm、0.5-1cm和≥1cm。在表2中,年龄、性别和ptnm差异没有统计学意义(p>0.05),snca和sept9在不同大小息肉之间差异有统计学意义(p<0.05)。
表2不同分子靶标在结直肠癌(大肠癌)、息肉和正常黏膜之间甲基化差异
(2)不同的分子标记组合对大肠癌和大肠息肉筛查的敏感性、特异性、阳性预测值和阴性预测值
以肠镜检查结果为金标准,分别计算1个、2个、3个和4个分子标记甲基化阳性对于大肠癌、大肠息肉及大肠肿瘤(癌+息肉)诊断的敏感性、特异性、阳性预测值和阴性预测值。
在结直肠癌中,没有4个分子标记dna甲基化全为阴性;结直肠息肉中,5例(18.5%)患者分子标记dna甲基化全为阴性,但是这5例息肉病人,息肉小于3mm,病理上均为增生性息肉;正常人中4个分子标记dna甲基化全为阴性为24例(40.7%);所以,当四个分子标记均为阴性时,对于大肠癌阴性预测值为100%,对于结直肠息肉的阴性预测值为82.8%。
①一个分子标记阳性时对大肠癌和大肠息肉筛查的敏感性、特异性、阳性预测值和阴性预测值
当1个分子标记dna甲基化阳性时,snca等4个分子标记在结直肠癌甲基化率均高于正常人,差异有统计学意义;而在腺瘤中,仅fbn1和sept9在结直肠腺瘤甲基化率均高于正常人,差异有统计学意义。1个分子标记阳性对于结直肠癌和结直肠腺瘤筛查的敏感性、特异性、阳性预测值和阴性预测值见表3。
表3一个分子标记阳性时对大肠癌和大肠息肉筛查价值
②二个分子标记阳性时对大肠癌和大肠息肉筛查的敏感性、特异性、阳性预测值和阴性预测值
当2个分子标记dna阳性时,癌、腺瘤与正常黏膜相比差异均有显著一样,不管对于癌还是腺瘤筛查的特异性明显上升,均达到93%以上,但是敏感性下降,对于癌筛查的敏感性为52.6%-73.7%,对于腺瘤筛查的敏感性为25.9-40.7%,阳性预测值上升而阴性预测值下降。2个分子标记阳性时对于结直肠癌和结直肠腺瘤筛查的敏感性、特异性、阳性预测值和阴性预测值见表4。
表4二个分子标记阳性时对大肠癌和大肠息肉筛查价值
③三个或四个分子标记阳性时对大肠癌和大肠息肉筛查的敏感性、特异性、阳性预测值和阴性预测值
当3个或4个分子标记dna甲基化阳性时,癌、腺瘤与正常黏膜相比差异均有显著一样,不管对于癌还是腺瘤筛查的特异性接近100%,但是敏感性下降,对于癌筛查的敏感性为31.6%-52.6%,对于腺瘤筛查的敏感性为14.8%-25.9%,阳性预测值上升而阴性预测值下降。2个分子标记阳性时对于结直肠癌和结直肠腺瘤筛查的敏感性、特异性、阳性预测值和阴性预测值见表5。
表5三个或四个分子标记阳性时对大肠癌和大肠息肉筛查价值
提取病人粪便中的脱落细胞的原理是通过不同孔径的将脱落细胞与粪便中的杂质分离出来。再通过沉淀法将dna纯化。纯化的dna溶液通过亚硫酸盐进行转化。转化的过程是亚硫酸盐离子通过亲核反应添加到胞嘧啶c上并被转化成尿嘧啶u,但是发生了甲基化的胞嘧啶是不会被亚硫酸盐转化的。
通过本研究证实,多靶点粪便dna甲基化筛查试剂盒其敏感性和特异性达到筛查大肠肿瘤的要求,操作方便,结果稳定,具有重要的临床价值;当四个分子标志中,有一个标志为dna甲基化阳性时,就需要进行肠镜检查;随着甲基化标志增加,其诊断的特异性逐渐升高,当2个以上标志dna甲基化阳性时,患者阳性预测值达到90%以上,属于极高风险结直肠癌或者结直肠息肉患者患者,需要立即进行肠镜检查和治疗,以发现结肠息肉或结直肠癌;当四个分子标记均为阴性时,可以排除受检者有结直肠癌可能。
表6snca,spg20,fbn1和sept9基因的pcr引物、探针序列表
应说明的是,以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围,其均应涵盖在本发明的权利要求范围当中。
- 还没有人留言评论。精彩留言会获得点赞!