一种高产环糊精葡萄糖基转移酶的突变菌株及其应用的制作方法
1.本发明属于基因工程技术领域,具体内容涉及一株高产环糊精葡萄糖基转移酶的毕赤酵母菌株及其应用。
技术背景
2.环糊精葡萄糖基转移酶(cyclodextrin glycosyltransferase, cgtase, ec2.4.1.19)是α-淀粉酶家族中的重要成员之一,属于水解酶类,可以水解需含有α-1,4-葡萄糖苷键的直链葡聚糖,而且从基因序列上分析,cgtase的n端与α-淀粉酶具有极高的同源性。同时,也属于转移酶类,是由微生物发酵产生的胞外酶。环糊精葡萄糖基转移酶能够催化四种反应,分别为歧化反应(disproportionation)、水解反应(hydrolysis)、开环反应(coupling)和环化反应(cyclization)。cgtase酶的主要应用是生产环糊精,除此之外,还可以通过歧化作用和耦合作用,将反应中产生的单糖、双糖或寡糖分子转移到各种受体分子中,提高受体分子的性质。因此,被广泛应用于食品、化妆品、药品、农业等领域。
3.1939年,tilden等首次发现软化芽孢杆菌(bacilus macerans)分泌的酶能将淀粉转化成环糊精。自然界中生产cgtase的微生物种类众多,有芽孢杆菌(bacillaceae)、放线菌(actinomycete)、微球菌(micrococcaceae)、短杆菌(brevibacterium flavum)、曲霉(aspergillus)、古细菌(archaea)等。现在工业上生产环糊精所使用的环糊精葡萄糖基转移酶多来自芽孢杆菌属。
4.环糊精葡萄糖基转移酶的性质随酶的来源而变化,来源不同,酶的性质差异也很大。由软化芽孢杆菌分泌的酶生成的环糊精以α-环糊精为主;巨大芽孢杆菌分泌的酶生成β-环糊精较多;而枯草芽孢杆菌分泌的酶生成的则只有γ-环糊精。1986年takashikato等人报道了bacillus subtilis no.313只产γ-cgtase,但其γ-环糊精的产率只有5%。曹新志等对一株嗜碱芽孢杆菌1177菌株经紫外线和γ射线诱变处理后,筛选得到突变株7-l2,γ-cd相对淀粉的转化率为16%左右。李皎等分离到一株芽孢杆菌,证实其中γ-cgtase的产量比较高。王雁萍等利用离子注入的方法对产β-cgtase菌株02-5-71和bacillus sp.ha-1进行选育发酵条件研究,结果发现其产酶能力提高。
5.目前,常用于工业上生产环糊精葡萄糖基转移酶的菌种仅包括嗜热脂肪芽孢杆菌、嗜碱脂肪芽孢杆菌、软化芽孢杆菌等少数几种,产量普遍较低,而且所述菌株产的大部分环糊精葡萄糖基转移酶催化淀粉生成的环糊精种类较杂,专一性较差。因此,现在急需开发一种产量高且转化效率高的环糊精葡萄糖基转移酶生产菌株,有利于促进该酶在工业上的广泛应用。
技术实现要素:
6.本发明为解决现有技术问题,提供了一株高产环糊精葡萄糖基转移酶的毕赤酵母菌株及其应用。申请人首先将环糊精葡萄糖基转移酶基因在毕赤酵母宿主中过表达,构建得到重组菌株,然后通过紫外诱变的方法进一步筛选获得一株环糊精葡萄糖基转移酶基因
产量得到大幅提升的突变菌株,有利于降低该酶的生产成本,应用前景广泛。
7.本发明一方面涉及一种毕赤酵母工程菌株,其携带有表达环糊精葡萄糖基转移酶的表达载体。
8.所述环糊精葡萄糖基转移酶的氨基酸序列为seq id no:1,其编码核苷酸序列为seq id no:2。
9.本发明另一方面涉及一种毕赤酵母突变菌株,是以上述毕赤酵母工程菌为出发菌,通过紫外诱变获得的。
10.所述突变菌株命名为巴斯德毕赤酵母cgt-2(pichia pastoris cgt-2),已于2020 年3月17日保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏地址为北京 市朝阳区北辰西路1号院3号中国科学院微生物研究所,保藏编号为cgmcc no.19484。
11.本发明还涉及上述毕赤酵母菌株在环糊精葡萄糖基转移酶生产中的应用。
12.本发明通过紫外诱变方法筛选获得的突变菌株毕赤酵母cgt-2,能大幅度提高环糊精葡萄糖基转移酶的表达量,10l罐发酵160h后,环糊精葡萄糖基转移酶酶活达到60.4u/ml,较出发菌提高了91.7%,取得了意料不到的技术效果。所述毕赤酵母菌株可广泛应用于环糊精葡萄糖基转移酶的生产,从而有利于降低环糊精葡萄糖基转移酶的生产成本,促进其在甜菊糖加工领域中的推广与应用。
附图说明
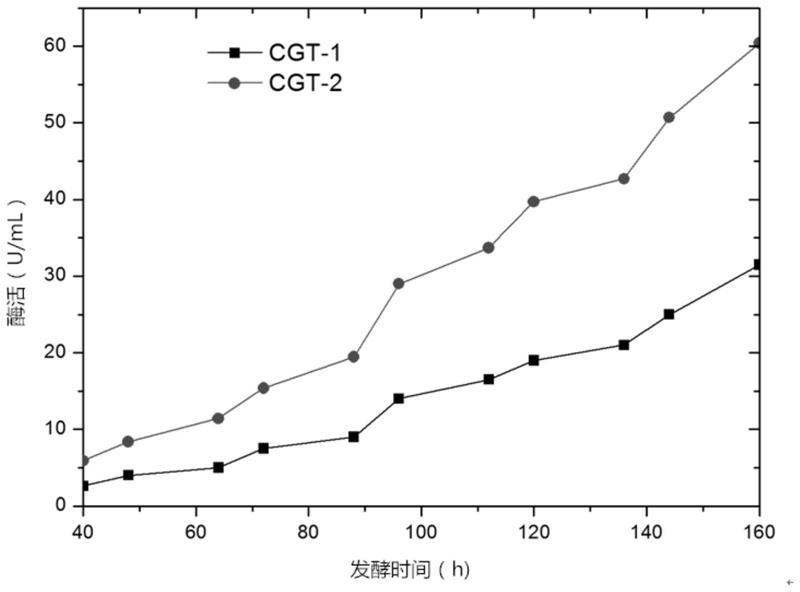
13.图1为发酵酶活曲线。
具体实施方式
14.本发明用到了遗传工程和分子生物学领域使用的常规技术和方法,例如molecular cloning: a laboratory manual, 3nd ed. (sambrook, 2001)和current protocols in molecular biology (ausubel, 2003)中所记载的方法。这些一般性参考文献提供了本领域技术人员已知的定义和方法。但是,本领域的技术人员可以在本发明所记载的技术方案的基础上,采用本领域其它常规的方法、实验方案和试剂,而不限于本发明具体实施例的限定。
15.培养基配方:大肠杆菌培养基(lb培养基):0.5%酵母提取物,1%蛋白胨,1%nacl,ph7.0);酵母培养基(ypd培养基):1%酵母提取物、2%蛋白胨2%葡萄糖;酵母筛选培养基(md培养基):2%蛋白胨、2%琼脂糖;bmgy培养基:2%蛋白胨,1%酵母提取物,100 mm磷酸钾缓冲液(ph6.0),1.34% ynb,4
×
10-5
生物素,1%甘油;bmmy培养基:2%蛋白胨,1%酵母提取物,100 mm磷酸钾缓冲液(ph6.0),1.34% ynb,4
×
10-5
生物素,0.5%甲醇;lb-amp培养基:0.5%酵母提取物,1%蛋白胨,1%nacl,100μg/ml氨苄青霉素,ph7.0;lb-amp平板:0.5%酵母提取物,1%蛋白胨,1%nacl,1.5%琼脂,100μg/ml氨苄青霉素,ph7.0;下面结合具体实施方式对本发明进行详细描述。
16.实施例1 环糊精葡萄糖基转移酶基因的克隆及重组载体构建申请人将来源于高温厌氧杆菌属(thermoanaerobacter sp.)的环糊精葡萄糖基转移酶基因,命名为cgt,其编码的氨基酸序列为seq id no:1,其核苷酸序列为seq id no:2。利用引物1和引物2扩增出环糊精葡萄糖基转移酶基因片段,引物两端引入ecori、noti位点。引物序列如下:引物1(f):gtagaattcgctccagatacttctgtttct引物2(r):gacgcggccgcttatggctgccaatcaacaatpcr反应条件为:94℃变性5min;然后94℃变性30s,58℃复性30s,72℃延伸120s,30个循环后,72℃保温10min。琼脂糖凝胶电泳结果显示,环糊精葡萄糖基转移酶基因为大小2052bp的片段。
17.将上述获得的环糊精葡萄糖基转移酶基因片段与表达载体ppic9k分别进行限制性内切酶ecori、noti双酶切,酶切条件如下:pcr片段酶切体系(50ul)质粒ppic9k酶切体系(50ul)pcr片段 20ulppic9k质粒 20ul10*buffer 5ul10*buffer 5ulecori 3ulecori 3ulnoti 3ulnoti 3ulddh2o 19ulddh2o 19ul37℃水浴酶切处理2h,电泳后分别回收两个目的片段,溶于20 ul ddh2o。用t4 dna连接酶进行连接,连接体系如下:pcr片段2ulppic9k2ul10*buffer1ult4dnaligase1ulddh2o4ul总体积10ul22℃连接1h,转化大肠杆菌dh5a感受态,涂布lb+amp平板,37℃培养过夜后长出单菌落,菌落pcr验证连接正确的转化子提取质粒送测序,测序正确后,即得到含有环糊精葡萄糖基转移酶基因的重组载体ppic9k-cgt。
18.实施例2 环糊精葡萄糖基转移酶的重组表达重组酵母表达质粒ppic9k-cgt用sal i进行线性化,表达质粒线性化片段通过电穿孔法转化毕赤酵母gs115,在md平板上筛选得到毕赤酵母重组菌株gs115/ ppic9k-cgt,再在含不同浓度遗传霉素的ypd平板上筛选多拷贝的转化子。
19.分别挑取单个转化子转接于bmgy培养基中,30℃、250rpm振荡培养1 d后,再转入bmmy培养基中30℃、250rpm振荡培养,每天添加0.5%的甲醇。诱导表达4 d后,离心去除菌体,得发酵上清液。采用下述方法分别测定各转化子发酵上清液中环糊精葡萄糖基转移酶的活力。结果显示,所述转化子中发酵酶活最高的达到3.6u/ml,申请人将该转化子命名为毕赤酵母cgt-1(pichia pastoris cgt-1)。
20.(1)环糊精葡萄糖基转移酶酶活单位的定义
bmgy液体培养基的96孔板,30℃ 250rpm振荡培养1 d后,离心去掉上层培养基,再加入200ul bmmy培养基,30℃ 250rpm振荡培养2 d,每天添加0.5%的甲醇。诱导表达2 d后,离心去除菌体,得到发酵上清液,测定上清液中环糊精葡萄糖基转移酶的酶活,以出发菌作为对照,筛选出发酵酶活力得到显著提高的突变菌株。
30.结果显示,第一轮紫外诱变筛选获得的502株突变菌中,没有一株突变菌发酵上清液中环糊精葡萄糖基转移酶酶活高于出发菌。其中,492株突变菌的酶活与出发菌基本相当,其余10株突变菌的酶活甚至低于比出发菌。
31.申请人按照上述方法继续进行了21轮诱变筛选,最终获得一株环糊精葡萄糖基转移酶产量显著高于出发菌的突变菌株,命名为毕赤酵母cgt-2(pichia pastoris cgt-2)。该突变菌株摇瓶发酵上清液中环糊精葡萄糖基转移酶酶活力达到7.2 u/ml,比出发菌提高了100%,取得了意料不到的技术效果。
32.实施例4 发酵放大在10l发酵罐上分别进行毕赤酵母cgt-1和突变菌毕赤酵母cgt-2的发酵,发酵使用的培养基配方为:硫酸钙1.1 g/l、磷酸二氢钾5.5 g/l、磷酸二氢铵55 g/l、硫酸钾20.3 g/l、硫酸镁16.4 g/l、氢氧化钾1.65 g/l、消泡剂0.05%。
33.发酵生产工艺:ph值5.0、温度25℃、搅拌速率300rpm、通风量1.0-1.5(v/v)、溶氧控制在20%以上。
34.整个发酵过程分为三个阶段:第一阶段为菌体培养阶段,按7%比例接入种子,30℃培养24-26 h,以补完葡萄糖为标志;第二阶段为饥饿阶段,当葡萄糖补完之后,不流加任何碳源,当溶氧上升至80%以上表明该阶段结束,为期约30-60 min;第三阶段为诱导表达阶段,流加甲醇诱导,并且保持溶氧在20%以上,培养时间在160 h左右。发酵结束后,发酵液通过板框过滤机处理后获得粗酶液。
35.通过测定不同时间发酵液中环糊精葡萄糖基转移酶活力,可得发酵进程曲线(图1)。
36.发酵结果显示,出发菌毕赤酵母cgt-1最终的发酵酶活为31.5 u/ml,而突变菌毕赤酵母cgt-2最终的发酵酶活为60.4u/ml,比出发菌提高了91.7%,取得了意料不到的技术效果。
37.申请人已于2020年3月17日将所述突变菌株毕赤酵母cgt-2(pichia pastoris cgt-2)保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏地址为北京市朝阳区北辰西路1号院3号中国科学院微生物研究所,保藏编号为cgmcc no. 19484。
38.实施例5 环糊精葡萄糖基转移酶在甜菊糖加工领域中的应用1、称取莱鲍迪苷(纯度97%)20g,β-环糊精20g,加入纯化水200ml,进行充分溶解;2、调节ph5.0-6.0;3、加入实施例4所述突变菌毕赤酵母cgt-2发酵粗酶液200ul,充分混合均匀;4、50℃水浴锅中反应48h,转速调节为180rpm;5、分离、提纯,得到单一的转化产物α-葡萄糖基-甜菊糖苷产品。
39.经国标法检测,α-葡萄糖基-甜菊糖苷的转化率高达98.5%,从而说明本发明所述环糊精葡萄糖基转移酶能有效提高甜菊糖苷的转化效率,大大改善甜菊糖类甜味剂的品质,市场前景广阔。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1