一种山药多糖、其制备方法及其用途与流程
本发明涉及山药多糖,具体涉及了一种从山药(dioscoreaoppositathunb.)当中提取得到的山药多糖dop0.2-s-3、其制备方法,以及其在制备预防和/或治疗肠道菌群紊乱的药物或保健品中的用途。
背景技术:
肠道菌群的稳态和多样性与宿主细胞增殖、神经信号通路等有密切的关系。在成人体内,肠道微生物群形成一个明显的核心微生物群,以此降低内部与外部环境变化产生的影响,维持身体的平衡。然而,在人体的衰老进程中,运动减少、营养改变、药物以及居住状态的变化均会影响微生物及其代谢产物,带来生理以及免疫的变化。
山药(rhizomadioscoreae)是薯蓣科植物薯蓣(dioscoreaoppositathunb.)的干燥根茎,是一种药食两用的中药。据《本草纲目》记载,山药性甘、温、平、无毒,主治脾胃虚弱、湿热虚泄、肿毒初起等症状。山药中含皂苷、胆碱、淀粉、氨基酸等化学成分。
技术实现要素:
本发明用一种简单有效的提取和纯化植物多糖的工艺和方法,以河北产地的山药为原料获得了一种混合多糖组分,并进一步进行了纯化获得了均一的多糖dop0.2-s-3。通过体内实验证明,该多糖可以缓解复合抗生素(克林霉素,氨苄青霉素,头孢曲松钠,万古霉素)造成的急性腹泻症状。因此该多糖具有潜在的治疗急性腹泻,调节肠道紊乱的效果,有望开发成为一种治疗肠道紊乱疾病的糖类药物。
本发明提供了一种山药多糖dop0.2-s-3,其是一种1,4-α-半乳糖醛酸聚糖,具有如下结构:
[→4)-α-d-galap(1→4)-α-d-galap(1→]n
其重均分子量范围为1-65kda。
本发明还提供了所述山药多糖dop0.2-s-3的制备方法,其包括如下步骤:
(1)多糖的提取:山药沸水提取,得到提取液,提取液浓缩后加入乙醇进行沉淀,收集沉淀得山药粗多糖dop;
(2)多糖的纯化:粗多糖dop经deaesepharosetmfastflow阴离子交换柱分离,收集0.2mnacl洗脱液的洗脱组分,得到山药次级粗多糖dop0.2,该次级粗多糖dop0.2再经过sephacryls-300hr凝胶柱进一步纯化,得到所述山药多糖dop0.2-s-3。
优选地,步骤(1)中,在进行沸水提取前,先用乙醇对山药药材浸泡3~10天(比如7天),然后风干;
优选地,步骤(1)中,沉淀所用乙醇为体积分数95%的乙醇;沉淀所用的乙醇体积为浓缩液的3~6倍(比如5倍);
优选地,步骤(1)中,在进行乙醇沉淀前,先对浓缩液进行离心,然后对离心上清液进行透析,透析时间优选为24~48h;
优选地,步骤(1)得到的粗多糖在进行步骤(2)的多糖纯化前进行洗涤,采用乙醇和丙酮交替洗,各洗涤2-4次;
优选地,步骤(1)中,在收集沉淀后或在将沉淀用乙醇和丙酮交替洗后对其进行干燥,例如冻干;
优选地,步骤(2)所述阴离子交换柱分离时依次使用去离子水、0.1m、0.2m的nacl溶液进行梯度洗脱,收集0.2mnacl洗脱液的洗脱组分;
优选地,步骤(2)所述sephacryls-300hr凝胶柱进一步纯化时,使用0.2mnacl洗脱液进行洗脱,收集得到的洗脱组分为山药多糖dop0.2-s-3。
本发明对所得到的山药多糖dop0.2-s-3的鉴定,包括进行纯度及分子量的测定,然后采用糖组成的测定及核磁共振等方法对其结构特征进行分析。
本发明还提供了一种药物组合物,其包含所述山药多糖dop0.2-s-3,以及药学上可接受的辅料。
本发明还提供了所述山药多糖dop0.2-s-3或所述药物组合物在制备预防和/或治疗肠道菌群紊乱的药物或保健品中的用途。所述肠道菌群紊乱包括,例如急性腹泻。所述急性腹泻例如为复合抗生素(克林霉素,氨苄青霉素,头孢曲松钠,万古霉素)造成的急性腹泻。
附图说明
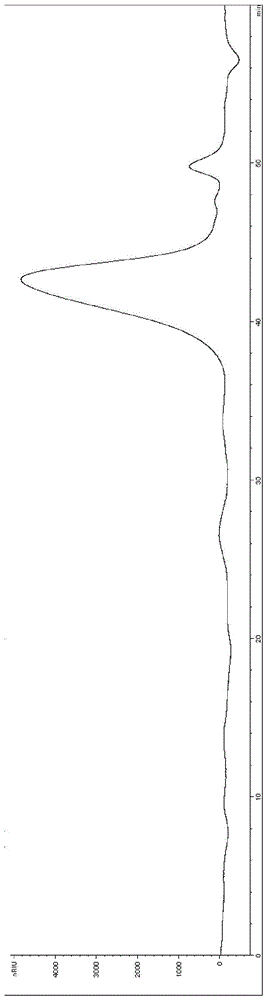
图1为制备实施例1中制得的山药多糖dop0.2-s-3高效液相色谱的纯度图。
图2为制备实施例1中制得的山药多糖dop0.2-s-3的1hnmr(a)和13cnmr图谱(b)。
图3为制备实施例1中制得的山药多糖dop0.2-s-3对抗生素造成小鼠急性腹泻模型中小鼠体重的影响折线图。
图4为制备实施例1中制得的山药多糖dop0.2-s-3对抗生素造成小鼠急性腹泻模型中小鼠排便次数散点图,其中a为第7天计数结果,b为第14天计数结果。
图5为制备实施例1中制得的山药多糖dop0.2-s-3对抗生素造成小鼠急性腹泻模型中小鼠粪便含水量柱状图,其中a为第7天检测结果,b为第14天检测结果。
具体实施方式
制备实施例1山药多糖组分dop0.2-s-3的提取分离纯化和结构表征
(1)多糖的提取分离
将山药多糖用沸水提取法进行多次提取,硫酸-苯酚法检测提取液的糖含量,直至糖反应不明显。合并提取液,浓缩至小体积后,离心去沉淀。将上清液用对流水透析两天。透析内液用体积分数95%的乙醇以提取液与乙醇的体积比为1:3(v/v)进行醇沉,静置过夜。弃掉上层多余乙醇,沉淀离心后将沉淀用乙醇和丙酮交替洗三次,干燥后得山药水提粗多糖dop(4.4%)。
(2)多糖的纯化
每次取7.3g粗多糖溶解于80ml去离子水中,搅拌过夜,离心取上清上样于deaesepharosetmfastflow阴离子交换柱,用去离子水和不同浓度的nacl溶液(0.1m、0.2m)进行梯度洗脱,流速控制在13ml/15min,用自动收集仪收集。每管取100μl用硫酸-苯酚法显色并用酶标仪在490nm下检测其吸光度,用吸光度和洗脱体积绘制洗脱曲线。根据洗脱曲线收集分离的多糖进行减压浓缩、透析、冷冻干燥,最后得到0.2mnacl洗脱液的洗脱组分,干燥后得到次级粗多糖dop0.2(261mg)。
每次将85mg的次级粗多糖dop0.2溶于3ml去离子水中,离心(4,000r/min)取上清上样于sephacryls-300hr凝胶柱,经0.2mnacl洗脱液洗脱,流速控制在5ml/15min,自动收集仪收集。经过硫酸苯酚法显色、酶标仪检测吸光度并绘制洗脱曲线,收集所需的分离组分进行浓缩透析,最后冷冻干燥得到该均一的山药多糖dop0.2-s-3(21mg,24.7%)。
(3)多糖的结构鉴定
多糖dop0.2-s-3在串联ultrahydrogeltm2000(7.8mm×300mm,排阻极限5×104-10×106da)和ultrahydrogeltm500(7.8mm×300mm,排阻极限1×104-4×105da)分析凝胶柱上的特征图谱如图1所示,其色谱条件为:流动相:0.1mnano3;流速:0.5ml/min;柱温:25℃;agilent1260液相色谱仪;检测器:示差检测器和紫外检测器。样品的重均分子量根据多糖标准曲线来计算:取已知分子量的标准品葡聚糖系列(180da,667da,6,000da,11,300da,21,700da,48,800da,113,000da,210,000da,393,000da,805,000da)分别溶于流动相,配置成浓度为2mg/ml溶液,离心,取上清液,自动进样分析。由gpc专用软件绘制标准曲线。
取山药多糖组分样品dop0.2-s-335mg,加d2o0.5ml溶解,加2.5μl丙酮为内标(δh=2.29ppm,δc=31.5ppm),于brukeravanceiii500m核磁共振仪上,25℃分别测定一维核磁共振谱,结果如图2所示。图2的a表示多糖的1hnmr图谱,半乳糖醛酸聚糖中h1-h5的化学位移分别为5.13ppm,3.82/3.84ppm,4.05/4.07ppm,4.48ppm和4.83ppm。图2的b表示多糖的13cnmr图谱,c1-c6的化学位移分别为100.24ppm,69.34ppm,70.04ppm,79.14ppm,72.49ppm和176.55ppm。所述的多糖dop0.2-s-3具体结构为:
[→4)-α-d-galap(1→4)-α-d-galap(1→]n
经高效凝胶渗透色谱法(hpgpc)测定山药多糖组分样品dop0.2-s-3的重量平均相对分子质量为14kda。
测试实施例1山药多糖组分dop0.2-s-3的调节肠道菌群生长的活性
(1)抗生素诱导的急性腹泻模型检测山药多糖组分dop0.2-s-3对动物体重的影响
此次动物实验遵行实验动物管理和使用指南,获得中国科学院上海药物研究所动物伦理委员会批准,iacuc审批号2019-02-dk-74。
从上海灵畅生物科技有限公司购得四周龄雄性c57bl/6小鼠20只。动物随机分为三组,对照组6只,模型组6只,实验组8只,每4-6只一牢饲养,鼠牢可以自由获取无菌饮水和食物。在温度(25℃±2℃)恒定,光照循环(12小时光照,12小时黑暗)环境中饲养,适应环境饲养一周后开始实验。
模型组和实验组饮水中加入浓度为500ug/ml的混合抗生素(克林霉素:氨苄青霉素:头孢曲松钠:万古霉素=3:1:1:1),持续一周。一周后更换为无菌饮水,持续一周。从实验第一天起给与实验组动物30mg/kgdop0.2-s-3多糖每天一次,持续十四天,每次0.2ml,模型组和对照组给予等体积生理盐水。每周检测动物体重三次。
结果如图3所示,抗生素处理四天后模型组(15.98±0.22)动物体重显著低于对照组(18.78±0.35,***p<0.001)和实验组(18.41±0.33,***p<0.001)。动物实验结束时,与对照组(22.56±0.34)相比,模型组(20.08±0.17,***p<0.001),实验组(21.13±0.35,*p<0.05)体重均显著下降,但实验组体重高于模型组(p=0.0504),说明多糖dop0.2-s-3可以减轻抗生素诱导的急性腹泻症状。
(2)排便次数计数检测dop0.2-s-3对排便次数的影响
用无菌透明鼠牢将每只动物单独放置,统计每只动物五分钟和十分钟之内的排便次数,在第七天和第十四天进行计数。结果如图4所示。
从图4的a中可以看出,第七天时与对照组(2.83±0.17,4.83±0.31)相比,模型组的排便次数在五分钟(5.5±0.5,**p<0.01)和十分钟(9.0±0.61,***p<0.001)内显著增高,与模型组相比,实验组的排便次数在五分钟(2.87±0.44,**p<0.01)和十分钟(4.62±0.50,***p<0.001)内显著下降,对照组与实验组间无显著差异。从图4的b中可以看出,第十四天时与对照组(0.40±0.40,3.4±0.92)相比,模型组的排便次数在五分钟(4.00±0.26,***p<0.001)和十分钟(7.33±0.42,**p<0.01)内显著增高,与模型组相比,实验组的排便次数在五分钟(2.25±0.41,**p<0.01)和十分钟(4.00±0.46,**p<0.01)内显著下降,对照组与实验组间十分钟内排便次数无差异。说明多糖dop0.2-s-3可以降低抗生素诱导的急性腹泻造成的排便次数增加。
(3)粪便含水量检测动物粪便中的含水量
用无菌透明鼠牢将每只动物单独放置,收集十分钟内动物的全部粪便,在第七天和第十四天进行检测。称量新鲜粪便重量后,放置于100℃烘箱中烘干24小时,称量粪便干重。计算公式如下:粪便含水量(%)=(新鲜粪便重量-粪便干重)/新鲜粪便重量。实验结果如图5所示。
从图5的a可以看出,在第七天时与对照组(59.86±1.61)相比,模型组(79.28±0.98,***p<0.001)的粪便含水量显著增高,与模型组相比,实验组(73.76±0.52,**p<0.01)给药后粪便含水量显著下降,从图5的b可以看出,在第十四天时与对照组(53.65±0.81)相比,模型组(67.80±0.90,***p<0.001)的粪便含水量显著增高,与模型组相比,实验组(58.76±1.11,***p<0.001)给药后粪便含水量显著下降。说明多糖dop0.2-s-3可以降低抗生素诱导的急性腹泻模型中动物粪便中的含水量。
综上,通过测试实施例可知,山药多糖组分dop0.2-s-3能够降低抗生素诱导的急性腹泻症状,包括维持动物的体重,减少动物排便次数,降低动物粪便中的含水量。该多糖组分dop0.2-s-3可成为治疗急性腹泻,调节肠道菌群紊乱的潜在糖类药物。
- 还没有人留言评论。精彩留言会获得点赞!