一种4,6-α-葡萄糖基转移酶及其在抗性糊精生产中的应用的制作方法
本发明涉及一种4,6-α-葡萄糖基转移酶及其在抗性糊精生产中的应用,属于基因工程技术领域。
背景技术:
近年来,随着社会的发展,人类生活环境发生了很大的变化,如生活节奏加快、饮食结构改变、社会竞争激烈、环境污染等。这些变化时刻威胁着人们的健康,使得大多数人处于亚健康状态。为了顺应现代食品科技发展的方向并满足消费者的健康需求,低血糖、低热量的功能性碳水化合物已成为21世纪健康食品的发展潮流。
抗性糊精是包含α-1,4、α-1,6、α-1,3、α-1,2键,分子量为1-5kda的葡萄糖聚合物,因为富含慢消化的α-1,6键及抗消化的α-1,3、α-1,2键,所以抗性糊精不易被人体内消化酶分解,不易被小肠消化吸收,能够进入大肠被益生菌所利用促进其增殖;同时抗性糊精具有性质稳定、水溶性好、持水性高、饱腹感强等特点,因此作为一种优质膳食纤维在饮料、烘焙、乳制品等行业具有广泛的应用。
迄今为止,抗性糊精的工业化生产均采用高温酸解化学法,即淀粉在酸性高温条件下处理,但是高温酸解化学法生产抗性糊精存在能源消耗大、污染严重、原料利用率低、分离纯化工艺复杂、易产生糠醛类有害成分等问题,而酶转化法作为一种绿色节能高效安全的替代方法可显著降低抗性糊精生产成本、提高产品品质、满足大众消费需求,是推动抗性糊精产业可持续发展的原动力。
国内外研究者在前期研究中尝试使用葡聚糖分支酶(ec2.4.1.18)和α-葡萄糖苷酶(ec3.2.1.20)对淀粉进行改性,但由于作用底物的限制和产物的理化指标不能满足抗性糊精产品要求,所以目前还没有一种有效的方法用于酶法制备抗性糊精。2011年发现的gh70家族的新分支——4,6-α-葡萄糖基转移酶可利用淀粉或淀粉衍生物合成富含α-1,6键可溶性多糖,且具有作用底物谱较宽、形成的产物形式多样、抗性成分及产率均较高等优势。该家族酶的发现为抗性糊精的制备提供了新思路,使其酶法工业化生产成为可能。目前报道表征的4,6-α-葡萄糖基转移酶的产物分子量较大(7-27kda),较大的分子量一方面不符合抗性糊精的要求,另一方面降低了产品的可溶性,限制了其应用。
技术实现要素:
针对现有技术存在的缺点,本发明报道了一种4,6-α-葡萄糖基转移酶,采用该酶制备的产物富含α-1,6键,分子量在1000-4000da之间,并利用该酶的生化特性开发了一种工艺技术,可获得一系列符合抗性糊精理化指标的产品,该产品溶解性好、抗性含量达80%以上、产率达60%以上,其可能构成一种新型益生元,为维持和改善人类健康提供有力保障,本发明为酶法制备抗性糊精的工业化生产奠定坚实的理论基础。
本发明提供一种产4,6-α-葡萄糖基转移酶的重组菌,所述重组菌以枯草芽孢杆菌cctccno:m2016536为表达宿主;所述枯草芽孢杆菌cctccno:m2016536已公开于公开号为cn106754466a的专利中;所述4,6-α-葡萄糖基转移酶的氨基酸序列如seqidno.1所示。
在本发明的一种实施方式中,所述4,6-α-葡萄糖基转移酶的编码基因的核苷酸序列如seqidno.2所示。
在本发明的一种实施方式中,所述4,6-α-葡萄糖基转移酶来源于发酵乳杆菌(lactobacillusfermentum)。
本发明提供一种表达载体,所述载体以phy系列载体为出发载体,所述载体携带seqidno.2所示的核苷酸序列,或表达氨基酸序列如seqidno.1所示的4,6-α-葡萄糖基转移酶。
在本发明的一种实施方式中,所述phy系列载体为phy300plk。
本发明提供一种生产4,6-α-葡萄糖基转移酶的方法,是将所述重组菌接种至含有80~120μg/ml卡那霉素的lb中在35~39℃、200~220rpm,培养8~10h得到培养液,然后将培养液以培养基体积的5~10%的接种量接种到tb培养基中,先在35~39℃、200~220rpm,培养1.5~3h,当菌体达到一定浓度时,再进行摇瓶诱导发酵得到发酵液,发酵液经高压匀浆破碎后离心,上清即为4,6-α-葡萄糖基转移酶。
在本发明的一种实施方式中,所述菌体od600在0.5~1.0时进行摇瓶发酵。
在本发明的一种实施方式中,所述摇瓶发酵的条件为30~35℃、200~220rpm进行摇瓶诱导发酵45~50h。
本发明提供一种制备低分子量抗性糊精的方法,所述方法是以淀粉为底物,应用seqidno.1所示的4,6-α-葡萄糖基转移酶进行酶法转化。
在本发明的一种实施方式中,所述方法以淀粉或含有淀粉的物质为底物,先将底物进行高温糊化,再加α-淀粉酶液化5~40min,制得液化液。
在本发明的一种实施方式中,所述淀粉底物为玉米淀粉、小麦淀粉、大米淀粉、绿豆淀粉、豌豆淀粉等谷物淀粉或木薯淀粉、马铃薯淀粉、红薯淀粉等薯类淀粉、或麦芽糊精、糊精、可溶性淀粉等淀粉衍生物。
在本发明的一种实施方式中,所述含有淀粉的物质为大米蛋白肽。
在本发明的一种实施方式中,将淀粉加水调成10%~30%悬浊液后,将悬浊液开始进行糊化;在淀粉酶液化过程中控制液化液de值在3~25。
在本发明的一种实施方式中,控制液化液ph值在5.5~7.5和温度在30~45℃,向液化液中加入普鲁兰酶和4,6-α-葡萄糖基转移酶,在35~50℃反应22~28小时;所述4,6-α-葡萄糖基转移酶为2500~5000u/g底物,普鲁兰酶添加量为10~80u/g底物。
在本发明的一种实施方式中,调节温度至90~100℃,添加热稳定α-淀粉酶,反应25~35min;α-淀粉酶至酶的作用剂量不少于900u/g底物。
在本发明的一种实施方式中,调节温度至50~70℃,调节ph至4.0~5.0,加入淀粉葡萄糖苷酶,反应25~35min;反应后对产物进行纯化,去除体系中的葡萄糖和麦芽糖;所述淀粉葡萄糖苷酶至酶的作用剂量不少于600u/g底物。
在本发明的一种实施方式中,调节温度90~100℃,15~25min灭酶,降至室温,添加活性干酵母消化或通过色谱分离除去体系葡萄糖、麦芽糖等小分子糖。
本发明保护所述4,6-α-葡萄糖基转移酶,或核苷酸序列如seqidno.2所示的基因,或所述重组菌,或所述载体,或所述生产4,6-α-葡萄糖基转移酶的方法,或所述制备低分子量抗性糊精的方法在食品、保健品或化妆品领域中的应用。
在本发明的一种实施方式中,所述应用包括制备低分子量抗性糊精,和/或利用低聚糖,和/或生产含有α-1,6糖苷键的糊精。
在本发明的一种实施方式中,所述食品包含乳制品、婴幼儿配方食品、米面制品、肉制品、糖果、饮料。
在本发明的一种实施方式中,所述乳制品包含酸奶、奶酪、冰淇淋、植物蛋白乳制品。
在本发明的一种实施方式中,饮料包含运动饮料、低糖饮料、膳食纤维饮料、五谷杂粮饮料。
在本发明的一种实施方式中,所述米面制品包含烘焙制品、面条、米粉、方便面条、方便米饭。
在本发明的一种实施方式中,所述烘焙制品包含面包、西饼、蛋糕。
本发明的有益效果:本发明的一种酶促反应制备抗性糊精的方法和现有技术相比,具有以下特点:
(1)本发明所使用的4,6-α-葡萄糖基转移酶能够在不同de值范围内使用,可以有效利用底物;
(2)本发明利用酶法制备出一种低分子量抗性糊精,平均分子量为1000-4000da,平均聚合度为6~25,抗性含量在80%以上,产率在60%以上;
(3)相比于传统高温酸解法制备抗性糊精,本方法产率高,制备工艺简单,反应条件比较温和,清洁安全、无毒性产物生成;
(4)本发明制备得到的抗性糊精可作为食品添加剂,进入结肠,例如作为益生元能够被用于多种食品应用中,从乳制品到烘焙食品、糖果和饮料应用,可改善食品的质地和口感,便于在食品、保健品尤其是高端食品和保健品领域广泛应用。
(5)本发明的这种抗性糊精的添加将会降低代谢(例如淀粉代谢)速率,从而降低食品产品的升糖指数(gi)。因此,根据本发明所述的抗性糊精也能够有助于降低食品产品的热值和/或血糖负荷,有助于低gi饮食。在普通的以及特殊的代谢疾病中,包括糖尿病和肥胖症,这对于人类健康特别有利。
附图说明
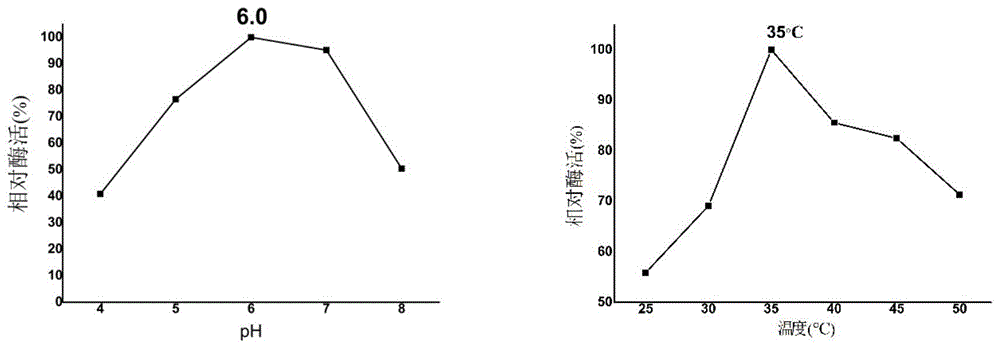
图1为4,6-α-葡萄糖基转移酶最适温度与最适ph。
图2为4,6-α-葡萄糖基转移酶底物特异性,m表示标品,纵向的g1~g7分别表示标准样品的葡萄糖以及麦芽二糖到麦芽七糖;横向的g1~g7分别表示葡萄糖以及麦芽二糖到麦芽七糖,s表示蔗糖,g2’表示异麦芽二糖、g3’表示异麦芽三糖、n表示黑曲霉二糖、p表示潘糖,pol表示多糖聚合物。
图3为4,6-α-葡萄糖基转移酶产物特异性;表示核磁共振一维氢谱1hnmr。
图4为4,6-α-葡萄糖基转移酶产物特异性;表示核磁共振一维碳谱13cnmr。
图5为4,6-α-葡萄糖基转移酶产物特异性;表示高效凝胶过滤色谱hpgfc。
图6为抗性糊精分子量分布;其中,a为3237da抗性糊精分子量分布,b为1543da抗性糊精分子量分布。
具体实施方式
下面结合具体实施方式对本发明的技术方案做进一步说明,但本发明所保护范围不局限于此。
实施例中所述的培养基配方如下:
lb培养基(g/l):蛋白胨10,酵母提取物5,nacl10。
tb培养基(g/l):蛋白胨10,酵母粉24,甘油5,k2hpo4·3h2o16.43,kh2po42.31。
rm培养基(g/l):酵母提取物5.0,胰蛋白胨10.0,nacl10.0,山梨醇90.0,甘露醇70.0。
实施例中所述的耐高温α-淀粉酶、淀粉葡萄糖苷酶、普鲁兰酶均购自山东隆科特酶制剂有限公司,酶活分别为40000u/ml、100000u/ml、2000u/ml。
胶回收试剂盒购自天根生化科技(北京)有限公司,质粒提取试剂盒购自天根生化科技(北京)有限公司。
干酵母粉为安琪酵母股份有限公司的活性干酵母,活菌数150亿每克。
实施例中所述的pepsinfromporcinegastricmucosa(3,200-4,500u/mg)、pancreatinfromporcinepancreas(8×uspspecification)均购自sigmaaldrich化学有限公司。
酶活测定:
用碘法测定实施例3中得到的gtfb总酶活:1g/l直链淀粉母液:40mg的直链淀粉加入2ml的蒸馏水充分润湿,加入2ml的2m的naoh溶液,漩涡振荡充分溶解;用时取500ul的直链淀粉母液加250ul的2m的hcl溶液,然后加入3250μl的磷酸-柠檬酸缓冲液(ph7.0)配成0.125%的底物。
鲁戈碘液:0.26g碘与2.60g碘化钾溶于10ml的容量瓶中(提前3天配制,确保碘完全溶解);用时取100μl的鲁戈碘液,加入50μl的2m的hcl溶液然后补水到26ml配成碘显色液。
反应时,取200ul的底物于1.5ml离心管中,35℃温浴10min。加入200μl的gtfb酶液35℃反应10min,反应结束后取200μl反应液加入到3800μl的碘显色液中显示5min,分光光度计测定660nm下的吸光度。对照用缓冲液代替酶液,空白取200μl的缓冲液加入到3800μl的碘显色液中显示5min。
一个相对酶活单位定义为,单位时间吸光值下降一个百分点为一个酶活单位。
酶活(u/ml)=[100×d(稀释倍数)×(a对照-a实验)]/[10min×0.1ml×(a对照-a空白)]。
薄层色谱(tlc)检测方法:在tlcsilicagel60f254,aluminiumsheets20×20cm上进行薄层色谱(tlc)分析,选择正丁醇:乙酸:水(2:1:1,v/v)的溶剂系统作为展开剂。将20-30μg的反应混合物和混合标样(g1-g7)分别点样在tlc板上,然后将板在展开剂中运行8-10h。当展开剂靠近tlc薄板顶部时取出自然干燥,重复此过程两次以完全分离g1-g7。喷上5%硫酸乙醇显色液,然后在95℃加热10-30分钟后观察斑点。
抗性糊精含量的测定方法:测定方法参照国标gb/t22224-2008《食品中膳食纤维的测定-酶重量法》,测定结果为质量占比,采用百分比表示,例如60g/l表示为60%。
抗性糊精的得率(%)=干燥后物质重量/反应前焦糊精重量×100。
抗性含量测定方法:抗性含量(%)=1-葡萄糖%-麦芽糖%。
实施例1:重组质粒phy300plk-gtfb的构建
化学合成核苷酸序列如seqidno.2所示的目的基因4,6-α-葡萄糖基转移酶基因(gtfb)片段,构建重组质粒phy300plk-gtfb。具体步骤如下:
pcr引物:d-f和d-r,下划线处分别为限制性酶ndeⅰ酶和bamhⅰ酶的酶切位点。
d-f:catatgcaggccaacgatggtcat,seqidno.3;
d-r:ggatccttaatcatcttcaatatttgcataa,seqidno.4。
pcr体系为:20um引物d-f和d-r各0.5μl,dntpmix4μl,5×psbuffer10μl,2.5u/μl的primestar聚合酶0.5μl,模板0.5μl,加双蒸水补齐50μl。
pcr条件:94℃预变性4min;98℃变性10s,55℃退火10s,72℃延伸3.5min,30个循环。
将pcr产物进行胶回收,利用rtaq酶在产物3’端添加一个碱基a,纯化后与克隆载体pmd18t利用dna连接酶于16℃连接过夜,得到酶连产物,将酶连产物转化e.colijm109,涂布在含有氨苄(100μg/ml)抗性的lb平板,37℃培养10-12h,挑取转化子,提取重组质粒并双酶切验证,然后对验证正确的重组质粒测定dna序列,得到阳性克隆子即pmd18t-gtfb-jm109。
利用ndeⅰ酶和bamhⅰ酶对质粒pmd18t-gtfb进行酶切并回收目的基因片段gtfb,同时对表达载体phy300plk进行双酶切并回收酶切产物;将目的基因片段gtfb与酶切后的表达载体phy300plk用t4连接酶于16℃连接过夜,转化e.colijm109,涂布含有卡那霉素(100μg/ml)抗性的lb平板,37℃培养10-12h,挑取转化子,提取重组质粒并双酶切验证,然后对验证正确的重组质粒测定dna序列,阳性克隆子即phy300plk-gtfb。
酶连产物转化e.colijm109具体步骤:
(1)吸取10μl酶连产物转入100μljm109感受态;
(2)冰浴15-20min;
(3)42℃水浴热激90s,取出后迅速放入冰中静置冰浴3-5min;
(4)加入800μl无抗性lb培养基混匀,于37℃,200rpm培养1-2h;
(5)5000rpm离心2min收菌;
(6)移去上清,剩余100-200μl吹吸混匀涂布至添加卡那霉素(100μg/ml)抗性的lb平板。
实施例2:重组质粒phy300plk-gtfb的枯草芽孢杆菌转化
(1)将提前制备好的枯草芽孢杆菌感受态放在冰上5min,向其中加入10μl重组质粒phy300plk-gtfb,轻柔吹吸均匀后,置于冰上放置15min。
(2)电转仪提前打开预热30min,电击电压设置为2400v,将冰浴结束的感受态缓慢加入到提取预冷的直径为2mm规格的电击杯中,将电击杯外壁的水擦干净后,将电击杯放到转化仪中电击。
(3)电击结束后将快速向其中加入1ml提前预冷好的rm培养基,吹吸均匀后将菌液转移到1.5ml的灭菌的ep管中,置于37℃摇床中,200rpm震荡培养3h。
(4)培养结束的菌液3000rpm离心5min,弃部分上清液,留200μl左右的上清液将菌体重新吹吸重悬,涂布到含四环素抗性的lb固体平板上,37℃培养箱培养10h左右,等待平板长出单菌落。
(5)挑选单菌落至含卡那霉素(100μg/ml)抗性的10ml液体lb培养基中,37℃培养8h,保存甘油管,贮存于-80℃冰箱。测序验证正确的阳性转化子即为含质粒phy300plk-gtfb的基因工程菌枯草芽孢杆菌。
实施例3:摇瓶发酵产酶
将实施例2中得到的重组枯草芽孢杆菌接种于lb培养基中,在37℃下培养8h后,以发酵培养基体积5%的接种量转接至50mltb发酵培养基中,先放至37℃、200rpm恒温培养1-2h,在菌体od600为0.5~0.7时添加0.4μm浓度的iptg并转至33℃、200rpm诱导发酵48h。发酵结束后,将发酵液经高压匀浆破碎(破碎条件为4℃,80mpa)后离心(10000rpm、20min、4℃),上清即为重组枯草芽孢杆菌所产的4,6-α-葡萄糖基转移酶酶液。
测定酶液酶活,经测定,4,6-α-葡萄糖基转移酶酶活为2031u/ml。
最适ph和最适温度测定:在37℃下测定gtfb最适ph,范围从ph4.0-10.0,其中ph4.0-8.0选择磷酸-柠檬酸缓冲液,ph8.0-9.0选择tris-hcl缓冲液,ph9.0-10.0选择gla-naoh缓冲液;最适温度在ph7.0下测定,范围25℃-50℃。
在上述条件下,测得gtfb酶最适ph为6.0,最适温度分别为35℃(见图1)。
实施例4:4,6-α-葡萄糖基转移酶在利用低聚糖或生产α-1,6键中的应用
1、4,6-α-葡萄糖基转移酶对低聚糖的利用
用25mm蔗糖、黑曲霉二糖、潘糖、异麦芽糖、异麦芽三糖、葡萄糖和具有不同聚合度(g2-g7)的麦芽低聚糖单独温育发酵乳杆菌(lactobacillusfermentum)纯化的ctfb酶。所有反应均在ph7.0的磷酸-柠檬酸缓冲液中进行(含1mmcacl2)。在37℃下进行10小时后将样品加热至100℃并反应10min。最后用薄层色谱(tlc)检测反应的进行情况。
在上述条件下检测到gtfb不能利用单独的异麦芽二糖、异麦芽三糖、蔗糖、黑曲霉二糖、潘糖、葡萄糖、麦芽二糖底物,当底物聚合度为麦芽三糖及以上时,gtfb能够进行转苷/歧化反应(见图2)。
2、4,6-α-葡萄糖基转移酶生产α-1,6键
将过量(220-300个酶活单位)的gtfb与10ml的直链淀粉(6mg/ml)在ph7.0下37℃下温浴24h,煮沸10min灭酶,离心(12000rpm,15min)取上清冷冻干燥即得酶转化产物。
(1)产物分子量测定
采用高效凝胶过滤色谱法(hpgfc)来确定产物的分子量。使用配备有2414示差折光检测器的waters1525高性能液相色谱系统进行hpgfc分析,并用empower3工作站记录和处理色谱数据。使用ultrahydrogeltmlinear(300mm×7.8mm,内径×2)凝胶过滤柱进行分离,柱温为45℃,以0.9ml/min的流速注入50μl的样品,0.1mnano3作为流动相。从
在上述条件下检测到gtfb产物的平均分子量为3116da(见图3)。
(2)nmr光谱分析
将40mg发酵乳杆菌gtfb产物与500μld2o(99.9原子%d)混合,超声处理5分钟以完全溶解样品。在avanceiii400mhz数字nmr光谱仪(brukerbiospininternationalag)上记录样品的一维1h和13c核磁共振(nmr)光谱,温度为60℃。将三甲基甲硅烷基丙酸(tmsp0.03%溶解在样品中作为内标,以校准化学位移(δ)并通过在δ5.36和δ4.97处的信号峰面积的积分来估计α-1,4和α-1,6糖苷键的百分比)。
在上述条件下检测到gtfb产物的α-1,4和α-1,6键的百分比为24%:76%(如图3)。
实施例5:4,6-α-葡萄糖基转移酶在低分子量抗性糊精制备中的应用
包括如下步骤:
(1)以淀粉为底物,将淀粉加水调成20%的悬浊液,升温至60-80℃糊化,加α-淀粉酶液化10-30min,控制de值为3-7;
(2)冷却至30-45℃,调节ph值6.5-7.0,同时添加普鲁兰酶30u/g底物和4,6-α-葡萄糖基转移酶3500u/g底物,放入恒温式水浴摇床,37℃反应24h;
(3)升温至95℃灭酶,加入热稳定α-淀粉酶至酶的作用剂量不少于1000u/g底物,置于95℃水浴中持续振荡,反应30min;
(4)将反应物取出冷却至室温,调ph至4.2-4.8,加淀粉葡萄糖苷酶至酶的作用剂量不少于660u/g底物,置于60℃水浴摇床中持续振荡,反应30min;
(5)反应结束后95℃,20min灭酶,加入食品级干酵母粉20g/l进行消化,放入酵母摇床中,30℃、200rpm反应12h,以对产物进行纯化,去除体系中的葡萄糖和麦芽糖;
(6)将反应产物8000rpm离心20min取上清,0.45μm滤膜过滤后喷雾干燥,最终得到淡黄色粉末成品。
测定所得的低分子量抗性糊精产率为75.32%,经酵母消化后,抗性含量为95%,α-1,6键含量为89.02%,平均分子量约3237da(如图4),约20个聚合度葡萄糖。
实施例6:4,6-α-葡萄糖基转移酶在低分子量抗性糊精制备中的应用
包括如下步骤:
(1)将淀粉加水调成20%的悬浊液,升温至60-80℃糊化,加α-淀粉酶液化10-30min,控制de值为8-13;
(2)冷却至30-45℃,调节ph值6.5-7.0,同时添加普鲁兰酶30u/g底物和4,6-α-葡萄糖基转移酶3500u/g底物,放入恒温式水浴摇床,37℃反应24h;
(3)升温至95℃灭酶,加入热稳定α-淀粉酶至酶的作用剂量不少于1000u/g底物,置于95℃水浴中持续振荡,反应30min;
(4)将反应物取出冷却至室温,调ph至4.2-4.8,加淀粉葡萄糖苷酶至酶的作用剂量不少于660u/g底物,置于60℃水浴摇床中持续振荡,反应30min;
(5)反应结束后95℃,20min灭酶,加入食品级干酵母粉30g/l进行消化,放入酵母摇床中,30℃、200rpm反应18h,以对产物进行纯化,去除体系中的葡萄糖和麦芽糖;
(6)将反应产物8000rpm离心20min取上清,0.45μm滤膜过滤后喷雾干燥,最终得到淡黄色粉末成品。
测定所得的低分子量抗性糊精产率为69.82%,经酵母消化后,抗性含量为92.3%,α-1,6键含量为85.42%,平均分子量约2417da,约15个聚合度葡萄糖。
实施例7:4,6-α-葡萄糖基转移酶在低分子量抗性糊精制备中的应用
包括如下步骤:
(1)将淀粉加水调成20%的悬浊液,升温至60-80℃糊化,加α-淀粉酶液化10-30min,控制de值为15-20;
(2)冷却至30-45℃,调节ph值6.5-7.0,同时添加普鲁兰酶30u/g底物和4,6-α-葡萄糖基转移酶3500u/g底物,放入恒温式水浴摇床,37℃反应24h;
(3)升温至95℃灭酶,加入热稳定α-淀粉酶至酶的作用剂量不少于1000u/g底物,置于95℃水浴中持续振荡,反应30min;
(4)将反应物取出冷却至室温,调ph至4.2-4.8,加淀粉葡萄糖苷酶至酶的作用剂量不少于660u/g底物,置于60℃水浴摇床中持续振荡,反应30min;
(5)反应结束后95℃,20min灭酶,加入食品级干酵母粉50g/l进行消化,放入酵母摇床中,30℃、200rpm反应20h,以对产物进行纯化,去除体系中的葡萄糖和麦芽糖;
(6)将反应产物8000rpm离心20min取上清,0.45μm滤膜过滤后喷雾干燥,最终得到淡黄色粉末成品。
测定所得的低分子量抗性糊精产率为60.02%,经酵母消化后,抗性含量为87.2%,α-1,6键含量为78.35%,平均分子量约1543da(如图4),约9~10个聚合度葡萄糖。
实施例8:低分子量抗性糊精的抗消化实验
包括如下步骤:
(1)将获得的抗性糊精产品配制成溶液,浓度为5g/l;
(2)称取nacl775mg,kcl275mg,cacl2·2h2o37.5mg,nahco3150mg,溶于去离子水中,定容至250ml,配制成gastricelectrolytesolution(ges)溶液;
(3)取上述配制好的ges溶液150ml,加入gastriclipase37.5mg,pepsinfromporcinegastricmucosa35.4mg,ph5.0的1mch3coona溶液1.5ml,磁力搅拌器搅拌10min,hcl调ph至3.0,配制成simulatedgastricmedium(sgm)溶液;
(4)取20ml抗性糊精溶液与20mlsgm溶液混合均匀,37℃,120rpm水浴反应,分别在0、2、4、6h取样,100℃10min灭酶后检测抗性糊精在模拟胃液中的消化情况;
(5)称取nacl1.35g,kcl162.5mg,cacl2·2h2o82.5mg,溶于去离子水中,定容至250ml,用1mnahco3调ph至7.0,配制成intestinalelectrolytesolution(ies)溶液;
(6)取上述配制好的ies100ml,加入pancreatinsolution100ml(7%,w/w),trypsin13mg,bilesaltsolution200ml(4%,w/w),磁力搅拌器搅拌10min,1mnahco3调ph至7.0,配制成simulatedintestinalmedium(sim)溶液;
(7)将模拟胃消化后的溶液ph调至7.0,和模拟肠液10:3混合,37℃,120rpm水浴反应,分别在0、2、4、6h取样,100℃、10min灭酶后检测抗性糊精在模拟肠液中的消化情况。
经检测,制备的低分子量抗性糊精:在其非还原端富含α-1,6糖苷键,平均分子量约为1000-4000da,聚合度约6~25,在胃肠道中几乎不消化,可到达结肠,供肠道益生菌发酵。
虽然本发明已以较佳实施例公开如上,但其并非用以限定本发明,任何熟悉此技术的人,在不脱离本发明的精神和范围内,都可做各种的改动与修饰,因此本发明的保护范围应该以权利要求书所界定的为准。
sequencelisting
<110>江南大学
<120>一种4,6-α-葡萄糖基转移酶及其在抗性糊精生产中的应用
<160>4
<170>patentinversion3.3
<210>1
<211>1047
<212>prt
<213>lactobacillusfermentum
<400>1
metglnalaasnaspglyhistrptyrleuphethralaaspglythr
151015
alaalaserargvalalalystrpalaglythrtyrtyrtyrpheasp
202530
proglnthrhisleuargvalaspaspasntyrvalglnserglntrp
354045
glyasptrptyrmetpheglylysaspglyargilealathrglyleu
505560
tyrlystrpasplysasnasnglntrptyrtyrpheaspprovalthr
65707580
tyrleulysvalthrasnlystrpvalaspglyasntyrtyraspglu
859095
aspglyalaglnalaileserlysleuvalthrileasnasnargleu
100105110
tyrtyrpheaspaspglnglylysgluileserasnglnpheargthr
115120125
ilehisglyasplystyrtyrpheglyasnaspseralaalavalthr
130135140
glyglnglnthrileaspglylysvaltyrlyspheserasntyrgly
145150155160
tyrleuleuglyasnargtyrglylysilegluasnglylysleuasn
165170175
iletyrserleualaaspasnserleuilelysthrvalglualagly
180185190
protrpgluasnmetalatyrsermetaspserasnserileasnasn
195200205
ileaspglytyrilesertyrthrglytrptyrargprotyrglythr
210215220
serglnaspglylysthrtrptyrprothrthrvalalaasptrparg
225230235240
proileleumettyrvaltrpproserlysaspvalglnvallysphe
245250255
ileglntyrphevalasnhisglytyrgluasnserasntyrglyleu
260265270
thralaglyservallysaspleusergluasnthralaserilelys
275280285
leuasngluvalalaglnasnleuargtyrvalilegluglnhisval
290295300
valalaalalysserthrserglnleualaasnaspileasnasnphe
305310315320
ilethrthrileprogluleuserlysalasergluleuservalval
325330335
asnsertyrglytyrlysproaspasnserglyservalaspaspasp
340345350
glnvalilephevalasnasnaspserlysasnglnlysileglyasn
355360365
thrsertyralaaspserasntyrargleumetasnargthrileasn
370375380
asnglnasnglyaspasnasnseraspaspserprogluleuleuval
385390395400
glyasnaspileaspasnserasnprovalvalglnalagluasnleu
405410415
asntrpglutyrpheleuleuasntyrglylysphemetasntyrasn
420425430
proasnglyasnpheaspglypheargileaspalaalaaspasnile
435440445
aspalaaspvalleuaspglnalaalaglnleuileasnseriletyr
450455460
asnthrlysglyasnglnalaasnalaasnasphisleuiletyrasn
465470475480
gluglytyrhisleuglyalaalaasnmetleuasparglysserasn
485490495
progluleutyrmetaspserglytyrphetyrthrleugluasnval
500505510
leuglyargalaseraspargaspaspileasnasnleuilethrasn
515520525
serilevalasnargglnasnaspvalsergluasnvalalathrpro
530535540
asntrpserphevalthrasnhisaspglnarglysasnleuileasn
545550555560
glnilevalileaspasphisproglyvalalaaspilemetserasp
565570575
glytyrlysalaglutyrvalasnglnalatrplysgluphetyrala
580585590
aspglnalaargthrasplyslystyrthrglntyrasnleuproala
595600605
glntyralaleuleuleuthrasnlysaspthrvalproglnvaltyr
610615620
tyrglyaspleutyraspgluthraspglntyrmetglnasnlysser
625630635640
valtyrtyraspalailethrthrleumetlysalaarglyssertyr
645650655
valserglyglyglnsermetilelysileasnasphisleuleuthr
660665670
servalargtyrglylysglyileileaspglyasnvalsermetthr
675680685
aspileleuglyargasnserglyilealavalvalvalglyasnasp
690695700
alaglnmetalaasnglnthrileserileasnmetglylysalahis
705710715720
alaasnglnalatyrlysglnleuleuglythrileaspserglyleu
725730735
thrserseraspthrthriletyrhisthraspserasnglyvalleu
740745750
asnvalthrvallysglytyrserasnprotyrvalserglytyrleu
755760765
glyvaltrpvalproleuasnglyglyalaasnilethrthrlysala
770775780
sergluvalthrasnglnserasplysthrtyrserserasnalaala
785790795800
leuaspserhisvaliletyrgluasppheserleupheglnproglu
805810815
prothrserlysalagluhisalatyrasnileilealaaspasnala
820825830
serleupheasngluleuglyilethraspphetrpmetalaproala
835840845
tyrthrpropheasnthrserargtyrasngluglytyrsermetthr
850855860
aspargtyrasnleuglythrglualaasnleuthrlystyrglyser
865870875880
glyglugluleuserasnalailealaalaleuhisaspalaglyleu
885890895
lysvalglngluaspleuvalmetasnglnmetileglyphesergly
900905910
glnglualavalthrvalthrargthraspglyhisalalysglnleu
915920925
thrvalaspglylysthrphealaasnglniletyrphealatyrthr
930935940
argglyglyglygluglyglnlysasntyrglyglylystyrleuasp
945950955960
gluleuglnlyslystyrprogluleuphethrthrlysalavalser
965970975
thrglyvalalaproaspproservalhisilethrglutrpserala
980985990
lystyrglnasnglythrserleuglnasnileglyileglyleuala
99510001005
vallysleualaasnglyasptyralatyrleuasnaspserasn
101010151020
asnlysalapheasnthrthrleuprogluthrmetserserala
102510301035
asptyrtyralaasnilegluaspasp
10401045
<210>2
<211>3144
<212>dna
<213>人工序列
<400>2
atgcaggccaacgatggtcattggtatctgtttacggccgatggtacggcggcgagccgt60
gttgcgaaatgggccggtacgtattattattttgatccgcagacgcatctgcgtgttgat120
gataattatgttcagagccagtggggtgattggtatatgtttggtaaagatggtcgtatt180
gcaaccggcctgtataaatgggataaaaataatcagtggtattattttgatcctgtgaca240
tatctgaaagtgacaaataaatgggttgatggtaattattatgatgaagatggtgcgcag300
gcaattagcaaactggttaccattaataaccgtctgtattattttgatgatcagggcaaa360
gaaatcagtaatcagtttcgtacgattcatggtgataaatattattttggcaacgatagt420
gcagcagtgaccggccagcagaccatcgatggtaaagtttataaatttagcaactatggc480
tatctgctgggtaatcgttatggtaaaattgaaaacggtaaactgaacatttatagcctg540
gcagataacagtctgattaaaaccgttgaagcaggtccgtgggaaaatatggcatatagc600
atggatagtaacagcattaataacattgatggttatatcagctatacgggctggtatcgt660
ccgtatggtacaagccaggatggtaaaacatggtatccgacaaccgttgcagattggcgt720
ccgattctgatgtatgtttggccgagcaaagatgttcaggttaaatttattcagtatttt780
gtgaaccacggttatgaaaattcaaattatggcctgaccgcaggtagtgttaaagattta840
agcgaaaacaccgcaagcattaaactgaatgaagttgcacagaatctgcgttatgtcatt900
gaacagcatgtcgtggcagccaaaagcaccagccagctggcaaatgatattaataatttt960
atcaccaccatcccggaactgagcaaagcaagcgaactgagcgtagttaatagttatggc1020
tataaacctgataactcaggttccgtcgatgatgatcaggtgatttttgttaacaatgat1080
agcaaaaaccagaaaatcggtaataccagctatgcagattcaaattatcgcctgatgaac1140
cgcaccattaataatcagaatggtgataataacagcgatgatagcccggaactgctggta1200
ggcaatgatattgataatagcaatccagttgtgcaggccgaaaatctgaattgggaatat1260
tttctgctgaattatggtaaatttatgaactataaccctaacggtaactttgatggtttt1320
cgcattgatgcagccgataacattgatgcggatgttctggatcaggccgcccagctgatt1380
aatagcatctataataccaaaggtaaccaggcaaatgcaaatgatcatctgatttataac1440
gaaggttatcatctgggcgcagcaaatatgctggatcgtaaaagcaatcctgaactgtat1500
atggatagcggctatttttataccctggaaaatgtactgggtcgtgcaagcgatcgtgat1560
gatattaataacctgattaccaactctatcgtgaatcgtcagaacgatgtgtcagaaaac1620
gtggcaaccccgaattggagctttgttacgaatcatgatcagcgtaaaaatctgattaac1680
cagatcgtgatcgatgatcatccgggcgttgcggatattatgagcgatggttataaagca1740
gaatatgttaaccaggcatggaaagaattttatgcagatcaggcacgcaccgataaaaag1800
tatacccagtataatctgccggcacagtatgcactgctgctgacgaataaagatacagtg1860
ccgcaggtgtattatggtgatctgtatgatgaaaccgatcagtatatgcagaataaaagc1920
gtttattatgatgccattaccaccctgatgaaagcccgtaaaagctatgtgagcggtggt1980
cagagcatgattaaaattaatgatcatctgctgaccagcgtgcgttatggtaaaggtatt2040
attgatggtaatgtgagcatgaccgatattctgggtcgtaatagcggtattgcagttgtt2100
gttggtaacgatgcccagatggcaaatcagacaattagtattaacatgggtaaagcccat2160
gcaaatcaggcatataaacagctgctgggtacaatcgattcaggtctgaccagttctgat2220
acaacaatttatcataccgatagcaacggcgtgctgaacgtcaccgtgaaaggttatagc2280
aacccatacgttagcggttatctgggtgtttgggttccgctgaatggcggtgccaatatt2340
accaccaaagccagcgaagttaccaatcagagcgataaaacctatagcagtaatgcagca2400
ctggatagccatgttatttatgaagattttagcctgtttcagccggaaccgaccagcaaa2460
gcagaacatgcctataatattatcgcagataatgcaagcctgtttaatgaactgggtatt2520
accgatttttggatggccccggcatataccccgtttaatacaagccgttataatgaaggt2580
tattccatgaccgatcgttataatctgggtacagaagccaatctgaccaaatatggcagc2640
ggtgaagaactgagtaatgcaatcgctgcactgcatgatgcaggtctgaaagtgcaggaa2700
gatttagttatgaatcagatgatcggttttagtggtcaggaagcagtgaccgttacccgt2760
accgatggtcatgccaaacagctgaccgttgatggtaaaacgtttgcaaatcagatttat2820
tttgcgtatacccgtggtggtggtgaaggtcagaaaaattatggtggcaaatatctggat2880
gaactgcaaaaaaaatatccggaactgtttaccaccaaagcagttagcaccggcgttgca2940
ccggaccctagcgttcatattaccgaatggagcgcaaaatatcagaatggtacaagcctg3000
caaaatattggtattggtctggcagttaaactggcaaatggtgattatgcctatctgaat3060
gatagcaataataaagcatttaataccaccctgccggaaaccatgagcagcgcagattat3120
tatgcaaatattgaagatgattaa3144
<210>3
<211>24
<212>dna
<213>人工序列
<400>3
catatgcaggccaacgatggtcat24
<210>4
<211>31
<212>dna
<213>人工序列
<400>4
ggatccttaatcatcttcaatatttgcataa31
- 还没有人留言评论。精彩留言会获得点赞!