一种从葡萄皮渣中提取原花青素的方法与流程
本发明属于葡萄皮渣提取技术领域,具体涉及一种从葡萄皮渣中提取原花青素的方法。
背景技术:
葡萄是世界上经济价值较高的一种水果,为葡萄科(vitaceae)葡萄属(vitis)植物。葡萄果实中含有大量的酚类物质,其中30-40%存在于葡萄皮中,60-70%存在于葡萄籽中。其中葡萄皮中存在色素类物质,相对于化学合成的色素来讲,对人体无害,其中原花青素,简称opc,是一类黄烷醇单体及其聚合体的多酚化合物,属于生物类黄酮。经过大量研究证实,原花青素对于改善血液循环、滋润皮肤、降低胆固醇等方面都有非常突出的作用。
有研究报道表明葡萄皮中富含有原花青素,而葡萄本身作为一种日常的水果,从其中提取得到的花青素属于食药同源的产品,是理想的保健品原材料。随着人们对于饮食健康保健的广泛重视和追求,对于原花青素需求快速增长。亟需一种简单易行的能够从葡萄中大量提取原花青素的方法。
葡萄籽中的原花青素物质通常以结合态与蛋白质、纤维素结合在一起,一般不易提出,提取原花青素常用的方法有水提取法、有机溶剂-水提取法和仪器辅助提取法,水提取法浸提耗时长,温度高,容易造成原花青素的损失,同时水的极性较大,溶出杂质也较多。有机溶剂-水提取法中大多数有机溶剂毒副作用大且产物提取率低。仪器辅助提取法由于设备昂贵,推广使用比较困难。因此急需一种新的方法来提取葡萄皮渣中的原花青素。
技术实现要素:
本发明的目的在于提供一种新的从葡萄皮渣中提取原花青素的方法,用以解决现有技术中存在的问题。
为实现上述目的,本发明采取如下技术方案:
一种从葡萄皮渣中提取原花青素的方法,所述制备方法包括如下步骤:
(1)提取:准确称取葡萄皮渣粉末,准确称取葡萄皮渣粉末,按照葡萄皮渣粉末与des溶剂的料液比(g/m1)为1∶8-16的比例加入des溶剂,所述des溶剂为氯化胆碱∶乳酸=1∶2,两者比例为摩尔比,于20-60℃下磁力搅拌20-60min;
(2)分离:将提取液上d101大孔吸附树脂柱,提取液与d101大孔吸附树脂柱的体积比为1∶12.5,首先用纯化水洗脱,纯化水的用量为柱体积的5倍,然后加入45%乙醇缓慢洗脱至柱体无颜色,将洗脱液根据柱子上洗脱液颜色深浅分段收集,采用减压浓缩法回收其中的乙醇,浓缩后的洗脱液冷冻干燥24h以上,得到葡萄皮渣提取物。
优选地,所述des溶剂的含水量10-30%。更加优选地,所述des溶剂的含水量16.02%。
优选地,所述葡萄皮渣粉末与des的料液比为1∶10.63。
优选地,采用在50℃磁力搅拌40min效果最佳。
优选地,所述减压浓缩法的压力范围为-0.07~-0.1mpa。
其中,所述葡萄皮渣粉末是由取自葡萄酒厂的葡萄皮籽渣晾晒干燥后,使用中草药粉碎机进行粉碎,过40目筛收集而得。
本发明具有如下优点:
本发明采用des(氯化胆碱∶乳酸=1∶2,n/n)为提取溶剂,该溶剂萃取能力强,对环境友好,组成相对简单,操作简单易行,提取方式容易实现,并且原花青素提取率高。并且本发明对提取的各种条件进行了优化,原花青素提取率高。
本发明从天然植物葡萄皮渣中提取原花青素,其中葡萄皮渣日常也可食用,根据提取物的抗氧化活性,将其用于制备天然色素类产品。相对于化学合成类色素,更加安全。
附图说明
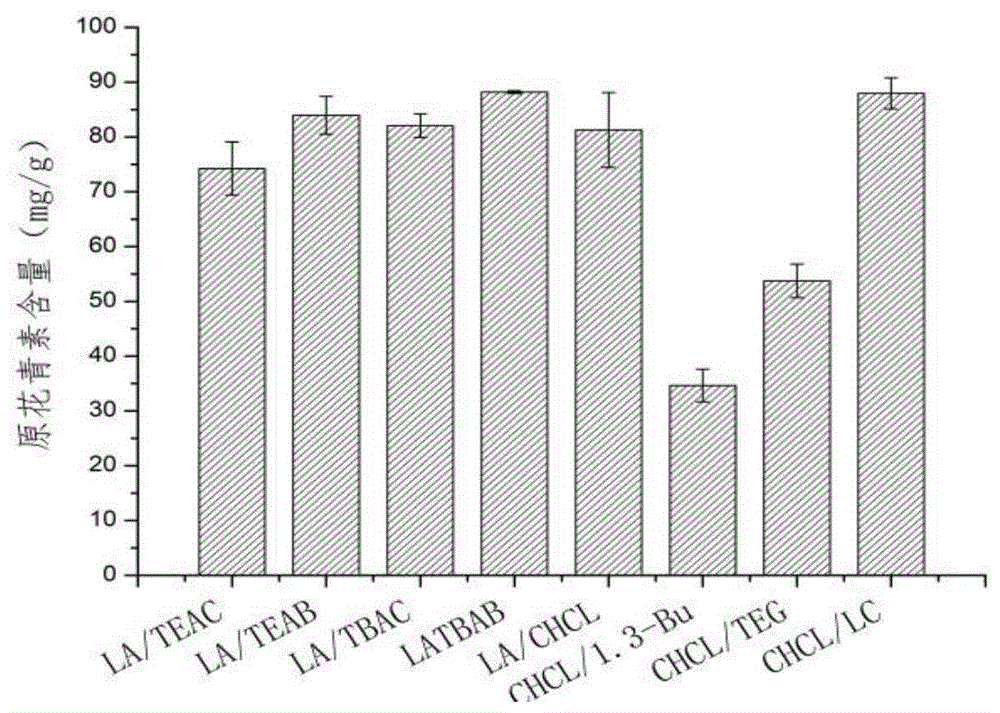
图1是不同des提取葡萄皮渣原花青素对比;
图2是不同料液比提取葡萄皮渣原花青素的对比;
图3是不同提取方式提取葡萄皮渣原花青素对比;
图4是不同提取时间条件下葡萄皮渣原花青素含量对比;
图5是不同提取温度提取葡萄皮渣原花青素对比;
图6是不同含水量的des提取葡萄皮渣原花青素对比;
图7是不同提取次数提取葡萄皮渣原花青素对比;
图8是避光与否提取葡萄皮渣原花青素对比;
图9是两种因素交互作用对葡萄皮渣原花青素含量影响的等高线;
图10是两种因素交互作用对葡萄皮渣原花青素含量影响的响应面图;
图11是加样量对吸附效果的影响;
图12是解吸液浓度对解吸效果的影响;
图13是各个流分原花青素含量对比;
图14是葡萄皮渣提取物的dpph自由基清除活性对比。
具体实施方式
下面将通过具体实施例对本发明进行详细的描述。提供这些实施例是为了能够更透彻地理解本发明,并且能够将本发明的范围完整的传达给本领域的技术人员。
如在通篇说明书及权利要求当中所提及的“包含”或“包括”为一开放式用语,故应解释成“包含但不限定于”。说明书后续描述为实施本发明的较佳实施方式,然所述描述乃以说明书的一般原则为目的,并非用以限定本发明的范围。本发明的保护范围当视所附权利要求所界定者为准。
本发明以葡萄皮渣为基础,提取其中的色素类物质,通过对其提取物中的主要成分原花青素为目标,来得到最佳的提取原花青素的工艺,具体地,发明人进行了如下试验,具体试验过程如下:
一、des的筛选
发明人查阅文献,从众多可能形成低共熔溶剂的组分,将其组成中的hba与hbd按特定摩尔比计算称量至50ml具塞锥形瓶中,置于水浴锅中,缓慢升温加热至融化。加热至80℃为止,确定可以形成的低共熔溶剂的组分,所选择的低共熔溶剂和性状如表1所示。
表1低共熔溶剂的制备及性状表述
根据表中描述,des(氯化胆碱∶甘油和氯化胆碱∶丙二酸)形成的低共熔溶剂黏度过大,不利于葡萄皮渣的提取,可选择基于la(乙酰丙酸)的5种des(编号21,22,23,24,25)和基于chcl(氯化胆碱)的3种des(编,4,11,20)为提取溶剂。其中,teac为四乙基氯化铵,teab为四乙基溴化铵,tbac为四丁基氯化铵,tbab为四丁基溴化铵,chcl为氯化胆碱。
然后对des进行优化,具体如下:
准确称取处理后的葡萄皮渣粉末1g,按料液比1∶15加入不同的des,55℃提取2h,提取液离心(3500rpm,5min)收集上清液,将上清液稀释10倍,取稀释液0.5ml,加入2%的硫酸铁铵溶液(2mol/l的盐酸溶液配制)0.2ml,正丁醇-盐酸(95∶5,v/v)溶液6ml,摇匀,60℃水浴40min,取出后立即置于冷水浴冷却15min,在550nm处测定吸光度,计算原花青素含量。计算结果见图1。
从图1可以看出,des(氯化胆碱∶甘油和氯化胆碱∶丙二酸)黏度过大,不利于溶剂的渗透和活性成分的扩散,根据不同提取液中原花青素的含量测定结果(如图1)可知基于乙酰丙酸的des(乙酰丙酸∶tbab=3∶1,v/v)和基于氯化胆碱的des(氯化胆碱∶乳酸=1∶2,v/v)提取原花青素含量相当,从经济和安全方面考虑,本实验最终选择基于氯化胆碱的des(氯化胆碱∶乳酸=1∶2,v/v)为原花青素的提取溶剂。
二、料液比的选择
准确称取葡萄皮渣粉末0.5g,按料液比1∶8、1∶10、1∶12、1∶14、1∶16加入des(氯化胆碱∶乳酸=1∶2),37℃水浴磁力搅拌提取30min,提取液3700rpm离心5min取上清液,稀释10倍。取稀释液0.5ml加入2%的硫酸铁铵溶液(2mol/l的盐酸溶液配制)0.2ml,正丁醇-盐酸(95∶5,v/v)溶液6ml,摇匀,60℃水浴40min,取出后立即置于冷水浴冷却15min,在550nm处测定吸光度,计算原花青素含量,结果见图2。
使用des(氯化胆碱∶乳酸=1∶2)提取葡萄皮渣原花青素,采取不同料液比进行提取,由图2可知,料液比为1∶10时,提取率最高,因此本实验采用料液比1∶10进行葡萄皮渣原花青素的提取。
三、提取方式的选择
准确称取葡萄皮渣粉末0.5g,按料液比1∶10加入des(氯化胆碱∶乳酸=1∶2),分别采用37℃水浴磁力搅拌提取30min,37℃超声提取30min,37℃恒温培养摇床提取3h,提取液3700rpm离心5min取上清液,稀释10倍。取稀释液0.5ml加入2%的硫酸铁铵溶液(2mol/l的盐酸溶液配制)0.2ml,正丁醇-盐酸(95∶5,v/v)溶液6ml,摇匀,60℃水浴40min,取出后立即置于冷水浴冷却15min,在550nm处测定吸光度,计算原花青素含量,比较结果见图3。
使用des(氯化胆碱∶乳酸=1∶2)提取葡萄皮渣原花青素,采用不同提取方式辅助提取,由图3可知,采用磁力搅拌辅助提取时,提取率最高,因此本实验采用磁力搅拌辅助方式进行葡萄皮渣原花青素的提取。
四、提取时间的选择
准确称取葡萄皮渣粉末0.5g,按料液比1∶10加入des(氯化胆碱∶乳酸=1∶2),37℃水浴磁力搅拌提取,分别在20min、30min、40min、50min、60min吸取提取液1ml,同时向其中加入1ml空白溶剂,提取液3700rpm离心5min取上清液,稀释10倍。取稀释液0.5ml加入2%的硫酸铁铵溶液(2mol/l的盐酸溶液配制)0.2ml,正丁醇-盐酸(95∶5,v/v)溶液6ml,摇匀,60℃水浴40min,取出后立即置于冷水浴冷却15min,在550nm处测定吸光度,计算原花青素含量,比较结果见图4。
使用des(氯化胆碱∶乳酸=1∶2)提取葡萄皮渣原花青素,采取不同提取时间进行提取,由图4可知,提取时间为40min和50min时提取率无显著性差异,60min时提取率稍有降低,原花青素属于多酚类化合物,提取时间过长可能会造成氧化或分解,因此本实验选择提取时间为40min,进行葡萄皮渣原花青素的提取。
五、提取温度的选择
准确称取葡萄皮渣粉末0.5g,按料液比1∶10加入des(氯化胆碱∶乳酸=1∶2),分别在20℃、30℃、40℃、50℃、60℃水浴磁力搅拌提取,提取液3700rpm离心5min取上清液,稀释10倍。取稀释液0.5ml加入2%的硫酸铁铵溶液(2mol/l的盐酸溶液配制)0.2ml,正丁醇-盐酸(95∶5,v/v)溶液6ml,摇匀,60℃水浴40min,取出后立即置于冷水浴冷却15min,在550nm处测定吸光度,计算原花青素含量,比较结果见表5。
在不同的温度使用des(氯化胆碱∶乳酸=1∶2)提取葡萄皮渣原花青素,由图5可知,提取温度为60℃时提取率最高,但50℃的提取率与60℃相比无显著性,考虑到原花青素对温度较为敏感,因此本实验采用提取温度为50℃进行葡萄皮渣原花青素的提取。
六、des含水量的选择
准确称取葡萄皮渣粉末0.5g,按料液比1∶10加入不同含水量(10%,15%,20%,25%,30%)的des(氯化胆碱∶乳酸=1∶2),在37℃水浴磁力搅拌提取40min,提取液3700rpm离心5min取上清液,稀释10倍。取稀释液0.5ml加入2%的硫酸铁铵溶液(2mol/l的盐酸溶液配制)0.2ml,正丁醇-盐酸(95∶5,v/v)溶液6ml,摇匀,60℃水浴40min,取出后立即置于冷水浴冷却15min,在550nm处测定吸光度,计算原花青素含量,结果见图6。
使用不同含水量的des(氯化胆碱∶乳酸=1∶2)37℃磁力搅拌40min提取葡萄皮渣原花青素,des含水量为15%时其提取率最高,因此本实验采用含水量为15%的des进行葡萄皮渣原花青素的提取。
七、提取次数的选择
准确称取葡萄皮渣粉末0.5g,按料液比1∶10加入des(氯化胆碱∶乳酸=1∶2),37℃水浴磁力搅拌提取40min,提取液3700rpm离心5min取上清液,稀释10倍。同时向离心沉淀的部分按料液比1∶10加入des((氯化胆碱∶乳酸=1∶2),依次提取5次,取稀释液0.5ml加入2%的硫酸铁铵溶液(2mol/l的盐酸溶液配制)0.2ml,正丁醇-盐酸(95∶5,v/v)溶液6ml,摇匀,60℃水浴40min,取出后立即置于冷水浴冷却15min,在550nm处测定吸光度,计算原花青素含量。
从图7可以看出,使用des(氯化胆碱∶乳酸=1∶2)37℃磁力搅拌40min提取葡萄皮渣原花青素,提取次数越多原花青素累积提取含量越高,前3次累积提取含量显著增加,之后提取含量无明显增加,因此本实验葡萄皮渣原料提取原花青素可以提取3次。
八、光照影响
准确称取葡萄皮渣粉末0.5g,按料液比1∶10加入des(氯化胆碱∶乳酸=1∶2),37℃水浴磁力搅拌提取30min,避光条件下同法操作,提取液3700rpm离心5min取上清液,稀释10倍。取稀释液0.5ml加入2%的硫酸铁铵溶液(2mol/l的盐酸溶液配制)0.2ml,正丁醇-盐酸(95∶5,v/v)溶液6ml,摇匀,60℃水浴40min,取出后立即置于冷水浴冷却15min,在550nm处测定吸光度,计算原花青素含量。
使用des(氯化胆碱∶乳酸=1∶2)提取葡萄皮渣原花青素,比较避光与光照的条件下同时进行提取的原花青素含量,由上图可知,避光与否对原花青素含量无明显影响。
单因素筛选结果表明,不同料液比和des含水量对葡萄皮渣原花青素的提取含量影响明显,因此选择料液比和des含水量作为提取工艺优化的考察因素。
九、ccd(centralcompositedesign)中心组合设计优化葡萄皮渣原花青素des提取工艺
1.工艺优化
根据预实验结果,选择料液比(a)、des含水量(b)两个因素,以提取液中原花青素含量为评价指标,优化提取工艺条件。ccd实验因素与水平设计见表2,利用design-expert8.06软件设计各组实验条件,提取葡萄皮渣计算原花青素含量测定结果见表3。
表2ccd实验因素和水平表
以响应值(原花青素含量)最高为目标优化提取工艺条件。取葡萄皮渣粉末0.5g,按中心组合设计提取条件提取,测定并计算葡萄皮渣原花青素含量。
表3中心组合实验设计及结果
使用二次方程式的数学模型对试验数据进行拟合,原花青素含量的数学模型:r=-362.18618+76.08223*a+12.59841*b-0.070246ab-3.52690*a2-0.36981*b2,方程相关系数r2和r2adj分别为0.9439和0.9038,说明模型拟合程度良好,回归方程能较好地描述各因素与响应值之间的关系。
表4葡萄皮渣原花青素提取率ccd模型方差分析
对响应曲面数据进行分析和显著性检验,结果见上表。由上表可知,该模型有显著性且失拟项无显著性,表明模型拟合程度良好、误差小。料液比与des含水量对原花青素含量的影响都达到了显著性水平(p<0.05),各因素对原花青素含量的影响顺序为:a>a2>b>b2。
等高线形状和三维响应曲面可以反应出交互效应的强弱,根据二次拟合模型的响应曲面和等高线模型评价料液比与des含水量对葡萄皮渣原花青素提取含量的影响,结果见图9和10。
由拟合结果图可知:des含水量与料液比过大或过小均会减少原花青素的提取含量;根据方差分析结果可知两者的交互作用对提取含量的影响并不显著,但两因素的二次项a2、b2对原花青素含量影响显著,根据design-export软件预测的最佳条件为料液比1∶10.63,des含水量16.02%。
2.验证试验
根据二次回归方程绘制的两因素交互作用的三维立体图和等高线图,可以更加直观的观察料液比和des含水量对原花青素含量的影响。经design-expert8.0.6软件预测所得的最优提取条件为料液比1∶10.63、des含水量16.02%,此时预测的葡萄皮渣原花青素含量为142.994mg/g。根据模型预测的的最优提取条件下,同时提取3个样品,测定提取液中原花青素含量,验证实验求得预测值与实际值之间的误差[误差=(预测值-实际值)/预测值]为0.3%,所得葡萄皮渣原花青素含量为143.53mg/g(rsd=1.06%)与预测值基本一致。表明上述模型的预测准确度较高。
3.对比des与乙醇提取葡萄皮渣原花青素的含量
根据文献,使用乙醇浸提法最优提取工艺(提取温度76℃,料液比1∶20,56%乙醇,提取74min)提取原花青素,乙醇浸提葡萄皮渣原花青素含量为62.03mg/g(rsd=1.51%)。本文经过工艺优化后des提取葡萄皮渣中原花青素的含量为143.53mg/g(rsd=1.06%),与乙醇提取原花青素含量相比提高了一倍以上。
十、葡萄皮渣提取物分离纯化
1.大孔吸附树脂的筛选
大孔吸附树脂预处理:大孔吸附树脂经无水乙醇浸泡过夜,湿法上柱,纯水冲至无醇味。再用5%hcl冲洗4倍柱体积,用纯水冲至中性后,用5%naoh冲洗4倍柱体积,再用纯水洗至中性,用乙醇浸泡备用。
大孔吸附树脂的筛选:分别称取2g预处理过的大孔吸附树脂d101,ab-8,hpd400至50ml锥形瓶中,按料液比1∶5加入葡萄皮渣提取液,将锥形瓶置于恒温振荡器中,37℃,100rpm,震荡24h,用200目滤布过滤,收集滤液,用滤纸吸干残留液,测定滤液吸光度。将吸干残留液的三种大孔吸附树脂装回锥形瓶中,按料液比1∶5加入75%乙醇,同样条件下震荡24h,过滤后收集解吸液,测定解吸液吸光度,根据下面方程计算各树脂吸附率与解吸率,确定用于葡萄皮渣提取液分离的大孔吸附树脂。
c0:吸附前溶液浓度;c1:吸附后溶液浓度;c2:解吸液浓度;v1:吸附液体积;v2:解吸液体积。
表5不同大孔吸附树脂的吸附率和解吸率
根据吸附率与解吸率评价不同大孔吸附树脂对葡萄皮渣提取液的吸附和解吸附的效果,选择大孔吸附树脂d101作为分离纯化葡萄皮渣提取液的树脂。
2提取液上样量确定
经过预处理的大孔吸附树脂d101约500g湿法上柱,加入稀释后的葡萄皮渣提取液100ml,每10ml收集流分,紫外分光光度法测定吸光度,计算原花青素浓度,确定泄漏点。加样量对吸附效果的影响见图11。
在动态吸附开始时,树脂的吸附能力随着提取液的增加而增加,上样量过多会造成提取液浪费且会对树脂的再生造成影响,过少则会降低实验效率。根据上述实验结果,湿法上柱的提取液加样量(提取液与大孔树脂的柱体积的体积比)应为1∶12.5。
3、洗脱液的最佳浓度
将上面经过吸附饱和的大孔吸附树脂柱静置12h,使其充分吸附,设置乙醇浓度为0%,35%,45%,55%,65%,75%,首先用洗脱液0%乙醇洗脱5倍柱体积,以除去残留树脂床中未被树脂吸附的杂质,其余浓度洗脱液2倍柱体积进行梯度洗脱,收集洗脱液,测定吸光度,筛选最佳洗脱液浓度。
由图12可知,在乙醇浓度0%到45%范围内,随着乙醇浓度的增加,洗脱液中原花青素含量升高,在乙醇浓度45%时原花青素含量达到最大值,乙醇浓度大于45%之后,洗脱液中原花青素含量显著降低,即用45%的乙醇就可以将树脂中的原花青素解吸完全。
4、葡萄皮渣的洗脱过程
采用d101大孔吸附树脂湿法上柱,按照优化得到的最佳上样量比值将葡萄皮渣提取液湿法上柱,首先用纯化水洗脱5倍柱体积,然后加入45%乙醇缓慢洗脱至柱体无颜色。将各洗脱液分段收集并测定其吸光度,计算原花青素含量。
从图13可看出,第9流分原花青素含量最高,之后含量逐渐下降,第8流分之前和16流分之后的流分未检测到原花青素。因此,本实验收集8-16流分的洗脱液,减压浓缩回收洗脱液中的乙醇,冷冻干燥得到葡萄皮渣提取物。
根据上述结果,将洗脱液根据洗脱液颜色深浅分段收集,采用减压浓缩法回收其中的乙醇,浓缩后的洗脱液冷冻干燥24h以上,得到葡萄皮渣提取物。
十一、葡萄皮渣提取物的评价
然后对得到的提取物计算回收率,休止角,松密度与堆密度,具体如下:
准确称取提取物20mg至10ml容量瓶中,用90%乙醇溶液定容后,测定提取物中原花青素的含量,计算提取物的回收率。计算结果得出提取物中原花青素含量为615.19mg/g(rsd=0.01%),原花青素回收率60.77%。
采用固定漏斗法,将两只漏斗串联并固定于水平放置的坐标纸上方一定高度(约2cm),将葡萄皮渣提取物从最上面的漏斗中缓缓加入,直至形成的堆积圆锥顶部与漏斗底部刚好接触,测定圆锥底部直径(2r),以漏斗底高度(h)与圆锥半径比作为正切值计算休止角(tanα=h/r)。本实验制备的葡萄皮渣提取物休止角为37.37°±2.13,小于40°,表明葡萄皮渣提取物流动性较好。
取适量葡萄皮渣提取物倒入25ml塑料量筒中,上下振动至体积不发生变化(约50次),读取体积,计算松密度与堆密度。本实验制备的葡萄皮渣提取物松密度为0.40±0.02g/ml,堆密度为0.48±0.01g/ml。
十二、抗氧化活性
dpph自由基清除活性测定:准确配制0.1mmol/l的dpph溶液,避光保存。取不同浓度提取物溶液100μl与100μldpph溶液加入同一孔中,测定吸光度a样,同时测定100μl提取物溶液与100μl无水乙醇加入同一孔中的吸光度a对照,100μldpph溶液与100μl90%乙醇加入同一孔中的吸光度a空白。将样品放置于37℃保温箱中,50min后测定吸光度。以vc为阳性对照,按照下式计算dpph自由基清除率。
自由基清除能力表示为:
清除率(%)=[1-(a样-a对照)/a空白]*100%
由图14可知,葡萄皮渣提取物浓度在5μg/ml~90μg/ml的范围内,随着提取物浓度的增加,dpph自由基清除率增大。当提取物浓度达到90μg/ml时,dpph自由基清除率达到83.09%。
虽然,上文中已经用一般性说明及具体实施例对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
- 还没有人留言评论。精彩留言会获得点赞!