一种病毒纯化方法及经由该方法制备得到的二联灭活疫苗与流程
本发明涉及兽用疫苗技术领域,具体涉及一种病毒纯化方法及经由该方法制备得到的二联灭活疫苗。
背景技术:
猪流行性腹泻(porcineepidemicdiarrhea,ped)是由猪流行性腹泻病毒(porcineepidemicdiarrheavirus,pedv)引起的以水样腹泻、呕吐、食欲下降为基本特征的一种急性、高度接触性肠道传染病。各年龄阶段猪只均易感此病,尤以仔猪最为严重,其死亡率高达100%。我国在1982年首次报道ped,并在国内持续流行,直到2010年,变异毒株pedv在国内开始流行,给我国养猪业造成了巨大的经济损失。近年来,ped的流行更是越来越广泛,新的变异株不断出现,商品化疫苗与流行毒株的抗原性不匹配,免疫效果不佳,从而严重影响我国养猪业的健康发展。
pedv属于冠状病毒科冠状病毒属,是不分节段的、单股正链rna病毒(ssrna),有囊膜,其基因组全长约28.5kb。pedv的病毒粒子具有多形性,大致呈现球形,平均直径在95-190nm之间,病毒粒子表面存在长度约18nm的花瓣状纤突,从核心向四周呈放射状分布。pedv不耐酸碱,对乙醇和氯仿敏感,普通消毒剂可将其杀灭,耐低温不耐高温,在4℃-50℃相对稳定,在60℃以上处理30min后就会丧失感染能力。
猪传染性胃肠炎(transmissiblegastroenteritis,tge)是由猪传染性胃肠炎病毒(transmissiblegastroenteritisvirus,tgev)引起猪的急性、高度接触性的消化道传染病,以呕吐、严重的腹泻、脱水为主要临床症状,并且经常同其他疾病混合发生,所有品种和年龄的猪对此病毒都易感,新生仔猪尤为严重,随着日龄的增大死亡率逐渐下降。其常与猪轮状病毒(porcinerotavirus,porv)、猪流行性腹泻病毒(porcineepidemicdiarrheavirus,pedv)以及致病性大肠杆菌(enteropathogenice.coli)等病原混合,是引起规模化猪场仔猪腹泻性死亡的主要原因,给我国养猪业造成了严重的经济损失。
tgev是属于冠状病毒科、α冠状病毒属,经纯化后在电镜下观察,tgev粒子形态多样,多呈圆形、椭圆形,直径大约90nm~200nm,表面具有双层膜结构,最外层是由双层脂质层构成的囊膜,囊膜上有8nm~24nm的花瓣样突起。tgev在低温条件比较稳定,对热抵抗力低。
针对于ped、tge目前尚无特效治疗药物,临床上以发病急、死亡率高、危害大为显著特征,疫苗免疫是预控该病的有效措施。目前已研制出ped和tge的弱毒疫苗、灭活疫苗和亚单位疫苗等,这些疫苗能在一定程度上降低ped和tge所造成的严重危害,但反应特异性弱,中和抗体水平低,由于pedv与tgev颗粒比较脆弱,耐受力低,故迫切需要高纯度且结构完整的病毒抗原,开发新的工艺以获得高质量的病毒。疫苗安全性和有效性主要受病毒滴度,抗原纯度等因素的影响。常规工艺生产的疫苗在临床应用中存在一定的副反应,主要与病毒抗原中所含的异源成分有关。这些异源成分不仅容易引起免疫副反应,造成母猪流产等问题,而且疫苗的效力会大打折扣。鉴于以细胞培养的病毒作为抗原,在临床应用上会存在一定的非特异性反应,所以,为了提高疫苗的纯净性、安全性、有效性,急需对病毒滴度和抗原纯净性做进一步提高。
膜包浓缩技术是料液以一定的流速在膜的上表面循环,小于膜孔径的物质可以透过膜到透过端,而大于膜孔径的物质会被膜截留,从而实现目标物质的浓缩以及不同物质的分级分离。膜包超滤属于切向流过滤技术,液体切向流过膜表面,流体产生的跨膜压力将部分溶液压过滤膜,截留部分则在系统中循环回流,整个过程中液体以一定速度连续流过滤膜表面,过滤的同时也对滤膜表面进行了冲刷,使膜表面不会形成凝胶层,从而使料液中的颗粒不会很快堵塞滤膜,保持了稳定的过滤速度,且具有更低的剪切力,温和的操作可以有效防止病毒表面糖蛋白的脱落和蛋白的聚集,同时有助于杂蛋白的透过和去除。
分子筛凝胶层析是一种多孔性的不带表面电荷的物质,当带有多种成分的样品在凝胶内运动时,由于分子量不同在缓冲液洗脱时,分子量大的物质不能进入凝胶孔内,而在凝胶间几乎是垂直的向下运动,而分子量小的物质则进入凝胶孔内进行"绕道"运行,这样就可以按分子量的大小,先后流出凝胶柱,达到分离的目的。凝胶层析的分离纯化方法广泛应用在人用疫苗和兽用疫苗的生产中,可以有效分离目的蛋白和杂蛋白,获得纯净的目的蛋白。
技术实现要素:
本发明的目的是提供一种病毒纯化方法及经由该方法制备得到的二联灭活疫苗,用以克服现有技术中病毒纯度低导致的疫苗安全性较差,且免疫效果较差的技术问题。
第一方面,本发明提供一种病毒纯化的方法,包括:
(1)将所述病毒的病毒液进行离心、过滤得到上清液作为待浓缩样品;
(2)将所述待浓缩样品通过100kd膜包进行浓缩,获得病毒浓缩液;
(3)将所述病毒浓缩液利用4ff凝胶层析柱进行纯化得到纯化后的病毒液;
所述病毒为猪流行性腹泻病毒或猪传染性胃肠炎病毒。
进一步地,在步骤(1)中,采用贴壁vero细胞培养猪流行性腹泻病毒,和/或,采用贴壁st细胞培养猪传染性胃肠炎病毒。
进一步地,步骤(2)所述浓缩为将所述待浓缩样品浓缩10~15倍。
进一步地,步骤(2)的方法如下:
将所述待浓缩样品移至样品处理罐中,循环5~10min,保持进液端压力维持在0.05~0.1mpa,打开透过端持续透过100kd膜包,待样品体积浓缩至上样体积的1/10~1/40时,补加与剩余体积相同的医用生理盐水溶液进行洗滤,循环5~10min,打开透过端持续透过;重复多次所述洗滤流程,循环2~5min后得到所述病毒浓缩液。
各部分循环过程优选为高泵速循环2min,进液端压力优选为0.1mpa;所述高泵速为1.5~2.0l/min。
在进行膜包浓缩时,当流速较快时,虽然可以增加浓缩效率,但会导致样品中蛋白回收率降低,而且不利于病毒颗粒的完整性,而流速较慢时也不利于病毒液的浓缩,同时浓缩效率也较差。本发明采用100kd膜包以特定的浓缩工艺进行浓缩,可以实现最高的回收率以及保证病毒颗粒的完整性。
进一步地,步骤(1)为对所述病毒液进行连续流离心、膜过滤后取上清液作为所述待浓缩样品。
进一步地,步骤(3)中所述4ff凝胶层析柱的填料为sepharose4ff琼脂糖凝胶层析填料。
进一步地,步骤(3)中的纯化条件为:病毒浓缩液上样的线性流速为30~80cm/h,压力小于2.5bar,上样量控制在10%~15%柱体积,洗脱采用医用生理盐水溶液。
进一步地,步骤(3)的方法为:
用0.5~1.0mol/lnaoh溶液对分子筛凝胶层析柱清洗消毒,再用无菌水冲洗至ph为7.0~7.5,然后用医用生理盐水溶液平衡分子筛凝胶层析柱至柱前柱后电导率一致,ph稳定在7.0,紫外检测uv280基线平稳,最后将步骤(2)所得病毒浓缩液上样,用医用生理盐水溶液洗脱,待uv280值开始回升时,收集第一个蛋白峰,即为所述纯化后的病毒液。
第二方面,本发明提供一种二联灭活疫苗,包括由灭活的由上述方法纯化的猪流行性腹泻病毒和猪传染性胃肠炎病毒以及201佐剂。
进一步地,201佐剂属于油佐剂,由相应的可注射油与表面活性剂组成,与传统的弗氏佐剂相比,具有很强的免疫增强作用且副作用小,属于经典的油乳佐剂,可以特异性的诱导淋巴细胞增殖反应、中和抗体反应,并且反应产生速度快、强度大,均优于其他佐剂。进一步地,灭活猪流行性腹泻病毒、灭活猪传染性胃肠炎病毒以及201佐剂的比例为2:1:3。
本发明提供一种病毒纯化方法及经由该方法制备得到的二联灭活疫苗,具有如下有益效果:
(1)本发明所述工艺不仅适用于猪流行性腹泻病毒,同时也适用于猪传染性胃肠炎病毒,现有方法中只有针对其中一种病毒的纯化方法。本发明所述方法操作简单、重复性好、成本低、处理效率高,并适合工业化大规模生产。经过纯化所得猪流行性腹泻病毒和猪传染性胃肠炎病毒的纯度高,在后期疫苗配制过程中,减少了抗原的使用量,既节约了成本,又从根本上解决了疫苗副反应的问题,具有良好的推广前景。
(2)本发明解决了猪流行性腹泻病毒和猪传染性胃肠炎病毒难以实现高纯度的技术难题,通过膜包超滤浓缩纯化处理及sepharose4ff分子筛凝胶层析纯化处理,实现了制备高纯度的猪流行性腹泻病毒和猪传染性胃肠炎病毒,并且获得完整的病毒粒子,较传统工艺完有显著提升,是疫苗品质的根本保证。
(3)本发明通过利用100kd膜包超滤浓缩、sepharose4ff凝胶层析纯化处理,两步纯化步骤密切联系且不可分割。凝胶层析纯化的上样量直接限制了规模化生产的量和效率,因此前面采用浓缩步骤既可以去除部分蛋白质,同时缩小了后期抗原处理的体积,是实现大规模高效生产的关键步骤。
(4)本发明所述工艺,杂蛋白去除率高达91%,有效抗原含量高达95%,使由杂蛋白引起的疫苗副反应降至更低,提高了疫苗安全性的同时保持了良好的免疫原性,为猪流行性腹泻和猪传染性胃肠炎的防控奠定基础。
(5)本发明的的技术参数和生产规模可以进行线性放大,生产规模可以扩大到500l、1000l、2000l、3000l、5000l,均具有可操作性。
附图说明
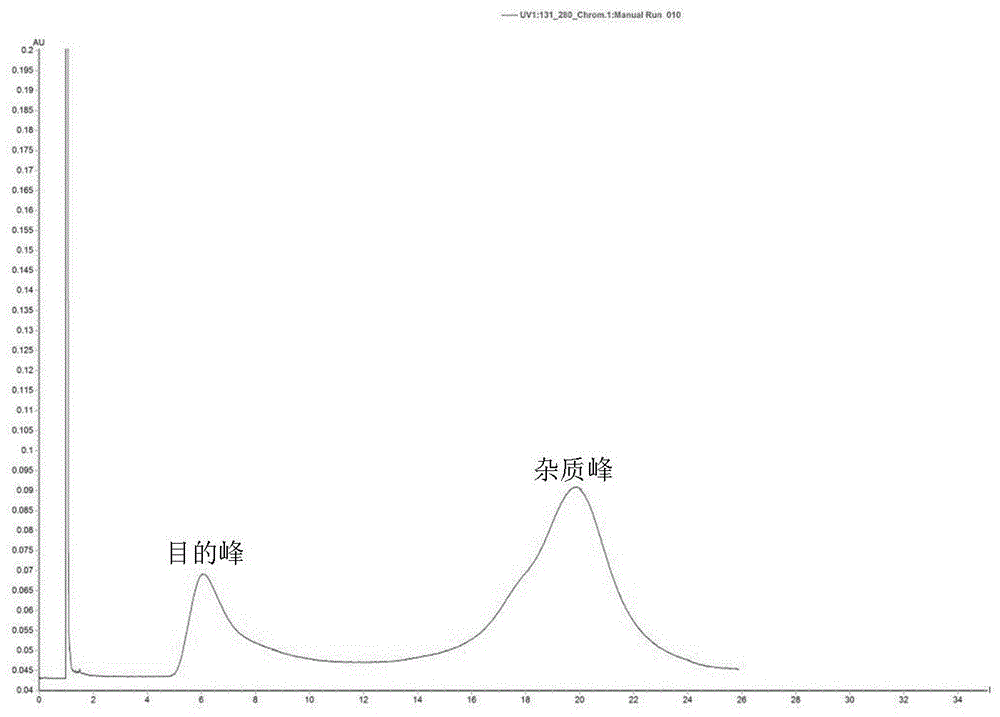
图1为本发明实施例4提供的猪流行性腹泻病毒4ff凝胶层析纯化图谱;
图2为本发明实施例4提供的猪传染性胃肠炎病毒4ff凝胶层析纯化图谱;
图3为本发明实施例4提供的猪流行性腹泻病毒电镜观察结果;
图4为本发明实施例4提供的猪传染性胃肠炎病毒电镜观察结果;
图5为本发明试验例2提供的纯化疫苗和未纯化疫苗接种后体温变化。
具体实施方式
以下实施例用于说明本发明,但不用来限制本发明的范围。
以下实施例中,所用仪器如下:
用于澄清过滤的微滤膜型号为:赛多利斯0.65um。
用于超滤浓缩的膜包型号为:3m21446807e-sw。
分子筛凝胶层析柱型号为:bpg200/1000column。
分子筛凝胶层析柱填料为:sepharose4ff凝胶层析填料。
病毒液如下:转瓶培养和悬浮片状载体培养猪流行性腹泻病毒,毒价不低于107.0tcid50/ml,转瓶培养和悬浮片状载体培养猪传染性胃肠炎病毒可市售购得。
医用生理盐水配方(1l):0.79g磷酸氢二钠,0.43g磷酸二氢钾,5.8g氯化钠。
对每步所得产物分别通过a280检测蛋白含量,并通过tcid50检测病毒滴度。
流速公式v=1.56πr2ml/min中,r表示层析柱半径。
实施例1膜包超滤浓缩工艺
1系统预处理
1.1将30kd、100kd、300kd膜包分别安装到超滤控制设备中,接通相应的管道,组装完毕后用无菌注射用水循环冲洗中空纤维柱10min。
1.2系统完整性检测
压力保持法检测系统的完整性。
1.3系统的处理
清洗及灭菌:用无菌1.0mol/lnaoh溶液对系统进行循环消毒处理30min。然后用无菌注射用水对系统进行清洗,洗去残余的碱溶液,至ph为7.0。最后用无菌医用生理盐水溶液平衡膜包及管道。
2病毒超滤浓缩过程
采用连续流离心处理,经0.65um滤膜处理后的猪流行性腹泻病毒和猪传染性胃肠炎病毒滤至样品处理罐中,获得待浓缩抗原15l,以高泵速循环2min后,保持进液端压力维持在0.1mpa,使透过端以无压力的状态持续透过,待样品体积浓缩至上样体积的1/10时,补加和剩余体积一样的医用生理盐水第一次洗滤,以高泵速循环2min,打开透过端持续透过。重复以上操作洗滤四次。最后浓缩液循环2min,收集浓缩液1.5l。
表1猪流行性腹泻病毒超滤浓缩效果评价
表2猪传染性胃肠炎病毒超滤浓缩效果评价
表1和表2结果表明,不同孔径的膜包对猪流行性腹泻和猪传染性胃肠炎病毒的超滤浓缩的效果差异显著。300kd膜包的杂蛋白去除效果是最好的,但病毒回收率较低;30kd孔径的膜包病毒回收率最好,但是处理效率最差。综合处理效率、杂蛋白去除率和病毒回收率三个指标,100kd孔径的膜包是超滤浓缩中最合适的孔径。
实施例2
本实施例提供一种100kd膜包超滤浓缩工艺,具体步骤和实施例1相同,区别在于病毒浓缩流程的步骤2调整为:
采用连续流离心处理,经0.65um滤膜处理后的猪流行性腹泻病毒和猪传染性胃肠炎病毒滤至样品处理罐中,获得待浓缩抗原15l,以高泵速循环2min后,保持进液端压力维持在0.04mpa,使透过端以无压力的状态持续透过,待样品体积浓缩至上样体积的1/10时,补加和剩余体积一样的医用生理盐水第一次洗滤,以高泵速循环2min,打开透过端持续透过。重复以上操作洗滤四次。最后浓缩液循环2min,收集浓缩液1.5l。
实施例3
本实施例提供一种100kd膜包超滤浓缩工艺,具体步骤和实施例1相同:
采用连续流离心处理,经0.65um滤膜处理后的猪流行性腹泻病毒和猪传染性胃肠炎病毒滤至样品处理罐中,获得待浓缩抗原15l,以高泵速循环2min后,保持进液端压力维持在0.1mpa,使透过端以无压力的状态持续透过,待样品体积浓缩至上样体积的1/10时,补加和剩余体积一样的医用生理盐水第一次洗滤,以高泵速循环2min,打开透过端持续透过。重复以上操作洗滤四次。最后浓缩液循环2min,收集浓缩液1.5l。
表3猪流行性腹泻病毒超滤浓缩效果评价
表4猪传染性胃肠炎病毒超滤浓缩效果评价
在使用100kd膜包超滤浓缩工艺中,对比进液端压力为0.04mpa和0.1mpa时的浓缩效果,表3和表4结果表明,进液端压力为0.1mpa时,杂蛋白去除效果是最好的,处理效率最高,但病毒回收率偏低。但是综合处理效率、杂蛋白去除率和病毒回收率三个指标,保持进液端压力为0.1mpa是超滤浓缩中最合适的压力。
实施例4分子筛凝胶层析工艺
1系统预处理
1.1将4ff分子筛层析柱安装到位,测柱效。
1.2用无菌0.5mol/lnaoh处理分子筛凝胶层析柱2个柱体积(cv),再用无菌注射水清洗至ph7.0,然后用医用生理盐水溶液平衡离子交换柱至电导率柱前后一致,ph稳定在7.0,紫外uv280基线平稳。
2纯化过程
将浓缩后病毒样上样,设定上样线性流速为30cm/h,压力控制小于2.0bar。上样量为5%、10%、15%柱体积,上样结束后,用医用生理盐水溶液开始洗脱蛋白,待uv280值开始起峰时收集洗脱后样品,待目的蛋白峰结束uv280值下降至最低或者数值开始增加时停止收集第一洗脱峰洗脱样品,即为病毒纯化后样。
表5猪流行性腹泻病毒纯化效果评价
表6猪传染性胃肠炎病毒纯化效果评价
*采用a280方法检测蛋白浓度及tcid50检测病毒毒价。
图1和图2为本实施例提供的猪流行性腹泻病毒和猪传染性胃肠炎病毒的4ff凝胶层析纯化图谱。
图3和图4为本实施例提供的以15%上样量纯化所得的猪流行性腹泻病毒和猪传染性胃肠炎病毒的电镜观察结果。纯化后的病毒经负染色后进行电子显微镜观察,检查病毒粒子的完整性。图3显示pedv粒子较完整,可见完整的“冠”;图4显示tgev粒子较完整,可见完整的“冠”。
上表结果显示,5%上样量杂蛋白去除率高,病毒回收率也比较高。增加上样量杂蛋白去除率下降,病毒回收率同时下降。在大规模生产中10%~15%的上样量更加合适。
实施例5转瓶培养的猪流行性腹泻病毒和猪传染性胃肠炎病毒的纯化工艺
(1)取37℃转瓶贴壁培养的vero细胞和st细胞,分别接种猪流行性腹泻病毒和猪传染性胃肠炎病毒,收获的病毒液,采用连续流离心,分别经过3+0.8um滤膜或0.65um滤膜处理后即为待浓缩样品;
(2)膜包超滤浓缩:与实施例1方法相同,将15l待浓缩的样品经100kd膜包处理后获得浓缩后样品1.5l;
(3)分子筛凝胶层析:与实施例4方法相同,将浓缩后样品1.5l,以10%柱体积(15l)上样,收集洗脱后的第一个洗脱峰。
实施例6悬浮片状载体培养的猪流行性腹泻病毒和猪传染性胃肠炎病毒的纯化工艺
(1)取37℃悬浮培养的vero细胞和st细胞,分别接种猪流行性腹泻病毒和猪传染性胃肠炎病毒,收获的病毒液,采用连续流离心,经过0.65um滤膜处理后即为待浓缩样品;
(2)膜包超滤浓缩:与实施例1方法相同,将15l待浓缩的样品经100kd膜包处理后获得浓缩后样品1.5l;
(3)分子筛凝胶层析:与实施例4方法相同,将浓缩后样品1.5l,以10%柱体积(15l)上样,收集洗脱后的第一个洗脱峰。
表7实施例5和实施例6纯化所得猪流行性腹泻病毒的效果评价
表8实施例5和实施例6纯化所得猪传染性胃肠炎病毒的效果评价
上表结果显示:100kd膜包超滤浓缩和4ff凝胶层析纯化工艺组合,不仅适用于转瓶培养的猪流行性腹泻病毒和猪传染性胃肠炎病毒,也适用于悬浮片状载体培养的猪流行性腹泻病毒和猪传染性胃肠炎病毒,而且这两种培养方式的病毒回收率可达92%,杂蛋白去除率高达94%。
实施例7大规模生产高纯度猪流行性腹泻病毒和猪传染性胃肠炎病毒
(1)抗原连续流离心取上清300l,经0.65um滤膜处理后即为待浓缩样品;
(2)膜包超滤浓缩:与实施例1方法相同,将300l待浓缩的样品经100kd膜包处理,获得浓缩后样品30l;
(3)分子筛凝胶层析:与实施例4方法相同,将浓缩后样品30l,以15%柱体积(15l)上样,收集洗脱后的第一个洗脱峰,共需两次上样完成纯化。
实施例8大规模生产高纯度猪流行性腹泻病毒和猪传染性胃肠炎病毒
(1)抗原连续流离心取上清500l,经0.65um滤膜处理后即为待浓缩样品;
(2)膜包超滤浓缩:与实施例1方法相同,将300l待浓缩的样品经100kd膜包处理,获得浓缩后样品45l;
(3)分子筛凝胶层析:与实施例4方法相同,将浓缩后样品45l,以15%柱体积(15l)上样,收集洗脱后的第一个洗脱峰,共需三次上样完成纯化。
表9实施例7和实施例8纯化所得猪流行性腹泻病毒的效果评价
表10实施例7和实施例8纯化所得猪传染性胃肠炎病毒的效果评价
实施例9猪流行性腹泻病毒、猪传染性胃肠炎病毒二联灭活疫苗的生产
在实施例1-8的基础上,确定最佳的生产工艺参数采用线性放大的原则,匹配相应的罐体和管道,可以将生产规模扩大为2000l、3000l、5000l。
本实施例用确认的最优生产工艺参数进行疫苗检验用病毒液的纯化,将猪流行性腹泻病毒液和纯化后病毒液、猪传染性胃肠炎病毒液和纯化后病毒液,分别采用0.2%甲醛灭活48h。灭活病毒液经细胞法检测病毒灭活彻底。采用201佐剂与猪流行性腹泻病毒、猪传染性胃肠炎病毒按3:2:1的比例配比二联灭活疫苗。
试验例1佐剂对比试验
本试验例使用实施例7制备得到的高纯度猪流行性腹泻病毒、猪传染性胃肠炎病毒,分别采用0.2%甲醛灭活48h。灭活病毒液经细胞法检测病毒灭活彻底。分别采用201佐剂和cpc佐剂与猪流行性腹泻病毒、猪传染性胃肠炎病毒进行乳化,制成二联灭活疫苗。其中201佐剂与猪流行性腹泻病毒、猪传染性胃肠炎病毒按3:2:1的比例进行配比;cpc佐剂与猪流行性腹泻病毒、猪传染性胃肠炎病毒按3:4:8的比例进行配比(cpc佐剂占比为20%)。将这两种二联灭活疫苗进行疫苗中和抗体检测,对比佐剂效果。具体步骤如下:
选取4周龄的健康断奶仔猪5头/组,共12头,免疫前检测血清中的pedv和tgev中和抗体阴性。采用免疫剂量2ml/头进行后海穴注射。观察疫苗接种后动物是否出现局部反应和全身反应,并且在14天、28天采血进行pedv、tgev中和抗体水平的检测。
得到如下表所示结果:
表11201佐剂和cpc佐剂对比效果评价
连续监测仔猪首免后14天、28天中和抗体水平,检测结果显示:tgev和pedv中和抗体效价在一免后14天~28天抗体快速上升,但201佐剂制备的二联灭活疫苗免疫后抗体水平要显著高于cpc佐剂,所以优选201佐剂。
试验例2疫苗安全性检测
本试验例使用实施例9制备得到的猪流行性腹泻病毒、猪传染性胃肠炎病毒二联灭活疫苗对新生仔猪进行免疫,具体步骤如下:
选取3日龄的新生仔猪5头/组共10头,免疫前检测血清中的pedv和tgev中和抗体阴性。采用两倍剂量(4ml/头)进行后海穴注射。观察疫苗接种后动物是否出现局部反应和全身反应,对疫苗的安全性进行研究。具体结果观察新生仔猪的体温、采食饮水、是否有腹泻症状。
具体得到如图5所示结果,结果显示新生仔猪接种疫苗后,纯化疫苗接种新生仔猪的体温波动明显小于未纯化疫苗接种后新生仔猪的体温波动。观察新生仔猪的采食饮水都正常,并且无局部和全身反应,无腹泻症状。说明纯化疫苗的安全性较未纯化疫苗有明显改善,充分体现出纯化可以有效降低疫苗副反应。
试验例3疫苗中和抗体检测
本试验例对实施例9制备得到的猪流行性腹泻病毒、猪传染性胃肠炎病毒二联灭活疫苗进行疫苗中和抗体检测,具体步骤如下:
选取4周龄的健康断奶仔猪5头/组,共12头,免疫前检测血清中的pedv和tgev中和抗体阴性。采用免疫剂量2ml/头进行后海穴注射。观察疫苗接种后动物是否出现局部反应和全身反应,并且在14天、28天采血进行pedv、tgev中和抗体水平的检测。
得到如下表所示结果
表12实施例9所得疫苗中和抗体检测结果
连续监测仔猪首免后14天、28天中和抗体水平,检测结果显示:tgev中和抗体效价在一免后14天~28天抗体快速上升,未纯化疫苗免疫后由14天抗体效价39升高到21天抗体效价398;纯化疫苗免疫后由14天抗体效价61升高到28天抗体效价675。pedv中和抗体效价在一免后14天~28天抗体快速上升,未纯化疫苗免疫后由14天抗体效价24升高到28天抗体效价79;纯化疫苗免疫后由14天抗体效价34升高到28天抗体效价189;
同样的配苗标准纯化疫苗的抗体效价明显高于于未纯化疫苗抗体效价,说明纯化抗原配制的成品疫苗免疫效果更好。
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
- 还没有人留言评论。精彩留言会获得点赞!