亚胺甲基四氢叶酸环化脱氢酶截短蛋白及其制备方法,应用与流程
本发明属于抗原制备技术领域,具体涉及一种亚胺甲基四氢叶酸环化脱氢酶截短蛋白及其制备方法,应用。
背景技术:
自身免疫性肝病是一组原因不明、但与自身免疫密切相关的肝脏疾病,包括自身免疫性肝炎(autoimmunehepatitis,aih)、原发性胆汁性肝硬化和原发性硬化性胆管炎。血清自身抗体对自身免疫性肝病的诊断和分类具有重要意义,通常情况下,如果患者血清中有很高滴度的自身抗体,则其往往为自身免疫性肝病。
其中,aih是一种慢性进行性肝炎,主要损伤肝细胞,可发生于各年龄段,以年轻女性多见,男女发病比例约为1:4。尽管多种肝脏疾病均可出现自身抗体,不能单凭自身抗体来诊断aih,但自身抗体的检测对aih的辅助诊断和分型具有重要意义。
根据血清自身抗体的不同,将aih分为ⅰ型和ⅱ型,抗lkm-1抗体和抗肝细胞溶质抗原ⅰ型(livercytosolantigentype1,lc-1)抗体是ⅱ型aih典型的血清学标志,两者可同时或单独存在。其中,抗lc-1抗体主要存在于儿童和青少年患者中(年龄<20岁),其在aih患者中的阳性率约为56%~72%,lc-1抗体阳性提示aih患者可能存在其他自身免疫疾病、重症肝炎及进展性肝硬化,它是急性、急性重症、慢性肝炎儿童患者中唯一的血清标志物,也是aih的疾病活动标志及预后指标,是具有预测意义的血清标志物。lc-1抗体检测能通过早期诊断、建立个体化治疗方案以及指导撤药时机等来改善目前自身免疫性肝病的诊疗策略。
lc-1抗体的靶抗原为亚胺甲基四氢叶酸环化脱氢酶(formiminotransferasecyclodeaminase,ftcdorlc-1),分子量约为60kd,是一种四氢叶酸合成的双功能酶,涉及组氨酸和叶酸代谢,最初在人源细胞的细胞质中被发现。研究发现由于血清中lkm-1抗体的存在,可能会导致lc-1抗体的检测被掩盖,因此使用重组ftcd截短肽而非天然提取或者全长重组ftcd在免疫学检测中的检出率会更高。目前主流的检测方法包括化学发光法、间接免疫荧光法、对流免疫电泳检测、免疫沉淀反应、蛋白免疫印迹法和酶联免疫吸附测定(elisa),这些方法中存在ftcd不稳定、检测灵敏度低等问题。
技术实现要素:
为了解决现有对lc-1抗体的检测方法存在的检测灵敏度低,以及检测所采用亚胺甲基四氢叶酸环化脱氢酶不稳定的问题;本发明提供了一种亚胺甲基四氢叶酸环化脱氢酶截短蛋白的制备方法,通过该制备方法制备得到的亚胺甲基四氢叶酸环化脱氢酶截短蛋白性能稳定,检测灵敏度高。
本发明所采用的技术方案为:一种亚胺甲基四氢叶酸环化脱氢酶截短蛋白的制备方法,包括以下步骤:
s1:去除亚胺甲基四氢叶酸环化脱氢酶的mrna序列n端的543个碱基,得到第一mrna序列;
s2:根据营养组成型酵母的密码子偏好性对第一mrna序列进行截短基因序列的设计,得到全基因序列;
s3:在全基因序列的上游端加入第一限制性核酸内切酶位点且在其下游去掉终止密码子后加入第二限制性核酸内切酶位点,得到ftcd-c截短基因;
s4:将质粒采用ecori和xbai双酶切,得到剪切后的质粒;将ftcd-c截短基因采用ecori和xbai双酶切,得到剪切后的ftcd-c截短基因;
s5:将剪切后的质粒和剪切后的ftcd-c截短基因采用连接酶进行过夜连接,得到重组质粒;
s6:将重组质粒转化进大肠杆菌进行复制和抗性筛选,经过克隆测序验证,获得序列正确的重组质粒;
s7:将序列正确的重组质粒转化进入营养组成型酵母中,且进行抗性筛选,提取克隆子基因组并进行pcr验证,获得含外源基因正确同源重组的目的菌株;
s8:选取最佳表达时间且通过菌株分泌得到亚胺甲基四氢叶酸环化脱氢酶截短蛋白;
s9:纯化步骤s8得到的亚胺甲基四氢叶酸环化脱氢酶截短蛋白。
进一步限定,步骤s6中的验证是通过大肠杆菌dh5α进行转化和验证的。
进一步限定,步骤s2和步骤s7中的营养组成型酵母为毕赤酵母x33。
进一步限定,步骤s7中的抗性筛选是在含博来霉素的ypds平板上进行。
进一步限定,步骤s9具体为:利用螯合重金属镍的亲和树脂纯化步骤s8得到的亚胺甲基四氢叶酸环化脱氢酶截短蛋白。
进一步限定,步骤s7中通过聚合酶链式反应验证外源基因插入到酵母基因组的正确性。
进一步限定,所述第一限制性核酸内切酶位点为ecori的酶切位点,第二限制性核酸内切酶位点为xbai的酶切位点。
与现有技术相比,本发明的有益效果为:该亚胺甲基四氢叶酸环化脱氢酶截短蛋白在体外缓冲液中稳定性好,抗原抗体反应亲和力高;能提高lc-1抗体检测的灵敏度,且运用于检测试剂盒中可以提高检测试剂盒的灵敏度、稳定性和准确度。
本发明还公开了一种由前面所述的制备方法制备得到的亚胺甲基四氢叶酸环化脱氢酶截短蛋白。
本发明还公开了一种由前面所述的制备方法制备得到的亚胺甲基四氢叶酸环化脱氢酶截短蛋白在检测抗肝细胞溶质抗原ⅰ型抗体中的应用。
本发明还公开了一种抗肝细胞溶质抗原ⅰ型抗体检测试剂盒,包括前面所述的制备方法制备得到的亚胺甲基四氢叶酸环化脱氢酶截短蛋白。
附图说明
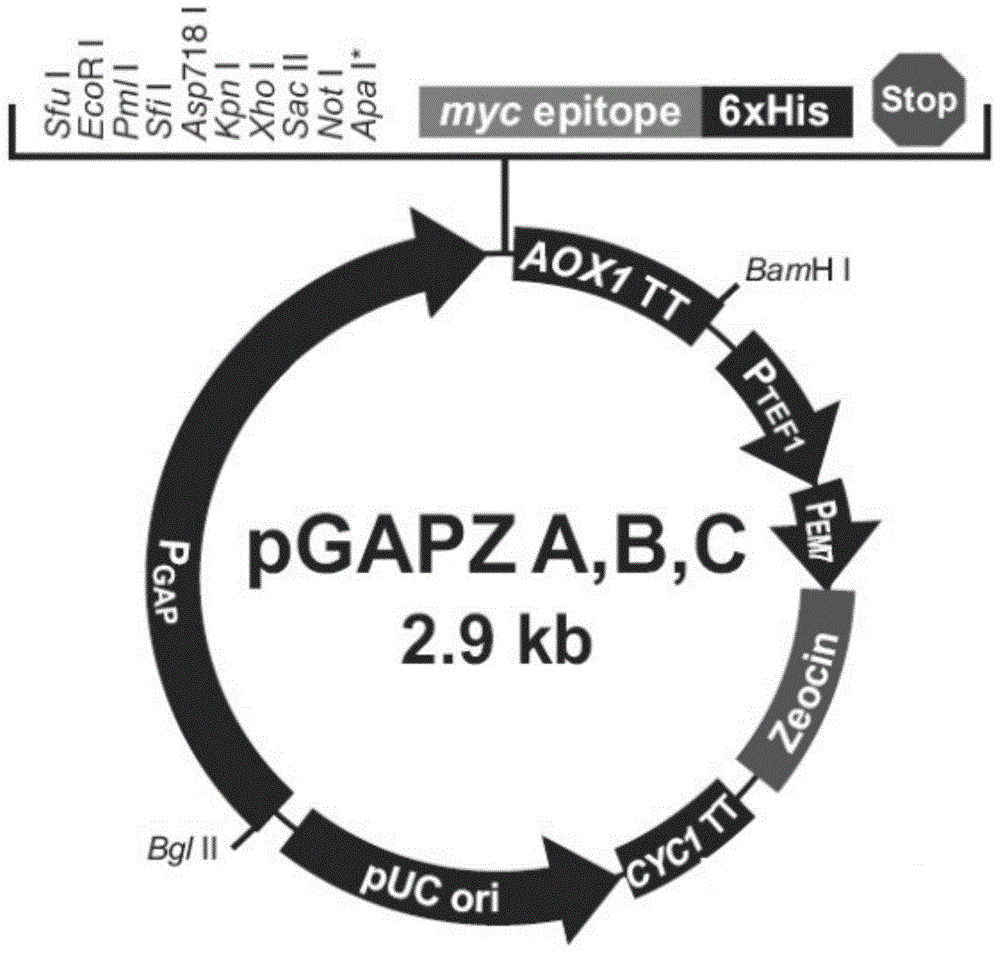
图1是质粒pgapza-a的质粒图;
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面对本发明的实施例进行详细、完整的描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
本技术领域技术人员可以理解,除非另外定义,这里使用的所有术语(包括技术术语和科学术语),具有与本发明所属领域中的普通技术人员的一般理解相同的意义。还应该理解的是,诸如通用字典中定义的那些术语,应该被理解为具有与现有技术的上下文中的意义一致的意义,并且除非被特定定义,否则不会用理想化或过于正式的含义来解释。
其中:亚胺甲基四氢叶酸环化脱氢酶截短蛋白英文简写为ftcd-c。
实施例1
一、ftcd-c截短蛋白的制备
1.ftcd-c截短基因的合成
1.1:根据美国国家生物技术信息中心(ncbi)的genbank,获取目的亚胺甲基四氢叶酸环化脱氢酶的蛋白信息(aaf15558)且去掉其n端的181氨基酸(即543个碱基)后,获得其c端截短蛋白序列;利用密码子优化软件dnaworks,根据毕赤酵母x33的密码子偏好性进行截短基因序列的设计,得到全基因序列;
1.2:在全基因序列上游端加入ecori的限制性核酸内切酶位点且在其下游去掉终止密码子后加入xbai的限制性核酸内切酶位点,得到ftcd-c截短基因;
其中,全基因序列如下:
gaattcctcattgcttttaacatcaacctgctcggcacaaaggagcaagcccaccgcatcgcgctcaacctgcgggagcagggccgcgggaaggaccagccaggacgtctgaagaaagttcagggcattggctggtacctggatgagaagaacctggctcaggtgtccaccaatcttctggactttgaggtcacggcactgcacacggtctacgaggagacctgccgagaagcacaggagctgagcctcccagtggtgggctcacagctggtgggcctggtgcccctgaaggctctgctggatgcggccgccttctactgcgagaaggagaacctcttcatcctggaggaggagcagcggatcaggctggtggtgagccggctgggcctggactccctgtgccccttcagccctaaggagcggatcatcgagtacctggtccctgagcgcgggcctgagcgaggcctgggcagcaagtccctgcgcgccttcgtgggggaggtgggtgcccgctctgcggcccccgggggcggctcggtggcggcggccgctgcggccatgggtgcggcgctgggctccatggtgggcctcatgacctacgggcggcgccaattccagtccctggacacgacgatgcggcgcctgatcccgcccttccgcgaggcttcggccaagctaaccacgctggtggatgccgacgccgaggccttcaccgcctacctggaagcaatgaggctccccaagaacacacctgaggaaaaggacaggcgcacggcggccctacaggagggtctgaggcgggcagtctctgtgccgctgacgctggcggagacggtggcctcgctgtggccggccctgcaggaactggcccggtgtgggaacctggcctgccggtcagacctccaggtggcggccaaagccctggagatgggcgtgtttggcgcatatttcaacgtgctcatcaacctgagggacatcacagacgaggcatttaaggaccagatccaccatcgtgtttccagcctcctgcaggaagccaagacccaggctgcactggtgctggactgcttggagacccggcaggagtctaga
氨基酸序列如下:
liafninllgtkeqahrialnlreqgrgkdqpgrlkkvqgigwyldeknlaqvstnlldfevtalhtvyeetcreaqelslpvvgsqlvglvplkalldaaafycekenlfileeeqrirlvvsrlgldslcpfspkeriieylvpergperglgskslrafvgevgarsaapgggsvaaaaaamgaalgsmvglmtygrrqfqsldttmrrlippfreasaklttlvdadaeaftayleamrlpkntpeekdrrtaalqeglrravsvpltlaetvaslwpalqelarcgnlacrsdlqvaakalemgvfgayfnvlinlrditdeafkdqihhrvssllqeaktqaalvldcletrqe
2.ftcd-c截短基因的克隆
2.1将ftcd-c截短基因采用ecori限制性内切酶和xbai限制性内切酶进行酶切;同时将质粒pgapza-a也采用ecori限制性内切酶和xbai限制性内切酶进行酶切;分别采用相应的试剂盒回收酶切后的ftcd-c截短基因和酶切后的质粒pgapza-a,将酶切后的ftcd-c截短基因和酶切后的质粒pgapza-a按照摩尔比3:1混合均匀,添加t4dna连接酶进行在温度为16℃的环境中进行过夜连接,得到重组质粒;其中,pgapza-a购买自invitrogen公司,质粒类型为毕赤酵母蛋白表达载体,载体大小:2884bp,产品目录号:v200-20。
2.2将重组质粒转化大肠杆菌dh5α感受态细胞中,重组质粒体积不应超过大肠杆菌dh5α感受态细胞体积的10%,轻旋混匀混合物;冰浴30分钟后,将ep管放入42℃水浴进行60秒热击,然后快速冰浴2分钟;接着加入400μl低盐lb培养基,在37℃和100rpm培养60分钟,使大肠杆菌dh5α复苏生长;最后离心去上清,用100μl培养基重悬菌体后,均匀涂布在含25μg/ml博来霉素的低盐lb平板上;
2.3将低盐lb平板倒置于37℃恒温培养箱,12-16小时过夜培养后,挑取单克隆进行聚合酶链式反应(pcr)验证重组质粒的正确转入,最后选取阳性克隆子培养并送测序公司进行测序验证,测序验证是证明前期基因合成和连接未引入突变,该序列和所列基因信息完全一样,得到正确重组质粒。
3.正确重组质粒的毕赤酵母x33转化
3.1将5-10μg的正确重组质粒进行avrii的单酶切线性化,通过琼脂糖电泳确认质粒线性化的完成;琼脂糖电泳图中只有一条显示带,表明线性化酶切进行彻底;
3.2依次通过酚氯仿抽提、无水乙醇-醋酸钠沉淀和75%乙醇洗涤的步骤,获取高质量的线性化重组质粒片段,保存于负20℃待用;
3.3制备新鲜毕赤酵母x33感受态细胞(详细见invitrogen说明书),用预冷的山梨醇进行重选,分装为80μl/管;
3.4将10μl蒸馏水溶解的线性化重组质粒片段溶液添加到毕赤酵母x33感受态细胞中,轻旋混匀,冰浴5分钟,在1.8kv电击作用下,转化进毕赤酵母x33细胞中,然后迅速用预冷的1ml山梨醇缓冲液缓慢重选,得到混悬液;其中线性化重组质粒片段溶液中线性化重组质粒片段的质量为5-10μg;
3.5将混悬液转移至15ml培养管中,静止在30℃培养2小时;
3.6培养液离心去上清,将毕赤酵母x33感受态细胞均匀涂布于含100μg/ml博来霉素的ypds平板上,在30℃倒置培养2-3天;
3.7选取10-20个在100μg/ml博来霉素的ypds平板上培养得到的毕赤酵母x33克隆子,用含不同博来霉素浓度(100、200、500、1000μg/ml)的ypd液体培养基进行抗性复筛,选取耐受高浓度的毕赤酵母x33克隆子,最后利用pcr扩增,验证线性化重组质粒片段通过正确同源重组插入到毕赤酵母x33的染色体上。
4.正确重组质粒在毕赤酵母x33中表达
4.1挑取正确同源重组的毕赤酵母x33转化子划线到含100μg/ml博来霉素的ypd平板上,30℃培养2-3天;
4.2选取纯化单克隆到小体积5ml液体ypd培养基中,30℃过夜培养;
4.3转移1/1000体积的新鲜毕赤酵母x33到三角瓶中进行表达,培养液体积不超过瓶子容量的1/5,且向其中加入步骤4.2中的经过过夜培养得到的培养液;在30℃和200rpm条件下,培养0天、1天、2天、3天和4天的各时间点,分别吸取1ml培养液,离心,分别保存上清液和菌体沉淀到-20℃,待样本收集完成后,统一进行蛋白活性和聚丙烯酰胺凝胶电泳(sds-page胶)的检测。
5.ftcd-c截短蛋白的纯化
5.1将步骤4.3中最终得到的毕赤酵母x33培养液,在5000g和4℃条件下,离心20分钟收集培养上清粗蛋白溶液;
5.2将上清粗蛋白溶液用浓缩管(10kda)进行平衡缓冲液(50mmtris-hcl,300mmnacl,ph7.5)的置换和浓缩,离心(4000g和4℃)多轮次后,体积浓缩到30ml内;
5.3将上清粗蛋白溶液与已经用平衡缓冲液清洗过的ni-nta树脂混匀,孵育4℃过夜;次日,将树脂粗酶混合物转移到空心柱中;
5.4依次用5个柱体积平衡缓冲液(50mmtris-hcl,300mmnacl,ph7.5)和2个柱体积wash缓冲液(20mm咪唑,50mmtris-hcl,300mmnacl,ph7.5)进行缓慢清洗,控制流速在0.5~1ml/min,清洗完成后得到ftcd-c截短蛋白;
5.5用洗脱缓冲液(250mm咪唑,50mmtris-hcl,300mmnacl,ph7.5)洗脱步骤5.4得到的ftcd-c截短蛋白,收集含ftcd-c截短蛋白的洗脱组分,然后进行1×pbs的透析,得到纯化的ftcd-c截短蛋白且保存于-80℃下。
5.6利用sds-page电泳检测纯化的ftcd-c截短蛋白大小和纯度,并测定纯化的ftcd-c截短蛋白的浓度。
二、ftcd-c截短蛋白的性能评价
采用前述所制备得到的ftcd-c截短蛋白以及未截短的亚胺甲基四氢叶酸环化脱氢酶作为检测物,其中前述所制备得到的ftcd-c截短蛋白为优化后,未截短的亚胺甲基四氢叶酸环化脱氢酶为优化前;
1.ftcd-c截短蛋白在lc-1抗体检测中效价确认
表1.ftcd-c截短蛋白在lc-1抗体检测中效价
由表1可得出:优化后的ftcd-c截短蛋白的亲和力比优化前提高了约1.5倍,信噪比比优化前提高约1.47倍,通过计算公式计算得出检测灵敏度(lod)提高了1.53倍,即优化后的ftcd-c截短蛋白的灵敏度明显高于优化前的灵敏度。
其中,计算公式可以参考行业标准中最低检测限的测定方法:用零浓度校准品或样本稀释液作为样本进行检测,重复测定20次,得出20次测量结果的rlu值(相对发光值),计算其平均值(cm)和标准差(sd),得出cm+2sd所对应的rlu值,根据试剂盒所用校准品的定标曲线方程或根据零浓度校准品与相邻校准品之间的浓度差-rlu值结果进行两点回归拟合得出一次方程,将cm+2sd所对应的rlu值带入上述方程中,求出对应的浓度值,即为最低检测限;只需要将零浓度校准品或样本稀释液换成标曲浓度即可,最终拟合出的一次方程就是检测灵敏度(lod)的计算公式。
2.ftcd-c截短蛋白在lc-1抗体检测中的稳定性评定
表2.ftcd-c截短蛋白优化前稳定性
表3.ftcd-c截短蛋白优化后稳定性
由表2和表3对比可知,优化后的ftcd-c截短蛋白稳定性优于优化前的稳定性;特别是在37℃加速7天的稳定性达到85%左右,优化前是30%左右,由此可知,相同条件下,优化后的ftcd-c截短蛋白的稳定性明显优于优化前的稳定性。
本发明不局限于上述可选实施方式,任何人在本发明的启示下都可得出其他各种形式的产品,但不论在其形状或结构上作任何变化,凡是落入本发明权利要求界定范围内的技术方案,均落在本发明的保护范围之内。
序列表
<110>四川携光生物技术有限公司
<120>亚胺甲基四氢叶酸环化脱氢酶截短蛋白及其制备方法,应用
<160>1
<170>siposequencelisting1.0
<210>1
<211>907
<212>dna
<213>毕赤酵母x33(pichiapastorisx33)
<400>1
aacccagcaacacaaccgccggcacaaaggagcaagcccaccgcacgcgccaaccgcggg60
agcagggccgcgggaaggaccagccaggacgcgaagaaagcagggcaggcggaccggaga120
gaagaaccggccagggccaccaaccggacgaggcacggcacgcacacggcacgaggagac180
cgccgagaagcacaggagcgagcccccaggggggccacagcgggggccgggccccgaagg240
ccgcggagcggccgcccacgcgagaaggagaaccccaccggaggaggagcagcggacagg300
cgggggagccggcgggccggaccccggcccccagcccaaggagcggacacgagaccggcc360
cgagcgcgggccgagcgaggccgggcagcaagcccgcgcgcccggggggaggggggcccg420
ccgcggcccccgggggcggccggggcggcggccgcgcggccaggggcggcgcgggcccag480
ggggcccagaccacgggcggcgccaaccagcccggacacgacgagcggcgccgacccgcc540
cccgcgaggccggccaagcaaccacgcggggagccgacgccgaggcccaccgccaccgga600
agcaagaggcccccaagaacacaccgaggaaaaggacaggcgcacggcggcccacaggag660
ggcgaggcgggcagccggccgcgacgcggcggagacggggcccgcgggccggcccgcagg720
aacggcccggggggaaccggccgccggcagaccccaggggcggccaaagcccggagaggg780
cggggcgcaacaacggccacaaccgagggacacacagacgaggcaaaggaccagaccacc840
acggccagccccgcaggaagccaagacccaggcgcacgggcggacgcggagacccggcag900
gagcaga907
- 还没有人留言评论。精彩留言会获得点赞!