一种嵌合蛋白及其制备方法和应用与流程
本发明涉及生物蛋白纤维技术领域,具体涉及一种嵌合蛋白及其制备方法和应用。
背景技术:
生物蛋白纤维是天然蛋白或其结构类似物形成的一种新型纤维,具有很好的生物相容性,且生产过程摆脱了石油资源限制能够实现可持续发展。其中,来源于生物力学结构蛋白的纤维材料具有低密度、高力学强度和强延展性等优点。与化学合成纤维相比,其机械性能实现了高强度和高韧性的结合,有望代替传统纤维成为下一代高技术材料。
目前对于高强天然蛋白纤维及其仿生的研究主要集中于蛛丝,尤以牵引丝最为普遍。天然蛛丝具有优异的机械性能,拉伸强度高达1.0-1.7gpa,延展性可达58%-69%,其力学性能远超蚕丝。然而,由于天然蛛丝的产量较低且蜘蛛无法像家蚕一样进行群体饲养,人造蛛丝纤维制备主要通过表达重组蛛丝蛋白并进行人工纺丝来实现。蜘蛛大壶状腺产生的牵引丝因机械性能优异得到普遍研究。两种ma(majorampullate)蛋白—masp1和masp2决定了牵引丝的力学性能,这两种蛋白的序列、结构及其与纤维力学性能之间的关系得到了深入研究。目前,通过细菌、哺乳动物细胞、转基因家蚕等多种宿主系统实现了外源ma蛋白的表达。同时,还开发出一系列纺丝方法用于生物纤维的制备,如静电纺丝、湿法纺丝、干法纺丝、熔融纺丝等。
然而,制造机械性能与天然蛛丝相似的人造蜘蛛丝纤维,几十年来一直是材料科学未达到的目标。主要原因有以下两方面:1)与天然蛛丝蛋白相比,异源宿主系统表达的重组蛋白分子量低或存在末端结构域缺失,导致蛋白高级结构形成受限、水溶性不高。2)目前的纺丝过程多在有机溶剂环境下进行,与生理条件相差甚远;且对于天然蛛丝纺丝系统包括体内化学环境、流变特性及物理压力等的认识不足,目前尚无法实现体外模拟。简言之,目前生产的重组蛛丝纤维由于机械性能差、再现性低或两者兼而有之,所生产的纤维很少或根本不能用于实际用途。因此,开发用于仿生纤维生产的、非蛛丝蛋白的替代结构蛋白是一个全新的、有意义的研究方向。
技术实现要素:
有鉴于此,本发明的目的在于提供一种嵌合蛋白及其制备方法,使得所述嵌合蛋白可用于制备高力学性能的生物蛋白纤维,所制得的生物蛋白纤维在断裂强度、杨氏模量、韧性和延展性上具备较佳水平,特别是在断裂强度上具备优异的性能;
本发明的另外一个目的在于提供上述嵌合蛋白在制备生物蛋白纤维中的应用以及一种具备优异力学性能的生物蛋白纤维。
为了实现上述目的,本发明提供如下技术方案:
一种嵌合蛋白,由一个或两个以上的elp-srt蛋白单元或srt-elp蛋白单元组成。
鱿鱼环齿蛋白(srt)从鱿鱼触手吸盘中提取得到,具有高度重复的模块化结构,每个重复模块均包含晶体结构域和非晶体的无定型结构域。晶体结构域含有较多丙氨酸,最终堆叠形成β-sheets结构;无定形部分富含甘氨酸和酪氨酸,最终形成不规则的柔性结构。srt蛋白的序列和结构特征为开发嵌合体蛋白提供了可能性。嵌合蛋白的设计和构建不仅有利于重组表达的过程,同时可以整合不同蛋白的结构和功能,该方法为制备具有优异力学性能的蛋白纤维提供了新策略。
对于srt蛋白的材料研究目前主要利用其高模量与热塑性来制备膜材料,尚无针对纤维材料的研究。鉴于srt独立的模块化结构,本发明选取srt蛋白中晶体结构域序列,同时融合类弹性蛋白多肽序列,后者由五肽重复单元vpgkg组成,其中赖氨酸残基(lysine,k)的游离氨基提供了戊二醛交联位点。通过表达系统得到的嵌合蛋白srt-elp/elp-srt具有较高的水溶性,可在水相条件下进行纺丝,避免了有机溶剂带来的蛋白结构破坏。最终,采用戊二醛交联法可成功制备了一系列srt-elp/elp-srt蛋白纤维。经过本发明证实嵌合蛋白交联而成的生物蛋白纤维的断裂强度和韧性优于许多重组蛛丝,甚至可以与一些天然蛛丝相媲美。
在本发明具体实施方式中,所述elp蛋白序列如seqidno:1所示,所述srt蛋白序列如seqidno:2所示。
作为优选,每个蛋白单元之间直接相连、通过连接蛋白连接或两种方式组合使用连接;每个蛋白单元中,elp蛋白与srt蛋白之间直接相连或通过连接蛋白连接。在本发明具体实施方式中,每个蛋白单元之间直接相连,elp蛋白与srt蛋白之间也直接相连。
同时,在嵌合蛋白的一端或两端引入半胱氨酸可以使蛋白多聚化,利用这种巧妙的方式来提升分子量,同样能够让力学性能提高。
基于上述嵌合蛋白的优势,本发明提出了所述嵌合蛋白在制备生物蛋白纤维中的应用。
根据应用,本发明提供了一种生物蛋白纤维,由本发明所述嵌合蛋白经戊二醛交联后获得。elp蛋白由五肽重复单元vpgkg组成,其中赖氨酸残基(lysine,k)的游离氨基提供了戊二醛交联位点,通过戊二醛将所有嵌合蛋白交联起来形成性能优越的纤维。所述生物蛋白纤维的制备方法为将所述嵌合蛋白与戊二醛溶液中交联,获得所述生物蛋白纤维。其中,所述嵌合蛋白以浓度为100~300mg/ml的蛋白溶液进行交联,更优选为200mg/ml。
作为优选,为了进一步提高力学性能,制备过程中将所述嵌合蛋白与低浓度的戊二醛溶液进行预交联,然后再与高浓度的戊二醛溶液中交联制备纤维,获得所述生物蛋白纤维。在本发明具体实施方式中,所述低浓度的戊二醛溶液浓度为0.01-0.1%,高浓度的戊二醛溶液为0.5-1%。
为了让本发明生物蛋白纤维变得更加均匀,取向变得一致,有助于其力学性能的提升,本发明在经过戊二醛交联后还包括将所述生物蛋白纤维进行后拉伸。在本发明具体实施方式中,所述后拉伸为将生物蛋白纤维在超纯水中浸泡至纤维蜷缩变软,再将纤维拉伸到原长的50%至150%。
此外,本发明还提供了所述嵌合蛋白的制备方法,包括:
步骤1、构建elp-srt蛋白单元或srt-elp蛋白单元的编码序列,以及酶切位点1、同源臂1、酶切位点2、同源臂2、酶切位点3、终止密码子对应的dna编码序列和酶切位点4;
步骤2、依次连接酶切位点1、同源臂1、酶切位点2、elp-srt蛋白单元/srt-elp蛋白单元编码序列、同源臂2、酶切位点3、终止密码子对应的dna编码序列和酶切位点4,组成酶切位点1+同源臂1+酶切位点2+elp-srt蛋白单元/srt-elp蛋白单元编码序列+同源臂2+酶切位点3+终止密码子对应的dna编码序列+酶切位点4的基因元件1;
其中,所述酶切位点1和酶切位点4依据所选择的表达载体确定,酶切位点3选择与酶切位点1和酶切位点4不同的酶切位点;所述同源臂1任意设计,所述酶切位点2与其余酶切位点不同且选择3’末端为起始密码子对应的dna编码序列的酶切位点;所述同源臂2选自elp-srt蛋白单元/srt-elp蛋白单元编码序列5’端的部分序列;
步骤3、将步骤2所述基因元件1通过酶切位点1和酶切位点4的双酶切转移至表达载体中,获得嵌合蛋白单体表达载体,转化宿主诱导蛋白表达可获得具有一个elp-srt蛋白单元或srt-elp蛋白单元的嵌合蛋白;
步骤4、将所述嵌合蛋白单体表达载体通过酶切位点1和酶切位点3的双酶切获得同源臂1+酶切位点2+elp-srt蛋白单元/srt-elp蛋白单元编码序列+同源臂2的基因元件2,在重组酶的作用下与经过酶切位点2单酶切的嵌合蛋白单体表达载体进行同源重组,获得嵌合蛋白二聚体表达载体;按照本步骤的方法不断同源重组基因元件2可获得嵌合蛋白多聚体表达载体;转化宿主诱导蛋白表达可获得具有两个以上elp-srt蛋白单元或srt-elp蛋白单元的嵌合蛋白。此外,还可在嵌合蛋白n聚体表达载体的基础上通过酶切位点1和酶切位点3的双酶切获得嵌合蛋白n聚体,经过与嵌合蛋白m聚体表达载体同源重组获得嵌合蛋白(m+n)聚体表达载体(m和n独立选自大于等于2的整数),这样的方式效率会更高,其实质与本发明上述方法相同。
作为优选,还包括在所述elp-srt蛋白单元/srt-elp蛋白单元编码序列的一端或两端添加半胱氨酸的编码序列。
在本发明具体实施方式中,所述表达载体可选择为m13(即pbluescriptiiks(+)质粒)和pet25b市售载体质粒,酶切位点1和4的选择也根据所选择的载体质粒上具备的酶切位点来确定,如上述提到的两个质粒载体中的xbai和ecori酶切位点;而酶切位点2在本发明中具体选择ndei酶切位点,其3’末端的序列为atg,对应于起始密码子aug;所述终止密码子对应的dna编码序列为taatga,对应于终止密码子uaa和uga;
为了方便检测嵌合蛋白单体、二聚体乃至多聚体表达载体是否成功构建,本发明还在酶切位点3和终止密码子对应的dna编码序列之间插入筛选标签用于验证,筛选标签可选择本领域常用的标签,如组氨酸标签。
由以上技术方案可知,本发明从仿生角度出发,利用基因重组技术,设计了一种非天然纤维来源、非蛛丝序列的嵌合蛋白,通过戊二醛的交联制造轻质、超强的生物纤维,其性能超过了许多重组蛛丝、重组蚕丝,甚至可以与天然蚕丝,乃至部分天然蛛丝相媲美。
附图说明
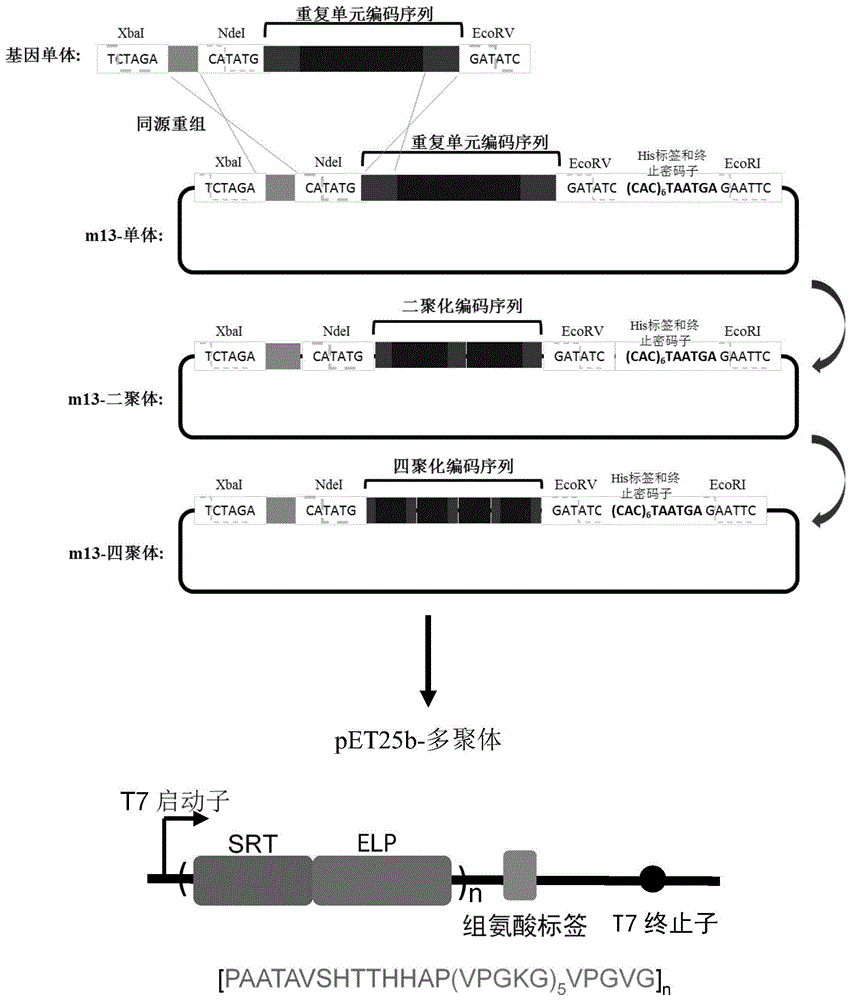
图1所示为本发明嵌合蛋白多聚体表达载体构建示意图;其中,重复单元编码序列即为srt-elp蛋白单元编码序列+同源臂2;基因单体即为基因元件2;
图2所示为本发明生物蛋白纤维的制备流程示意图;
图3所示为本发明多聚体嵌合蛋白的sds-page结果;其中,二聚体为两端带有半胱氨酸的嵌合蛋白通过二硫键共价交联形成;
图4-图8所示依次为srt-elp12聚体的嵌合蛋白、srt-elp24聚体的嵌合蛋白、srt-elp36聚体的嵌合蛋白、两端带有半胱氨酸的srt-elp24聚体的嵌合蛋白、两端带有半胱氨酸的srt-elp36聚体的嵌合蛋白制备的生物蛋白纤维的力学拉伸测试曲线。
具体实施方式
本发明公开了一种嵌合蛋白及其制备方法和应用,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明所述嵌合蛋白及其制备方法和应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文所述免疫抗原及其制备方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
本发明中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。
以下就本发明所提供的一种嵌合蛋白及其制备方法和应用做进一步说明。
实施例1:表达载体构建
构建srt-elp蛋白单元的编码序列(srt蛋白编码序列seqidno:3+elp蛋白编码序列seqidno:4),以及xbai酶切位点(tctaga)、同源臂1(ctgcaggaattcgttatc,seqidno:5所示)、ndei酶切位点(catatg)、同源臂2(seqidno:3序列1-21bp)、ecorv酶切位点(gatatc)、组氨酸标签序列((cac)6)、终止密码子对应的dna编码序列(taatga)和ecori酶切位点(gaattc),所有元件连接获得基因元件1,xbai+同源臂1+ndei+srt-elp蛋白单元编码序列+同源臂2+ecorv+(cac)6+taatga+ecori;通过xbai和ecori双酶切将基因元件1和m13质粒连接,获得嵌合蛋白单体载体(m13-单体);
通过xbai和ecorv双酶切从m13-单体上获得基因元件2,基因元件2与经过ndei酶切的m13-单体,在购自vazyme公司的重组酶clonexpressⅱ(在体外由重组酶催化的同源重组反应只能在载体切口附近~10bp以内的位置进行)作用下,依据同源臂1和同源臂2进行同源重组,获得嵌合蛋白二聚体载体(m13-二聚体);
通过xbai和ecorv双酶切从m13-二聚体上获得嵌合蛋白二聚体片段,嵌合蛋白二聚体片段与基因元件2相比多了一个srt-elp蛋白单元的编码序列,嵌合蛋白二聚体片段与经过ndei酶切的m13-二聚体,在购自vazyme公司的重组酶clonexpressⅱ(在体外由重组酶催化的同源重组反应只能在载体切口附近~10bp以内的位置进行)作用下,依据同源臂1和同源臂2进行同源重组,获得嵌合蛋白四聚体载体(m13-四聚体);
按照上述方式可不断获得嵌合蛋白八聚体载体(m13-八聚体)、嵌合蛋白十二聚体载体(m13-十二聚体)、嵌合蛋白十六聚体载体(m13-十六聚体)等更多的载体,构建流程示意图见图1。各嵌合蛋白多聚体载体再通过xbai和ecori双酶切连接到pet25b质粒上,形成表达载体pet25b-多聚体,准备转入到大肠杆菌表达系统进行iptg诱导表达。
实施例2:蛋白表达和纯化
表达载体“pet25b-多聚体”转化大肠杆菌感受态细胞e.coliblr(de3)。挑取阳性克隆在10mllb培养基(100μg/ml氨苄西林)中培养8-12小时(37℃,220rpm),摇瓶体积为100ml,待菌液od600至4-5时,将其转移至含500mllb培养基(200μg/ml氨苄西林)大摇瓶(体积为500ml)中培养1.5-3小时后(37℃,220rpm),待菌液od600至0.5-0.7时添加诱导剂iptg(isopropylβ-d-1-thiogalactopyranoside,异丙基硫代半乳糖苷)至终浓度为1mm,诱导蛋白大量表达,发酵培养4小时后(37℃,220rpm)将菌液离心(7000g,20min,4℃),将菌体保存在-80℃。
菌体超声破碎后离心(11000g,30min,4℃)取上清,上清液依次经过镍柱,除盐柱,阳离子交换柱,除盐柱进行精细纯化,最终将srt-elp多聚体嵌合蛋白水溶液置于-80℃冷冻并冻干。
实施例3:生物蛋白纤维的制备
将初始质量浓度为0.1%戊二醛水溶液加入到srt-elp多聚体的蛋白水溶液(200mg/ml)中,戊二醛终浓度稀释至质量浓度为0.01%,交联10min。
将经过预交联后的蛋白水溶液用注射器挤入质量浓度为0.5%戊二醛水溶液(凝固浴)中,并用注射泵调节推进速度为10μl/min,用转筒收集器以线速度为0.6m/min的速度来收集纤维,示意图将图2。
将收集到的纤维晾干,将其至于超纯水中浸泡三秒至纤维蜷缩变软,随后将纤维取出立即后拉伸至原长的100%。
实施例4:本发明生物蛋白纤维的检测
参照实施例1-3的制备方式用srt-elp12聚体的嵌合蛋白(含12个srt-elp蛋白单元)、srt-elp24聚体的嵌合蛋白(含24个srt-elp蛋白单元)、srt-elp36聚体的嵌合蛋白(含36个srt-elp蛋白单元)、两端带有半胱氨酸的srt-elp24聚体的嵌合蛋白(含24个srt-elp蛋白单元且两端有半胱氨酸)、两端带有半胱氨酸的srt-elp36聚体的嵌合蛋白(含36个srt-elp蛋白单元且两端有半胱氨酸)制备多种生物蛋白纤维,然后对各多聚体蛋白进行sds凝胶电泳检测和分析,对制备成的纤维进行力学性能检测,结果见图3-图8以及表1和表2。
表1
由图3和表1结果可知,所得蛋白分子量与预期相符,但由于赖氨酸的存在使嵌合蛋白带有多个正电荷,因此电泳时条带位置靠上,同时说明带有半胱氨酸的蛋白,可通过二硫键共价连接形成二聚体。
表2
由图4-8及其汇总的表2结果可知,随着分子量的提升,纤维的力学性能发生了显著地提高,并且通过在蛋白两端引入半胱氨酸可以使蛋白多聚化,利用这种巧妙的方式来提升分子量,同样能够让力学性能提高。
实施例5:本发明生物蛋白纤维与其它产品的性能对比
对比本发明采用两端带半胱氨酸的36聚体嵌合蛋白制备的生物蛋白纤维、天然蚕丝、重组蚕丝、蛛丝以及重组蛛丝和尼龙,在断裂强度、杨氏模量、韧性和延展性方面的性能;
其中,蛛丝数据来源于文献:hayashi,cheryly.,todda.blackledge,andrandolphv.lewis.2004.“molecularandmechanicalcharacterizationofaciniformsilk:uniformityofiteratedsequencemodulesinanovelmemberofthespidersilkfibroingenefamily.”molecularbiologyandevolution21(10):1950–59
重组蚕丝1数据来源于:madurga,rodrigo,alfonsom.
重组蚕丝2数据来源于:ling,shengjie,zhaoqin,chunmeili,wenwenhuang,davidl.kaplan,andmarkusj.buehler.2017.“polymorphicregeneratedsilkfibersassembledthroughbioinspiredspinning.”naturecommunications8(1):1387.
重组蛛丝1数据来源于:xia,xiaoxia,zhigangqian,changseokki,younghwanpark,davidl.kaplan,andsangyuplee.2010.“native-sizedrecombinantspidersilkproteinproducedinmetabolicallyengineeredescherichiacoliresultsinastrongfiber.”proceedingsofthenationalacademyofsciencesoftheunitedstatesofamerica107(32):14059–63.
重组蛛丝2数据来源于:marthageffers,gregorlang,andthomasscheibel.2015.“biomimeticfibersmadeofrecombinantspidroinswiththesametoughnessasnaturalspidersilk.”advancedmaterials27(13):2189–94.
重组蛛丝3数据来源于:lin,zhi,qinqiudeng,xiangyangliu,anddaiwenyang.2013.“engineeredlargespidereggcasesilkproteinforstrongartificialfibers.”advancedmaterials25(8):1216–20.
重组蛛丝4数据来源于:copeland,camerong.,briannee.bell,chadd.christensen,andrandolphv.lewis.2015.“developmentofaprocessforthespinningofsyntheticspidersilk.”acsbiomaterialsscienceandengineering1(7):577–84.
重组蛛丝5数据来源于:andersson,marlene,qiupinjia,anaabella,xiauyeenlee,michaellandreh,pasipurhonen,hanshebert,etal.2017.“biomimeticspinningofartificialspidersilkfromachimericminispidroin.”naturechemicalbiology13(3):262–64.
结果见表3;
表3
“-”表示文献未记载该项数据;
由上表可以看出,本发明生物蛋白纤维从断裂强度、模量、延展性等方面综合考量,性能优于天然蚕丝、蛛丝、重组蚕丝、蛛丝以及尼龙,特别是在断裂强度上具备极其优异的性能。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
序列表
<110>中国科学院长春应用化学研究所
<120>一种嵌合蛋白及其制备方法和应用
<130>mp2004484
<160>5
<170>siposequencelisting1.0
<210>1
<211>30
<212>prt
<213>人工序列(artificialsequence)
<400>1
valproglylysglyvalproglylysglyvalproglylysglyval
151015
proglylysglyvalproglylysglyvalproglyvalgly
202530
<210>2
<211>14
<212>prt
<213>人工序列(artificialsequence)
<400>2
proalaalathralavalserhisthrthrhishisalapro
1510
<210>3
<211>42
<212>dna
<213>人工序列(artificialsequence)
<400>3
ccagctgccacagctgtcagccacaccacccatcatgctcct42
<210>4
<211>90
<212>dna
<213>人工序列(artificialsequence)
<400>4
gtaccgggtaaaggcgtgccgggcaaaggtgttccaggcaaaggcgttccgggcaaaggc60
gtgccgggtaaaggcgtgccgggtgtgggt90
<210>5
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>5
ctgcaggaattcgttatc18
- 还没有人留言评论。精彩留言会获得点赞!