一种血小板生成素拟肽-Fc融合蛋白的制备方法与流程
一种血小板生成素拟肽-fc融合蛋白的制备方法
技术领域
1.本发明涉及蛋白制备领域,具体涉及一种血小板生成素拟肽-fc融合蛋白的制备方法。
背景技术:
2.原发免疫性血小板减少症是一种常见血液系统疾病,可发生于不同年龄、不同性别、不同种族,原先被称为“特发性血小板减少性紫癜(idiopathic thrombocytopenic purpura,itp)”。近年,国际itp工作组建议将其定名为原发免疫性血小板减少(immune thrombocyto penia),保留原缩写itp。以血小板计数减少及全身皮肤、黏膜、内脏出血为主要临床表现,严重者可出现致命性胃肠道和颅内出血。目前该病治疗的主要目的是减少血小板破坏以及促进血小板生成,常规治疗方案包括糖皮质激素、静脉丙种球蛋白、利妥昔单抗、硫唑嘌呤、环磷酰胺、达那唑、环孢素和切脾术等,尽管上述药物或治疗方式通常是有用的,但对有些患者效果却不明显。
3.研究表明,血小板生成素拟肽-fc融合蛋白能够促进血小板的生成,有效地治疗在原发免疫性血小板减少症。血小板生成素拟肽-fc融合蛋白是抗体的“fc”区结修饰血小板生成素拟肽构建而成,fc区可延长血小板生成素拟肽的半衰期和提升稳定性等。
4.然而,在现有的血小板生成素拟肽-fc融合蛋白的制备和纯化工艺中,存在许多缺点,如杂质较高,且收率极低,成本高,不利于工业化生产,从而限制了血小板生成素拟肽-fc融合蛋白的制备和应用。
5.因此,本领域需要开发一种制备工艺简单、高收率、高纯度且利于工业化生产的血小板生成素拟肽-fc融合蛋白的制备方法。
技术实现要素:
6.本发明的目的在于提供一种制备工艺简单、高收率、高纯度且利于工业化生产的血小板生成素拟肽-fc融合蛋白的制备方法。
7.本发明第一方面,提供一种血小板生成素拟肽-fc融合蛋白的制备方法,所述的方法包括步骤:
8.(6)将血小板生成素拟肽-fc融合蛋白提取液依次经过第一阳离子交换树脂柱层析、疏水柱层析和第二阳离子交换树脂柱层析纯化,得到血小板生成素拟肽-fc融合蛋白。
9.在另一优选例中,所述的血小板生成素拟肽-fc融合蛋白为人源血小板生成素拟肽-fc融合蛋白。
10.在另一优选例中,所述的方法制备血小板生成素拟肽-fc融合蛋白的初度≥95%,较佳地≥97%,更佳地≥98%,更佳地≥99%。
11.在另一优选例中,所述的血小板生成素拟肽-fc融合蛋白提取液为菌体提取液
12.在另一优选例中,所述的血小板生成素拟肽-fc融合蛋白提取液为含有血小板生成素拟肽-fc融合蛋白的菌体提取液。
13.在另一优选例中,所述的血小板生成素拟肽-fc融合蛋白提取液为对含有血小板生成素拟肽-fc融合蛋白的菌体进行提取获得提取液。
14.在另一优选例中,所述为菌体为大肠杆菌菌体。
15.在另一优选例中,所述为菌体为含有表达血小板生成素拟肽-fc融合蛋白的基因的大肠杆菌工程菌。
16.在另一优选例中,所述的基因选自下组:dna、mrna,或其组合。
17.在另一优选例中,所述的表达血小板生成素拟肽-fc融合蛋白的dna的核苷酸序列如seq id no:1所示。
18.在另一优选例中,所述的血小板生成素拟肽-fc融合蛋白的氨基酸序列如seq id no:2所示。
19.在另一优选例中,所述的第一阳离子交换树脂柱层析的填料选自下组:sp sepharose fast flow、sp sepharose high performance、source 30s、cm sepharose fast flow、capto s、toyopearl gigacap s-650m,或其组合。
20.在另一优选例中,所述第一阳离子交换树脂柱层析的洗脱液为a液和b液。
21.在另一优选例中,所述第一阳离子交换树脂柱层析的洗脱为a液和b液的梯度洗脱;
22.其中,a液为含有无机盐的醋酸-醋酸钠缓冲液;b液为含有无机盐的醋酸-醋酸钠缓冲液。
23.在另一优选例中,b液的洗脱浓度从5-45(v/v)%。
24.在另一优选例中,a液和b液的洗脱体积为20-40个柱体积,较佳地25-35个柱体积,更佳地28-32个柱体积。
25.在另一优选例中,所述a液的ph为4.0-6.0,较佳地4.5-5.8,更佳地4.8-5.8,更佳地5.0-5.8,更佳地5.3-5.8,最佳地5.5。
26.在另一优选例中,在所述a液中,所述无机盐的浓度为20-80mm,较佳地30-70mm,更佳地40-60mm,最佳地45-65mm。
27.在另一优选例中,在所述a液中,所述的醋酸-醋酸钠缓冲液的浓度为5-50mm(以醋酸根计),较佳地10-45mm,更佳地10-40mm,更佳地15-35mm,最佳地20-30mm。
28.在另一优选例中,在所述a液中,所述的无机盐选自下组:氯化盐、硫酸盐、硫酸氢盐、硝酸盐、磷酸氢盐,或其组合。
29.在另一优选例中,在所述a液中,所述的无机盐选自下组:钠盐、钾盐、钙盐、镁盐、铵盐,或其组合。
30.在另一优选例中,在所述a液中,所述的无机盐选自下组:氯化钠、氯化钾、氯化钙、氯化镁、氯化胺,或其组合。
31.在另一优选例中,所述b液的ph为4.0-6.0,较佳地4.5-5.8,更佳地4.8-5.8,更佳地5.0-5.8,更佳地5.3-5.8,最佳地5.5。
32.在另一优选例中,在所述b液中,所述无机盐的浓度为200-800mm,较佳地300-700mm,更佳地400-600mm,最佳地450-550mm。
33.在另一优选例中,在所述b液中,所述的醋酸-醋酸钠缓冲液的浓度为5-50mm(以醋酸根计),较佳地10-45mm,更佳地10-40mm,更佳地15-35mm,最佳地20-30mm。
34.在另一优选例中,在所述b液中,所述的无机盐选自下组:氯化盐、硫酸盐、硫酸氢盐、硝酸盐、磷酸氢盐,或其组合。
35.在另一优选例中,在所述b液中,所述的无机盐选自下组:钠盐、钾盐、钙盐、镁盐、铵盐,或其组合。
36.在另一优选例中,在所述b液中,所述的无机盐选自下组:氯化钠、氯化钾、氯化钙、氯化镁、氯化胺,或其组合。
37.在另一优选例中,在将血小板生成素拟肽-fc融合蛋白提取液上样于第一阳离子交换树脂柱之前,用所述a液对所述第一阳离子交换树脂柱层析的填料进行平衡。
38.在另一优选例中,将血小板生成素拟肽-fc融合蛋白提取液上样于第一阳离子交换树脂柱后,先用所述a液对所述的第一阳离子交换树脂柱进行平衡,然后再进行洗脱。
39.在另一优选例中,将血小板生成素拟肽-fc融合蛋白提取液上样于第一阳离子交换树脂柱后,先用所述a液对所述的第一阳离子交换树脂柱进行平衡3-7个,较佳地4-6个柱体积,然后再进行洗脱。
40.在另一优选例中,所述第一阳离子交换树脂柱层析的洗脱体积为柱体积的10-50倍,较佳地20-40倍,更佳地25-35倍。
41.在另一优选例中,所述的疏水柱层析为疏水琼脂糖柱层析。
42.在另一优选例中,所述的疏水柱层析的填料选自下组:phenyl sepharose high performance、phenyl sepharose 6fast flow(high sub)、phenyl sepharose 6fast flow(low sub)、butyl sepharose high performance、butyl sepharose 4fast flow、butyl-s sepharose 6fast flow、octyl sepharose 4fast flow、toyopearl phcnyl-650m、toyopearl phcnyl-600m、toyopearl butyl-650m、toyopearl butyl-600m、toyopearl ppg-600m、toyopearl hexyl-650c,或其组合。
43.在另一优选例中,所述疏水柱层析的洗脱液为c液和d液。
44.在另一优选例中,所述疏水柱层析的洗脱为c液和d液的梯度洗脱;
45.其中,c液为含有无机盐的醋酸-醋酸钠缓冲液;d液为醋酸-醋酸钠缓冲液。
46.在另一优选例中,d液的洗脱浓度从30-100(v/v)%。
47.在另一优选例中,c液和d液的洗脱体积为10-40个柱体积,较佳地15-35个柱体积,更佳地20-30个柱体积,最佳地23-28个柱体积。
48.在另一优选例中,所述c液的ph为4.0-6.0,较佳地4.5-5.8,更佳地4.8-5.8,更佳地5.0-5.8,更佳地5.3-5.8,最佳地5.5。
49.在另一优选例中,在所述c液中,所述无机盐的浓度为0.2-5m,较佳地0.2-4m,更佳地0.5-3m,更佳地0.5-2m,更佳地0.5-1.5m,最佳地0.8-1.2m。
50.在另一优选例中,在所述c液中,所述的醋酸-醋酸钠缓冲液的浓度为5-50mm(以醋酸根计),较佳地10-45mm,更佳地10-40mm,更佳地15-35mm,最佳地20-30mm。
51.在另一优选例中,在所述c液中,所述的无机盐选自下组:氯化盐、硫酸盐、硫酸氢盐、硝酸盐、磷酸氢盐,或其组合。
52.在另一优选例中,在所述c液中,所述的无机盐选自下组:钠盐、钾盐、钙盐、镁盐、铵盐,或其组合。
53.在另一优选例中,在所述c液中,所述的无机盐选自下组:硫酸钠、硫酸钾、硫酸钙、
硫酸镁、硫酸铵,或其组合。
54.在另一优选例中,所述d液的ph为4.0-6.0,较佳地4.5-5.8,更佳地4.8-5.8,更佳地5.0-5.8,更佳地5.3-5.8,最佳地5.5。
55.在另一优选例中,在所述d液中,所述的醋酸-醋酸钠缓冲液的浓度为5-50mm(以醋酸根计),较佳地10-45mm,更佳地10-40mm,更佳地15-35mm,最佳地20-30mm。
56.在另一优选例中,在所述的步骤(6)中,在将所述第一阳离子交换树脂柱层析纯化后的样品上样于疏水柱之前,用所述c液对所述疏水柱层析的填料进行平衡。
57.在另一优选例中,在所述的步骤(6)中,所述第一阳离子交换树脂柱层析纯化后的样品为含有目的蛋白的洗脱液。
58.在另一优选例中,在所述的步骤(6)中,在将所述第一阳离子交换树脂柱层析纯化后的样品上样于疏水柱之后,先用所述的c液对所述的疏水柱进行平衡,然后再进行洗脱。
59.在另一优选例中,在所述的步骤(6)中,在将所述第一阳离子交换树脂柱层析纯化后的样品上样于疏水柱之后,先用所述的c液对所述的疏水柱进行平衡3-7个,较佳地4-6个柱体积,然后再进行洗脱。
60.在另一优选例中,所述疏水柱层析的洗脱体积为柱体积的10-50倍,较佳地15-40倍,更佳地15-35倍,最佳地20-30倍。
61.在另一优选例中,在所述的步骤(6)中,在将所述第一阳离子交换树脂柱层析纯化后收集的含有目的蛋白的洗脱液与1-3m(nh4)2so4以0.8-1.2:0.8-1.2(体积/体积)的比例混合后上样于疏水柱层析。
62.在另一优选例中,所述的第二阳离子交换树脂柱层析的填料选自下组:sp sepharose fast flow、sp sepharose high performance、source 30s、cm sepharose fast flow、capto s、toyopearl gigacap s-650m,或其组合。
63.在另一优选例中,所述第二阳离子交换树脂柱层析的洗脱液为e液和f液。
64.在另一优选例中,所述第二阳离子交换树脂柱层析的洗脱为e液和f液的梯度洗脱;
65.其中,e液为含有无机盐的醋酸-醋酸钠缓冲液;f液为含有无机盐的醋酸-醋酸钠缓冲液。
66.在另一优选例中,f液的洗脱浓度从0-50(v/v)%。
67.在另一优选例中,e液和f液的洗脱体积为20-40个柱体积,较佳地25-35个柱体积,更佳地28-32个柱体积。
68.在另一优选例中,所述e液的ph为4.0-6.0,较佳地4.5-5.8,更佳地4.8-5.8,更佳地5.0-5.8,更佳地5.0-5.5,最佳地5.3。
69.在另一优选例中,在所述e液中,所述无机盐的浓度为20-80mm,较佳地30-70mm,更佳地40-60mm,最佳地45-65mm。
70.在另一优选例中,在所述e液中,所述的醋酸-醋酸钠缓冲液的浓度为5-50mm(以醋酸根计),较佳地10-45mm,更佳地10-40mm,更佳地15-35mm,最佳地20-30mm。
71.在另一优选例中,在所述e液中,所述的无机盐选自下组:氯化盐、硫酸盐、硫酸氢盐、硝酸盐、磷酸氢盐,或其组合。
72.在另一优选例中,在所述e液中,所述的无机盐选自下组:钠盐、钾盐、钙盐、镁盐、
铵盐,或其组合。
73.在另一优选例中,在所述e液中,所述的无机盐选自下组:氯化钠、氯化钾、氯化钙、氯化镁、氯化胺,或其组合。
74.在另一优选例中,所述f液的ph为4.0-6.0,较佳地4.5-5.8,更佳地4.8-5.8,更佳地5.0-5.8,更佳地5.0-5.5,最佳地5.3。
75.在另一优选例中,在所述f液中,所述无机盐的浓度为200-800mm,较佳地300-700mm,更佳地400-600mm,最佳地450-550mm。
76.在另一优选例中,在所述f液中,所述的醋酸-醋酸钠缓冲液的浓度为5-50mm(以醋酸根计),较佳地10-45mm,更佳地10-40mm,更佳地15-35mm,最佳地20-30mm。
77.在另一优选例中,在所述f液中,所述的无机盐选自下组:氯化盐、硫酸盐、硫酸氢盐、硝酸盐、磷酸氢盐,或其组合。
78.在另一优选例中,在所述f液中,所述的无机盐选自下组:钠盐、钾盐、钙盐、镁盐、铵盐,或其组合。
79.在另一优选例中,在所述f液中,所述的无机盐选自下组:氯化钠、氯化钾、氯化钙、氯化镁、氯化胺,或其组合。
80.在另一优选例中,在所述的步骤(6)中,在将所述疏水柱层析纯化后的样品上样于第二阳离子交换树脂柱之前,用所述e液对所述第二阳离子交换树脂柱层析的填料进行平衡。
81.在另一优选例中,在所述的步骤(6)中,所述疏水柱层析纯化后的样品为含有目的蛋白的洗脱液。
82.在另一优选例中,在所述的步骤(6)中,在将所述疏水柱层析纯化后的样品上样于所述第二阳离子交换树脂柱之后,先用所述的e液对所述的疏水柱进行平衡,然后再进行洗脱。
83.在另一优选例中,在所述的步骤(6)中,在将所述疏水柱层析纯化后的样品上样于所述第二阳离子交换树脂柱之后,先用所述的e液对所述的疏水柱进行平衡3-7个,较佳地4-6个柱体积,然后再进行洗脱。
84.在另一优选例中,所述第二阳离子交换树脂柱层析的洗脱体积为柱体积的10-50倍,较佳地15-40倍,更佳地15-35倍,最佳地20-30倍。
85.在另一优选例中,在所述的步骤(6)中,在将所述疏水柱层析纯化后收集的含有目的蛋白的洗脱液与水以1:2.5-3.5(体积/体积)的比例混合后,用0.4-0.6m醋酸调节ph至5.0-5.5后上样于第二阳离子交换树脂柱层析。
86.在另一优选例中,所述的血小板生成素拟肽-fc融合蛋白提取液通过以下方法制备:
87.(1)提供表达目的蛋白的菌体;
88.(2)对所述的菌体进行破菌后,获得包涵体;
89.(3)用包涵体裂解液对所述的包涵体进行裂解,离心,收集上清液,得到裂解后的混合液;
90.(4)将裂解后的混合液与复性液混合,得到复性后的混合液;
91.(5)对复性后的混合液进行酸沉淀,离心,收集上清液,得到血小板生成素拟肽-fc
融合蛋白提取液;
92.在另一优选例中,所述的表达目的蛋白的菌体通过以下方法制备:
93.(1-1)将表达目的蛋白的菌株接种至液体培养基进行培养,得到种子液;
94.(1-2)将所述种子液接种入含有发酵培养液的发酵罐中,形成发酵体系;和
95.(1-3)对所述发酵体系进行发酵,得到表达目的蛋白的菌体。
96.在另一优选例中,所述的步骤(1-1)中,所述的液体培养基为lb液体培养基。
97.在另一优选例中,所述的种子液od600为3.0-4.0。
98.在另一优选例中,所述的步骤(1-2)中,添加的种子液的体积为发酵培养液体积的1-8%,较佳地2-5%,更佳地2-4%。
99.在另一优选例中,所述的步骤(1-2)中,所述发酵培养液的体积为所述发酵罐容积的50%-70%。
100.在另一优选例中,所述的步骤(1-2)中,所述发酵培养液包括:
101.葡萄糖1-3g/l、甘油15-25g/l、酵母抽提物5-10g/l、硫酸铵2-6g/l、十二水合磷酸氢二钠15-25g/l、磷酸二氢钾2-6g/l、柠檬酸铵1-5g/l、氯化钠3-7g/l、无水硫酸镁0.2-0.8g/l、氯化钙0.005-0.015g/l和水。
102.在另一优选例中,所述发酵培养液还包括微量元素。
103.在另一优选例中,所述的微量元素选自下组:铁、锰、锌、铜、硼酸、钼酸铵,或其组合。
104.在另一优选例中,所述发酵培养液的ph为6.5-7.5,较佳地6.95-7.00。
105.在另一优选例中,用酸试剂或碱试剂(如氢氧化钠)调节发酵培养液的ph。
106.在另一优选例中,所述的步骤(1-3)中,初始发酵的参数包括选自下组的一种或多种:
107.温度:20-40℃,较佳地37℃;
108.ph值:6.5-7.5,较佳地6.7-7.1;
109.转速:300-500r/min,较佳地350-450r/min;
110.通气量:2-3vvm,
111.罐压:0.1-0.12mpa,
112.溶氧量:30-50%。
113.在另一优选例中,在所述的步骤(1-3)中,当菌株的od600为30-40开始向发酵罐中加入补料培养基,补充碳源。
114.在另一优选例中,在所述的步骤(1-3)中,当菌株的od600为30-40开始向发酵罐中加入补料培养基,补充碳源。
115.在另一优选例中,所述的补料培养基包括:500-1000g/l甘油、10-40g/l无水硫酸镁和水。
116.在另一优选例中,所述的补料培养基包括:700-800g/l甘油、15-28g/l无水硫酸镁和水。
117.在另一优选例中,所述的补料培养基的加入速度为50-70ml/h,较佳地55-65ml/h。
118.在另一优选例中,在所述的步骤(1-3)中,当菌株的od600为70-90加入iptg诱导剂后继续发酵8-10h后终止发酵,得到含有表达目的蛋白的菌体。
tris缓冲液和1-5mm edta。
147.在另一优选例中,所述的洗涤液的ph为7-9,较佳地7.5-8.5。
148.在另一优选例中,所述的湿包涵体与所述的洗涤液的重量/体积比(g:ml)为1:1-10,较佳地1:2-8。
149.在另一优选例中,所述的离心的转速为5000-7000rpm,较佳地6000-7000rpm。
150.在另一优选例中,所述的离心的时间为10-20rpm。
151.在另一优选例中,所述的离心的温度为15-25℃。
152.在另一优选例中,在所述的步骤(2)和所述的步骤(3)之间包括以下步骤:用洗涤液对所述的包涵体进行洗涤。
153.在另一优选例中,所述的步骤(3)中,所述的包涵体与所述的包涵体裂解液的重量/体积比(g:ml)为1:2-30,较佳地1:5-20,更佳地1:5-15,最佳地1:8-12。
154.在另一优选例中,所述的包涵体裂解液包括:2-15m盐酸胍、30-70mm tris缓冲液、0.5-5mm edta和30-70mm dtt。
155.在另一优选例中,所述的包涵体裂解液包括:4-8m盐酸胍、40-60mm tris-hcl缓冲液、1-3mm edta和40-60mm dtt。
156.在另一优选例中,所述包涵体裂解液的ph值为7.5-9.5,较佳地8-9。
157.在另一优选例中,所述的步骤(3)中,所述的离心的转速为10000-15000rpm,较佳地11000-13000rpm。
158.在另一优选例中,所述的步骤(3)中,所述的离心的时间为10-20min。
159.在另一优选例中,所述的步骤(3)中,所述的离心的温度为15-25℃。
160.在另一优选例中,所述的包涵体裂解液与所述的包涵体混合后,搅拌1-3h。
161.在另一优选例中,所述的复性液包括0.5-8m尿素、1-15%蔗糖、100-300mm arg、30-70mm tris缓冲液、0.5-8mm edta、0.5-8mm半胱氨酸和1-12mm胱氨酸。
162.在另一优选例中,所述的复性液包括1-3m尿素、3-7%蔗糖、150-250mm arg、40-60mm tris缓冲液、1-3mm edta、1-5mm半胱氨酸和2-6mm胱氨酸。
163.在另一优选例中,述的复性液的ph值为7-9.5,较佳地7.5-9,较佳地8-9。
164.在另一优选例中,所述的步骤(4)中,所述的裂解后的混合液与所述的复性液的重量/体积比(g:ml)为1:2-30,较佳地1:5-20,更佳地1:5-15,最佳地1:8-12。
165.在另一优选例中,所述的步骤(4)中,所述混合的温度为2-8℃。
166.在另一优选例中,所述的步骤(4)中,所述混合的时间为36-72h,较佳地45-55h。
167.在另一优选例中,所述的步骤(4)中,所述混合是在搅拌下进行混合。
168.在另一优选例中,所述的步骤(4)中,将裂解后的混合液滴加到复性液中进行混合。
169.在另一优选例中,所述的滴加速率为0.5-2ml/min,较佳地0.8-1.2ml/min。
170.在另一优选例中,所述的步骤(4)中,所述的混合后进行过滤(优选0.1-0.5μm,较佳地0.15-0.3μm,更佳地0.22μm微孔滤膜过滤),得到复性后的混合液。
171.在另一优选例中,在所述的步骤(5)中,所述的酸沉淀前,对复性后的混合液进行过滤。
172.在另一优选例中,所述的过滤为超滤。
173.在另一优选例中,所述的超滤的截留分子量为10kd-20kd。
174.在另一优选例中,所述的超滤为使用截留分子量为10kd-20kd的中空纤维膜或超滤膜进行超滤。
175.在另一优选例中,在所述的步骤(5)中,所述的酸沉淀过程中的ph为4.5-6.5,较佳地4.5-6,更佳地5-6,最佳地5.2-5.7。
176.在另一优选例中,在所述的步骤(5)中,所述的离心后,进行过滤(优选0.1-0.5μm,较佳地0.15-0.3μm,更佳地0.22μm微孔滤膜过滤)得到上清液。
177.在另一优选例中,所述的步骤(5)包括:
178.对复性后的混合液进行过滤,浓缩过滤液,对浓缩后的过滤液用稀释缓冲液进行稀释,调节稀释后溶液的ph为4.5-6.5(较佳地4.5-6,更佳地5-6,最佳地5.2-5.7),进行酸沉淀,离心,得到上清液。
179.在另一优选例中,所述的稀释缓冲液包括:0.5-4m尿素和2-20mm tris-hcl缓冲液。
180.在另一优选例中,所述的稀释缓冲液包括:1-3m尿素和8-12mm tris-hcl缓冲液。
181.在另一优选例中,所述稀释缓冲液ph值为7-10,较佳地8-9。
182.在另一优选例中,所述的浓缩后的过滤液与稀释缓冲液的体积比为1:2-8,较佳地1:4-6。
183.在另一优选例中,所述的离心的转速为7000-9000rpm,较佳地7500-8500rpm。
184.在另一优选例中,所述的离心的时间为10-20min。
185.在另一优选例中,所述的离心的温度为15-25℃。
186.应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
187.图1为菌株构建质粒图。
188.图2为对照样品1、对照样品2、对照样品3、实施例1制备的血小板生成素拟肽-fc融合蛋白样品和参比制剂的非还原样sds-page图对比,其中,泳道1:对照样品1;泳道2:对照样品2;泳道3:对照样品3;泳道4:实施例1所制样品;泳道5:参比制剂;泳道m:marker。
189.图3为对照样品1、对照样品2、对照样品3、实施例1制备的血小板生成素拟肽-fc融合蛋白样品和参比制剂的还原样sds-page图对比,泳道1:对照样品1;泳道2:对照样品2;泳道3:对照样品3;泳道4:实施例1所制样品;泳道5:参比制剂;泳道m:marker。
190.图4为实施例1制备的血小板生成素拟肽-fc融合蛋白的质谱图。
191.图5为实施例1制备的血小板生成素拟肽-fc融合蛋白样品和参比制剂液相色谱图。
192.图6为实施例1制备的血小板生成素拟肽-fc融合蛋白样品和参比制剂的肽图比对液相色谱图。
193.图7为实施例1制备的血小板生成素拟肽-fc融合蛋白样品和参比制剂的生物活性图
具体实施方式
194.本发明人经过广泛而深入的研究,意外地开发一种血小板生成素拟肽-fc融合蛋白的制备方法,特别开发了一种对从大肠杆菌中提取的血小板生成素拟肽-fc融合蛋白提取液进行分离纯化,得到高收率和高纯度血小板生成素拟肽-fc融合蛋白。在本发明所述的方法中,第一阳离子交换树脂柱层析、疏水柱层析和第二阳离子交换树脂柱层的特定组合纯化能够从血小板生成素拟肽-fc融合蛋白提取液中分离纯化得到高纯度和高收率的目的蛋白,且操作简单,易于工业化生产。本发明中对目的蛋白提取液进行分离纯化处理的步骤工艺参数条件具有一定的广谱性,也适用于通过其它方法获得的蛋白提取液,并能取得了良好效果。在此基础上完成了本发明。
195.本发明的实验表明,capto s阳离子交换树脂柱层析、butyl sepharose high performance疏水柱层析和sp sepharose high performance阳离子交换树脂柱层析特定组合纯化将从大肠杆菌中提取的目的蛋白提取液进行有效的分离纯化,得到纯度≥95%的血小板生成素拟肽-fc融合蛋白。
196.术语
197.除非另有定义,否则本文中所用的所有技术和科学术语的含义与本发明所属领域普通技术人员普遍理解的含义相同。
198.如本文所用,术语“包括”、“包含”与“含有”可互换使用,不仅包括开放式定义,还包括半封闭式、和封闭式定义。换言之,所述术语包括了“由
……
构成”、“基本上由
……
构成”。
199.血小板生成素拟肽-fc融合蛋白
200.如本文所用,术语“本发明的蛋白”、“本发明的目的蛋白”、“本发明的血小板生成素拟肽-fc融合蛋白”、“血小板生成素拟肽-fc融合蛋白”与“目的蛋白”具有相同的含义,可互换使用。
201.血小板生成素拟肽-fc融合蛋白是一种fc融合蛋白,由2个相同的单链亚基组成,每个亚基包含人类igg1 fc域(延长蛋白半衰期),在c端共价连接到一个包含2个血小板生成素受体(tpo-r)结合域的tpo模拟肽(tpo mimetic peptide,tmp)。
202.在另一优选例中,所述的血小板生成素拟肽-fc融合蛋白的dna的核苷酸序列如seq id no:1所示。
203.在另一优选例中,所述的血小板生成素拟肽-fc融合蛋白的氨基酸序列如seq id no:2所示。
204.血小板生成素拟肽-fc融合蛋白提取液
205.本发明中,“血小板生成素拟肽-fc融合蛋白提取液”、“目的蛋白提取液”、与“本发明提取液”具有相同的含义,可以互换使用,是指含有血小板生成素拟肽-fc融合蛋白的提取液。
206.在本发明的一个优选例中,所述的血小板生成素拟肽-fc融合蛋白提取液为菌体提取液。
207.在另一优选例中,所述为菌体为含有表达血小板生成素拟肽-fc融合蛋白的基因的大肠杆菌工程菌。
208.在另一优选例中,所述的表达血小板生成素拟肽-fc融合蛋白的dna的核苷酸序列
如seq id no:1所示。
209.代表性地,所述的血小板生成素拟肽-fc融合蛋白提取液通过以下方法制备:
210.(1)提供表达目的蛋白的菌体;
211.(2)对所述的菌体进行破菌后,获得包涵体;
212.(3)用包涵体裂解液对所述的包涵体进行裂解,离心,收集上清液,得到裂解后的混合液;
213.(4)将裂解后的混合液与复性液混合,得到复性后的混合液;
214.(5)对复性后的混合液进行酸沉淀,离心,收集上清液,得到血小板生成素拟肽-fc融合蛋白提取液;
215.在另一优选例中,所述的血小板生成素拟肽-fc融合蛋白提取液如本发明第一方面所述。
216.血小板生成素拟肽-fc融合蛋白的制备方法
217.本发明提供一种血小板生成素拟肽-fc融合蛋白的制备方法,所述的方法包括步骤:
218.(6)将血小板生成素拟肽-fc融合蛋白提取液依次经过第一阳离子交换树脂柱层析、疏水柱层析和第二阳离子交换树脂柱层析纯化,得到血小板生成素拟肽-fc融合蛋白。
219.在一个优选例中,所述的血小板生成素拟肽-fc融合蛋白的制备方法如本发明第一方面所述。
220.在一个优选例中,所述的第一阳离子交换树脂柱层析的填料选自下组:sp sepharose fast flow、sp sepharose high performance、source 30s、cm sepharose fast flow、capto s、toyopearl gigacap s-650m,或其组合。
221.在本发明的一个优选例中,所述第一阳离子交换树脂柱层析的洗脱为a液和b液的梯度洗脱;
222.其中,a液为含有无机盐的醋酸-醋酸钠缓冲液;b液为含有无机盐的醋酸-醋酸钠缓冲液。
223.在另一优选例中,b液的洗脱浓度从5-45(v/v)%。应当理解的是,b液的洗脱浓度是指在b液占洗脱液(a液和b液的混合液)的体积百分比。
224.在另一优选例中,a液和b液的洗脱体积为20-40个柱体积,较佳地25-35个柱体积,更佳地28-32个柱体积。
225.在本发明的另一优选例中,所述的疏水柱层析的填料选自下组:phenyl sepharose high performance、phenyl sepharose 6fast flow(high sub)、phenyl sepharose 6fast flow(low sub)、butyl sepharose high performance、butyl sepharose 4fast flow、butyl-s sepharose 6fast flow、octyl sepharose 4fast flow、toyopearl phcnyl-650m、toyopearl phcnyl-600m、toyopearl butyl-650m、toyopearl butyl-600m、toyopearl ppg-600m、toyopearl hexyl-650c,或其组合。
226.在另一优选例中,所述疏水柱层析的洗脱为c液和d液的梯度洗脱;
227.其中,c液为含有无机盐的醋酸-醋酸钠缓冲液;d液为醋酸-醋酸钠缓冲液。
228.在另一优选例中,d液的洗脱浓度从30-100(v/v)%。应当理解的是,d液的洗脱浓度是指在d液占洗脱液(c液和d液的混合液)的体积百分比。
229.在另一优选例中,c液和d液的洗脱体积为10-40个柱体积,较佳地15-35个柱体积,更佳地20-30个柱体积,最佳地23-28个柱体积。
230.在本发明的另一优选例中,所述的第二阳离子交换树脂柱层析的填料选自下组:sp sepharose fast flow、sp sepharose high performance、source 30s、cm sepharose fast flow、capto s、toyopearl gigacap s-650m,或其组合。
231.在另一优选例中,所述第二阳离子交换树脂柱层析的洗脱为e液和f液的梯度洗脱;
232.其中,e液为含有无机盐的醋酸-醋酸钠缓冲液;f液为含有无机盐的醋酸-醋酸钠缓冲液。
233.在另一优选例中,f液的洗脱浓度从0-50(v/v)%。应当理解的是,f液的洗脱浓度是指在f液占洗脱液(e液和f液的混合液)的体积百分比。
234.在另一优选例中,e液和f液的洗脱体积为20-40个柱体积,较佳地25-35个柱体积,更佳地28-32个柱体积。
235.本发明的主要优点包括:
236.本发明意外地开发一种血小板生成素拟肽-fc融合蛋白的制备方法,所述的方法能够制备高收率和高纯度血小板生成素拟肽-fc融合蛋白,且工艺简单,利于工业化生产。
237.下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。
238.实施例1血小板生成素拟肽-fc融合蛋白的制备
239.1.菌株构建
240.按照大肠杆菌bl21(de3)的偏好密码子,把血小板生成素拟肽-fc融合蛋白的氨基酸序列翻译成dna序列,并在序列的5’和3’两端分别添加限制性酶切位点为ncoⅰ(c
↓
catgg)和ecorⅰ(g
↓
aattc),序列共有818bp。由此构成目的基因序列,转入到载体pet28a中,命名为pet28a-fc-tmp2。热击法将重组pet28a-fc-tmp2转化至大肠杆菌dh5α中,测序验证。提取测序正确的重组质粒,通过电击转化法转入大肠杆菌bl21(de3)感受态细胞中,使用卡那霉素抗性平板筛选出阳性单克隆,其中,菌株构建质粒图如图1所示,所述的血小板生成素拟肽-fc融合蛋白的dna的核苷酸序列如seq id no:1所示,所述的血小板生成素拟肽-fc融合蛋白的氨基酸序列如seq id no:2所示。
241.seq id no:1:
242.ccatggataaaacacacacctgcccaccatgcccggcaccagaactgctgggtggtccgtctgttttcctgttcccaccgaaaccgaaagacaccctgatgatctctcgtaccccagaagtgacctgcgttgtggttgatgtgagccatgaagacccggaagtgaagttcaactggtacgtggatggtgtggaagtgcataacgcgaaaaccaaaccgcgtgaggaacagtacaacagcacgtaccgtgttgtctctgtcctgaccgttctgcatcaggactggctgaatggtaaagagtacaagtgcaaagtctccaacaaagcactgccagcaccaatcgagaaaaccatctccaaagcgaaaggtcagccacgtgaaccacaggtgtacaccctgccaccatctcgtgatgagctgaccaagaaccaggtcagcctgacctgcctggtcaaaggtttctatccaagcgatatcgcagtggaatgggaaagcaatggtcagccggagaacaactacaagaccacgccaccagtgctggattccgatggatccttcttcctgtacagcaaactgaccgtggacaagagccgttggcagcagggtaacgtcttctcatgctctgtgatgcatgaggctctgcacaaccactacacgcagaaaagcctgtctctgtc
tccgggtaaaggtggtggtggtggtatcgaaggtccaactcttcgtcagtggcttgctgctcgtgctggtggtggtggtggtggtggtggtatcgaaggtccgactctgcgtcagtggctggctgctcgtgcttaagaattc。
243.seq id no:2:
244.mdkthtcppcpapellggpsvflfppkpkdtlmisrtpevtcvvvdvshedpevkfnwyvdgvevhnaktkpreeqynstyrvvsvltvlhqdwlngkeykckvsnkalpapiektiskakgqprepqvytlppsrdeltknqvsltclvkgfypsdiavewesngqpennykttppvldsdgsfflyskltvdksrwqqgnvfscsvmhealhnhytqkslslspgkgggggiegptlrqwlaaraggggggggiegptlrqwlaara。
245.2.血小板生成素拟肽-fc融合蛋白提取液的制备
246.2.1菌株的发酵扩增
247.发酵培养液的配制:葡萄糖:2g/l,甘油:20g/l,酵母抽提物:7.5g/l,硫酸铵:4g/l,十二水合磷酸氢二钠:20.15g/l,磷酸二氢钾:4g/l,柠檬酸铵:2.5g/l,氯化钠:5g/l,无水硫酸镁:0.5g/l,氯化钙:0.01g/l,微量元素(包括铁、锰、锌、铜、硼酸、钼酸铵):适量,加水混合均匀,然后用5-10m naoh调节ph为约6.95-7.00,最后用量筒定容。按5
‰
(v/v)加入消泡剂后,121℃,高压蒸汽灭菌30分钟。
248.补料培养基的制备:取750g的甘油,20g的无水硫酸镁,然后加入水用量筒定容至1l,充分搅匀即为补料培养基。121℃,高压蒸汽灭菌30分钟。
249.2.1.1菌种活化和发酵菌种培养:
250.将保存在-80℃的菌株解冻,按10μl接种于30ml lb液体培养基250ml三角瓶(含25mg/l卡那霉素)中进行活化,37℃,220r/min摇床振荡培养6-8h。取10μl上述菌液,接种于100ml lb液体培养基750ml三角瓶(含25mg/l卡那霉素)中,37℃,220r/min摇床振荡培养9-12h,所得的菌液即为发酵菌种培养液(种子培养液),od600为3.0-4.0。
251.2.1.2发酵:
252.在5l发酵罐中放入3l发酵培养液,转接100ml的od600为3.0-4.0的发酵菌种培养液至发酵罐中进行恒氧补料培养,初始发酵参数设定如下:温度:37℃,ph值:6.95,转速:400r/min,通气量:2-3vvm,罐压:0.1-0.12mpa,溶氧:40%,溶氧与转速关联;当发酵约8h时,菌体od600在30-40,此时溶氧急剧上升,表明培养基中碳源被完全耗完,此时开始以60ml/h的速度流加补料培养基,当od600在70-90是时,加入6ml浓度为100mm的iptg(异丙基硫代半乳糖苷,isopropylβ-d-thiogalactoside)进行目的蛋白的诱导表达,诱导8-10h后终止发酵操作,收集发酵液,获得3.5l发酵液。
253.菌体的洗涤:将收集的发酵液在20℃下6500rpm离心15分钟,获得683.2g菌体;菌体按约为1:10(重量/体积)的比例加入6.9l的25mm tris-hcl缓冲液(ph值为8.0),充分混匀后,在20℃下6500rpm离心15分钟,刮去离心沉淀表面黑褐色菌体,重复两次,收集得到菌体。
254.2.2.高压均质破菌:
255.取将洗涤后的100g菌体,按约1:10(质量/体积)的比例加入1l的25mm tris-hcl缓冲液(ph值为8.0),充分混匀;混悬液在8℃的稳定性下进行高压均质破胞,破胞压力在1250bar,重复3次,然后在20℃温度下6500rpm离心15分钟,收集沉淀,获得含有血小板生成素拟肽-fc融合蛋白的湿包涵体28.6g。
256.2.3.包涵体洗涤:
醋酸钠缓冲液平衡5个柱体积,用ph为5.3的含50mm nacl的25mm醋酸-醋酸钠缓冲液作为洗脱e液和ph为5.3的含500mm nacl的25mm醋酸-醋酸钠缓冲液作为洗脱f液进行梯度洗脱,其中f液从0-50(v/v)%,洗脱30个柱体积,洗脱目的蛋白,收集第二个洗脱峰,合并洗脱液得9ml洗脱液,如果浓缩得到干目的蛋白;通过外标法计算得2.34mg的血小板生成素拟肽重组蛋白,通过换算每升发酵液可获得508.03mg血小板生成素拟肽-fc融合蛋白。
271.对比例1血小板生成素拟肽-fc融合蛋白的制备
272.1.血小板生成素拟肽-fc融合蛋白提取液的制备
273.血小板生成素拟肽-fc融合蛋白提取液的制备同实施例1.
274.2.柱分离和纯化
275.2.1阳离子sp sepharose fast flow柱层析
276.先用ph为5.0的含100mm nacl的20mm醋酸-醋酸钠缓冲液,充分平衡sp sepharose fast flow层析柱,将步骤1获得血小板生成素拟肽-fc融合蛋白提取液上样,再用ph为5.0的含100mm nacl的20mm醋酸-醋酸钠缓冲液平衡3-5个柱体积,用ph为5.0的含100mm nacl的20mm醋酸-醋酸钠缓冲液作为洗脱g液和ph为5.0的含500mm nacl的20mm醋酸-醋酸钠缓冲液作为洗脱h液进行梯度洗脱,其中h液从0-100(v/v)%,洗脱20个柱体积,洗脱目的蛋白,收集含有目的蛋白的洗脱液。
277.2.2阳离子sp sepharose high performance:
278.先用ph为5.0的含150mm nacl的20mm醋酸-醋酸钠缓冲液,充分平衡sp sepharose high performance层析柱,将步骤2.1收集的含有目的蛋白洗脱液上样,再用ph为5.0的含150mm nacl的20mm醋酸-醋酸钠缓冲液平衡3-5个柱体积,用ph为5.0的含150mm nacl的20mm醋酸-醋酸钠缓冲液作为洗脱i液和ph为5.0的含400mm nacl的20mm醋酸-醋酸钠缓冲液作为j液进行梯度洗脱,其中j液从0-100(v/v)%洗脱20个柱体积,洗脱目的蛋白,收集洗脱峰,制得血小板生成素拟肽-fc融合蛋白,作为对照样品1。
279.对比例2血小板生成素拟肽-fc融合蛋白的制备
280.1.血小板生成素拟肽-fc融合蛋白提取液的制备
281.血小板生成素拟肽-fc融合蛋白提取液的制备同实施例1.
282.2.柱分离和纯化
283.2.1亲和层析ezfast rprotein a 4ff柱层析
284.先用ph为7.0的含500mm nacl的30mm磷酸盐缓冲液,充分平衡ezfast rprotein a 4ff层析柱,将步骤1获得血小板生成素拟肽-fc融合蛋白提取液上样,然后用ph为6.0的60mm醋酸-醋酸钠缓冲液平衡3-5个柱体积,再用ph为3.0的60mm醋酸-醋酸钠缓冲液洗脱,收集含有目的蛋白的洗脱液。
285.2.2阴离子q sepharose high performance柱层析:
286.q sepharose high performance柱子用ph为6.5的20mm tris缓冲液平衡3-5个柱体积,将步骤2.1收集的含有目的蛋白洗脱液上样;用1m tris调节将ph为3.0的60mm醋酸-醋酸钠缓冲液洗脱调节ph至6.0,作为洗脱液,进行洗脱,收集含有目的蛋白的洗脱液。
287.2.3陶瓷羟基磷灰石层析chtⅰ型:
288.用ph为7.0的20mm磷酸盐缓冲液,充分平衡陶瓷羟基磷灰石层析chtⅰ型层析柱,将步骤2.2收集的含有目的蛋白洗脱液上样;上样,再用ph为7.0的20mm磷酸盐缓冲液平衡3-5
个柱体积;在步骤2.2的阴离子层析洗脱液中加入30mm磷酸盐缓冲液,并用盐酸调节ph至6.0,作为洗脱k液,将ph为7.0的含1.5m nacl的20mm磷酸盐缓冲液作为洗脱l液,用洗脱k液和洗脱l液进行梯度洗脱,其中l液从0-100(v/v)%洗脱25个柱体积,洗脱目的蛋白,收集洗脱峰,制得血小板生成素拟肽-fc融合蛋白,作为对照样品2。
289.对比例3血小板生成素拟肽-fc融合蛋白的制备
290.1.血小板生成素拟肽-fc融合蛋白提取液的制备
291.血小板生成素拟肽-fc融合蛋白提取液的制备同实施例1.
292.2.柱分离和纯化
293.2.1亲和层析ezfast rprotein a 4ff
294.先用ph为8.5的含2m尿素的50mm的tris-hcl缓冲液,充分平衡ezfast rprotein a 4ff层析柱,将步骤1获得血小板生成素拟肽-fc融合蛋白提取液上样,然后用ph为8.5的含2m尿素的50mm的tris-hcl缓冲液平衡2-3个柱体积,再用ph为7.2的20mm pbs的缓冲液平衡2-3个柱体积,最后用ph为3.0的50mm醋酸-醋酸钠缓冲液作为洗脱液洗脱目的蛋白,洗脱目的蛋白,收集含有目的蛋白的洗脱液。
295.2.2阳离子sp sepharose high performance:
296.sp sepharose high performance柱子用ph为5.0的含100mm nacl的20mm醋酸-醋酸钠缓冲液平衡,将步骤2.1收集的含有目的蛋白洗脱液上样,然后用ph为5.0的含210mm nacl的20mm醋酸-醋酸钠缓冲液洗脱杂质,最后用ph为5.0的含300mm nacl的20mm醋酸-醋酸钠缓冲液洗脱目的蛋白,收集含有目的蛋白的洗脱液。
297.2.3分子筛superdex 75 10/300gl:
298.将superdex 75 10/300gl用ph为5.0的20mm醋酸-醋酸钠缓冲液平衡2-3个柱体积,将步骤2.2收集的含有目的蛋白洗脱液上样,上样量为柱体积的3%,再用ph为5.0的20mm醋酸-醋酸钠缓冲液洗脱目的蛋白,收集洗脱峰,制得血小板生成素拟肽-fc融合蛋白,作为对照样品3。
299.测试例1和对比例1-3制备的血小板生成素拟肽-fc融合蛋白效果评价
300.测试例1中使用的参比制剂为romiplostim,商品名nplate,规格500μg/瓶,生产商amgen。
301.1电泳纯度测定和比较
302.1.1非还原电泳测定
303.实施例1和对比例1-3制备的血小板生成素拟肽-fc融合蛋白的非还原电泳结果如表1和图2所示。所述非还原电泳法参照《中国药典》2015版三部0541电泳法第五法进行纯度检测,分离胶胶浓度为12.5%。
304.表1各样品非还原电泳结果
[0305][0306]
备注:参比制剂为romiplostim,商品名nplate,规格500μg/瓶,生产商amgen。
[0307]
从表1和图2可以看出,对照样品1、2和3的低分子量杂质仍存在,且在主条带上方还存在一个高分子量杂质,而实施例1制备样品和参比制剂近似一致,不存在低分子量和高分子量杂质,可见实施例1制备的样品纯度明显高于对照样品1、2和3。
[0308]
1.2还原电泳测定
[0309]
实施例1和对比例1-3制备的血小板生成素拟肽-fc融合蛋白的还原电泳结果如表2和图3所示。所述还原电泳法参照《中国药典》2015版三部0541电泳法第五法进行纯度检测,分离胶胶浓度为12.5%,其中仅在制样阶段与该法不同,在所制样品中加入终浓度为50mm的二硫苏糖醇(dtt)。
[0310]
表2各样品还原电泳结果
[0311][0312]
[0313]
从表2和图3可以看出,对照样品1和实施例1样品与参比制剂近似一致,对照样品2在主条带1附件有较少杂质,而对照样品3则出现较多杂质,可见在还原状态下对照样品1和实施例1样品纯度明显高于对照样品2和3。
[0314]
1.3 lc-ms测定分子量
[0315]
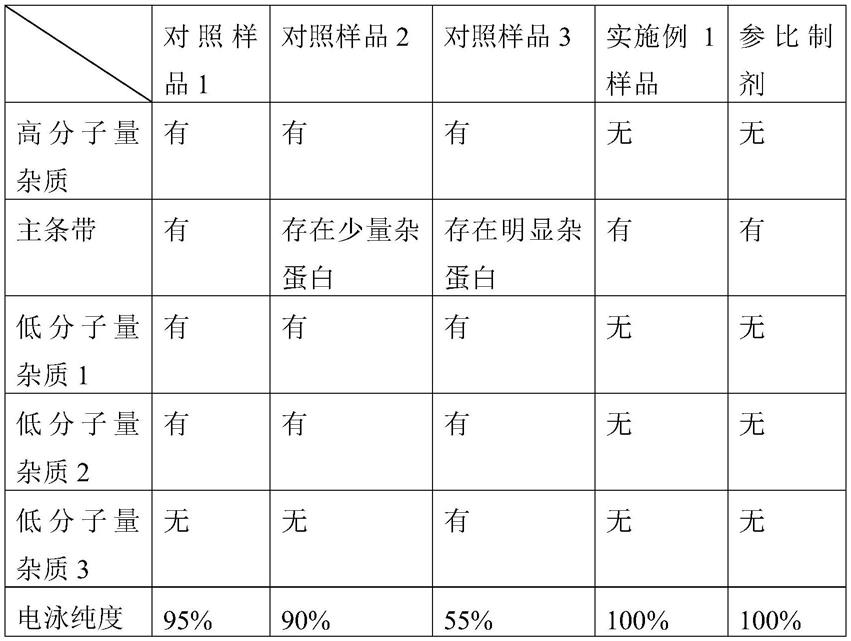
采用mabpac
tm rp(4μm,2.1x 50mm)色谱柱,以含0.1%甲酸-水溶液为流动相a,以含0.1%甲酸-乙腈溶液为流动相b,柱温为80℃,按表3进行梯度洗脱,待测样品为实施例1制备的血小板生成素拟肽-fc融合蛋白样品。
[0316]
表3洗脱条件
[0317]
时间(min)流速(ml/min)a%b%0.00.390103.00.390107.00.310908.00.310908.10.39010100.39010
[0318]
lc-ms测定的结果如图4所示,测得实施例1制备的血小板生成素拟肽-fc融合蛋白分子量为59084da,与理论值一致。
[0319]
1.4反相色谱法纯度测定
[0320]
采用mabpac
tm rp(4μm,2.1x 50mm)色谱柱,以含0.1%三氟乙酸-水溶液为流动相a,以含0.1%三氟乙酸-乙腈溶液为流动相b,柱温为80℃,检测波长280nm,按表4进行梯度洗脱,样品为实施例1制备的血小板生成素拟肽-fc融合蛋白样品和参比制剂(romiplostim,商品名nplate,规格500μg/瓶,生产商amgen)。
[0321]
表4:洗脱条件
[0322]
时间(min)流速(ml/min)a%b%0.00.775255.00.775256.00.76832150.76535160.75050180.75050190.77525200.77525
[0323]
反相色谱法(如图5所示)测定结果表明,实施例1制备的血小板生成素拟肽-fc融合蛋白样品和参比制剂与参比制剂保留时间一致,色谱几乎完全重叠,且反相色谱法测定实施例1制备的血小板生成素拟肽-fc融合蛋白样品的纯度为97.31%。
[0324]
1.5肽图测定
[0325]
参照《中国药典》2015版三部3405肽图检查法第一法胰蛋白酶裂解-反相高效液相色谱法进行测定,结果如图6所示,实施例1所获血小板生成素拟肽-fc融合蛋白样品与参比制剂肽图近似一致。
[0326]
1.6生物活性测定
[0327]
参照专利cn 104181290《一种评价促血小板生成素受体激动剂体外活性的分析方法》,用m07e细胞增值法测定实施例1所获血小板生成素拟肽-fc融合蛋白样品与参比制剂差异。结果如图7所示,实施例1所获血小板生成素拟肽-fc融合蛋白样品与参比制剂具有相同的曲线趋势,说明实施例1所获最终样与标准品参比制剂具有相同的生物活性。
[0328]
在本发明提及的所有文献都在本技术中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本技术所附权利要求书所限定的范围。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1