一种提高间充质干细胞适应高糖环境的驯化方法及其应用与流程
本发明涉及一种干细胞驯化方法及其应用。
背景技术:
糖尿病(diabetesmellitus)是一组由遗传和环境因素相互作用而引起的临床综合征。因胰岛素分泌绝对或相对不足以及靶组织细胞对胰岛素敏感性降低,引起糖、蛋白、脂肪、水和电解质等一系列代谢紊乱,患病率逐年上升,已成为全球慢性非传染性疾病中最具流行性的疾病,糖尿病患者中以ii型糖尿病患者为主,占比超过90%。现有糖尿病治疗药物主要包括磺脲类、双胍类、格列奈类、噻唑烷二酮类、α-葡萄糖苷酶抑制剂、胰高血糖素样肽-1(glp-1)受体激动剂、二肽基肽酶iv(dpp-4)抑制剂和钠–葡萄糖协同转运蛋白2(sglt2)抑制剂。它们在降糖控糖作用机制上各具特点和优势,但仍无法针对糖尿病病因从根本上治愈该病。
从国内外临床实践来看,糖尿病治疗性产品的研究一直是资本和医药巨头竞相进入的市场,礼来、诺和诺德、viacyte等大公司争先恐后进入干细胞治疗糖尿病领域,国内也有5家医院正在组织开展一项多中心大型临床研究,在国家干细胞基地备案的糖尿病研究项目中仅有2项。截止2019年11月12日,clinicaltrials.gov上注册干细胞治疗糖尿病临床研究213项。213项临床研究中69项为mscs的糖尿病研究,可见mscs有可能最先突破成为在ii型糖尿病治疗性药物。科研人员已发现mscs具有激发α细胞向β细胞分化、改善免疫紊乱和缓解胰岛素抵作用。但mscs移植到糖尿病患者体内后,由于高糖环境促使干细胞老化而影响其存活及长期效果,因而导致干细胞的作用不持久、缓解胰岛素抵抗能力弱等重大问题。
由于体内高糖环境对干细胞存活、增殖存在影响,干细胞在移植前进行高糖驯化成为一些干细胞研究者的一种思路,以往报道中,干细胞高糖驯化均是在移植前或培养高代次时进行,这种mscs无法发挥持久作用。同时,直接将细胞置于高糖环境可导致细胞衰老的产生,体外实验研究表明衰老的mscs往往具有以下改变:①细胞体积增大变宽、细胞均一性较差;②细胞的增殖潜能的改变;③分化能力减弱;④生长曲线变慢,生长缓慢;⑤端粒长度缩短;⑥β-半乳糖苷酶蓝染阳性细胞增加;⑦亚细胞器等超微结构发生改变;⑧mscs分泌细胞因子异常;⑨衰老相关基因的异常表达。总体而言,高糖环境不利于细胞生长及特性维持。
技术实现要素:
本发明是要解决现有干细胞治疗糖尿病中,干细胞对体内高糖环境不适应而存活时间短、起效作用弱的问题,提供一种间充质干细胞的培养方法及其应用。
本发明提高间充质干细胞适应高糖环境的驯化方法,包括以下步骤:
一、将脐带组织消毒,清洗,然后剪成组织段,将组织段清洗至无血色,去除血管及表皮获得华通氏胶,将华通氏胶组织剪碎至1-2mm3,于含spl的l-dmem培养基中培养,得到p0代细胞;所述含spl的l-dmem培养基中葡萄糖浓度为1g/l;
二、将p0代细胞进行传代获得p1代细胞,传代所用培养基为含spl的l-dmem培养基;所述含spl的l-dmem培养基中葡萄糖浓度为1g/l;
三、将p1代传p2代,传代所用培养基为含spl的1.5g/l葡萄糖的dmem培养基;
将p2代传p3代,传代所用培养基为含spl的2g/l葡萄糖的dmem培养基;
将p3代传p4代,传代所用培养基为含spl的3g/l葡萄糖的dmem培养基;
将p4代传p5代,传代所用培养基为含spl的4.5g/l葡萄糖的dmem培养基,即完成;其中spl为高因子含量血小板裂解液。
进一步的,步骤一和步骤二中所述含spl的l-dmem培养基中spl的质量浓度为5%。
进一步的,步骤三所述含spl的1.5g/l葡萄糖的dmem培养基、含spl的2g/l葡萄糖的dmem培养基、含spl的3g/l葡萄糖的dmem培养基和含spl的4.5g/l葡萄糖的dmem培养基中spl的质量浓度均为5%。
进一步的,步骤三所述含spl的1.5g/l葡萄糖的dmem培养基、含spl的2g/l葡萄糖的dmem培养基、含spl的3g/l葡萄糖的dmem培养基和含spl的4.5g/l葡萄糖的dmem培养基中均添加盐酸吡硫醇。
进一步的,所述吡硫醇在培养基中的终浓度为0.5mg/ml。
本发明还提供上述驯化方法在提高间充质干细胞适应高糖环境中的应用。
本发明的有益效果:
本发明创新性地从mscsp1开始,逐代进行提高糖浓度进行细胞适应性驯化,以获得耐糖细胞系,同时结合spl多因子,有助于干细胞增殖及特性维持,从而保证干细胞移植后的长期存活及缓解胰岛素抵抗效果。
(1)本发明从mscsp1开始,逐代提高葡萄糖浓度进行细胞适应性驯化,获得耐糖细胞系,避免直接过高浓度葡萄糖造成的细胞老化的产生,以使其应用于糖尿病治疗时,在体内高糖环境中更利干细胞存活、增殖及持续起效;
(2)spl本身即具有较多种类及较高浓度的细胞增长及调节性因子,有助于干细胞增殖及特性维持,本发明利用逐代高糖驯化方法,同时结合spl多因子对细胞的促增殖作用,能够使细胞即使处于高糖坏境,也能扩增出较高质量的临床级别细胞,可进行糖尿病治疗方面的应用。
(3)本发明的间充质干细胞从脐带组织中获得。间充质干细胞经体外实验证实对机体具有免疫调节能力、组织修复功能及抗炎潜能,可有效缓解糖代谢异常情况并治疗高血糖引起的并发症,且具有取材方便,细胞数量多,感染风险小等优点。
本发明方法为提高干细胞在高糖环境适应性及糖尿病治疗提供支持。
附图说明
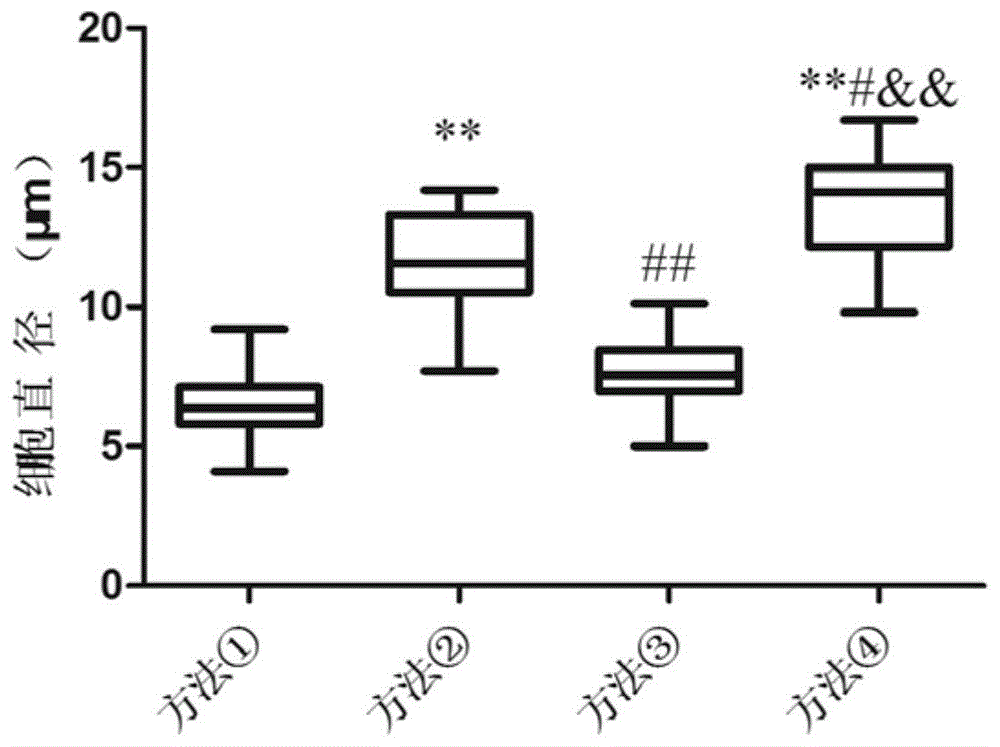
图1为实施例2中各驯化方法的p5代细胞的直径测量结果
图2为实施例2中各驯化方法的p5代细胞增殖曲线图
图3为实施例2中各驯化方法的p5代细胞对应倍增时间
图4为实施例2中驯化方法的p5代细胞中衰老基因表达对比结果
具体实施方式
本发明技术方案不局限于以下所列举具体实施方式,还包括各具体实施方式间的任意组合。
具体实施方式一:本实施方式提高间充质干细胞适应高糖环境的驯化方法,包括以下步骤:
一、原代脐带组织块分离及p0代细胞培养:
将脐带组织用75%医用酒精消毒10min后,利用生理盐水清洗3次后剪成1-1.5cm小段,利用生理盐水清洗至无血色,去除其中血管及表皮获得华通氏胶,将华通氏胶组织剪碎至1-2mm3,于含spl的l-dmem培养基中培养,得到p0代细胞;所述含spl的l-dmem培养基中葡萄糖浓度为1g/l;
二、p0代传p1代:
将原代组织经爬片法获得的p0代细胞进行传代获得p1代细胞,传代方法为:利用trypletmexpress消化液进行原代细胞消化,使原代细胞呈单细胞状态后,收集细胞并计数,经离心弃上清后,用含spl的l-dmem培养基重悬细胞进行传代,传代密度为5000个/cm2;所述含spl的l-dmem培养基中葡萄糖含量为1g/l;
三、p1代传至p5代
将p1代传p2代,传代方法为:利用trypletmexpress消化液进行细胞消化,使p1代细胞呈单细胞状态后,收集细胞并计数,经离心弃上清后,用含spl的1.5g/l葡萄糖的dmem培养基重悬细胞进行传代,传代密度为5000个/cm2;
将p2代传p3代,传代方法为:利用trypletmexpress消化液进行细胞消化,使p2代细胞呈单细胞状态后,收集细胞并计数,经离心弃上清后,用含spl的2g/l葡萄糖的dmem培养基重悬细胞进行传代,传代密度为5000个/cm2;
将p3代传p4代,传代方法为:利用trypletmexpress消化液进行细胞消化,使p3代细胞呈单细胞状态后,收集细胞并计数,经离心弃上清后,用含spl的3g/l葡萄糖的dmem培养基重悬细胞进行传代,传代密度为5000个/cm2;
将p4代传p5代,传代方法为:利用trypletmexpress消化液进行细胞消化,使p4代细胞呈单细胞状态后,收集细胞并计数,经离心弃上清后,用含spl的4.5g/l葡萄糖的dmem培养基重悬细胞进行传代,传代密度为5000个/cm2;
具体实施方式二:本实施方式与具体实施方式一不同的是:所述spl的制备方法为:
将抗凝血转移至离心管中,700×g室温离心10min,过程中注意缓慢升速及降速,离心后将上层富含血小板的血浆转移到超滤离心管中,3000×g室温离心15min,最终获得超浓缩prp;
向分离获得的超浓缩prp中加入15~20mmol/lcacl2与2u/ml低分子肝素钠于37℃孵育1~2h,使血小板充分激活释放血小板源因子,而后转移到-80℃条件下冷冻1~2h,37℃融化,4℃冷却1h使纤维蛋白凝聚,于750×g、4℃离心10min后,取上清利用0.22μm滤器过滤后即得到spl。其它与具体实施方式一相同。
具体实施方式三:本实施方式与具体实施方式一不同的是:步骤一和步骤二中所述含spl的l-dmem培养基中spl的质量浓度为5%。其它与具体实施方式一相同。
具体实施方式四:本实施方式与具体实施方式一至三之一不同的是:步骤三所述含spl的1.5g/l葡萄糖的dmem培养基、含spl的2g/l葡萄糖的dmem培养基、含spl的3g/l葡萄糖的dmem培养基和含spl的4.5g/l葡萄糖的dmem培养基中均添加盐酸吡硫醇。其它与具体实施方式一至三之一相同。
具体实施方式五:本实施方式与具体实施方式五不同的是:所述吡硫醇在培养基中的终浓度为0.5mg/ml。其它与具体实施方式五相同。
吡硫醇,英文名称为pyritinol,是维生素b6的衍生物,能促进细胞内6—磷酸葡萄糖脱氢酶(g6pd)的活性,g6pd可以减轻细胞和器官受氧化应激而产生的损害,同时吡硫醇可以通过提高g6pd活性来调节体内能量代谢来控制机体器官抗衰作用。本发明通过加入吡硫醇,来提高间充质干细胞在高糖条件下的细胞适应性及血糖调节能力。
本实施方式在驯化过程中创新性加入一定浓度的吡硫醇,增强干细胞在高糖环境中的糖调节基因表达及糖代谢调节作用,维持干细胞的增殖能力及抵抗衰老能力,从而保证干细胞移植后的长期存活及缓解胰岛素抵抗效果。
本实施方式利用逐代高糖驯化方法,同时结合spl多因子及吡硫醇对细胞的保护作用及促增殖作用,能够使细胞即使处于高糖坏境,也能扩增出较高质量的临床级别细胞,可进行糖尿病治疗方面的应用。
下面对本发明的实施例做详细说明,以下实施例在以本发明技术方案为前提下进行实施,给出了详细的实施方案和具体的操作过程,但本发明的保护范围不限于下述的实施例。
实施例1:细胞分离与传代培养
一、原代脐带组织块分离及p0代细胞培养:
将脐带组织用75%医用酒精消毒10min后,利用生理盐水清洗3次后剪成1-1.5cm小段,利用生理盐水清洗至无血色,去除其中血管及表皮获得华通氏胶,将华通氏胶组织剪碎至1-2mm3,于含spl的l-dmem培养基中培养,得到p0代细胞;所述含spl的l-dmem培养基中葡萄糖浓度为1g/l,spl的质量浓度为5%;
二、p0代传p1代:
将原代组织经爬片法获得的p0代细胞进行传代获得p1代细胞,传代方法为:利用trypletmexpress消化液进行p0细胞消化,使p0细胞呈单细胞状态后,收集细胞并计数,经离心弃上清后,用含spl的l-dmem培养基重悬细胞进行传代,传代密度为5000个/cm2;平行传4个t75培养瓶,分别命名为培养瓶①、培养瓶②、培养瓶③、培养瓶④;所述含spl的l-dmem培养基中葡萄糖含量为1g/l,spl的质量浓度为5%;
三、p1代传至p5代
将p1代细胞进行传代,最终获得p5代细胞,传代方法为:每次传代均利用trypletmexpress消化液进行细胞消化,使其呈单细胞状态后收集细胞并计数,经离心弃上清后用各自对应培养基进行传代,传代密度为5000个/cm2。
培养瓶①采用传代方法①:p1传p2代、p2传p3代、p3传p4代及p4传p5代均利用含spl的l-dmem培养基进行传代;其中含spl的l-dmem培养基的葡萄糖浓度为1g/l,spl的质量浓度为5%,不加吡硫醇。
培养瓶②采用传代方法②:p1传p2代利用含spl的1.5g/l葡萄糖的dmem培养基(不加吡硫醇)进行传代;p2传p3代利用含spl的2g/l葡萄糖的dmem培养基(不加吡硫醇)进行传代;p3传p4代利用含spl的3g/l葡萄糖的dmem培养基(不加吡硫醇)进行传代;p4传p5代利用含spl的4.5g/l葡萄糖的dmem培养基(不加吡硫醇)进行传代。培养基中spl的质量浓度均为5%。其中,葡萄糖浓度为2g/l时为糖尿病诊断确诊标准11.1mmol/l(即200mg/dl)。
培养瓶③采用传代方法③:p1传p2代利用含spl及0.5mg/ml吡硫醇的1.5g/l葡萄糖的dmem培养基进行传代;p2传p3代利用含spl及0.5mg/ml吡硫醇的2g/l葡萄糖的dmem培养基进行传代;p3传p4代利用含spl及0.5mg/ml吡硫醇的3g/l葡萄糖的dmem培养基进行传代;p4传p5代利用含spl及0.5mg/ml吡硫醇的4.5g/l葡萄糖的dmem培养基进行传代。培养基中spl的质量浓度均为5%。
培养瓶④采用传代方法④:p1传p2代、p2传p3代、p3传p4及p4传p5代均利用含spl的h-dmem培养基进行传代;其中含spl的h-dmem培养基的葡萄糖浓度为4.5g/l,spl的质量浓度为5%,不加吡硫醇。
实施例2:四组驯化方法获得的p5代细胞特性检测
1、p5代细胞的直径测量
分别取培养瓶①、②、③、④中四种驯化方法下的p5代细胞进行细胞直径测量:使用trypletmexpress消化液进行细胞消化,当细胞完全分散后,取2滴细胞消化液涂布到载玻片下,静置3min,在显微镜20倍镜下拍照,并根据图片比例测量胞直径,每种细胞测量20个细胞的直径。
2、p5代细胞倍增时间分析
分别取培养瓶①、②、③、④中四种驯化方法下的p5代细胞,按5×103/孔接种到24孔板中,每种驯化方法的p5代细胞分别接种21个孔,连续消化计数7天,每天3个重复孔。
根据公式计算细胞倍增时间:倍增时间的定义t=δt·lg2/(lgnt-lgn0)(nt为对数增长期的观测值,n0为初始细胞值)。根据生长曲线选择第3天到第4天指数增长阶段,计算细胞倍增时间。
3、p5代细胞衰老相关基因检测
分别取培养瓶①、②、③、④中四种驯化方法下的p5代细胞,将培养上清收集到对应标记的离心管中,利用trypletmexpress消化液进行培养瓶中细胞消化,待细胞完全变圆并自培养瓶底脱离后收集细胞至对应标记的离心管中,1300rpm5min离心收集细胞,弃上清后利用细胞裂解液裂解细胞并进行总rna提取并将其中mrna反转录成cdna,通过real-timepcr检测衰老相关基因p53、p21、p16的表达变化情况。
表1衰老相关基因上下引物游序列
结果如下:
(一)各驯化方法下细胞大小对比
图1为各驯化方法中,p5代细胞直径大小对比结果,如图1可知,四种驯化方法中,一直在低糖环境(方法①)中培养的细胞直径更小,均一性更好,而一直在高糖环境(方法④)中培养的细胞直径最大,均一性不佳;逐代增加糖浓度驯化的两组细胞大小介于高糖和低糖之间,说明逐代增加糖浓度有利于细胞的状态维持,且加吡硫醇的方案(方法③)中,细胞大小和均一度较方法②更好,与方法①的一直低糖环境培养效果无差异。
(二)各驯化方法下细胞增殖曲线及倍增时间
图2和图3为各驯化方法下细胞增殖曲线及倍增时间检测结果,图2中●表示方法①,■表示方法②,▲表示方法③,▼表示方法④。如图可知,四种驯化方法中,细胞增殖能力从强到弱的顺序为方法①、方法③、方法②、方法④,说明低糖环境下更利于细胞的生长,同时逐渐增加糖浓度进行驯化较直接处于高糖更利于细胞增殖,逐代增加高糖驯化研究中发现加入吡硫醇可以更好的维持细胞增殖状态,使其接近于低糖培养条件。
(三)各驯化方法下细胞衰老相关基因表达差异情况检测
图4为各驯化方法下细胞衰老相关基因表达差异情况检测结果,其中
- 还没有人留言评论。精彩留言会获得点赞!