羟基喜树碱亚油酸酯小分子前药及其自组装纳米粒的构建的制作方法
本发明属于药物制剂新辅料和新剂型领域,包括羟基喜树碱亚油酸酯小分子前药及其自组装纳米粒的构建,以及其在药物递送中的应用。
背景技术:
癌症威胁着全人类的健康,据世界卫生组织(who)统计,全球每年有超过800万人死于癌症。化疗是癌症治疗中的一个重要手段,对于那些不能通过手术切除和转移扩散的肿瘤尤为重要。喜树碱类药物可以通过抑制dna拓扑异构酶ⅰ发挥良好的抗肿瘤药物。在对喜树碱极其衍生物的探究中发现,对喜树碱10位进行羟基化可以极大地增强喜树碱的抗肿瘤活性,因此10-羟基喜树碱(简称羟基喜树碱)和7-乙基-10-羟基喜树碱就成为了喜树碱类抗癌药物的首选。然而因其水溶性和酯溶性都极差,且有极强的泌尿毒性,实现喜树碱类药物的高效递药并不容易。虽然喜树碱类药物有潜力应用于各种实体肿瘤,但是对于喜树碱类药物制剂的开发一度止步不前。
随着纳米技术的发展,国内外同行对喜树碱类药物的开发仍然着手于传统纳米制剂。但是传统纳米制剂仍存在着一些问题,如载药量低、在体循环中的渗漏和稳定性等。因此对于高载药量、稳定性好的喜树碱类药物的开发需要新的思路。小分子前药自组装纳米药物递送系统是由小分子前药既作为药物载体又可释放出活性母药,小分子前药自组装纳米药物递送系统展现出了超高载药量和低辅料相关毒性的优点,已成为近几年化疗药物递送研究的热点。但是,紫杉醇-二十二碳六烯酸前药已经进入了临床iii期,其iii期临床结果并不理想,由于母药很难从前药中快速释放,所以在抑制黑色素瘤生长方面,与一线抗癌药物达卡巴嗪相比,没有明显优势。
而将具有氧化还原敏感的二硫键引入脂肪酸与化疗药之间,构建的二硫键桥连的小分子前药,可以利用肿瘤微环境中高表达的氧化还原环境高效地释放母药。因此开发氧化还原敏感的羟基喜树碱前药,着眼于解决喜树碱类药物溶解性低、难以开发制剂的困难,提高其成药性。该平台有一定的普适性,也可以应用于其他喜树碱及其衍生物药物制剂的开发,扭转喜树碱类药物临床应用受限的现状,延长喜树碱类药物的临床寿命。
技术实现要素:
本发明所解决的技术问题是提供一种具有氧化还原双敏感的羟基喜树碱亚油酸酯前药,如表1所示,在不同程度的peg化前后,该自组装纳米制剂都有极高的载药量。将该前药用于自组装纳米粒,可实现载药量高、稳定性好、毒副作用低的效果,进而提高抗肿瘤活性。
本发明的目的是设计和合成高载药量的具有氧化还原双敏感的羟基喜树碱亚油酸酯前药,制备前药自组装纳米粒,与溶液剂相比研究前药自组装纳米粒的制剂特征及形态与及体内外药效学产生的影响,探究氧化还原双敏感前药的优越性,为开发肿瘤微环境智能响应型药物递送系统提供新的策略和更多的选择,满足临床中对高效化疗制剂的迫切需求。
本发明通过以下技术方案实现上述目的:
本发明所述的具有氧化还原双敏感的羟基喜树碱亚油酸酯(hcpt-ss-la)前药,是以羟基喜树碱作为模拟药物,通过2,2'-二硫二乙醇相连合成前药,其结构式为:
进一步地,本发明提供了所述的羟基喜树碱亚油酸酯前药的合成方法,包括如下步骤:首先将亚油酸与2,2'-二硫二乙醇成酯得到中间产物。然后中间产物再与一分子羟基喜树碱成碳酸酯,得到终产物。
具体地,本发明提供了亚油酸与2,2'-二硫二乙醇成酯中间产物的合成方法:
将亚油酸加入已经溶解有对甲苯磺酸和2,2'-二硫二乙醇的甲苯溶液中,反应体系在n2保护下升温至110℃。用tlc检测反应完全后,用饱和nahco3溶液萃取,再用无水na2so4除去多余的水,最后用柱层析法分离得到此中间产物。
本发明提供了羟基喜树碱亚油酸酯小分子前药的合成方法:
将中间产物溶解在二氯甲烷中,加入在冰浴条件下加入dipea与对硝基苯氯甲酸酯,室温搅拌过夜。减压旋蒸除去溶剂,用dmf将体系复溶,冰浴至0℃,缓慢加入溶解于dmf的羟基喜树碱溶液,在加入无水三乙胺,在室温条件下反应24小时,萃取处理后所得产物经制备液相分离纯化。
本发明中所述的亚油酸可以用油酸、硬脂酸、反式油酸、α-亚麻酸、γ-亚麻酸、二十二碳六烯酸、花生四烯酸替换。
本发明还提供了所述的羟基喜树碱亚油酸酯小分子前药自组装纳米粒及其制备方法。
所述的小分子前药纳米粒可以是非peg化的前药纳米粒和peg修饰的前药纳米粒。
本发明中所述的羟基喜树碱可以用其他含有活性羟基或氨基的抗癌药物,如喜树碱类化合物、核苷类化合物、蒽环类化合物或紫杉烷类化合物所代替。
本发明提供的羟基喜树碱亚油酸酯小分子前药自组装纳米粒的制备方法如下:
将一定量的羟基喜树碱亚油酸酯小分子前药单独或与peg修饰剂的混合物溶解到适量的四氢呋喃中,搅拌下,将该四氢呋喃溶液缓缓滴加到水中,前药自发形成均匀的纳米粒。最后,采用减压旋转蒸发法除去制剂中的四氢呋喃,得到不含任何有机溶剂的纳米胶体溶液。
所述的peg修饰剂为tpgs、dspe-peg、plga-peg和pe-peg等,优选的peg修饰剂为tpgs。所述peg的分子量为1000-5000,具体为1000、2000和5000,优选的peg分子量为2000。小分子前药与peg修饰剂的重量比为:92:8~70:30,在此范围条件下,羟基喜树碱可以发挥最好的抗肿瘤效果。
(1)非peg化的小分子前药自组装纳米粒的制备方法:将一定量的前药溶解到适量的四氢呋喃中,搅拌下,将该四氢呋喃溶液缓缓滴加到水中,前药自发形成均匀的纳米粒。采用减压旋转蒸发法除去制剂中的四氢呋喃,得到不含任何有机溶剂的纳米胶体溶液。
(2)peg修饰的小分子前药自组装纳米粒的制备方法:将一定量的peg修饰剂(tpgs、dspe-peg、plga-peg或pe-peg)和前药溶解到适量的四氢呋喃中,搅拌下,将该四氢呋喃溶液缓缓滴加到水中,前药自发形成均匀的纳米粒。采用减压旋转蒸发法除去制剂中的四氢呋喃,得到不含任何有机溶剂的纳米胶体溶液。
本发明考察了羟基喜树碱亚油酸酯前药的最佳处方以及表征,以及前药自组装纳米粒的抗肿瘤活性。
结果表明,peg化与否该前药均可以自组装成纳米粒。非peg化时hcpt-ss-la也可形成稳定的纳米粒,粒径160nm左右。peg化纳米粒粒径明显减小,8%peg化时粒径为140nm左右,20%peg化时粒径为135nm左右。20%peg化时纳米粒胶体稳定性更好,相比之下,非peg化和8%peg化纳米粒的胶体稳定性较差。与传统纳米制剂相比,小分子自组装前药策略显著提高了载药量,三种纳米粒的载药量都在35%以上。二硫键的引入使纳米粒具有明显的氧化敏感释放,可选择性地在肿瘤细胞中释放活性母药。hcpt-ss-la纳米粒具有良好的抗肿瘤活性,显著降低了羟基喜树碱的毒性。
本发明的羟基喜树碱亚油酸酯小分子前药或其药物组合物或其小分子前药自组装纳米粒可以用于制备肿瘤微环境智能响应型药物传递系统。且可用于注射给药、口服给药或局部给药。
本发明具有以下有益效果:(1)设计合成了二硫键桥连的氧化还原双敏感小分子前药,合成方法简单易行;(2)制备了均匀的小分子前药自组装纳米粒,制备方法简单易行,稳定性好,实现羟基喜树碱的高效包载;(3)考察了二硫键桥连的前药自组装纳米粒的形态表征,体内外的抗肿瘤效果。彰显出二硫键桥连的小分子自组装前药的优势,为开发肿瘤微环境智能响应型药物递送系统提供新的策略和更多的选择,满足临床中对高效低毒化疗制剂的迫切需求。
附图说明
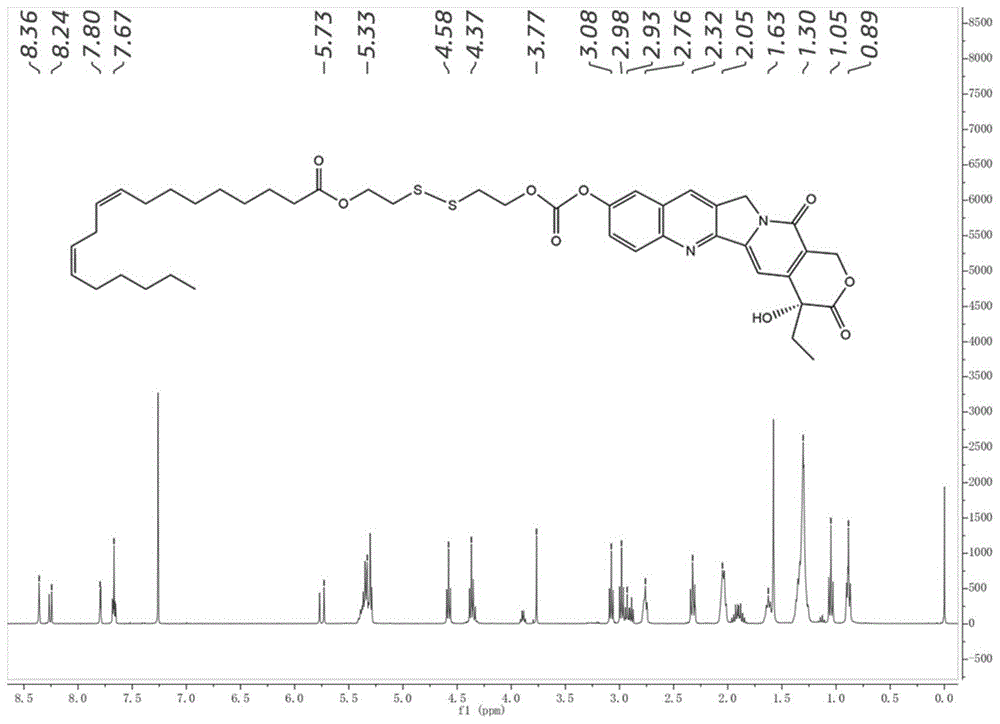
图1为本发明实施例1的羟基喜树碱亚油酸酯(hcpt-ss-la)的1hnmr谱图。
图2为为本发明实施例1的羟基喜树碱亚油酸酯(hcpt-ss-la)的质谱图。
图3为本发明实施例2的未peg修饰的小分子前药自组装纳米粒透射电子显微镜图。
图4为本发明实施例2的8%peg修饰的小分子前药自组装纳米粒透射电子显微镜图。
图5为本发明实施例2的20%peg修饰的小分子前药自组装纳米粒透射电子显微镜图。
图6为本发明实施例2的羟基喜树碱纳米晶透射电子显微镜图。
图7为本发明实施例3的peg修饰的小分子前药自组装纳米粒的细胞毒性图。
图8为本发明实施例4的peg修饰的小分子前药自组装纳米粒的在体抗肿瘤实验中小鼠肿瘤体积变化图。
图9为本发明实施例4的peg修饰的小分子前药自组装纳米粒的在体抗肿瘤实验中小鼠肿瘤负荷图。
图10为本发明实施例4的peg修饰的小分子前药自组装纳米粒的在体抗肿瘤实验中小鼠体重变化图。
图11为本发明实施例4的peg修饰的小分子前药自组装纳米粒的在体抗肿瘤实验中小鼠肿瘤对比图。
图12为本发明实施例4的peg修饰的小分子前药自组装纳米粒的安全性实验图。
具体实施方式
下面通过实施例的方式进一步说明本发明,但并不因此将发明限制在所述的实施例范围之中。
实施例1:羟基喜树碱亚油酸酯小分子前药(hcpt-ss-la)的合成
将亚油酸加入已经溶解有对甲苯磺酸和2,2'-二硫二乙醇的甲苯溶液中,反应体系在n2保护下升温至110℃。用tlc检测反应完全后,用饱和nahco3溶液萃取,再用无水na2so4除去多余的水,最后用柱层析法分离得到此中间产物。将中间产物溶解在二氯甲烷中,加入在冰浴条件下加入dipea与对硝基苯氯甲酸酯,室温搅拌过夜。减压旋蒸除去溶剂,用dmf将体系复溶,冰浴至0℃,缓慢加入溶解于dmf的羟基喜树碱溶液,在加入无水三乙胺,在室温条件下反应24小时,萃取处理后所得产物经制备液相分离纯化。
采用质谱法以及核磁共振氢谱法来确定实施例1中前药的结构,结果如图1所示。核磁共振选用的溶剂为cdcl3,波谱解析结果如下:
1hnmr(400mhz,cdcl3)δ8.36(s,1h,ar-h),8.26(d,j=9.3hz,1h,ar-h),7.79(d,j=2.6hz,1h,ar-h),7.69–7.64(m,1h,ar-h),5.75(d,j=16.4hz,1h,py-h),5.43–5.27(m,4h,-ch=ch-),4.58(d,j=6.6hz,1h,-oh),4.37(q,j=6.5hz,2h,py-ch2-o-c=o-),3.77(s,2h,py-n-ch2-),3.08(t,j=6.5hz,2h,-ch2-o-c=o-o-),2.98(t,j=6.6hz,2h,-c=o-ch2-),2.95–2.86(m,4h,-ch2-ss-ch2-),2.76(s,2h,-ch=ch-ch2-ch=ch-),2.32(t,j=7.8hz,2h,-ch2-c=o-o-),2.03(s,4h,-ch=ch-ch2-),1.63(s,2h),1.30(s,18h,-ch2-),1.05(t,j=7.4hz,3h,-ch2-ch3),0.94–0.83(m,3h,-(ch2)4-ch3).ms(esi)m/zforhcpt-ss-la[m+h]+=807.33263,[m-h]-=805.31754.
实施例2:小分子前药自组装纳米粒的制备
精密称取tpgs2k适量(8%为0.35mg,20%为1mg,30%为1.7mg)和前药4mg,用1ml四氢呋喃将其溶解,搅拌下,将该四氢呋喃溶液缓缓滴加到4ml去离子水中,自发形成均匀的纳米粒(hcpt-ss-la纳米粒,hcpt-ss-la/8%peg纳米粒,hcpt-ss-la/20%peg纳米粒,hcpt-ss-la/30%peg纳米粒)。在35℃的条件下减压旋转蒸发除去纳米制剂中的有机溶剂。
表1.羟基喜树碱亚油酸酯前药的载药量
表1中的处方均可制得前药自组装纳米粒,但是30%peg化的纳米粒在不同批次的粒径不可重现,在130-160nm附近波动,而8%和20%peg化的纳米粒的粒径批次间几乎没有差别,猜测可能是30%用量的peg纳米粒表面修饰的tpgs已经饱和,有部分tpgs自组装成了胶束在体系中,同时考虑到载药量的因素,因此在后续研究中淘汰了30%peg化的处方。
如表2所示,纳米粒的粒径都在135-165nm,peg化后的纳米粒粒径分布小于0.2,表面电荷在-20mv左右,载药量都在35%以上。通过透射电子显微镜测定实施例2中制备的小分子前药自组装纳米粒以及同法制得的羟基喜树碱纳米晶的粒径和形态,结果如图2,透射电镜图表明载药纳米粒为均一的球形,粒径在120-100nm。
表2.小分子前药自组装纳米粒的粒径、粒径分布、表面电荷和载药量
实施例3:peg修饰的小分子前药自组装纳米粒的细胞毒性
采用mtt法考察peg修饰的小分子前药自组装纳米粒对小鼠乳腺癌(4t1)细胞的细胞毒性。将状态良好的细胞消化,用培养液稀释至1000cells/ml细胞密度,吹匀后于96孔板中每孔加入细胞悬液200μl,置培养箱中孵育24h使其贴壁。待细胞贴壁后加羟基喜树碱或实施例2中制备的前药纳米粒。实验中药物溶液与纳米粒制剂的配制和稀释均用1640培养液,并用0.22μm滤膜无菌过滤。受试溶液每孔加入200μl,每个浓度3个平行孔。对照组,即不加待测药液,单一补加200μl培养液,置培养箱中和细胞共同孵育。于加药后48h,将96孔板取出,每孔加入5mg/mlmtt溶液35μl,置培养箱中孵育4h后甩板,将96孔板倒扣于滤纸上充分吸干残留液体后,每孔加入200μldmso于振荡器上振荡10min以溶解蓝紫色结晶物。设定a1孔(只含有200μldmso)为调零孔。使用酶标仪在490nm处测定各孔调零后的吸光度值。
细胞毒性结果如图3所示。由于前药纳米粒释放羟基喜树碱需要一定时间,羟基喜树碱发挥受到一定限制,所以与羟基喜树碱组相比,前药纳米粒的细胞毒性要低。hcpt-ss-la/8%peg纳米粒的细胞毒性要弱于hcpt-ss-la/20%peg纳米粒,这是因为hcpt-ss-la/20%peg纳米粒的稳定性要好于前者,前药能够在肿瘤细胞内存在更长的时间。如表3所示,在72小时孵育后hcpt-ss-la/20%peg纳米粒的优势更加明显,更加证明了要保证纳米粒的细胞毒性,首先要保证纳米粒的胶体稳定性,因此在同样的给药剂量下20%的peg修饰比8%的peg修饰能够提供具有更强抗肿瘤能力的纳米制剂。
表3.羟基喜树碱和前药纳米粒对小鼠乳腺癌(4t1)细胞的半抑制浓度(ic50)
实施例4:peg修饰的小分子前药自组装纳米粒的在体抗肿瘤实验
考察了peg修饰的小分子前药自组装纳米粒对4t1异位瘤模型的抗肿瘤活性。将4t1细胞悬液(5x106cells/50μl)接种于雌性balb/c右侧背部皮下注射构建4t1异位瘤模型。待肿瘤体积生长至100m3左右时,将荷瘤小鼠随机分组,每组五只,分别给与生理盐水、羟基喜树碱溶液剂和实施例2中制备的peg修饰的小分子前药自组装纳米粒。每隔1天给药1次,连续给药4次,按羟基喜树碱计算,给药剂量为2.5mg/kg。给药后,每天观察小鼠的存活状态,称体重,测量肿瘤体积。最后一次给药的后两天将荷瘤小鼠处死,获取器官和肿瘤,进行进一步分析评价。收集主要器官(心脏,肝脏,脾脏,肺,肾脏)和肿瘤组织并用福尔马林固定用于h&e染色。
实验结果如图4所示,羟基喜树碱溶液剂纳米粒的抗肿瘤活性低,这是由于游离药物在体内随机分布,容易被清除。相比之下,hcpt-ss-la纳米粒可在肿瘤部位蓄积且在肿瘤细胞内释放出活性母药,具有显著的抗肿瘤作用。但是,由于hcpt-ss-la/20%peg纳米粒具有更好的胶体稳定性,更长的血液循环和有效地药物释放,hcpt-ss-la/20%peg纳米粒的抗肿瘤活性强于hcpt-ss-la/8%peg纳米粒。通过纳米粒治疗的小鼠体重维持在稳定的水平,并且没有表现出明显的身体功能损伤。这说明,由于hcpt-ss-la纳米粒选择性地在肿瘤细胞内释放药物,降低了羟基喜树碱的毒性。如图5肿瘤组织切片图所示,hcpt-ss-la纳米粒在具有明显的抗肿瘤效果的同时,没有对机体造成显著的非特异性毒性,是安全有效的抗癌药物传递系统。
- 还没有人留言评论。精彩留言会获得点赞!