一种降钙素原突变体蛋白的原核重组表达及纯化方法与流程
本发明涉及一种降钙素原突变体蛋白的原核重组表达及纯化方法。
背景技术:
降钙素原蛋白(pct)是一种含116个氨基酸残基的炎症相关蛋白,经体内水解酶水解可形成n端pct(1-57aa),降钙素(60-91aa)和降钙蛋白(96-116aa)三部分。这三部分有各自独立的免疫原性,现有的免疫学检测使用的单克隆抗体均是独立针对这三个多肽片段之一。
在pct的检测过程中要求使用的配对抗体分别针对其中两个多肽片段。pct序列中的58-59aa(-lys58-arg59-)和92-95aa(-gly92-lys93-lys94-arg95-)作为多肽片段连接臂是水解位点,也是序列易降解部分。
天然pct本身易降解,稳定性差,现有技术无法有效改善pct的稳定性。原核表达重组降钙素原蛋白的免疫原性和天然降钙素原蛋白可能是有差异的,不一定能准确检测体内降钙素原的表达水平。综上,pct需要通过改变易降解位点序列提高稳定性,同时蛋白序列的变化不能引起免疫原性的改变。
技术实现要素:
本发明的目的在于针对上述现有技术的不足,提供一种降钙素原突变体蛋白的原核重组表达及纯化方法,通过改造pct序列和整套的原核表达以及分离纯化技术可以制备具有天然免疫原性的高纯度重组pct蛋白,提高了pct蛋白的稳定性。
本发明的目的是通过以下技术方案实现的:
一种降钙素原突变体蛋白的原核重组表达及纯化方法,包括以下步骤:
a、重组降钙素原蛋白的基因克隆
从ncbi上获取pct的氨基酸序列,对天然pct蛋白序列进行改造,对易降解位点进行序列替换,根据大肠杆菌密码子偏嗜性特征,人工优化并合成重组pct编码基因,n端加入pelbleader信号肽序列,以10个连续组氨酸序列(-(his)10-)作为纯化标签,并在首尾两端引入ndei、xhoi酶切位点用于分子克;
设计引物进行pcr反应用于鉴定合成基因,正向引物序列见seqidno:3,反向引物序列见seqidno:4,pcr条件如下:
b、重组pct表达载体的构建
将步骤a的合成基因和原核表达质粒pet26b(+)分别采用限制性内切酶ndei和xhoi进行双酶切,酶切条件为37℃,2h,使用琼脂糖凝胶回收试剂盒对酶切片段进行回收,然后用t4连接酶将目的基因与表达载体pet26b(+)连接,将连接产物转入大肠杆菌dh5α感受态细胞中,进行阳性克隆pcr验证,pcr条件见步骤a,得到重组pct的表达载体;
c、重组pct表达菌的构建
将上述重组pct的表达载体转入用于表达的大肠杆菌bl21(de3),得到重组pct表达菌;
d、重组pct表达菌的诱导表达
将重组后的大肠杆菌bl21(de3)接种于含有卡那霉素抗性的lb液体培养基中,加入0.2~5mm的iptg进行诱导,16~37℃震荡培养6~12h;
e、重组pct的分离纯化
重组pct表达菌菌液在6000~12000r/min条件下4℃离心2~15min,收集菌体;将菌体使用含0.5mnacl的tris-hcl溶液,在12000r/min条件下4℃离心2~15min,0.5mnacl的tris-hcl溶液4℃洗涤10min,重复操作2~5次,收集菌体沉淀;反复冻融5~8次,0.5mnacl的tris-hcl溶液重悬,于4℃,80~160r/min搅拌洗涤20~40min,然后在6000~12000r/min条件下4℃离心10~15min,收集上清液。上清液采用镍离子亲和层析柱对进行纯化,然后过分子筛层析柱得到纯化的重组pct。
在本发明的实施方案中,所述重组pct的蛋白序列如seqidno.1所示,重组pct编码基因序列如seqidno.2所示。
在本发明的实施方案中,所述pcr反应的正向引物如seqidno.3所示,pcr反应的反向引物如seqidno.4所示。
进一步地,步骤a,所述对易降解位点进行了序列替换具体是利用-ala58-ala59-和-ala92-ala93-ala94--ala95-替换了-lys58-arg59-和-gly92-lys93-lys94-arg95-。
进一步地,步骤e,所述tris-hcl溶液的浓度为5~50mm,ph=6~8。
与现有技术相比,本发明的有益效果在于:
本发明通过分析pct蛋白结构,对天然pct蛋白序列进行了改造,对易降解位点进行了序列替换(利用-ala58-ala59-和-ala92-ala93-ala94-ala95-替换了-lys58-arg59-和-gly92-lys93-lys94-arg95-),制备具有天然免疫原性的高纯度重组pct蛋白,提高了pct蛋白的稳定性,同时保持了原有的免疫原性;利用基因合成技术替代了原有的pcr技术制备目的基因,提高了基因操作的准确性和工作效率,缩短了表达菌构建的实验周期;设计了完整的蛋白表达纯化体系,得到的突变体蛋白可以作为标准抗原用于制备单克隆抗体,或作为标准品用于pct的免疫学检测。
附图说明
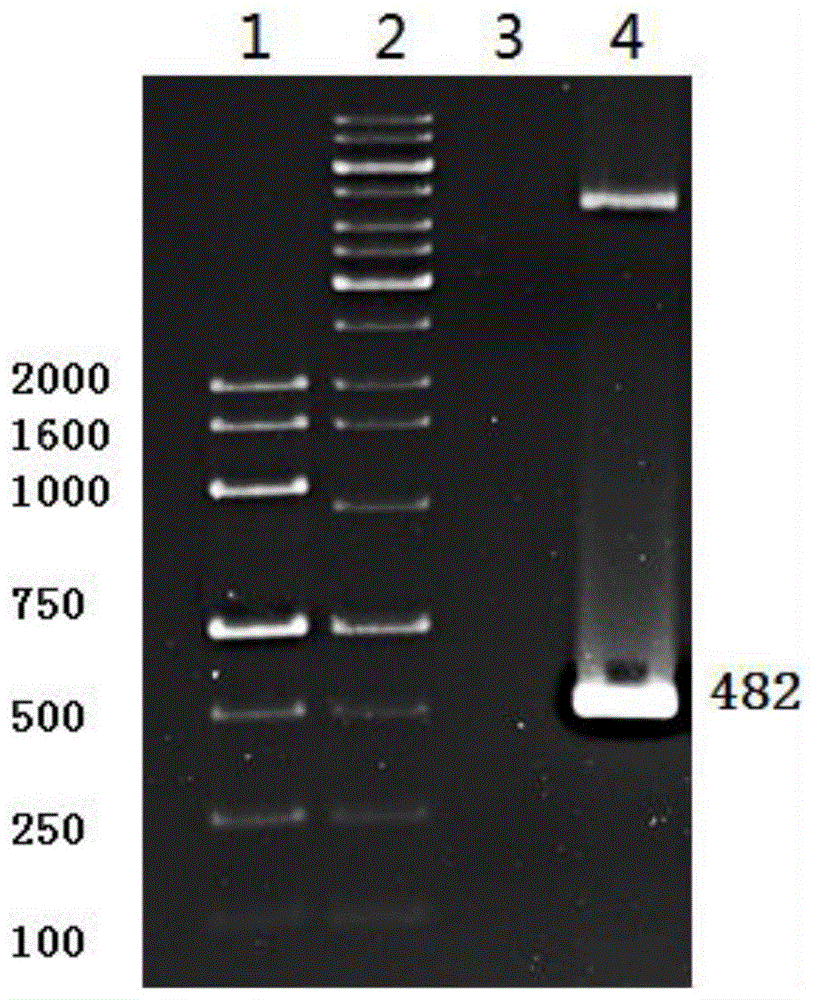
图1为本发明提供的重组pct表达载体pcr验证图;其中,1:marker;2:marker;3:阴性对照(无模板);4为阳性克隆菌株的质粒pcr;
图2为本发明提供的重组pct的sds-page电泳验证图;其中,1:marker,2:重组pct表达菌(全菌蛋白,1mmiptg诱导16h),3:重组pct表达菌(全菌蛋白,未诱导),4:重组pct表达菌(包涵体沉淀,1mmiptg诱导16h),5:重组pct表达菌(可溶上清,1mmiptg诱导16h);
图3elisa检测重组pct图。
具体实施方式
下面结合实施例对本发明作进一步说明:
为了使本发明的目的、技术方案及优点更加清楚明白,以下结合实施例对本发明进行进一步的详细说明。
实施例1
(1)重组降钙素原蛋白(pct)的基因克隆
从ncbi上获取降钙素原蛋白(pct)的氨基酸序列,对天然pct蛋白序列进行了改造,对易降解位点进行了序列替换(利用-ala58-ala59-和-ala92-ala93-ala94--ala95-替换了-lys58-arg59-和-gly92-lys93-lys94-arg95-),根据大肠杆菌密码子偏嗜性特征,人工优化并合成重组pct编码基因,n端加入pelbleader信号肽序列,以10个连续组氨酸序列(-(his)10-)作为纯化标签,并在首尾两端引入ndei、xhoi酶切位点用于分子克隆。
设计引物进行pcr反应用于鉴定合成基因,正向引物序列见seqidno:3,反向引物序列见seqidno:4。pcr条件如下:
目的基因全序列和正反向引物均由生工生物工程(上海)有限公司合成。
(2)重组pct表达载体的构建
将步骤(1)的合成基因和原核表达质粒pet26b(+)分别采用限制性内切酶ndei和xhoi进行双酶切,37℃酶切2h.使用琼脂糖凝胶回收试剂盒对pet26b(+)和基因的目的条带进行回收,然后用t4连接酶将目的基因与表达载体pet26b(+)连接,16℃连接过夜。将连接产物转入大肠杆菌dh5α感受态细胞中,进行阳性克隆pcr验证,pcr条件见步骤(1),得到重组pct的表达载体。
将完成步骤(1)的pcr产物和原核表达质粒pet26b(+)分别采用限制性内切酶ndei和xhoi进行双酶切,37℃酶切两个小时后使用琼脂糖凝胶回收试剂盒对pet26b(+)和基因的目的条带进行回收,然后用t4连接酶在37℃条件连接2h,将目的基因与表达载体pet26b(+)连接。
将上述连接产物50ng加入到200μl大肠杆菌dh5α感受态细胞中,轻轻混匀,置于冰中冷却30min。将感受态细胞迅速从冰移至42℃水浴热激60s,再快速将其转移到冰浴中冷却5min,加入800μl的lb液体培养基(1g胰蛋白胨,0.5g酵母提取物,0.5g氯化钠,100ml去离子水,121℃湿热灭菌30min,温度降至室温备用),将经上述操作后的感受态细胞于37℃,120r/min振荡培养80min。将已转化的感受态细胞均匀涂布到含有卡那霉素(50μg/ml)固体lb培养基上,37℃倒置培养12~16h。
挑取选取阳性菌落,提质粒,双酶切及pcr进行验证,pcr的参数同步骤(1),确定序列无误后提取质粒即为重组pct表达载体,-80℃保存。(pcr鉴定结果如附图1所示)
(3)重组pct表达菌的获得
将完成步骤(2)的重组pct表达载体50ng加入200μl的肠杆菌bl21(de3)感受态细胞中,轻轻混匀,置于冰中30min,然后将感受态细胞迅速从冰移至42℃水浴热激90s,再快速将其转移到冰浴中冷却5min,加入800μl的lb液体培养基(1g胰蛋白胨,0.5g酵母提取物,0.5g氯化钠,100ml去离子水,121℃湿热灭菌30min),于37℃,120r/min振荡培养50min。将已转化的大肠杆菌bl21(de3)感受态细胞均匀涂布到含有卡那霉素(50μg/ml)的lb固体培养基上,37℃倒置培养14h,获得重组pct表达菌。
实施例2
重组pct表达菌的诱导表达
挑取重组pct表达菌阳性单菌落接种于5ml含有卡那霉素(50μg/ml)抗性的lb液体培养基中,在37℃,180r/min条件下培养12h,然后分别取1ml菌液,并分别加入100ml含有卡那霉素(50μg/ml)抗性的lb液体培养基中,在37℃,180r/min条件下培养6h,加入1mm的iptg进行诱导,在16℃,180r/min条件下培养12h。
取少部分菌液离心分离,收集菌体,进行sds-page电泳验证(验证结果如附图2所示)。
实施例3
重组pct的分离纯化
重组pct表达菌菌液在12000r/min条件下4℃离心15min,收集菌体。将菌体使用含0.5mnacl的tris-hcl溶液(50mm,ph=7.4),在12000r/min条件下4℃离心5min,0.5mnacl的tris-hcl溶液4℃洗涤10min,重复操作3次,收集菌体沉淀。反复冻融5次,0.5mnacl的tris-hcl溶液(50mm,ph=7.4)重悬,于4℃,120r/min搅拌洗涤30min,然后在12000r/min条件下4℃离心15min,收集上清液。上清液采用镍离子亲和层析柱对进行纯化,然后过分子筛层析柱得到纯化的重组pct,并进行sds-page电泳验证(验证结果如附图3所示)。
重组pct的elisa验证
使用双抗夹心法elisa检测重组pct的免疫原性。抗n端pct(1-57aa)的单克隆抗体包被包被96孔酶标板(100ng/孔),用重组pct和天然pct作为待检抗原,hrp标记的抗降钙蛋白(96-116aa)的单克隆抗体作为检测抗体进行双抗夹心法elisa检测(验证结果如附图2所示)。
1.重组pct蛋白序列seqidno.1
2.重组pct的dna序列seqidno.2
ggtacatatgaaatacctgctgccgaccgctgctgctggtctgctgctcctcgctgcccagccggcgatggcccatcatcatcatcatcatcatcatcatcatagcagcggccatatcgacgacgacgacaaggctccttttcgttctgctctggaatcttctcctgccgatcctgctaccctgtccgaagatgaagcgcgtctgctgctggcagctctggtacaggactacgttcagatgaaagcgtccgagctggaacaggaacaggaacgtgagggtagctccctggactccccacgttctaaacgttgcggtaacctgtctacctgcatgctgggtacgtacacccaggatttcaataaattccacacgttcccgcagactgctatcggtgttggtgccccgggtaaaaaacgcgatatgagctctgatctggaacgtgaccatcgcccgcatgttagcatgccgcagaacgcgaactgactcgagatgg
3.正向引物序列见seqidno:3
正向(sense):5'-ggtacatatgaaatacctgctgccg-3',tm:64.2℃
4.反向引物序列见seqidno:4
反向(antisense):5'-ccatctcgagtcagttcgcg-3',tm:63.3℃。
sequencelisting
<110>润方(长春)生物科技有限公司润方(北京)生物医药研究院有限公司
<120>一种降钙素原突变体蛋白的原核重组表达及纯化方法
<130>20201020
<160>3
<170>patentinversion3.5
<210>2
<211>494
<212>dna
<213>人工序列
<400>2
ggtacatatgaaatacctgctgccgaccgctgctgctggtctgctgctcctcgctgccca60
gccggcgatggcccatcatcatcatcatcatcatcatcatcatagcagcggccatatcga120
cgacgacgacaaggctccttttcgttctgctctggaatcttctcctgccgatcctgctac180
cctgtccgaagatgaagcgcgtctgctgctggcagctctggtacaggactacgttcagat240
gaaagcgtccgagctggaacaggaacaggaacgtgagggtagctccctggactccccacg300
ttctaaacgttgcggtaacctgtctacctgcatgctgggtacgtacacccaggatttcaa360
taaattccacacgttcccgcagactgctatcggtgttggtgccccgggtaaaaaacgcga420
tatgagctctgatctggaacgtgaccatcgcccgcatgttagcatgccgcagaacgcgaa480
ctgactcgagatgg494
<210>3
<211>25
<212>dna
<213>人工序列
<400>3
ggtacatatgaaatacctgctgccg25
<210>4
<211>20
<212>dna
<213>人工序列
<400>4
ccatctcgagtcagttcgcg20
- 还没有人留言评论。精彩留言会获得点赞!