具有抗肿瘤活性的多糖及其应用和制备方法与流程
本发明涉及医药技术领域,具体而言,涉及一种具有抗肿瘤活性的多糖及其应用和制备方法。
背景技术:
多糖是由多种相同或者不同的单糖以α-或者β-糖苷键组成的一类化合物。来源于天然植物中的多糖属于植物体内一类非常重要的生物大分子,同时也是有效维持和保证生物体生命活动能够正常运转的基本物质。国内外报道有关植物多糖具有免疫调节、抗肿瘤、抗病毒、抗氧化、降血压、抗血栓、降血糖、对免疫性肝损伤的保护以及抗辐射活性等药理作用功效,这为植物多糖在药品、食品等相关领域更好的开发和利用提供了良好的理论基础。
作为天然的免疫调节剂,植物多糖具有多靶点的免疫调节活性,对机体免疫器官的生长、免疫细胞的激活以及免疫因子的释放均起到积极的促进作用。一定程度上,多糖的纯度决定其生物活性,但来源于植物中多糖的主要结构非常复杂多样,就多糖的一级结构与其生物活性的关系而言,多糖的单糖组成、连接方式、糖苷键类型、分支度、取代基的种类和取代度等因素对多糖的免疫活性均有不同程度的影响。因此,寻求构效稳定、有效部位含量(非总糖含量)占总提取物50%以上,并具有抗肿瘤活性作用的多糖,是困扰本领域技术人员的技术难题。
鉴于此,特提出本发明。
技术实现要素:
本发明的目的在于提供一种具有抗肿瘤活性的多糖及其应用和制备方法。本发明从紫锥菊植物原料中提取了一种新的多糖,该多糖构效稳定,其具有抗肿瘤活性,能够用于制备抗肿瘤等药物。
本发明的另一目的在于提供。
本发明是这样实现的:
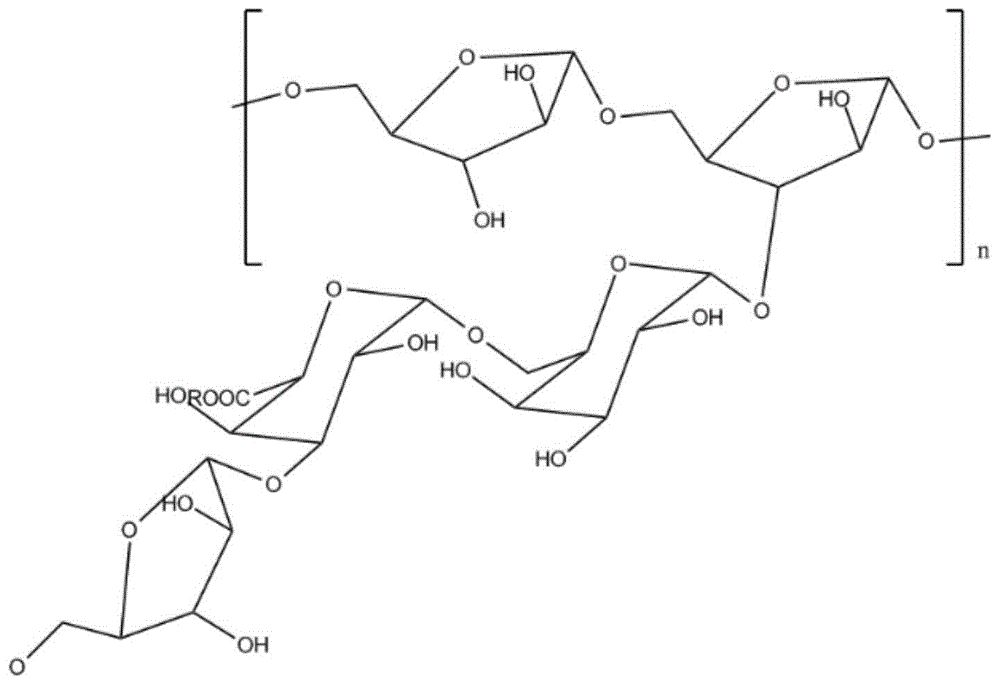
第一方面,本发明提供一种具有抗肿瘤活性的多糖,其具有如下式(i)所示的结构:
r为h或甲基。
本发明提供了一种新的多糖分子,其具有如上式(i)所示结构单元,r为h或甲基。该结构单元以α-(1→5)-l-阿拉伯聚糖为骨架结构的阿拉伯半乳聚糖。侧链结构包括α-l-araf-(1→,→6)-β-d-galp-(1→和→4)-α-d-galpa-(其中1→仅由galp,galpa和araf组成,其摩尔比为2.7:1:1),本发明的研究显示,其具有抗肿瘤活性,此外,该多糖来自紫锥菊,能促进巨噬细胞的激活并分泌促炎细胞因子,不仅能提高巨噬细胞的吞噬能力,还能促进巨噬细胞吞噬紫锥菊多糖自身,持续发挥免疫刺激作用,具有广泛的用途;此外,该多糖的构象及性质较稳定,利于生物效应的发挥。
进一步地,在本发明的一些实施方案中,所述多糖的分子量为20kd-50kd。
进一步地,在本发明的一些实施方案中,所述多糖的分子量38kd。
第二方面,本发明提供如上所述的多糖在制备药物中的应用,所述药物具有如下功能中的一种或多种:
免疫调节、抗肿瘤、抗病毒、抗氧化、降血压、抗血栓、降血糖、保护免疫性肝损伤的以及抗辐射。
进一步地,在本发明的一些实施方案中,所述肿瘤选自肝癌、乳腺癌或肺癌。
第三方面,本发明提供一种药物,其具有如下功能中的一种或多种:免疫调节、抗肿瘤、抗病毒、抗氧化、降血压、抗血栓、降血糖、保护免疫性肝损伤的以及抗辐射。
所述药物含有作为活性成分的如上任一项所述的多糖。
进一步地,在本发明的一些实施方案中,所述药物还包括药学上可接受的辅料。
第四方面,本发明提供制备如上所述的多糖的方法,其包括:从紫锥菊原料中提取得到所述多糖;
进一步地,在本发明的一些实施方案中,从紫锥菊原料中提取得到所述多糖包括如下步骤:
(1):粉碎所述紫锥菊原料,得到紫锥菊微粉;
(2):对所述紫锥菊微粉进行脱脂处理;
(3):将经所述脱脂处理后的所述紫锥菊微粉进行多糖提取,得到粗多糖提取液;
(4):去除所述粗多糖提取液中的蛋白,得到粗多糖;
(5):去除所述粗多糖的无机盐,得到初步纯化的粗多糖;
(6):采用离子层析柱纯化所述初步纯化的粗多糖,得到多糖纯品。
术语“粗多糖(crudepolysaccharides)”是指将药材或者植物水提或醇沉后得到的产物,本领域中有时也称为“总多糖”。本领域技术人员知悉,如果药材中含有多糖,药材经过水提取、乙醇沉淀获得的沉淀部分中一定含有多糖,但可能还含有其它非糖成分。本领域技术人员能够理解,总多糖并非是指药材或植物的全部多糖,因为无论怎样提取也很难获得植物的全部多糖。
进一步地,在本发明的一些实施方案中,所述紫锥菊微粉的粒径为0.1-10μm。
进一步地,在本发明的一些实施方案中,所述紫锥菊微粉中,粒径≤0.1μm的颗粒重量比不超过30%;1μm≤粒径≤5μm的颗粒重量比在65%以上。
进一步地,在本发明的一些实施方案中,采用气流粉碎的方式粉碎所述紫锥菊原料。
进一步地,在本发明的一些实施方案中,采用气流粉碎的方式粉碎所述紫锥菊原料时,控制空气压力为0.35-0.85mpa,空气流量为10-30m3/min,进料量1.2-3kg/h。
粉碎粒度与活性及多糖提取率是密切相关的。在控制粉碎粒度过程中连续不断的机械力会影响多糖的含量,本发明实施例中优选使用气流粉碎的方式制备符合粒度要求的物料,在气流粉碎中压缩空气压力和喷射入粉碎腔中的速度是密切相关的,空气压力相对越高,物料在气流交汇点处反复碰撞、摩擦、剪切而粉碎的粒度分布较为集中。在实际操作过程中,控制合理的空气压力使物料能够以稳定的速度喷射入粉碎腔即可,应当避免压力过高导致物料与高压气流交汇时间过短。因此粉碎的方法优选采用气流粉碎,控制空气压力为0.35~0.85mpa,空气流量为10~30m3/min,进料量1.2~3kg/h。通过这样的参数控制可以保持多糖的活性以及提高提取率。
进一步地,在本发明的一些实施方案中,所述紫锥菊原料摘取自紫锥菊植物的叶、根、花及茎中的一种或多种的组合。
上述药用部位的多糖含量较高,以此药物部位为提取原料,可以提高多糖的得率。
进一步地,在本发明的一些实施方案中,所述紫锥菊原料摘取自处于盛花期的所述紫锥菊植物。
进一步地,在本发明的一些实施方案中,所述紫锥菊植物为1-多年生植物;
进一步地,在本发明的一些实施方案中,所述紫锥菊植物选自紫锥菊(e.purpurea)、狭叶紫锥菊(e.angustifolia)和淡白松果菊(e.pallida)。
进一步地,在本发明的一些实施方案中,所述脱脂处理包括步骤(a)或步骤(b):
步骤(a):将所述紫锥菊微粉浸渍于乙醇中以脱脂;
步骤(b):将所述紫锥菊微粉与石油醚混合进行热回流处理以脱脂;
进一步地,在本发明的一些实施方案中,步骤(a)中,所述紫锥菊微粉与乙醇的质量体积比为1:10-50,进一步优选为1:30;所述的乙醇浓度为55-95%,进一步优选为95%;
进一步地,在本发明的一些实施方案中,步骤(a)中,浸渍的时间为3-8h,进一步优选为3h;
进一步地,在本发明的一些实施方案中,在步骤(b)中,所述紫锥菊微粉与石油醚的质量体积比为1:30-50,进一步优选为1:30;所述的石油醚沸程为30~120℃,进一步优化为60~90℃;
进一步地,在本发明的一些实施方案中,在步骤(b)中,热回流处理的时间为1-3h,进一步优选为2h。
进一步地,在本发明的一些实施方案中,所述多糖提取包括:将所述紫锥菊微粉与水混合进行热回流提取,然后进行固液分离,取液体组分并进行浓缩,得到所述粗多糖提取液;
进一步地,在本发明的一些实施方案中,热回流提取的时间为2h;
进一步地,在本发明的一些实施方案中,采用离心的方式进行固液分离;
进一步地,在本发明的一些实施方案中,离心的转速为500-1000rpm,离心的时间为10-20min。
进一步地,在本发明的一些实施方案中,采用水提醇沉法或sevage试剂法去除所述粗多糖提取液中的蛋白;
进一步地,在本发明的一些实施方案中,去除所述粗多糖的无机盐包括:将所述粗多糖与有机溶剂混合进行透析以去除无机盐;
进一步地,在本发明的一些实施方案中,所述有机溶剂选自乙醇、乙酸乙酯、氯仿或正丁醇中的一种或多种;
进一步地,在本发明的一些实施方案中,所述有机溶剂为乙醇,乙醇浓度为30%-80%,进一步优选为60%;
进一步地,在本发明的一些实施方案中,进行透析时的分子截留量为1.5-9kd。
进一步地,在本发明的一些实施方案中,所述离子层析柱选自大孔阳离子交换树脂、阴离子交换树脂或deae-sepharosefastflow柱中的一种或多种的联合;
进一步地,在本发明的一些实施方案中,采用所述离子层析柱纯化所述初步纯化的粗多糖时,控制流速为0.8-1.2ml·min-1,并使用连续ph梯度的洗脱介质进行洗脱;
进一步地,在本发明的一些实施方案中,所述洗脱介质为nacl溶液或pbs缓冲液中的一种或多种;
进一步地,在本发明的一些实施方案中,nacl溶液的浓度为0.05-5m;
进一步地,在本发明的一些实施方案中,洗脱后,根据糖显色反应和紫外检测的结果合并相同流分,得到所述多糖纯品。
本发明提供的制备方法所提取的上述多糖,其纯度高,组分较为均一,所提取的多糖维持了其抗肿瘤的生物活性,可以作为药用原料,制备成抗肿瘤药物等。
另一方面,本发明还提供一种具有抗肿瘤活性的提取物,其由如上任一项所述的方法提取得到。
进一步地,在本发明的一些实施方案中,所述提取物含有如下式a和/或式b的组分:
式a;
式b。
式a即式i中的r为h,式b即式i中的r为甲基(ch3)。
附图说明
为了更清楚地说明本发明实施例的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,应当理解,以下附图仅示出了本发明的某些实施例,因此不应被看作是对范围的限定,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他相关的附图。
图1是epds-2的结构式。
图2是epds-2的高效液相凝胶渗透色谱图。
图3是epds-2的1h-nmr图谱。
图4是epds-2的13c-nmr图谱。
图5是epds-2灌胃给药12天后肿瘤解剖图。
具体实施方式
为使本发明实施例的目的、技术方案和优点更加清楚,下面将对本发明实施例中的技术方案进行清楚、完整地描述。实施例中未注明具体条件者,按照常规条件或制造商建议的条件进行。所用试剂或仪器未注明生产厂商者,均为可以通过市售购买获得的常规产品。
以下结合实施例对本发明的特征和性能作进一步的详细描述。
实施例1
本实施例提供的制备抗肿瘤活性的多糖方法如下:
(1)取摘取自处于花期的1-多年生狭叶紫锥菊(e.angustifolia)的根,作为提取多糖的原料,将其置于40℃低温条件下鼓风干燥8h。
(2)粉碎:采用气流粉碎对原料进行微粉化,控制空气压力为0.55-0.65mpa,空气流量为15-20m3/min,进料量1.5-1.8kg/h,得到微粉。微粉的粒径分布如下:粒径≤0.1μm的颗粒重量比不超过30%;1μm≤粒径≤5μm的颗粒重量比在65%以上。
(3)脱脂:按质量体积比为1:30的比例,将上述微粉与石油醚混合,加热回流1-3h,结束后,将微粉挥发至无有机溶剂。
(4)提取:将脱脂后的微粉与15-23倍水混合,加热回流提取,提取1-3次,每次1-3h;提取结束后,进行离心:1000-3000rpm,5-10min;取上清液,减压浓缩至约原体积的1/3,得到粗多糖提取液。
(5)去除蛋白:采用sevage试剂法去除蛋白;
将粗多糖提取液与sevage试剂按体积比为1:1的比例混合以去除蛋白,再加入乙醇调整醇浓度至60%,去除上清液,取沉淀即得粗多糖。
(6)去除无机盐:将上述粗多糖与60%乙醇混合,放入分子截留量为3500d的透析袋进行透析以去除无机盐,取沉淀物,加入适量去离子水,超声复溶,再进行冷冻干燥,得到初步纯化的粗多糖。
(7)层析纯化:取上述初步纯化的粗多糖,用水溶解,配成水溶液,0.45μm滤膜滤过后上deae-sepharosefastflow柱(φ2.6×20cm),流速为1ml·min-1,使用0.1-0.5m的nacl洗脱介质,根据吸光度和活性结果合并相同流分,得到epds-2。
实施例2
本实施例提供的制备抗肿瘤活性的多糖方法如下:
(1)取摘取自淡白松果菊(e.pallida)地上部分(花、叶和茎),作为提取多糖的原料,室温阴干。
(2)粉碎:采用万能粉碎机对原料进行粉碎至全部能通过65目筛,但能通过80目筛的粉体不低于总量的95%。
(3)脱脂:按质量体积比为1:30的比例,将上述微粉与石油醚混合,加热回流1-3h,结束后,将微粉挥发至无有机溶剂。
(4)提取:将脱脂后的微粉与15-23倍水混合,加热回流提取,提取1-3次,每次1-3h;提取结束后,进行离心:1000-3000rpm,5-10min;取上清液,减压浓缩至约原体积的1/5,得到粗多糖提取液。
(5)去除蛋白:采用水提醇沉法去除蛋白;
将粗多糖提取液与无水乙醇按体积比为1:1的比例混合以去除蛋白,再加入乙醇调整醇浓度至30%,去除上清液,取沉淀即得粗多糖。
(6)去除无机盐:将上述粗多糖与60%乙醇混合,放入分子截留量为8000d的透析袋进行透析以去除无机盐,取沉淀物,加入适量去离子水,超声复溶,再进行冷冻干燥,得到初步纯化的粗多糖。
(7)层析纯化:取上述初步纯化的粗多糖,用水溶解,配成一定浓度的水溶液,0.45μm滤膜滤过后上deae-sepharosefastflow柱(φ2.6×20cm),流速为1ml·min-1,使用0.1-0.5m的nacl为洗脱介质,根据吸光度和活性结果合并相同流分,得到epds-2的多糖纯品。
实施例3
(1)取摘取自9月的1-多年紫锥菊根,作为提取多糖的原料,室温阴干。
(2)粉碎:采用万能粉碎机对原料进行粉碎至全部能通过65目筛,但能通过80目筛的粉体不低于总量的95%。
(3)脱脂:按质量体积比为1:30的比例,将上述微粉与石油醚混合,加热回流1-3h,结束后,将微粉挥发至无有机溶剂。
(4)提取:将脱脂后的微粉与15-23倍水混合,加热回流提取,提取1-3次,每次1-3h;提取结束后,进行离心:1000-3000rpm,5-10min;取上清液,减压浓缩至约原体积的1/5,得到粗多糖提取液。
(5)去除蛋白:采用水提醇沉法去除蛋白;
将粗多糖提取液与无水乙醇按体积比为1:1的比例混合以去除蛋白,再加入乙醇调整醇浓度至30%,去除上清液,取沉淀即得粗多糖。
(6)去除无机盐:将上述粗多糖与60%乙醇混合,放入分子截留量为3500d的透析袋进行透析以去除无机盐,取沉淀物,加入适量去离子水,超声复溶,再进行冷冻干燥,得到初步纯化的粗多糖。
(7)层析纯化:取上述初步纯化的粗多糖,用水溶解,配成一定浓度的水溶液,0.45μm滤膜滤过后上deae-sepharosefastflow柱(φ2.6×20cm),流速为1ml·min-1,使用0.1-0.5m的nacl为洗脱介质,根据吸光度和活性结果合并相同流分,得到epds-2的多糖纯品。
实验例1
采用高效液相凝胶渗透色谱法对实施例1制得的多糖纯品进行纯度及分子量测定:
色谱条件:流动相为0.02mol/l的kh2po4缓冲溶液,凝胶柱为tskg-5000pwxlcolumn(7.8×300mm)和tskg-3000pwxlcolumn(7.8×300mm)串联使用,流速为0.6ml/min,示差检测器,柱温35℃。将紫锥菊多糖用适量流动相溶解,然后进样分析,多糖样品的出峰时间在20-25min之间,相对分子量较相近。epds-2为单一对称峰(见图2)。
以1h-nmr和13c-nmr进一步分析分析证明(见图3和图4),epds-2为均一组分的多糖,其分子量为37.9kd左右,主要由阿拉伯糖和半乳糖组成的多糖,二者之间的比例范围在3:1-4之间。
epds-2经高效凝胶渗透色谱法鉴别,证明已是单一成分(结构式如图1,r为h或甲基)。
实验例2
验证epds-2的抗肿瘤活性
选用肝癌h22细胞株对昆明种小鼠进行造模,动物造模方法如下:
将h22瘤株经体外培养后,用无菌生理盐水调整细胞浓度至1.5×107个/ml,制成细胞悬液,用注射器注入小鼠腹腔,观察到第一代的种鼠腹部凸起较为明显后(接种后7-8d左右)则可以传代,将种鼠腹部消毒后直接用针头抽取腹水细胞,调整至1.5×107个/ml后,再次传代。将肿瘤株经小鼠体内腹水传代3次后,抽取最后一次荷瘤小鼠腹水,制成浓度为1.5×107个/ml的细胞悬液,取0.2ml接种于适应性喂养1周后的小鼠右上肢腋部皮下处。接种24h后,皮下荷瘤小鼠模型,按实验要求随机分组,每组12只。
给药方案如下:
对照组:同等剂量生理盐水灌胃给药;
多糖组:20mg/kg多糖水溶液灌胃给药;
阳性对照组:40mg/kg环磷酰胺,腹腔注射;
按照以上给药剂量和途径连续给药12d,末次给药后禁食过夜,完整剥离瘤块并称重,按以下计算。
抑瘤率(%)=(模型组平均瘤重-实验组平均瘤重)/模型组平均瘤重×100。
结果见图5和下表1。
表1多糖灌胃对小鼠肿瘤生长的影响
从表1和图5结果可以看出,与对照组相比,多糖组和阳性对照组的瘤重和体积均明显减小,差异具有统计学意义。说明本发明实施例提供的多糖epds-2(图1)具有抗肿瘤活性,可以用于制备抗肿瘤药物以及用于免疫调节、抗病毒、抗氧化、降血压、抗血栓、降血糖、保护免疫性肝损伤的以及抗辐射的药物。
以上所述仅为本发明的优选实施例而已,并不用于限制本发明,对于本领域的技术人员来说,本发明可以有各种更改和变化。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!