一种木麻黄基因CeSC20及其应用的制作方法
本发明属于基因工程技术领域,具体涉及一种木麻黄基因cesc20及其应用。
背景技术:
植物生长的环境因素,如重金属、干旱、高盐、高温和低温等都会影响植物的生长发育。影响植物生长发育的诸多因素中,干旱和高盐是最为常见的类型。干旱胁迫影响植物光合产物的分配与运输,造成植物的生产力下降。盐胁迫打破植物细胞的离子平衡,破坏植物细胞活性氧的产生与清除的平衡。全球干旱和高盐地区面积巨大,植物以及农作物的生存与生长发育面临干旱和盐胁迫的挑战,研究响应干旱和盐胁迫的抗逆基因有利于培育高产、适应能力强的作物品种。研究极端环境中适生植物的抗逆记忆,能够为分子育种提供研究基础并具有指导意义。
木麻黄生长迅速,适应性强,对生长环境要求不高。木麻黄根系发达、叶表皮气孔凹陷,具有良好的抗风固沙、碱、耐干旱的能力。木麻黄是构建防风固沙绿地的理想树种,也是植被恢复的重要工具种,同时也是木材、药材等生产原材料,具有生态价值和经济价值。目前,木麻黄重要抗逆基因还有待挖掘和开发。
技术实现要素:
基于此,本发明提供一种木麻黄基因cesc20及其应用,通过基因克隆进行功能研究发现所述cesc20基因能够提高生物体的抗旱能力,可用于提高植物的抗旱性能,培育抗旱的植物品种。
具体技术方案为:
一种木麻黄抗旱基因cesc20,所述木麻黄抗旱基因cesc20的cdna序列如seqidno.1所示,或为与seqidno.1完全互补配对的序列,或为编码氨基酸序列如seqidno.2所示的序列。
在其中一些实施例中,所述木麻黄抗旱基因cesc20的表达蛋白的氨基酸序列如seqidno.2所示。
本发明还提供了上述木麻黄抗旱基因cesc20和上述木麻黄抗旱基因cesc20的表达蛋白在提高植物抗旱性能中的应用。
本发明还提供了上述木麻黄抗旱基因cesc20和上述木麻黄抗旱基因cesc20的表达蛋白在植物育种中提高植物抗旱性性中的应用。
在其中一些实施例中,所述植物为水稻、玉米、大豆。
本发明还提供了一种木麻黄抗旱基因cesc20重组表达载体。
具体技术方案为:
一种木麻黄抗旱基因cesc20重组表达载体,所述重组表达载体上插入有上述木麻黄抗旱基因cesc20。
上述重组表达载体在提高植物抗旱性能中的应用。
在其中一些实施例中,所述重组表达载体为酿酒酵母重组表达载体。
在其中一些实施例中,优选所述重组表达载体为pyes-dest52-cesc20。
上述酿酒酵母重组表达载体在提高酵母菌株抗旱性能中的应用。
在其中一些实施例中,所述重组表达载体为pcambia1300-cesc20。
在其中一些实施例中,在所述pcambia1300-cesc20重组表达载体中,控制所述cesc20基因表达的启动子为ubq启动子。
上述pcambia1300-cesc20重组表达载体在提高植物抗旱性能中的应用。
本发明还提供了一种提高植物抗旱性能的方法。
具体技术方案为:
一种提高植物抗旱性能的方法,所述方法为将上述木麻黄抗旱基因cesc20转入植物中,并使其表达,得到抗旱植物。
在其中一些实施例中,所述提高植物抗旱性能的方法包括以下步骤:
(1)将上述木麻黄抗旱基因cesc20的cdna序列插入pcambia1300质粒中,得到pcambia1300-cesc20重组表达载体;
(2)将步骤(1)中的pcambia1300-cesc20重组表达载体转化农杆菌,筛选阳性农杆菌;
(3)将步骤(2)中的阳性农杆菌侵染植物,得到抗旱植物。
在其中一些实施例中,通过以下方法获得所述木麻黄抗旱基因cesc20的cdna:
(1)取木麻黄新鲜根和叶片,提取得到rna;
(2)将步骤(1)获得的rna进行逆转录,得到cdna;
(3)以步骤(2)获得的cdna为模板,利用如seqidno.3所示的上游引物和seqidno.4所示的下游引物进行pcr扩增,得到木麻黄抗旱基因cesc20的cdna。
与现有技术相比,本发明具有以下有益效果:
本发明提供了一种木麻黄抗旱基因cesc20,并构建了所述cesc20基因的重组表达载体。通过基因克隆进行功能研究发现所述cesc20基因能够提高生物体的抗旱能力。将上述cesc20基因的重组表达载体转化进入酿酒酵母中,通过半乳糖诱导该基因在酵母中的超表达,能够在高盐和过氧化氢胁迫处理下,提高酵母对氧化胁迫的耐受性;将上述cesc20基因的重组表达载体转入植物中,使cesc20基因在植物中过表达,可以有效提高植物的抗旱能力。所述cesc20基因可广泛应用于提高生物体的抗旱能力,包括构建抗旱酿酒酵母工程菌株,培育抗旱的植物品种,提高植物的抗旱能力等,在微生物和农业领域具有广阔的应用价值。
附图说明
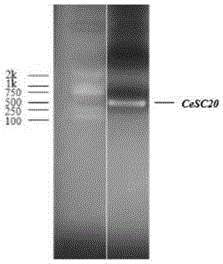
图1为cesc20基因pcr扩增产物的琼脂糖凝胶电泳检测结果图。
图2为实施例2构建的pyes-dest52-cesc20重组表达载体结构示意图。
图3为实施例3构建的pcambia1300-cesc20重组表达载体的结构示意图。
图4为h2o2敏感型酵母菌株by4741对氧化胁迫的耐受性实验结果。
图5为h2o2敏感型酵母菌株yap1对氧化胁迫的耐受性实验结果。
具体实施方式
为了便于理解本发明,下面将参照实施例对本发明进行更全面的描述,以下给出了本发明的较佳实施例。但是,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施例。提供这些实施例的目的是使对本发明的公开内容的理解更加透彻全面。应理解,下列实施例中未注明具体条件的实验方法,通常按照常规条件,或按照制造厂商所建议的条件。实施例中所用到的各种常用试剂,均为市售产品。
除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的技术领域的技术人员通常理解的含义相同。在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。
本发明所述木麻黄抗旱基因cesc20的cdna序列如seqidno.1所示,或为与seqidno.1完全互补配对的序列,或为编码氨基酸序列如seqidno.2所示的序列。
seqidno.1:
atgacggtgaagcctgttaacgtgtcgctggactgtgttgctgaaagtcggaagccgaaggatttctcctcgccggagtgcggtgatctcgcggggaaggtgtcgagggatgatcggagggtggaggagactgaacggtcgcctaaggcggtggggaaatgggggaagtacgtgcatagccagatcctgaggatcagggaggaggactcgcacctcggggaggaattcagtctcggcatcaaggagaacgttcatctttctcaccaccatcattatgatcacgtggatttgccggaccccgcggtattctccaagccgatcttgccgagctccccgctcagccgcaagaccagcgctgtagaggcgttactttga
应当理解,考虑到密码子的简并性,在不改变氨基酸序列的前提下,对上述cdna的碱基序列进行修改,也属于本发明的保护范围。
本发明所述木麻黄抗旱基因cesc20的表达蛋白氨基酸序列如seqidno.2所示。
seqidno.2:
mtvkpvnvsldcvaesrkpkdfsspecgdlagkvsrddrrveeterspkavgkwgkyvhsqilrireedshlgeefslgikenvhlshhhhydhvdlpdpavfskpilpssplsrktsaveall*(*表示终止)
实施例1一种木麻黄抗旱基因cesc20及其表达蛋白
本实施例一种木麻黄抗旱基因cesc20,其cdna序列如seqidno.1所示,或为与seqidno.1完全互补配对的序列,或为编码氨基酸序列如seqidno.2所示的序列。
上述木麻黄抗旱基因cesc20的表达蛋白的氨基酸序列如seqidno.2所示。
上述木麻黄抗旱基因cesc20的cdna通过以下方法获得:
(1)取木麻黄新鲜根和叶片,提取得到rna
使用北京华越洋生物科技有限公司的plantrnakit,超快型植物rna提取试剂盒提取木麻黄rna。
1)称取木麻黄新鲜根和叶片100mg后迅速放入研钵,加入液氮研磨法破碎。
2)将研磨后的植物组织放入离心管并加入1ml细胞裂解液。将匀浆物转移至干净的1.5ml离心管中。
3)在离心管中加入300μl去蛋白液和200μl氯仿,振荡器振荡30s混匀。室温12000g离心5min,将上清液转移至新的干净的1.5ml离心管。
4)加入等体积的漂洗液,充分颠倒混匀。将混合物加入离心吸附柱中,12000g室温离心1min,弃穿透液。
5)加500μl洗柱液,12000g室温离心1min,弃穿透液。加入500μl洗柱液,重复一边。然后再室温12000g离心1min除去残留液体。
6)将离心吸附柱转移到rnase-free收集管中,加入50μlrna洗脱液,室温静置3-5min。
7)12000g室温离心1min,离心管中即为木麻黄rna样品,存放于-80℃待用。
(2)将步骤(1)获得的rna进行逆转录,得到cdna
使用diamond公司的superm-mulv逆转录酶对步骤(1)获得的木麻黄rna进行逆转录。
1)在无菌的rnase-free离心管中配置以下体系:2μloligo(dt)18primer,2μldntpmixture(10mm),1.5μl木麻黄总rna,最后加rnasefreeddh2o定容至10μl。
2)65℃保温5min后迅速置于冰上1min以上。
3)离心数秒使rna的变性溶液聚集于离心管底部。
4)在上述离心管中配制逆转录反应液:rna变性溶液10μl,4μl的5×supermmlvbuffer,2μl的10×solution,1μl的rnaseinhibitor(40u/μl),1μl的superm-mulv(200u/μl),加rnasefreeddh2o定容至20μl。
5)轻弹离心管,37℃保温60min。
6)80℃保温15min后冰上冷却,得到cdna。
(3)以步骤(2)获得的cdna为模板,利用如seqidno.3所示的上游引物和seqidno.4所示的下游引物进行pcr扩增
使用toyobo的高成功率pcr酶kodfx进行pcr扩增。
1)扩增引物:
seqidno.3:5,-gcttggtaccgagctcggatgacggtgaagcctgttaa-3,
seqidno.4:5,-gacatctccgcaatgaaactcttaagacgtctataggt-3,
2)pcr反应液的配制
在无菌的dnase-free离心管中配置以下体系:25μl的2×pcrbufferforkodfx,10μl的dntps(2mm),1.5μl的引物1(10pmol/μl),1.5μl的引物2(10pmol/μl),0.2μl的cdna,1μl的kodfx(1.0u/μl),加distilledwater定容至50μl。
3)设置pcr程序
步骤1:预热,94℃,2min;
步骤2:变性,98℃,10sec;
步骤3:退火,55℃,30sec;
步骤4:延伸,68℃,2min;
步骤5:重复步骤2-4,40个循环。
对上述pcr反应产物进行琼脂糖凝胶电泳检测,包括具体包括以下步骤:
(1)配制琼脂糖凝胶:向50ml的tae(1×)加入1g琼脂糖,放入微波炉加热溶解,向溶解后的溶液中加入2μl的溴化乙啶(eb),倒入平板冷却30min。
(2)将冷却后的琼脂糖凝胶放入电泳槽,将pcr产物和dnamarker点入槽内,进行电泳。
(3)观察电泳结果,切条带后胶回收。
琼脂糖凝胶电泳检测结果如图1所示,成功扩增得到木麻黄抗旱基因cesc20。
使用生工生物工程股份有限公司胶回收试剂盒对上述琼脂糖凝胶电泳检测条带进行胶回收,包括具体包括以下步骤:
(1)从琼脂糖凝胶中切下含有cesc20基因片段的胶块,称重。
(2)每100mg胶块加入600μl的bufferb2,50℃水浴至琼脂糖凝胶溶解。
(3)将溶胶液移入吸附柱中,8000g离心30s,倒掉收集管中的液体。
(4)加入500μlwashsolution,9000g离心30s,倒掉收集管中液体。
(5)重复步骤4一次。
(6)空吸附柱于9000g离心1min。
(7)将吸附柱放入一个干净的1.5ml离心管中,在吸附膜中央加入25μlelutionbuffer,室温静置1min后,离心1min,保存管中的dna溶液。
实施例2一种cesc20基因的重组表达载体pyes-dest52-cesc20
本实施例一种cesc20基因的重组表达载体,其结构示意图如图2所示,通过将实施例1所述木麻黄抗旱基因cesc20插入pyes-dest52酵母表达载体中获得,具体构建方法包括以下步骤:
1、pyes-dest52酶切载体的获得
使用thermoscientific公司的内切酶和缓冲液
(1)配制pyes-dest52酶切反应液:5.8μl的酵母质粒,1μl的bamhi,1μl的ecori,5μl的kbuffer(1×),加distilledwater定容至50μl。
(2)将酶切反应液放置于37℃水浴锅,水浴3h。
2、木麻黄cesc20基因连接至酶切后的pyes-dest52载体。
使用生工生物工程股份有限公司ready-to-useseamlesscloningkit连接。
(1)在冰上配制infusion体系:1μl的实施例1胶回收获得的dna溶液,1μl的酶切后pyes-dest52载体,2.5μl的seamlesscloningmastermix(2x)。
(2)将配制的infusion体系放入50℃水浴锅,水浴20min。
(3)水浴完成后,冰浴2min。
3、将步骤2获得的产物导入大肠杆菌(dh5α)。
使用大肠杆菌感受态菌株dh5α。
(1)将infusion产物加入dh5α。
(2)冰浴30min。
(3)42℃,水浴1min。
(4)冰浴2min。
(5)在超净工作台内加lb液体培养基600μl。
(6)设置摇床温度37℃,振荡培养45min。
(7)取出培养完成的dh5α,离心机10000g,离心1min。
(8)在超净工作台中弃上清液(移液枪抽取,剩20-50μl)。
(9)重悬,用移液器吹打至底部无沉淀。
(10)全部涂于羧苄青霉素(cab)抗性(1μl/ml)培养基中。
(11)待培养基吹干后,于37℃培养箱过夜培养。
4、带有cesc20基因的酵母表达载体pyes-dest52-cesc20质粒的获得。
从抗性培养基挑取单菌落,在1.5ml无菌离心管中加入600μllb液体培养基和6μlcab抗生素,将单菌落加入离心管于37℃摇床过夜培养。
使用生工sanprep柱式质粒dna小量抽提试剂盒提取质粒。
(1)将过夜培养的菌液于8000g离心2min,收集菌体,弃尽培养基。
(2)向沉淀中加入250μlbufferp1,彻底悬浮菌体。
(3)加入250μlbufferp2,立即温和颠倒5-10次混匀,室温放置2-4min。
(4)加入350μlbufferp3,立即温和颠倒5-10次混匀。
(5)12000g离心5-10min,将上清液移入吸附柱,8000g离心30s,倒掉收集管中液体。
(6)加入500μlbufferdw1,9000g离心30s,倒掉收集管中液体。
(7)加入500μlwashsolution,9000g离心30s,倒掉收集管中液体。
(8)重复步骤7一次。
(9)空吸附柱于9000g离心1min。
(10)将吸附柱放入干净的1.5ml离心管中,在吸附膜中央加入50μlelutionbuffer,室温静置1min,9000g离心1min,保存管中dna溶液。
(11)将获得的质粒送测序公司测序,测序由广州擎科生物公司完成。
测序结果正确的质粒即为pyes-dest52-cesc20重组表达载体。
实施例3一种cesc20基因的重组表达载体pcambia1300-cesc20
本实施例一种cesc20基因的重组表达载体,其结构示意图如图3所示,通过将实施例1所述木麻黄抗旱基因cesc20插入pcambia1300载体中获得,具体包括以下步骤:将实施例1中胶回收获得的dna溶液和pcambia1300载体通过infusion体系进行反应,然后将infusion产物导入感受态细胞中,挑取阳性单菌落,扩大培养,提取质粒,将获得的质粒送测序公司测序,测序由广州擎科生物公司完成,测序结果正确的质粒即为cesc20基因的重组表达载体pcambia1300-cesc20。
实施例4cesc20基因在酵母中超表达可提高酵母对氧化胁迫的耐受性
将测序结果正确的pyes-dest52-cesc20重组表达质粒导入h2o2敏感型菌株by4741和yap1,将空pyes-dest52载体质粒导入野生型by4741酵母株系作为对照。
(1)分别在加入20ml液体ypd培养基的小锥形瓶中摇by4741和yap1单菌落,28℃摇过夜作为母液。
(2)取部分母液至装有20ml液体ypd培养基中,调节其初始od600值为02-0.3。28℃摇1.5-2h至od600为0.4-0.6。
(3)将锥形瓶中的酵母分装至15ml的离心管,6000g离心5min,弃掉上清液后用li盐重悬。
(4)向重悬后的试管加入10μl的鲤鱼精dna,4μl的空pyes-dest52载体质粒(对照组)或pyes-dest52-cesc20重组表达质粒(实验组),100μl感受态细胞和600μl的peg,混匀后在28℃摇床培养30min。
(5)42℃热激15min,4℃冷却2min,室温条件下6000g离心30s,弃上清液,吸干peg,随后用70μl1×te重悬,涂至加入相应氨基酸的固体ynb培养基(每100mlynb中加入组氨酸、亮氨酸和甲硫氨酸各830μl)。
(6)将培养基放至28℃烘箱培养3天,挑取单菌落至装有1mlynb液体培养基的离心管中。
(7)将装有菌的离心管放至28℃烘箱摇过夜,调至相同od600后。分别将菌液稀释为10×,100×和1000×,点至h2o2浓度为0.75mm、1mm和1.5mm的ynb固体培养基(每100mlynb中加入组氨酸、亮氨酸和甲硫氨酸各830μl)上,于37℃烘箱培养一周。
如图4所示,在无h2o2添加的ynb培养基上,含有pyes-dest52-cesc20重组表达质粒(图4中用cesc20表示)与含有空载pyes-dest52质粒(图4中用pyes2表示)的by4741不同浓度菌液生长情况基本一致。在0.75mmh2o2条件下,二者生长情况相近;但是在1mm和1.5mmh2o2浓度的ynb培养基上,导入pyes-dest52-cesc20重组表达质粒的by4741生长情况明显好于导入空载pyes-dest52质粒的by4741。
如图5所示,将pyes-dest52-cesc20重组表达质粒(图5中用cesc20表示)导入h2o2敏感型酵母yap1中,将空载体pyes-dest52质粒(图5中用pyes2表示)导入by4741中。在不添加h2o2的ynb培养基上二者长势基本一致。在0.75mmh2o2条件下,含有pyes-dest52-cesc20重组表达质粒的h2o2敏感型酵母yap1低浓度菌液生长情况好于含有空载体pyes-dest52质粒的by4741;在1mm和1.5mmh2o2浓度的ynb培养基上,稀释后的含有pyes-dest52-cesc20重组表达质粒的yap1酵母生长情况好于含有空载体pyes-dest52质粒的by4741酵母。
上述实验结果表明,pyes-dest52-cesc20重组表达质粒能够明显提高酵母的抗氧化胁迫能力,说明pyes-dest52-cesc20重组表达质粒能明显提高酵母的抗旱性能。
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对以上实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对本发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
sequencelisting
<110>中国科学院华南植物园
<120>一种木麻黄基因cesc20及其应用
<130>2020-04-08
<160>4
<170>patentinversion3.3
<210>1
<211>375
<212>dna
<213>artificialsequence
<400>1
atgacggtgaagcctgttaacgtgtcgctggactgtgttgctgaaagtcggaagccgaag60
gatttctcctcgccggagtgcggtgatctcgcggggaaggtgtcgagggatgatcggagg120
gtggaggagactgaacggtcgcctaaggcggtggggaaatgggggaagtacgtgcatagc180
cagatcctgaggatcagggaggaggactcgcacctcggggaggaattcagtctcggcatc240
aaggagaacgttcatctttctcaccaccatcattatgatcacgtggatttgccggacccc300
gcggtattctccaagccgatcttgccgagctccccgctcagccgcaagaccagcgctgta360
gaggcgttactttga375
<210>2
<211>124
<212>prt
<213>artificialsequence
<400>2
metthrvallysprovalasnvalserleuaspcysvalalagluser
151015
arglysprolysasppheserserproglucysglyaspleualagly
202530
lysvalserargaspaspargargvalglugluthrgluargserpro
354045
lysalavalglylystrpglylystyrvalhisserglnileleuarg
505560
ileargglugluaspserhisleuglygluglupheserleuglyile
65707580
lysgluasnvalhisleuserhishishishistyrasphisvalasp
859095
leuproaspproalavalpheserlysproileleuproserserpro
100105110
leuserarglysthrseralavalglualaleuleu
115120
<210>3
<211>38
<212>dna
<213>artificialsequence
<400>3
gcttggtaccgagctcggatgacggtgaagcctgttaa38
<210>4
<211>38
<212>dna
<213>artificialsequence
<400>4
gacatctccgcaatgaaactcttaagacgtctataggt38
- 还没有人留言评论。精彩留言会获得点赞!