呼吸道病毒处理试剂及其应用的制作方法
本发明涉及病毒检测领域,具体而言,涉及一种呼吸道病毒处理试剂及其应用。
背景技术:
呼吸道感染一直是困扰人类最常见、发生率最高的疾病,是引起老人和儿童因病死亡最多的病因,也是新发和突发传染病的最主要病源因素,而呼吸道病毒的感染占据其中的70-80%,如2019年12月中旬发生的新型冠状病毒肺炎疫情(covid-19),截止2020年4月25日已经导致全球超过260万感染、近20万患者死亡,目前仍在快速发展,给人类带来巨大的灾难。在呼吸道病毒造成的疫情防控过程中,早发现、早隔离、早治疗是最有效的防控手段。因此,安全、快速的病毒核酸检测对疫情防控及患者分流具有重要意义。
在导致人类呼吸道感染流行的病毒中,正粘病毒(如甲、乙型流感病毒infa、b)、副粘病毒(如呼吸道合胞病毒rsv、副流感病毒piv、偏肺病毒hmpv)、冠状病毒(如新型冠状病毒sars-cov-2)等都为有包膜病毒,这类病毒由于结构特点对有机溶剂非常敏感,易失活,而这些病毒正是导致人类感染流行的最主要病毒;而如腺病毒adv、肠道病毒ev、鼻病毒hrv等都为无包膜病毒,相对来说对有机溶剂不敏感。常规呼吸道样品如咽拭子等的采样中,一般采集后使用病毒转运培养基(vtm)或者等渗溶液(pbs或生理盐水)等进行保存及转运,在这类溶液中病毒仍为活病毒状态,因此,在运输及后续检测操作的过程中具有很高的感染风险,也提高了检测过程中的防护要求。如本次sars-cov-2核酸检测要求在二级实验室、三级防护下进行,一般基层医院很难开展,这也限制了检测能力的扩大;而如使用56℃30min等灭活病毒方式也将影响病毒核酸、特别是rna的稳定性,对结果造成影响。
在常规的病毒核酸检测过程中,核酸提取是其中的重要组成部分,一般需要30min甚至更长时间,在应对如covid-19这种超大量样品及高时效性核酸筛查工作中,核酸提取过程严重影响了筛查效率。因此,一种无需核酸提取、兼容病毒核酸检测的安全的即用型样品保存液将大大提高检测效率。
技术实现要素:
为了实现本发明的上述目的,特采用以下技术方案以全部或部分解决上述问题:
本发明涉及一种呼吸道病毒处理试剂,其为包含以下主要活性组分的溶液:
tween20、nonidetp40和二硫苏糖醇;
且所述主要活性组分在处理病毒时的工作浓度在以下范围内:
-tween200.6%~1.2%(v/v);
-nonidetp400.6%~1.2%(v/v);
-二硫苏糖醇10mm~60mm。
本发明还涉及一种保存病毒的方法,包括将如上所述的病毒处理试剂与病毒充分接触的步骤。
在本发明等另一方面,本发明还涉及如上所述的病毒处理试剂在配合额外的具有核酸提取功能的试剂进行病毒核酸提取中的应用。
在本发明等另一方面,本发明还涉及如上所述的病毒处理试剂作为病毒核酸提取的应用。
本发明的有益效果为:
1)细胞、咽拭子等样品无需核酸提取兼容病毒核酸检测;
2)本发明中的呼吸道病毒处理试剂保存样品可兼容常规商品化核酸提取试剂盒进行核酸提取;
3)本发明中的呼吸道病毒处理试剂保存样品可兼容用于抗原抗体类检测;
4)可灭活有包膜病毒活性,减少操作过程中的感染风险;
5)优于常规vtm的病毒核酸保存效果。
本发明所提供的呼吸道病毒处理试剂可以大大提高筛查效率,降低样品转运、检测操作过程中的人员感染风险,降低检测实验室操作过程的防护等级,节省转运、保存成本,对呼吸道病毒疫情如covid-19防控具有重要意义。
附图说明
为了更清楚地说明本发明具体实施方式或现有技术中的技术方案,下面将对具体实施方式或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图是本发明的一些实施方式,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1为本发明一个实施例中rsv-a2病毒在rtu保存液中完全灭活,经过盲传3代未观察到cpe(感染后第四天);
图2为本发明一个实施例中ev71病毒在rtu保存液中无法完全灭活,仍可感染增殖产生cpe(感染后第三天);
图3为本发明一个实施例中adv3-egfp重组病毒在rtu保存液中无法完全灭活,仍可感染增殖在细胞中产生绿色荧光(感染后第二天);
图4为本发明一个实施例中rtu保存rsv在室温(rt)、4℃、-20℃及-80℃下的核酸稳定性;数据为ct值平均值;a:高浓度rsv样品;b:低浓度rsv样品;vtm为商品化病毒转运培养基。
具体实施方式
现将详细地提供本发明实施方式的参考,其一个或多个实例描述于下文。提供每一实例作为解释而非限制本发明。实际上,对本领域技术人员而言,显而易见的是,可以对本发明进行多种修改和变化而不背离本发明的范围或精神。例如,作为一个实施方式的部分而说明或描述的特征可以用于另一实施方式中,来产生更进一步的实施方式。
因此,旨在本发明覆盖落入所附权利要求的范围及其等同范围中的此类修改和变化。本发明的其它对象、特征和方面公开于以下详细描述中或从中是显而易见的。本领域普通技术人员应理解本讨论仅是示例性实施方式的描述,而非意在限制本发明更广阔的方面。
本发明涉及一种呼吸道病毒处理试剂,其为包含以下主要活性组分的溶液:
tween20、nonidetp40和二硫苏糖醇;
且所述主要活性组分在处理病毒时的工作浓度在以下范围内:
-tween200.6%~1.2%(v/v);
-nonidetp400.6%~1.2%(v/v);
-二硫苏糖醇10mm~60mm。
在本发明中,“工作浓度”用于限定所述呼吸道病毒处理试剂在处理病毒时主要活性组分的比例,所述呼吸道病毒处理试剂中主要活性组分的浓度可以为工作浓度,也可以为能够稀释为该浓度的母液(例如2、3、4、5、6、7、8、9、10、20、30、40、50倍浓缩的母液)。
在一些实施方式中,tween20的工作浓度为0.7%、0.8%、0.9%、1.0%、1.1%(v/v)。
在一些实施方式中,nonidetp40的工作浓度为0.7%、0.8%、0.9%、1.0%、1.1%(v/v)。
在一些实施方式中,二硫苏糖醇的工作浓度为20mm、30mm、40mm。
在一些实施方式中,所述主要活性组分在处理病毒时的工作浓度在以下范围内:
-tween200.8%~1.0%(v/v);
-nonidetp400.8%~1.0%(v/v);
-二硫苏糖醇20mm~50mm。
在一些实施方式中,所述主要活性组分在处理病毒时的工作浓度在以下范围内:
-tween200.9%(v/v);
-nonidetp400.9%(v/v);
-二硫苏糖醇30mm。
在一些实施方式中,所述主要活性组分在处理病毒时的工作浓度在以下范围内:
-tween200.9%(v/v);
-nonidetp400.9%(v/v);
-二硫苏糖醇40mm。
呼吸道病毒具体可以包括正粘病毒(如甲、乙型流感病毒infa、b)、副粘病毒(如呼吸道合胞病毒rsv、副流感病毒piv、偏肺病毒hmpv)、冠状病毒(如严重急性呼吸系统综合症冠状病毒sars-cov、严重急性呼吸系统综合症冠状病毒2型sars-cov-2、中东呼吸综合症冠状病毒mers-cov)等。
在一些实施方式中,呼吸道病毒为有包膜病毒。
在一些实施方式中,呼吸道病毒为rna病毒。
在一些实施方式中,呼吸道病毒可以感染哺乳动物,优选灵长类动物,优选人类。
在本发明中,术语“呼吸道”可以包括下述的三部分:
·上呼吸道:鼻、鼻道、鼻窦、喉和咽。
·气管:喉结、气管、支气管和次级支气管。
·肺:小支气管、肺泡管和肺泡。
在本发明中,“处理病毒”但应用场景包括但不限于保存病毒、灭活病毒、病毒的核酸提取或核酸检测。
在一些实施方式中,病毒以样品的形式进行被处理,所述样品优选为可用于临床诊断的样品,示例的样品选自细胞、咽拭子、鼻拭子、痰液、呼吸道吸取物、支气管灌洗液、肺泡灌洗液、眼结膜拭子、唾液样品、粪便标本、抗凝血和血清标本中的一种或多种;样品优选经过纯化以获得纯度更高的病毒;优选的样品为细胞和/或咽拭子。
在一些实施方式中,其在处理病毒时的ph为7~9,ph还可以为7.5、7.6、7.7、7.8、7.9、8.0、8.1、8.2、8.3、8.4、8.5。
在一些实施方式中,其还包含缓冲组分。
如本文使用的术语“缓冲组分”指具有缓冲能力的水溶液或组合物,当酸或碱加入该溶液或组合物中时,所述水溶液或组合物抵抗ph中的变化。这种对ph变化的抗性是由于此类溶液的缓冲性质。因此,显示出缓冲活性的溶液或组合物被称为缓冲液或缓冲溶液。缓冲液一般不具有无限的维持溶液或组合物的ph的能力。相反,它们一般能够维持在特定范围内的ph,例如ph7–ph9。一般地,缓冲液能够维持在其pka上和下一个对数内的ph(参见例如,mohan,buffers,aguideforthepreparationanduseofbuffersinbiologicalsystems,calbiochem,1999)。缓冲液和缓冲溶液一般由缓冲盐或优选非离子缓冲液组分如tris和hepes制备。可以在本发明的方法中使用的缓冲液优选选自磷酸盐缓冲液、磷酸盐缓冲盐水缓冲液(pbs)、2-氨基-2羟甲基-1,3-丙二醇(tris)缓冲液、tris缓冲盐水溶液(tbs)和tris/edta(te)。
在一些实施方式中,所述缓冲组分为tris-cl。
在一些实施方式中,所述溶液的主要溶剂为水。
本发明还涉及一种保存病毒的方法,包括将如上所述的病毒处理试剂与病毒充分接触的步骤。
本发明所提供的保存病毒的方法可以在宽泛的温度下进行,例如-196℃、-80℃、4℃、20℃、30℃或更高。
虽然低温能保证更好的保存效果,但在一些实施方式中,为了契合样品的实际收集条件等因素,保存的温度≥4℃,进一步为室温(例如16℃~26℃)。
在本发明等另一方面,本发明还涉及如上所述的病毒处理试剂在配合额外的具有核酸提取功能的试剂进行病毒核酸提取中的应用。
在本发明等另一方面,本发明还涉及如上所述的病毒处理试剂作为病毒核酸提取的应用。
所述病毒处理试剂与核酸处理试剂具有很好的兼容性,并且本身也可以作为病毒核酸提取试剂使用以处理相对较纯的样本,例如细胞样本和/或咽拭子样本。
所述呼吸道病毒处理试剂还可以用于基于抗原-抗体法的呼吸道病毒检测方法,以及病毒的核酸检测。
具体的,本发明涉及一种呼吸道病毒检测方法,其包括将待检测病毒用如上所述的呼吸道病毒处理试剂进行保存和/或裂解,并对使用抗原-抗体法检测试剂和/或核酸提取试剂对待检测病毒的蛋白和/或核酸进行检测。
所述呼吸道病毒处理试剂兼容抗原-抗体法检测试剂和核酸提取试剂,在检测时不需要将所述呼吸道病毒处理试剂额外除去。
下面将结合实施例对本发明的实施方案进行详细描述。
实施例1即用型病毒采样保存液组成
本发明中的呼吸道病毒处理试剂(以下简称即用型病毒采样保存液,rtu)利用温和的非离子去污剂tween20及nonidetp40(np40)进行细胞、病毒裂解,并通过使用二硫苏糖醇dtt加强抑制相关核酸酶如rnase活性。
1×rtu成分:
在上述浓度范围内rtu能够稳定地发挥其功能。
实施例2rtu保存的病毒分离细胞样品、咽拭子样品的核酸检测即用性及常规核酸提取试剂盒兼容性
实验使用1×rtu对实验室保有的adv(dna病毒)和rsv(rna病毒)的培养分离的细胞进行裂解,并对照常规商品化核酸提取试剂盒进行对照,使用病毒荧光定量pcr试剂检测、评价rtu即用性,并评价rtu保存样品对常规商品化核酸提取试剂盒的兼容性。
1.rtu保存的病毒分离细胞可直接用于病毒核酸检测并兼容常规核酸提取试剂盒
(1)adv及rsv培养
adv的培养a549细胞使用dmem+5%fbs培养基于37℃5%co2培养箱中培养;细胞长满后消化接种至96孔板中;细胞密度80%左右时去除培养基,接种事前准备好的于dmem+2%fbs中的adv毒种,35℃5%co2培养箱中培养2天。
rsv的培养hep-2细胞使用dmem+10%fbs培养基于37℃5%co2培养箱中培养;细胞长满后消化接种至96孔板中;细胞密度80%左右时去除培养基,接种事前准备好的于dmem+2%fbs中的rsv毒种,35℃5%co2培养箱中培养2天。
(2)核酸提取
病毒培养2天后,吸弃培养基:
1)使用1×rtu100μl/孔裂解细胞并收集至1.5ml离心管中,高速涡旋震荡10sec,静置5min,直接用于病毒荧光定量pcr检测,实验设置3个平行;
2)使用qiagen公司rneasyminikit(cat#74104)提取试剂盒,使用takara公司takaraminibestviralrna/dnaextractionkitver.5.0(cat#9766)进行核酸提取,操作按照说明书进行,最终获得100μl/孔病毒核酸产物,实验设置3个平行。
3)为验证rtu保存的样品是否可以兼容常规核酸提取试剂盒,使用1×rtu100μl/孔裂解细胞并收集至1.5ml离心管中,高速涡旋震荡10sec,静置5min后,再使用qiagen公司rneasyminikit提取试剂盒、takara公司takaraminibestviralrna/dnaextractionkitver.5.0提取试剂盒对rtu保存的rsv病毒和adv病毒样品进行分别提取,最终获得100μl/孔病毒核酸产物,用于病毒荧光定量pcr检测,实验设置3个平行。
(3)病毒荧光定量pcr检测
分别使用商品化的adv、rsv荧光定量pcr检测试剂对rtu样品及试剂盒提取的核酸进行检测、评价。
25μl反应体系中加入1/10体积即2.5μlrtu样品,同时,使用试剂盒提取的核酸产物作为对照进行检测,记录检测所得ct值(表1)。
表1.rtu裂解培养的病毒分离细胞核酸荧光定量pcr检测即用性分析
实验结果可见,在病毒分离培养的细胞样品中使用rtu直接裂解细胞并直接进行病毒荧光定量pcr与常规核酸提取试剂盒进行核酸提取后进行核酸检测的结果基本一致,说明rtu具备在培养细胞中无需核酸提取即可直接用于核酸检测的能力;同时在rtu中的样品完全兼容常规商品化核酸提取方法,使得rtu保存样品也可以用于实验室中已经建立的核酸提取系统。
2.rtu在不同呼吸道样品类型中的即用性分析
为验证rtu在常规呼吸道样品中是否具备即用性核酸检测能力,实验针对常规呼吸道样品,如咽拭子、痰液、唾液、肺泡灌洗液等进行分析。
(1)咽拭子
采集10例呼吸道病毒阳性患者咽拭子至含2ml1×rtu的15ml离心管中,高速涡旋震荡10sec,静置5min;
(2)痰液、唾液、肺泡灌洗液
配置10×rtu;
采集呼吸道病毒阳性患者的痰液、唾液各5例,肺泡灌洗液2例。样品中加入10×rtu使其终浓度至1×;高速涡旋震荡10sec,静置5min。(注:rtu中含有约50mmdtt,对痰液具有液化能力)
(3)设置常规核酸提取试剂盒核酸提取对照
使用qiagen公司rneasyminikit提取试剂盒,takara公司takaraminibestviralrna/dnaextractionkitver.5.0提取试剂盒提取上述收集在rtu中的患者样品,操作按照说明书进行,最终获得与所用样品体积同样体积的核酸产物,以便对比分析。
(4)病毒荧光定量pcr检测
对呼吸道病毒阳性样品采用相应的病毒荧光定量pcr检测试剂进行检测。25μl反应体系中使用2.5μl核酸产物,记录实验ct值结果(表2)。
表2.不同类型呼吸道样品在rtu中的即用性分析
注:“-”为阴性。
从结果可见,几种常见呼吸道样品类型中,痰液、唾液由于含有大量粘液多糖等扩增抑制物,rtu无法直接用于病毒核酸检测;肺泡灌洗液虽然都检测出病毒阳性,但也因抑制物较多的问题,使其扩增受到较大抑制,与核酸提取后的结果ct值差异巨大,但都可以使用核酸提取试剂盒正常提取检测。咽拭子样品中rtu与提取试剂盒的结果基本一致,扩增结果差异较小(0.6-1.84ct值),且有包膜病毒(rsv/hmpv/piv3)的差异性(0.6-0.91ct值)小于无包膜病毒(adv/hrv)的差异性(1.78-1.83ct值),结合上述病毒分离细胞样品的实验结果,可见rtu核酸即用性在有包膜病毒中效果更佳,且采集的样品越干净效果越好,因此可以通过控制采样质量,减少带入粘液等方法,提高rtu即用性效果。
实施例3rtu保存样品兼容抗原检测实验
为验证rtu保存的样品是否兼容抗原抗体类分析,实验对rtu保存的adv样品进行抗原检测。
(1)adv的培养
a549细胞使用dmem+5%fbs于37℃5%co2培养箱中培养;细胞长满后消化接种至96孔板中;细胞密度80%左右时去除培养基,接种事前准备好的于dmem+2%fbs中的adv毒种,35℃5%co2培养箱中培养2天。
(2)样品收集
病毒培养2天后,吸弃培养基后:
使用1×rtu100μl/孔裂解细胞并收集至1.5ml离心管中,高速涡旋震荡10sec,静置5min,用于病毒抗原检测,实验设置3个平行;
使用1×vtm100μl/孔,冻融三次并收集至1.5ml离心管中,用于病毒抗原检测,实验设置3个平行;其中,vtm为商品化病毒转运培养基。
(3)样品稀释
由于rtu中含有较高浓度的非离子去污渍,直接使用情况下可能会影响抗原抗体结合,对adv阳性rtu保存样品使用pbs进行10×稀释后,再使用pbs进行2×梯度稀释终至320×稀释,即对以下样品稀释梯度进行抗原检测:1×、10×、20×、40×、80×、160×、320×;同时同样稀释同样浓度的adv阳性vtm保存样品作为对照。
(4)adv抗原检测
使用商品化“人腺病毒(adv)elisa检测试剂盒”对adv阳性样品进行检测,操作依照说明书进行,测得a450值记录于表3。
表3.elisa检测rtu保存下腺病毒样品抗原
注:数据为平均值±sd;阳性对照a450:3.463±0.102;阴性对照a450:0.008±0.018。试剂盒cut-off值为阴性对照a450平均值+0.15,即0.158。
从实验结果看出,rtu保存样品稀释梯度为20×情况下即可进行抗原检测,至80×稀释度下可与正常vtm保存样品具有同样的检测效果。因此,在一定稀释度下,rtu保存样品可以用于抗原抗体类检测应用。
实施例四:rtu保存液灭活病毒效果分析
在常规呼吸道样品采集中,vtm或等渗溶液是比较常见的样品保存液,在这类保存液中病毒仍保持活性,而使操作人员有感染风险,需要高防护要求。如sars-cov-2样品核酸检测要求二级生物安全实验室、三级防护标准才可进行。高防护要求限制了基层医院开展检测的能力,不利于疫情的防控。在常见的可造成严重疾病的呼吸道病毒中,有包膜类病毒占据了重要的比重,而且也是常发生全球传播的类型,如流感病毒、呼吸道合胞病毒、冠状病毒等。这类病毒由于结构特点,使用非离子去污剂可以使其包膜结构破坏,从而使其失活。
为验证rtu灭活有包膜病毒能力,实验对rtu保存的常见呼吸道有包膜病毒(rsv,有包膜rna病毒)和无包膜病毒(ev,无包膜rna病毒;adv,无包膜dna病毒)进行病毒培养,观察是否有病毒增殖。
(1)毒种
1)毒种:rsv-a2、ev71、adv3-egfp(带绿色荧光蛋白egfp的重组3型adv,感染细胞可产生绿色荧光,相关信息可见vaccine,2009,27:1145-1153);
2)准备新鲜培养的高浓度病毒,并使用荧光定量pcr对病毒原始浓度进行定量:rsv-a23.2×1010copies/ml;ev715.1×1011copies/ml;adv3-egfp1.5×1012copies/ml。
(2)不同稀释度接种样品准备
1)使用450μl病毒原液加入50μl10×rtu,高速涡旋震荡10sec,静置5min(记为1×稀释度样品);再使用dmem+2%fbs对其进行10×梯度稀释至10000×,即1×、10×、100×、1000×、10000×共计五组样品;
2)对照样品准备:使用450μl病毒原液加入50μldmem+2%fbs,吹打混匀(记为1×稀释度样品);再使用dmem+2%fbs对其进行10×梯度稀释至10000×,即1×、10×、100×、1000×、10000×共计五组样品;
(3)病毒培养
1)rsv-a2的培养
hep-2细胞使用dmem+10%fbs于37℃5%co2培养箱中培养;细胞长满后消化接种至96孔板中;细胞密度80%左右时去除培养基,接种事前准备好的不同稀释度样品100μl/孔,于35℃5%co2培养箱中培养1h后,去除培养基,使用dmem+2%fbs300μl/孔清洗未结合病毒3次。加入dmem+2%fbs100μl/孔至35℃5%co2培养,每天观察至第4天,如无病变则进行盲传,总计盲传3代。实验设置3个平行。
盲传步骤:培养的细胞连同培养基冻融三次破碎细胞,使用dmem+2%fbs1:1稀释后,100μl/孔接种至新的96孔板细胞中,至35℃5%co2培养箱中培养,每天观察cpe至四天。如无cpe可重复盲传。
2)adv3-egfp的培养
a549细胞使用dmem+5%fbs于37℃5%co2培养箱中培养;细胞长满后消化接种至96孔板中;细胞密度80%左右时去除培养基,接种事前准备好的不同稀释度样品100μl/孔,于35℃5%co2培养箱中培养1h后,去除培养基,使用dmem+2%fbs300μl/孔清洗未结合病毒3次。加入dmem+2%fbs100μl/孔至35℃5%co2培养,每天观察至第4天,如无病变则进行盲传,总计盲传3代。实验设置3个平行。
3)ev71的培养
vero细胞使用dmem+10%fbs于37℃5%co2培养箱中培养;细胞长满后消化接种至96孔板中;细胞密度80%左右时去除培养基,接种事前准备好的不同稀释度样品100μl/孔,于35℃5%co2培养箱中培养1h后,去除培养基,使用dmem+2%fbs300μl/孔清洗未结合病毒3次。加入dmem+2%fbs100μl/孔至35℃5%co2培养,每天观察至第4天,如无病变则进行盲传,总计盲传3代。实验设置3个平行。
(4)病毒检测
对上述培养的病毒进行观察与检测,对rsv-a2、ev71进行细胞病变(cpe)观察及病毒荧光定量pcr检测;对adv3-egfp进行荧光显微镜观察。
由于rtu中含有非离子去污剂tween20及np40,较高浓度下对细胞产生毒性,1×、10×、100×稀释度样品下细胞产生破损,无法正常生长,而1000×、10000×稀释度样品下,细胞生长正常,故相关分析对1000×、10000×稀释度样品进行。
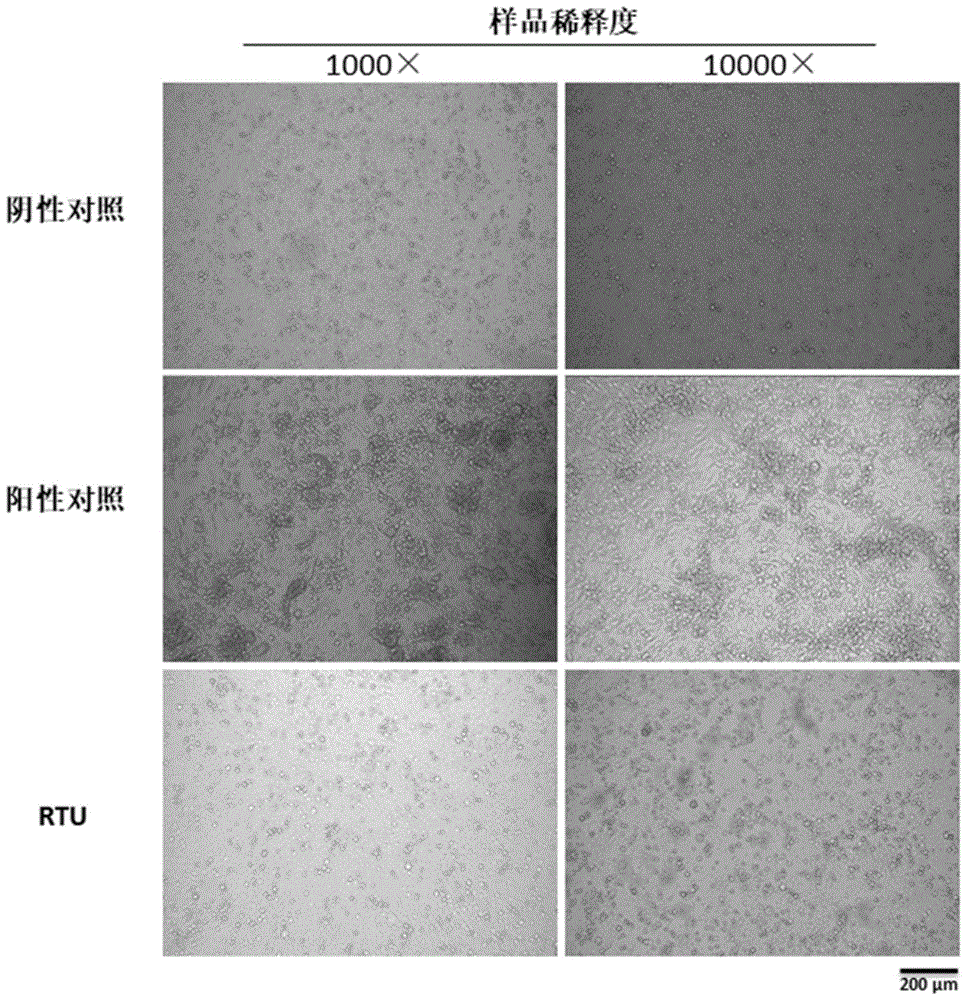
1)rsv-a2培养细胞中,rtu处理后的1000×、10000×稀释度病毒样品第一代培养后未产生cpe,经过盲传后也均未产生cpe,且核酸检测为阴性;而阳性对照组1000×、10000×稀释度病毒样品均可产生明显cpe,且核酸检测为阳性(图1,表4)。
2)ev71培养细胞中,rtu处理后的1000×、10000×稀释度病毒样品第一代培养后均可产生少量cpe,且核酸检测为阳性;阳性对照组1000×、10000×稀释度病毒样品均可产生明显cpe,且核酸检测为阳性(图2,表4)。
表4.rtu处理的rsv-a2与ev71病毒培养细胞后病毒核酸检测分析
注:数据为病毒荧光定量pcr的ct平均值±sd;“-”为阴性;
3)adv3-egfp培养细胞中,rtu处理后的1000×、10000×稀释度病毒样品第一代培养后少量细胞内产生绿色荧光;阳性对照组1000×、10000×稀释度病毒样品大量细胞产生绿色荧光(图3)。
从结果可见,rtu对有包膜病毒具有良好的灭活效果,对无包膜病毒则无法完全灭活。rtu对有包膜病毒的灭活特性,对如sars-cov-2、禽流感等高危病毒的采集、运输及检测具有重要的意义,可以保护操作人员,降低防护等级。
实施例五:rtu保存样品在不同条件下的稳定性
一般情况下,由于呼吸道病毒多为rna病毒,为保证临床来源的呼吸道样品核酸检测效果,采集样品应尽快送检,并且样品在运输过程中应保持低温,如无法在短时间内检测,则需要将样品分装后保存于-80℃冰箱中以防降解;rtu保存液中含有非离子去污剂及dtt,理论上可以抑制核酸酶如rnase的活性。为验证rtu保存样品的核酸稳定性,实验使用易降解的rna病毒rsv在rtu中,在室温(rt)、4℃、-20℃、-80℃下的核酸稳定性。
1)分别使用高浓度(ct值在20左右)和低浓度(ct值在30左右)rsv-a2病毒,分别置于1×rtu和1×vtm中,分装样品分别置于室温(rt)、4℃、-20℃、-80℃下四种条件下;
2)置于rtu中的rsv-a2直接取2.5μl至25μl反应体系中进行检测;置于vtm中的rsv-a2使用qiagen公司rneasyminikit提取试剂盒进行核酸提取,获得与样品同样体积的核酸产物,取其中2.5μl至25μl反应体系中进行检测;
3)分别于第0天(d0,实验起始点)、d1、d2、d3、d6、d10进行rsv荧光定量pcr检测,实验设置每组三个平行,记录检测ct值,并计算平均值作图(图4)。
数据为ct值平均值;a:高浓度rsv样品;b:低浓度rsv样品。vtm为商品化病毒转运培养基。
从结果可见,高、低浓度rsv在rtu保存下稳定性高于常规vtm。低温-20、-80℃条件下,10天实验期间内两种保存方式未见明显差异;4℃条件下,vtm保存样品第3天已经发现核酸降解,ct值升高,而rtu保存样品10天实验期间未见明显降解;室温条件下,rtu保存样品3天内检测未有明显降解,ct值基本一致,而vtm保存样品降解显著。rtu保存样品相比vtm保存样品核酸稳定性更强,这为呼吸道样品的运输及保存提供了更加便利的条件,节省转运、保存成本,对呼吸道病毒疫情防控具有重要意义。
以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。
以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- 还没有人留言评论。精彩留言会获得点赞!