特异性结合肝癌干细胞的抗体及其在制备肝癌检测试剂盒中的用途的制作方法
本发明涉及生物领域,具体的涉及生物抗体领域,更具体的涉及特异性结合肝癌干细胞的抗体及其在制备肝癌检测试剂盒中的用途。
背景技术:
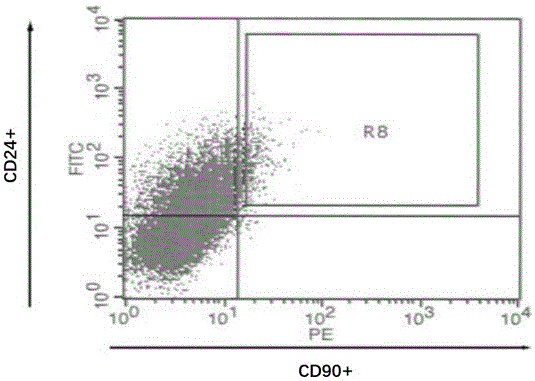
:近几十年来恶性肿瘤的治疗取得了很大进步,但是在常规治疗后肿瘤的复发与转移仍然是现今需要面对的严峻问题。肿瘤干细胞假说是近年来提出的一种新理论,假说认为肿瘤由肿瘤干细胞和一般肿瘤细胞组成(肿瘤的异质性),肿瘤干细胞是存在于肿瘤组织中的极少的具有自我更新、不定潜能性并促使肿瘤形成的细胞,是形成不同分化程度的肿瘤和肿瘤不断生长扩散的根源。肿瘤干细胞理论促使研究人员重新审视肿瘤起始、发展和治疗中抗药性的原因,并为肿瘤的早期诊断、治疗及预后判断提供了新的思路。而寻找和鉴定特异性的肿瘤干细胞分子表面标记物,识别肿瘤组织中的肿瘤干细胞是肿瘤干细胞靶向治疗的关键。肿瘤干细胞和干细胞除了拥有许多共同的细胞表面抗原标记外,肿瘤于细胞还具有一些特异的细胞表面抗原标记,这些表面标记犹如肿瘤干细胞的“指纹”,研究者可以通过识别和利用这些表面标记来准确地筛选与分离肿瘤干细胞;此外,这些标记大多与恶性肿瘤中致癌、转移、复发相关的标记相似,证明了肿瘤干细胞与肿瘤发生发展、转移及复发的相关性。目前,鉴定肿瘤干细胞最权威的方法是筛选确定肿瘤干细胞特异的细胞表面标记物,并根据这些标记物分离肿瘤干细胞。一般程序为:原代培养肿瘤干细胞;根据细胞表面特异性标记物,采用流式细胞仪分离肿瘤干细胞样细胞;鉴定其自我更新能力、增殖能力和分化能力;最后将细胞移植入nod/scid小鼠中进行成瘤实验,以鉴定细胞的成瘤能力。这种方法系统全面且可信度高,但关键在于科学地确定出肿瘤干细胞的特异性表面标记物。自2003年以来,许多研究已发现在一些实体瘤中存在肿瘤干细胞特异的标记物,如乳腺癌、脑癌、前列腺癌、胰腺癌、肝癌、肾癌、卵巢癌和黑色素瘤等。我国每年新发肝癌患者数高达46.6万例,每年因肝癌死亡的人数高达42.2万例,我国是一个肝癌大国,全世界近一半的肝癌患者都来自中国。因此,提早检测出肝癌变得愈发重要。越来越多的证据表明肝癌组织中存在一小部分具有肿瘤干细胞特性的癌细胞,即肝癌干细胞(livercancerstemcells,lcscs)。近年来lcscs特异性标记物的鉴定和针对靶向治疗的靶点是研究的热点。目前已经鉴定了几种lcscs标记物,包括cd133、cd44、cd90、epcam、ov6、cd13、cd24、cd47和角蛋白19等。cscs靶向的免疫疗法也是消除lcscs的治疗方法之一。由于cscs表达单个或多个特定的细胞表面标记,因此可以通过特异性的检测相应的标记物来检测肝癌干细胞。但是这些标记物检测费时费力并不能快速的实现肝癌干细胞的检测。随着技术的发展,特异性结合细胞的单克隆抗体技术变得越发成熟,因此,开发一种特异性结合肝癌干细胞的单克隆干细胞是本领域普遍的追求。技术实现要素:本发明克服了现有技术的缺陷,提供一种能够特异性的结合肝癌干细胞的单克隆抗体。具体的,本发明提供的单克隆抗体,轻链可变区序列如seqidno:1所示,重链可变区序列如seqidno:2所示。更进一步的,本发明提供一种单克隆抗体片段,所述抗体片段为fab。更进一步的,本发明提供一种制备单克隆抗体的方法,将肝癌干细胞注射于balb/c(nu/nu)小鼠腹部皮下(共6只),每只小鼠注射1×106个肝癌干细胞,每2周1次,连续免疫12个月。待肝癌干细胞免疫小鼠血清滴度不再升高时,取1×108个免疫小鼠脾细胞与2×107个对数生长期的sp2/o细胞融合,并接种于含有hat的甲基纤维素培养皿中,培养8~12d,挑取孤立的、较大的细胞集落,即杂交瘤细胞,接种于96孔板继续培养。更进一步地,本发明提供了上述单克隆抗体在制备检测肝癌试剂盒中的应用。本发明提供了一种用于检测人肝癌的试剂盒,含有上述单克隆抗体。对本发明的单克隆抗体,经生物标记或化学标记后获得的单克隆抗体也属于本发明的保护范围。进一步地,经酶标记的上述单克隆抗体属于本发明的保护范围。所述的酶为辣根过氧化物酶或碱性磷酸酶。含有本发明所述单克隆抗体的预防或治疗肺癌的药物属于本发明的保护范围。本发明提供的单克隆抗体具有如下有益效果:本发明分离并获得肝癌干细胞,以该干细胞为基础筛选并获得了单克隆抗体,以表皮细胞以及肝细胞作为反筛,筛选得到特异性的单克隆抗体,通过检测,该抗体不仅与人正常细胞等无交叉反应,还具有较好的特异性。可广泛应用于人肺癌的定性、定量诊断,以及在检测以及流行病调查均具有较大的应用前景。附图说明图1为肝癌干细胞荧光图谱。具体实施方式下面对本发明的具体实施方式作进一步详细描述。以下实施例用于说明本发明,但不用来限制本发明的范围。实施例1肝癌干细胞的培养分离肝癌干细胞,按照如下步骤操作:1)将人肝癌细胞smmc-7721用含100u/ml的青霉素和链霉素的10%胎牛血清的dmem高糖培育基于37℃、90%相对湿度、5%co2的培养箱中培养。2)当细胞覆盖率达88%时将步骤1得到的肝癌细胞培养液吸弃培养液后用pbs洗涤,加入0.25%的胰蛋白酶消化至细胞脱落,终止消化,传代。细胞传代按照如下步骤操作:当观察到培养瓶中细胞铺满度为90%时(细胞生长处于对数期时),解冻复活成功后的细胞进行分离培养。①弃去旧培养液,用pbs液(不含钙,镁离子)洗2次。②向瓶内加入1ml消化液(0.25%trypsin-0.53mmedta),置于37℃孵箱或室温(25℃温度)下进行消化,1-3min后把培养瓶放在倒置显微镜下进行观察,当发现胞质回缩、细胞间隙增大后,应立即中止消化(将培养瓶翻转过来,以保证细胞没有脱壁)。③倒出消化液,向瓶内用滴管加入培养液少量(约2ml),轻轻转动培养瓶,把残留胰蛋白液消化液冲掉,然后再加3ml培养液+15滴小牛血清。④使用吸管,吸取瓶内培养液,按顺序反复轻轻吹打瓶壁细胞,使之从瓶壁脱离形成细胞悬液。⑤将准备好的细胞悬液转入离心管中,离心(1000r/min)5min,弃掉上清,在离心管中加入3ml培养液,并反复吹打细胞,制成细胞悬液。⑥取3个无菌培养瓶,酒精棉球擦拭消毒,并在酒精灯下过火消毒。在培养瓶中各加入1ml细胞悬液、2ml培养液、15滴小牛血清,加好后酒精灯下过火加塞。⑦2~3d后换一次生长液。待细胞铺满器皿底面,即可使用。3)取步骤2中消化传代对数生长期的第9次传代细胞吸弃培养液后用pbs洗涤,加入0.25%的胰蛋酶消化至细胞脱落后用pbs洗涤,过40μm细胞尼龙滤网,肝癌细胞数量控制在5×107个/ml,将细胞转入流式细胞仪的流式管中,离心弃掉上清液,加入facs分选缓冲液重悬,混匀后加入crblocking试剂,室温孵育,加入40-60μlpbs缓冲液后加入4-6μl流式分选荧光抗体pe-cd90和fitc-cd24,混匀,5℃避光孵育40-50min。然后用流式细胞仪分选得到的cd90+cd24+肝癌细胞亚群即为分离得到的肝癌干细胞,其荧光图谱如图1所示,计算得到cd90+cd24+的肝癌细胞数为11.83%,将分选得到的细胞收集备用。实施例2肝癌干细胞特异性单克隆抗体的制备1、动物免疫将实施例1制备得到肝癌干细胞注射于balb/c(nu/nu)小鼠腹部皮下(共6只),每只小鼠注射1×106个肝癌干细胞,每2周1次,连续免疫12个月。2、免疫荧光法检测免疫血清的效价固定细胞免疫荧光检测:将肝癌干细胞接种于96孔培养板,1×104/孔,37℃、5%co2培养24h。pbs分次洗涤,经4%多聚甲醛固定15min、0.2%triton-100通透5min后,每孔加入免疫血清或对照一抗,室温反应1h,用含1%bsa的pbst洗涤5min×5次;每孔加入100ul生物素标记的igg/igm(1:300稀释),室温反应30min,洗涤同前。再加入100ulcy3-亲合素(1:900稀释),室温避光反应30min后,用1%bsa的pbs洗涤5min×4次,然后用pbs洗涤5min×2次。最后用含10g/mldapi及50%甘油的pbs封闭。通过免疫荧光法检测发现4号小鼠免疫血清滴度最高,其滴度达到1:60000。3、免疫小鼠脾细胞与sp2/0细胞的融合待hlcslcs免疫小鼠血清滴度不再升高时,取1×108个免疫小鼠脾细胞与2×107个对数生长期的sp2/o细胞融合,并接种于含有hat的甲基纤维素培养皿中,培养8~12d,挑取孤立的、较大的细胞集落,即杂交瘤细胞,接种于96孔板继续培养。4、抗肝癌干细胞杂交瘤单抗的筛选将实施例1的肝癌干细胞接种96孔板,用sfm培养基培养30h后,采用固定细胞免疫荧光法检测杂交瘤细胞库中1752个杂交瘤上清与肝癌干细胞的反应,其中显示荧光阳性反应的杂交瘤有201株。采用人表皮细胞以及肝细胞作为反筛细胞对201株细胞进行反向检测,去掉了能够起到结合反应的83株,剩余118个不起反应。将剩余的118个杂交瘤,再采用活细胞免疫荧光法检测这118个阳性杂交瘤,获得了特异性与肝癌干细胞特异性结合的高阳性杂交瘤1株,命名7f9。实施例3流式细胞术测评抗体结合肝癌干细胞的结合能力收集处于对数生长期的肝癌干细胞,用pbs洗细胞2次后用facs缓冲液(含2%胎牛血清的pbs溶液)重悬细胞。调节密度,以2x105个细胞/孔铺板于96孔底板中,300g离心5分钟,倾去上清,添加已梯度稀释的肝癌干细胞溶液而后置于冰上孵育40分钟。洗细胞2次,添加100μl/孔藻红蛋白荧光标记的羊抗小鼠二抗(jacksonimmunoresearch,cat#115-116-072,1:1000稀释),4度避光孵育40分钟后,洗细胞3次,而后每孔加100μl的facs缓冲液重悬,吹匀细胞后上机检测。使用bd公司cantoii型号流式细胞仪测定每孔细胞的荧光强度。使用graphpadprism软件进行数据处理,得出抗体结合细胞的ec50浓度值(即达到该抗体最大荧光结合信号50%时对应的抗体浓度值)。结果如表1所示。以cgmccno.8800的小鼠杂交瘤细胞对应的4p-120单抗为对照。表17f9单克隆抗体的结合活性mabec50,nm7f90.074p-12029.83实施例4单抗类型鉴定7f9单克隆抗体的亚类(型)的鉴定采用roche公司小鼠单克隆抗体分型试剂盒,操作按说明书进行。亚类(型)分析结果显示,抗体重链亚类为igg1,轻链为k型。实施例5单抗效价及kd值测定bca法测定抗体浓度,并调整至2mg/ml。以肝癌干细胞于4℃包被过夜,洗涤。封闭,洗涤,加入倍比稀释(起始浓度1:500)的mab,100ul/孔,于37摄氏度孵育2h。洗涤,加入1:10000稀释的hrp标记的山羊抗小鼠igg,于37℃孵育1h。洗涤后于室温显色5min,加入2mol/lh2so4(5o孔)终止反应,用酶标仪测定d450值。以(样品d450-空白d450)/(阴性对照d450-空白450)大于等于2.5为阳性阈值判断结果。结果显示,本发明的mab效价为1:2056000,具有极高的效价水平。另外,使用常用kd检测方法(elasa法)检测得到抗体的kd为19.8pm,具有较好的结合特性。实施例6单抗序列的鉴定使用trizol试剂从培养的小鼠7f9单克隆细胞株中提取总rna。过程简述如下,离心收集5x106的细胞到1.5ml离心管中,吸干上清。添加1ml的trizol试剂并反复吹打数次后室温放置5分钟用于裂解细胞。紧接着,每管加入0.2ml的氯仿溶液,剧烈震荡15秒后室温放置3分钟。而后,离心管4度12000g离心10分钟,取出离心管,吸取上层水相溶液到新的1.5ml离心管中,再加入0.4ml的异丙醇用于从水相中沉淀rna。手动混匀ep管并放置室温10min后,4度12000g离心10分钟,弃上清。加入1ml75%的乙醇,再次4度7500rpm离心5min,弃上清。管底rna沉淀于室温干燥10分钟后,加入30到50ul的无菌depc处理水溶解rna样品。使用逆转录cdna试剂盒把总rna变为cdna。实验体系配制如下,5μl的总rna+0.5μloligo(dt)+8.5μlrnase-free水(共14ul)先置于65度5min预变性,而后放冰上2分钟。进一步加入4μl的5x缓冲液+1μl的dntp混合物+0.5μl的rnase抑制剂+1μl逆转录酶(总共20.5ul体系),配好后混匀,使用pcr仪运行40度50分钟,70度10min,完成cdna合成。cdna进一步在3’端加polyg,反应体系配制如下:5μl的cdna样品+33.5μl的ddh2o+5μl的10xtdt缓冲液+5μl的cocl2+1μl的dgtp+0.5μl的末端脱氧核苷酸转移酶(总体积50ul),配好后混匀,使用pcr仪运行37度30分钟,70度10min,完成polyg加尾。进一步,以加尾的cdna为模板进行抗体可变区的基因扩增。对于扩增抗体重链可变区序列,配制pcr反应体系:10xtaq酶缓冲液5μl+通用polyc引物(正向引物)0.5μl+小鼠igg1反向引物0.5μl+dntp1μl+taq聚合酶1μl+cdna1μl+ddh2o41μl。对于扩增抗体轻链可变区序列,配制pcr反应体系:10xtaq酶缓冲液5μl+通用polyc引物(正向引物)0.5μl+小鼠iggkappa链反向引物0.5μl+dntp1μl+taq聚合酶1ul+cdna1μl+ddh2o41μl。抗体重链和轻链可变区pcr扩增的温度循环如下(其中步骤2到4,重复25个循环):1-预变性95℃.5min.2-变性95℃.20sec.3-退火56℃.20sec.4-延伸72℃.30sec.5-保存25℃.60min;pcr产物经1%琼脂糖凝胶电泳分析,切出对应大小的dna区段条带,用qiagen的凝胶dna回收试剂盒(catalog#28704)进行dna的抽提。简述如下:凝胶称重,加3倍凝胶体积的qg缓冲液,而后50度孵育10分钟直到凝胶完全溶解。加入1倍胶体积的异丙醇混匀后,样品移至qia纯化柱,离心13000rpm1分钟。加入750ul的pe缓冲液到柱中,而后13000rpm离心1分钟。并再次13000rpm离心1分钟去除柱中液体残留。加入30ul的水洗脱柱离心1分钟,获得制备的dna样品,纯化的pcr产物经测序获得抗体的可变区序列。结果显示,轻链可变区序列如seqidno:1所示,重链可变区序列如seqidno:2所示。实施例7抗体的生化稳定性测定将本发明的抗体与偶联荧光标签,而后分别置于4℃、16℃、37℃、50℃、60℃、70℃、80℃、90℃、100℃的水浴锅中水浴30min,取出,恢复至室温。各取100μl上清于聚苯乙烯板中,检测其荧光强度,分析类抗体的热稳定性。结果显示温度对本发明的抗体稳定性均有很大影响。在4℃–70℃内其稳定性较好,在90℃时几乎完全丧失稳定性。说明本发明的抗体具有较好的热稳定性。另外,针对ph稳定性试验,在1-11的ph范围内,检测抗体的稳定性,结果发现,稳定性在ph<6的范围内随ph的降低而降低,在ph=3时几乎丧失稳定性,在ph>9的范围内稳定性开始下降,在ph=11时丧失稳定性。实施例8抗体的特异性测定选择mcf-7乳腺癌细胞、hela宫颈癌细胞、u251神经胶质瘤细胞、u937白血病细胞、bgc-803胃癌细胞、endeavour-1人胚胎干细胞、人肝细胞qsg-7701、hek-a人表皮角质细胞、实施例1肝癌干细胞分别与本发明的单克隆抗体进行结合反应实验。结果见表2所示。表2细胞类型抗体结合反应结果(-表示不结合,+表示结合)mcf-7乳腺癌细胞-hela宫颈癌细胞-u251神经胶质瘤细胞-u937白血病细胞-bgc-803胃癌细胞-endeavour-1人胚胎干细胞-人肝细胞qsg-7701-hek-a人表皮角质细胞-实施例1肝癌干细胞+++++从反应结果来看本发明的抗体具有较好的特异性,只能特异性的结合肝癌干细胞而不能与其他的常见的癌细胞或者人细胞进行反应,具有较好的特异性。应当理解的是,本发明在其应用上并不一定局限于在说明中所描述和/或在附图中所说明的组件的构造和布置的细节。本发明能够具有除所述和以不同方式实践或进行的那些实施方案之外的实施方案。而且,应理解本文所采用的短语和术语以及摘要出于描述目的并且不应视为限制性的。序列表<110>北京广未生物科技有限公司<120>特异性结合肝癌干细胞的抗体及其在制备肝癌检测试剂盒中的用途<160>2<170>siposequencelisting1.0<210>1<211>108<212>prt<213>2ambystomalateralexambystomajeffersonianum<400>1aspilevalilethrglnserproalaleumetalametserprogly151015glulysargthrilethrcysaspseralaserproilethrthrser202530tyrlysglytrptyrglnlyslysserglyileserprolysprotrp354045iletyrthralaserasnleuglnleuglyvalproalaargpheser505560glyserglyserglythrsertyrserleuthrilethrsermetglu65707580alagluaspalaalathrtyrtyrcysserglutrpaspaspserser859095prothrpheglyalaglythrlysleugluleulys100105<210>2<211>116<212>prt<213>2ambystomalateralexambystomajeffersonianum<400>2gluvalglnleugluserserglythrgluleualaargproglyala151015servallysglusercyslysalaserglytyrilephesermetala202530trpglythrtrpilelysglnargproglyglnglyleuglutrpile354045glycyssertyrproglytrpileaspthrargtyrthrglnthrser505560glyglylysalathrleuthralaasplysserserserthralatyr65707580metglnleuserserleualasergluaspseralavaltyrtyrcys859095alaglymetsergluaspalavalasptrptrpleuglythrthrleu100105110alavalserser115当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1