一种基于自噬-外泌通路调节巨噬细胞极化的方法及其用途
1.本发明属生物医药领技术域,涉及调节巨噬细胞极化的方法,具体涉及一种基于自噬-外泌通路调节巨噬细胞极化的方法及其用途,本发明方法通过多种细胞自噬抑制剂、外泌体抑制剂调节巨噬细胞极化功能,进一步用于制备治疗流感病毒感染的药物。
背景技术:
2.现有技术公开了流感病毒属正黏科病毒属,是一种包含8个负义单链rna(ssrna)的有包膜的病毒,所述ssrna紧紧围绕在核蛋白周围,构成流感病毒的基因组。研究显示流感病毒表面附有糖蛋白,如血凝素(hemagglutinin,ha)和神经氨酸酶(neuraminidase,na),根据ha和na的不同,流感病毒分为不同的亚型[1]。据报道,流感病毒造成经常性的季节流行及不可预测的病毒突变导致流感大流行。根据世界卫生组织(world health organization,who)的报告,流感病毒每年造成10亿人感染,300-500万严重病例,30-50万患者死亡[2],在不规则时间间隔内,来自动物宿主的病毒通常会跨越物种屏障,通过禽流感病毒与人流感病毒之间的基因片段重组步骤,导致抗原重组而产生新的流感病毒株,造成流感病毒的大流行[3],该种新流感病毒大流行相关的发病率和死亡率远超季节性流感病毒,如1918年的h1n1流感病毒大流行,保守估计导致约4千万人死亡[4]。
[0003]
研究显示,流感病毒感染会募集呼吸道中的免疫和非免疫细胞到感染部位[5],引起一系列的炎症反应,诱发细胞因子风暴的产生,导致病毒性肺炎,增加死亡率[6];其中最严重的是急性肺损伤(acute lung injury,ali),伴随肺水肿,炎症细胞浸润,肺部免疫失衡等。临床实践抗流感病毒的药物主要是两种:m2离子通道抑制剂,如金刚烷胺;神经氨酸酶抑制剂,如奥司他韦等,这些药物并不能改善流感病毒感染诱导的病毒性肺炎等免疫过度应激问题,这也是流感死亡率居高不下的原因,同时这些抗病毒药物还面临流感病毒突变耐药的问题。
[0004]
巨噬细胞作为机体的固有免疫细胞之一,在生理和病理状态下发挥重要的作用。巨噬细胞的功能需要根据其所在组织进行调整,这种适应是由组织和环境因素共同驱动的,如肝脏中的枯否细胞,骨中的破骨细胞和肺脏中的肺泡巨噬细胞具有不同的作用,不同表型[7]。巨噬细胞按照极化功能分为2类:经典激活的m1型巨噬细胞(促炎)和替代激活的m2型巨噬细胞(抑炎)[8];m1型极化巨噬细胞分泌促炎细胞因子,产生抗菌抗病毒的作用,过量分泌的炎症细胞因子会造成组织损伤;m2型极化巨噬细胞分泌抗炎因子,在组织修复和肿瘤发生中发挥重要作用;研究表明,巨噬细胞功能的转化在不同疾病的不同进展阶段发挥重要作用。
[0005]
对于流感病毒感染,巨噬细胞既作为固有免疫细胞的一员,同时也是病毒感染复制的宿主细胞[9],因此巨噬细胞的角色会更加复杂。有文献报道,甲型流感病毒感染后,高剂量gm-csf的应用通过调节促炎m1型巨噬细胞极化减少病毒感染后的高致死率[10]。
[0006]
细胞自噬是一种保守的细胞内消化过程,在真核细胞内降解胞内受损细胞器或者蛋白的过程[11];受损的细胞器或者错误折叠的蛋白质被包裹在双层膜内,该双层膜结构
virus[j].proc natl acad sci u s a.2010;107:11531-11536.
[0016]
[6]teijaro j r,walsh k b,rice s,et al.mapping the innate signaling cascade essential for cytokine storm during influenza virus infection[j].proc natl acad sci u s a.2014;111:3799-3804.
[0017]
[7]geissmann f,manz m g,jung s,et al.development of monocytes,macrophages,and dendritic cells[j].science.2010;327:656-661.
[0018]
[8]tait wojno e d,artis d innate lymphoid cells:balancing immunity,inflammation,and tissue repair in the intestine[j].cell host microbe.2012;12:445-457.
[0019]
[9]iwasaki a,medzhitov r control of adaptive immunity by the innate immune system[j].nat immunol.2015;16:343-353.
[0020]
[10]gordon s alternative activation of macrophages[j].nat rev immunol.2003;3:23-35.
[0021]
[11]shaykhiev r,krause a,salit j,et al.smoking-dependent reprogramming of alveolar macrophage polarization:implication for pathogenesis of chronic obstructive pulmonary disease[j].journal of immunology.2009;183:2867-2883.
[0022]
[12]kasloff s b,weingartl h m swine alveolar macrophage cell model allows optimal replication of influenza a viruses regardless of their origin[j].virology.2016;490:91-98.
[0023]
[13]alenquer m,amorim m j exosome biogenesis,regulation,and function in viral infection[j].viruses.2015;7:5066-5083.
[0024]
[14]desdin-mico g,mittelbrunn m role of exosomes in the protection of cellular homeostasis[j].cell adh migr.2017;11:127-134.
[0025]
[15]yang y,li y,chen x,et al.exosomal transfer of mir-30a between cardiomyocytes regulates autophagy after hypoxia[j].j mol med(berl).2016;94:711-724.
[0026]
[16]shapouri-moghaddam a,mohammadian s,vazini h,et al.macrophage plasticity,polarization,and function in health and disease[j].journal of cellular physiology.2018;233:6425-6440.
[0027]
[17]liu y m,tseng c h,chen y c,et al.exosome-delivered and y rna-derived small rna suppresses influenza virus replication[j].j biomed sci.2019;26:58.
[0028]
[18]yang y,han q,hou z,et al.exosomes mediate hepatitis b virus(hbv)transmission and nk-cell dysfunction[j].cellular&molecular immunology.2017;14:465-475.
[0029]
[19]guo h,chitiprolu m,roncevic l,et al.atg5 disassociates the v1v0-atpase to promote exosome production and tumor metastasis independent of canonical macroautophagy[j].dev cell.2017;43:716-730.e717.
[0030]
[20]nowag h,munz c diverting autophagic membranes for exocytosis[j].autophagy.2015;11:425-427.
[0031]
[21]carolan l a,rockman s,borg k,et al.characterization of the localized immune response in the respiratory tract of ferrets following infection with influenza a and b viruses[j].j virol.2015;90:2838-2848.
[0032]
[22]betakova t,kostrabova a,lachova v,et al.cytokines induced during influenza virus infection[j].curr pharm des.2017;23:2616-2622.
[0033]
[23]cole s l,dunning j,kok w l,et al.m1-like monocytes are a major immunological determinant of severity in previously healthy adults with life-threatening influenza[j].jci insight.2017;2:e91868.
[0034]
[24]chang p,kuchipudi s v,mellits k h,et al.early apoptosis of porcine alveolar macrophages limits avian influenza virus replication and pro-inflammatory dysregulation[j].sci rep.2015;5:17999.
[0035]
[25]short k r,kroeze e,fouchier r a m,et al.pathogenesis of influenza-induced acute respiratory distress syndrome[j].lancet infect dis.2014;14:57-69.
[0036]
[26]julkunen i,melen k,nyqvist m,et al.inflammatory responses in influenza a virus infection[j].vaccine.2000;19suppl 1:s32-37.。
技术实现要素:
[0037]
本发明的目的在于基于现有技术的现状,提供一种调节巨噬细胞极化的方法,具体涉及一种基于自噬-外泌通路调节巨噬细胞极化的方法及其用途。
[0038]
本发明通过抑制细胞自噬行为和细胞外泌行为的化合物对巨噬细胞极化进行调节,更具体的通过多种细胞自噬抑制剂、外泌体抑制剂调节巨噬细胞极化功能,进一步用于制备治疗流感病毒感染的药物。
[0039]
本发明中,所述抑制细胞自噬的化合物,包括但不限于细胞自噬各个环节的阻断剂,如pi3k抑制剂ly294002,自噬溶酶体阻断剂氯喹cq等多种结构类似物中的一种或几种。
[0040]
本发明中,所述抑制细胞外泌行为的化合物,包括但不限于细胞外泌活化的各个环节阻断剂,如鞘磷脂酶(n-smase)抑制剂gw4869等多种结构类似物中的一种或几种。
[0041]
本发明的实施例中,通过pi3k抑制和外泌体抑制能有效的抑制流感病毒诱导的巨噬细胞招募和极化行为。
[0042]
本发明进行了以下体外细胞试验,结果显示:
[0043]
(1)在流感病毒感染的体外细胞体系中,自噬抑制剂和外泌体抑制剂对流感病毒感染招募巨噬细胞有明显的影响;
[0044]
(2)自噬抑制剂对流感病毒复制及巨噬细胞极化有明显影响;
[0045]
本发明的实验证实了通过细胞自噬抑制剂和外泌体抑制剂能有效的阻断巨噬细胞的m1极化和招募,为进一步用于制备治疗流感病毒感染的药物提供了基础。
[0046]
本发明中,可以不改变现有药物剂型下,将所述的两类化合物单独或组合方式,进行流感病毒治疗,或,将上述化合物制成一种剂型,其给药途径或制剂包括且不限定于:口
服、注射、粘膜给药,注射液等方式。
[0047]
本发明所述的调节巨噬细胞极化功能,与流感病毒感染不直接相关;本发明的方法可用于制备治疗多种流感病毒感染的药物,所述的流感病毒感染包括但不限于甲型流感病毒、乙型流感病毒、及新的流感病毒类型等。
[0048]
本技术提供了一种调节巨噬细胞极化的方法,尤其是基于自噬-外泌通路调节巨噬细胞极化的方法,进一步可制备治疗流感病毒感染的药物。本发明为研发新的抗流感病毒药物和抗病毒治疗策略提供基础。
附图说明
[0049]
图1显示pi3k抑制剂和外泌体抑制剂抑制流感病毒诱导的巨噬细胞招募及细胞聚集。
[0050]
图2显示泛pi3k抑制剂和pi3kγ抑制剂对细胞极化与流感病毒复制的影响。
[0051]
图3显示特异性pi3kγ抑制剂as605240对细胞自噬及外泌的影响。
[0052]
图4显示非活性pi3k结构类似物不影响流感病毒诱导的巨噬细胞自噬及活化。
[0053]
下面结合具体实施例对本发明作进一步说明。
具体实施方式
[0054]
实施例1pi3k抑制剂和外泌体抑制剂抑制巨噬细胞招募及细胞聚集
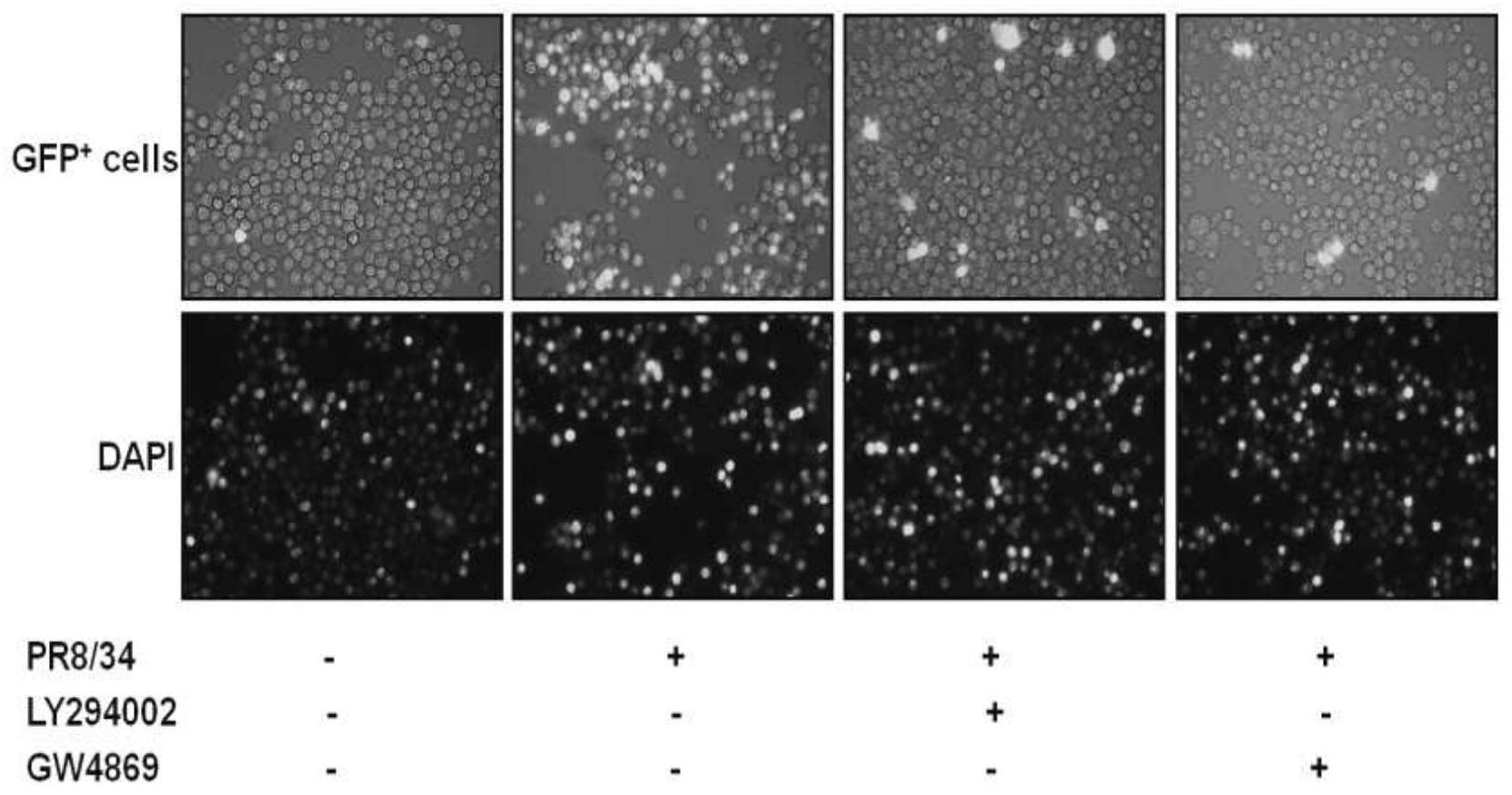
[0055]
分别在细胞穿膜迁移transwell系统的下室病毒感染的ana-1巨噬细胞中分别添加自噬抑制剂ly294002(1μm)和外泌体抑制剂gw4869(1μm),观察对上室gfp
+
巨噬细胞招募的影响(感染后给药干预24小时),如图1所示的免疫荧光分析显示,病毒感染能招募更多gfp
+
巨噬细胞;当使用自噬抑制剂ly294002和外泌体抑制剂gw4869时,结果显示均相似性的大幅度减弱了对gfp
+
巨噬细胞的招募,抑制了流感病毒诱导的过度炎症应答反应。
[0056]
实施例2泛pi3k抑制剂和pi3kγ抑制剂对巨噬细胞极化的影响
[0057]
在本实施例中,对比不同的pi3k抑制剂对于流感病毒感染的巨噬细胞极化的影响,如图2所示,当使用泛pi3k抑制剂ly294002和pi3kγ抑制剂as605240时,显著抑制inos转录水平,上调抑炎性il-10水平,无明显降低流感病毒的复制,结果表明,泛抑制剂一致性的调低了巨噬细胞的m1极化,il-1β的转录。
[0058]
实施例3pi3k抑制剂对细胞自噬及外泌的影响
[0059]
本试验对比了pi3kγ抑制剂as605240在感染和非感染条件下对巨噬细胞自噬和外泌行为的影响,如图3western blot图片所示,与正常组相比,病毒感染后,lc3ii/i的比例增加,表明细胞自噬增强;当使用特异性pi3kγ抑制剂as时,显示lc3ii/i的蛋白比例明显减少,表明as抑制流感病毒引起的细胞自噬,且与给药剂量呈依赖性;同时,结果显示,流感病毒感染后,外泌体cd63、cd81蛋白水平明显低于正常组,而当使用as阻断自噬lc3生成时,cd63、cd81蛋白呈现剂量依赖性的上升,自噬蛋白lc3与外泌蛋白cd63/cd81改变提示了一种自噬性外泌存在的可能性,当自噬lc3蛋白生成受限时,也抑制了自噬性外泌,导致胞内蛋白蓄积性增加;该过程印证了流感病毒诱导了细胞自噬蛋白lc3和外泌体蛋白cd63增加,并存在自噬性外泌的现象;
[0060]
进一步进行自噬抑制剂的非活性成分ly303511盐酸盐对流感病毒诱导的巨噬细
胞自噬和焦亡小体蛋白nlrp3的影响试验,如图4所示,随时间延长,流感病毒诱导了越来越显著的巨噬细胞发生细胞自噬lc3累积和m1活化现象,同时伴随着nlrp3的显著增加,表明细胞自噬和细胞焦亡同步性;ly303511盐酸盐时,并未对lc3ii/i的比例,p62水平,及nlrp3产生明显影响;巨噬细胞受流感病毒诱导的细胞自噬和细胞焦亡是被活性pi3k抑制分子所影响。
[0061]
本发明的实验证实了通过细胞自噬抑制剂和外泌体抑制剂能有效的阻断巨噬细胞的m1极化和招募,为进一步用于制备治疗流感病毒感染的药物提供了基础。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1