一种转基因去除型人皮肤成纤维饲细胞系的建立方法与流程
本发明涉及角膜细胞领域,特别是涉及一种转基因去除型人皮肤成纤维饲细胞系的建立方法。
背景技术:
角膜缘干细胞和口腔黏膜上皮细胞已被成功地用于眼表再生医学治疗严重眼表疾病。然而,治疗中使用的小鼠3t3成纤维细胞具有传染鼠类疾病给患者的风险。最近的报告表明,人类胚胎干细胞与小鼠饲养层细胞共培养后表达小鼠异种抗原neu5gc,并能诱发自身免疫反应。因此,需要寻找到一种安全有效的人来源的饲细胞替代小鼠3t3细胞。最近的一些研究报道,人类皮肤成纤维细胞有维持角膜缘和口腔黏膜上皮干细胞的生长和保持上皮细胞生物特性的能力,是一种很有前途成为替代小鼠3t3细胞的饲细胞。然而,在体外培养的正常人细胞的有限的增殖能力增加了工作量和生产成本,阻碍了皮肤成纤维细胞作为饲养层细胞在的临床应用。此外,所有种类的饲细胞可以很容易地混杂到细胞片成品,造成自身污染。
因此,市面上亟需一种能够解决对上述问题中一种或者几种的转基因去除型人皮肤成纤维饲细胞系的建立方法。
技术实现要素:
为解决现有技术中存在的一个或者多个问题,本发明提供了一种转基因去除型人皮肤成纤维饲细胞系的建立方法。
本发明为达到上述目的所采用的技术方案是:一种转基因去除型人皮肤成纤维饲细胞系的建立方法,所述方法包括:
步骤01、创建转基因人皮肤成纤维饲细胞;
步骤02、更昔洛韦的细胞毒性检测;
将tert+tk-d细胞按5,000个/孔接种于96孔培养板中,培养24小时后,分为四组,分别加入含0μg/ml,5μg/ml,25μg/ml,125μg/ml更昔洛韦的培养液,5%co2浓度37℃培养箱中培养1至6天;每隔24小时,用cck-8法检测一次细胞活性;与试验平行不加细胞只加培养液孔设为空白对照,最后比色以空白调零;未用药物处理的细胞孔为阴性对照;更昔洛韦的细胞毒作用用细胞存活的百分比表示;
步骤03、饲细胞层的制备;
步骤04、角膜缘干细胞的分离与培养;
步骤05、克隆形成率实验;
步骤06、角膜上皮再生细胞片的制备;
步骤07、逆转录pcr及定量pcr;
步骤08、免疫组织化学染色;
步骤09、所得数据采用统计分析软件处理。
在一些实施例中,所述步骤01具体包括:
利用gateway技术构建慢病毒载体;
复制缺陷型,自失活的含磷酸甘油酸激酶启动子的新霉素抗性基因或含pgk启动子的嘌呤霉素抗性基因的慢病毒载体为目的载体;
将人源端粒酶逆转录酶基因、内部核糖体进入位点,和增强型绿色荧光蛋白基因,克隆到pentr1a载体,生成pentr-tert-ires-egfp载体;
单纯疱疹病毒胸苷激酶基因克隆到pentr1a载体,生成pentr-tk载体;
转入载体和目的载体通过lr反应生成慢病毒表达载体plenti-tert-ires-egfp-neo或plenti-tk-puro;
将上述表达载体与plp/vsvg和包装构造plp1和plp2基因都被转染到293t细胞用于生成目的慢病毒;浓缩的目的慢病毒用来感染人皮肤成纤维细胞;
将正常人皮肤成纤维细胞感染plenti-tert-ires-egfp-neo慢病毒,通过800μg/mlg418药物筛选,生成tert+egfp转染的人皮肤成纤维细胞;
接着将tert+egfp转染的人皮肤成纤维细胞感染plenti-tk-puro慢病毒,通过1μg/ml嘌呤霉素药物筛选,生成tert+egfp+tk转染的人皮肤成纤维细胞;
创建的tert+tk-d细胞置于含1%–青霉素链霉素的fibrolifes2细胞培养液中常规培养。
在一些实施例中,所述步骤03具体包括:
tert+tk-d细胞和3t3细胞分别用加入8μg/ml丝裂霉素c的培养基在37℃培养2小时;
吸去丝裂霉素c培养基,pbs洗3次,胰蛋白酶消化后,按0.5×104个/cm2tert+tk-d细胞或者2×104个/cm23t3细胞密度将饲细胞接种入6孔细胞培养板和铺有i型胶原凝胶的transwell小室作为饲细胞层。
在一些实施例中,所述步骤04具体包括:
将角膜移植后剩余的角膜片,撕去内皮层后,用2.4u/mldispase溶液37℃水浴消化1小时,再用0.02%的edta溶液在室温下孵育2分钟;
用无菌手术镊沿着角膜缘将上皮细胞刮下,收集的细胞用0.25%胰酶-乙二胺四乙酸在37℃孵育15分钟;
然后加入改良的角化细胞培养基制成上皮细胞悬液,用于克隆形成率计算和角膜上皮再生细胞片培养;
所述改良的角化细胞培养基中添加有:dmem培养基和ham’sf12培养基,5%胎牛血清,1nm霍乱毒素,2nm三碘甲状腺原氨酸,0.4μg/ml氢化可的松,1%胰岛素-转铁蛋白补硒,100u/ml青霉素,100μg/ml链霉素。
在一些实施例中,所述步骤05具体包括:
将原代角膜缘干细胞按照1000个/孔的密度接种于覆盖有tert+tk-d或者3t3饲细胞层的6孔板,共培养10-13天;
终止培养后,用10%中性福尔马林固定,1%罗丹明b染色;克隆形成率=克隆数/接种活细胞数×100%。
在一些实施例中,所述步骤06具体包括:
将原代角膜缘上皮细胞按1-2×105个/孔分别接种在含有饲细胞层的胶原凝胶涂层的transwell小室;
细胞在kcm培养基中培养12天后,置于含25μg/mlgcv的kcm培养基中降低液平面培养6-8天,而非gcv处理对照组用不含gcv的kcm培养基降低液平面培养;每2天换液一次。
在一些实施例中,所述步骤07具体包括:
按试剂盒使用说明书提取各组织和细胞的总rna;
采用1ststrandcdnasynthesissystem进行逆转录翻译,合成pcr所需的cdna;
pcr热循环条件为:94℃预变性5min;94℃变性30s,60℃延伸30s,72℃延伸30s,共35个循环;最后72℃延伸10min;
用2%琼脂糖凝胶电泳鉴定pcr产物,紫外投射成像系统观察,凝胶图像分析软件分析目的基因的相对含量;
各种基因的表达均使用3-磷酸甘油醛脱氢酶作为内参进行标准化;
定量pcr使用
反应条件为:95℃预变性10sec;95℃变性15sec,60℃退火延伸1min,共45个循环;量化数据用gapdh作为内参标准化后,用序列检测系统软件进行分析,最后的结果取三次实验数据的平均值。
在一些实施例中,所述步骤08具体包括:
按qiaampdnaminikit试剂盒使用说明,将gcv添加组和非添加组的与tert+tk-d饲细胞共培养的角膜上皮细胞片组织dna提取;
长末端重复序列(ltr)是慢病毒载体的特异序列,通过慢病毒转染人皮肤成纤维细胞时整合到tert+tk-d细胞基因中;
按照之前所述pcr条件,使用ltr特异性引物:
ltr1:5’-aagggctaattcactcccaa-3’,
ltr2:5’-tgcgtcgagagagctctggttt-3’;
以gapdh作为阳性对照对提取的细胞片dna进行检测。
在一些实施例中,所述步骤09具体包括:
收获的上皮细胞片用tissue-tekoct包埋,用于h&e染色和免疫荧光染色;
h&e染色按照常规方法进行;
免疫荧光染色按照以下方法进行:切片用4%多聚甲醛在4℃下固定30min,4%脱脂牛奶pbs溶液室温1h封闭非特异结合,之后加入一抗,4℃孵育过夜;
之后用pbs洗3遍,每遍5min,加入相应的二抗常温孵育1h;
之后用pbs洗3遍,每遍5min,加dapi染细胞核,zeiss荧光显微镜观察;切片加入相同浓度非特异性抗体的作为阴性对照。
本发明的有益效果是:本发明经过转基因方法建立的tert+tk-d细胞系在体外经过6个月的连续传代后仍然表达绿色荧光蛋白,保持旺盛的分裂能力,对更昔洛韦(gcv)敏感。tert+tk-d组的克隆形成率(cfe=11.77±0.21%)与3t3组(cfe=12.8±1.61%)的差异无统计学意义(p=0.332)。经过共培养两组都形成了4至5层复层上皮细胞片。角膜缘干细胞克隆和上皮细胞片的免疫荧光染色及mrna定量分析结果显示,tert+tk-d组角蛋白k3表达量低于3t3组。并且,pcr结果证实tert+tk-d饲细胞在gcv作用下凋亡、裂解,没有混入生成的角膜上皮细胞片中。转基因荧光标记的永生化去除型人皮肤成纤维饲细胞有望替代3t3细胞用于角膜再生医疗。
附图说明
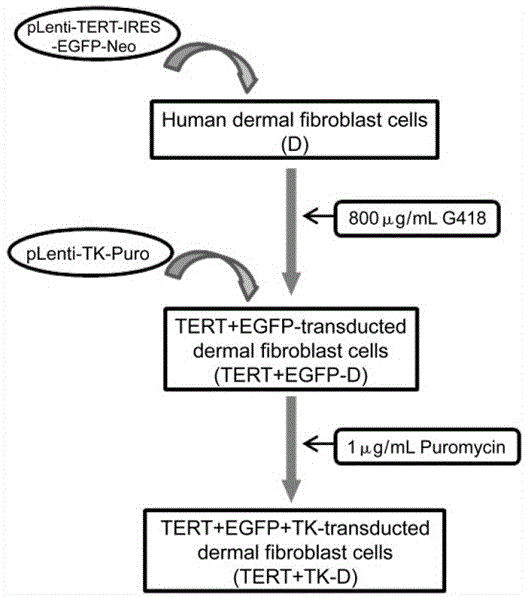
图1为本发明较佳实施例一种转基因去除型人皮肤成纤维饲细胞系的建立方法中tert+tk-d细胞创建流程图;
图2为本发明较佳实施例一种转基因去除型人皮肤成纤维饲细胞系的建立方法中逆转录pcr检测体外培养的人皮肤成纤维细胞与角膜基质成纤维细胞基因表型特征图片;
图3为本发明较佳实施例一种转基因去除型人皮肤成纤维饲细胞系的建立方法中tert+tk-d细胞的特性图片;
图4为本发明较佳实施例一种转基因去除型人皮肤成纤维饲细胞系的建立方法中克隆形成实验图片;
图5为本发明较佳实施例一种转基因去除型人皮肤成纤维饲细胞系的建立方法中角膜缘干细胞克隆特征图片;
图6为本发明较佳实施例一种转基因去除型人皮肤成纤维饲细胞系的建立方法中gcv处理和非gcv处理角膜上皮细胞片的培养流程图;
图7为本发明较佳实施例一种转基因去除型人皮肤成纤维饲细胞系的建立方法中pcr检测ltr序列的图片;
图8为本发明较佳实施例一种转基因去除型人皮肤成纤维饲细胞系的建立方法中角膜上皮再生细胞片的特征图片;
图9为本发明较佳实施例一种转基因去除型人皮肤成纤维饲细胞系的建立方法中pcr特异性引物序列信息表。
具体实施方式
为使本发明的上述目的、特征和优点能够更加浅显易懂,下面结合附图对本发明的具体实施方式做详细的说明。在下面的描述中阐述了很多具体细节以便于充分理解本发明。但是本发明能够以很多不同于在此描述的其它方式来实施,本领域技术人员可以在不违背本发明内涵的情况下做类似改进,因此本发明不受下面公开的具体实施例的限制。
图1.tert+tk-d细胞创建流程图tert+tk-d细胞创建分为两步:首先,将人皮肤成纤维细胞(d)感染plenti-tert-ires-egfp-neo慢病毒,用800μg/mlg418筛选,得到tert+egfp-d细胞。然后,用plenti-tk-puro慢病毒感染tert+egfp-d细胞,用1μg/ml嘌呤霉素筛选得到tert+tk-d饲细胞。
图2.逆转录pcr检测体外培养的人皮肤成纤维细胞与角膜基质成纤维细胞基因表型特征发现两组细胞均表达许多与角膜缘干细胞生长相关的生长因子。d,人皮肤成纤维细胞;s,角膜基质成纤维细胞;nt,阴性对照(没有逆转录酶)。
图3.tert+tk-d细胞的特性(a)tert+tk-d细胞与人皮肤成纤维细胞形态一样。(b)tert+tk-d细胞在紫外光照射下显示绿色荧光。(c)tert+tk-d细胞在25μg/mlgcv作用下6天内全部凋亡。(d)tert+tk-d细胞表达tk基因、ltr序列,而正常人皮肤成纤维细胞不表达。(e)tert+tk-d细胞生长曲线。(f)gcv药物毒性实验显示,tert+tk-d细胞最小gcv致死剂量为25μg/ml。标尺:200μm。
图4.克隆形成实验与tert+tk-d和3t3饲细胞共培养10-13日后,原代角膜缘干细胞生成典型单细胞克隆(a,b)。tert+tk-d组与两组3t3组相比,形成了更多典型上皮细胞形态的单细胞克隆(c)。克隆形成率cfe显示tert+tk-d组与2x104个/cm23t3细胞组无显著差异,而tert+tk-d组形成了更多大克隆(直径>2mm)。标尺,200μm。*p<0.05。
图5.角膜缘干细胞克隆特征(a)tert+tk-d组与3t3组相比,共培养的角膜上皮细胞较低表达角膜上皮分化标记物k3,(b)而表达角膜缘干细胞标记物δnp63无显著差异,(c)mrna定量分析结果同上。标尺,200μm。*p<0.05。
图6.gcv处理和非gcv处理角膜上皮细胞片的培养流程图将原代角膜缘干细胞接种到铺有胶原凝胶涂层并接种有饲细胞层的transwell小室,在5%fbs-kcm培养液中培养12天,然后降低液平面培养6天促角膜上皮复层化。在培养的最后6-8天,将25μg/mlgcv加入gcv处理组的培养液中,以去除tert+tk-d饲细胞。去除饲细胞层的角膜上皮再生细胞片可以很容易地用外科镊撕下来进行移植或者免疫组化染色。
图7.pcr检测ltr序列pcr方法检测角膜上皮再生细胞片中慢病毒特异lrt序列,gapdh基因为阳性参照。lrt特异序列在gcv未处理组显示阳性,而在gcv处理组未检测到。
图8.角膜上皮再生细胞片的特征(a)经过2-3周的共培养,tert+tk-d和3t3组均形成了4-5层复层角膜上皮细胞片。(b)与3t3组相比,tert+tk-d组角膜上皮细胞片较低表达角膜上皮分化标记物k3,(c)然而在基底细胞和翼细胞中高表达干细胞标记物δnp63。(d)角膜上皮细胞特异性标记物k12表达在两组无显著差异。标尺,200μm。
图9.pcr特异性引物序列信息表。
参照图1-图9所示,本发明公开了一种转基因去除型人皮肤成纤维饲细胞系的建立方法,所述方法包括:
步骤01、创建转基因人皮肤成纤维饲细胞;
利用gateway技术构建慢病毒载体(invitrogen,gaithersburg,md)。复制缺陷型,自失活的含磷酸甘油酸激酶(pgk)启动子的新霉素抗性基因(plentineo)或含pgk启动子的嘌呤霉素抗性基因(plentipuro)的慢病毒载体为目的载体。将人源端粒酶逆转录酶(tert)基因、内部核糖体进入位点(ires),和增强型绿色荧光蛋白(egfp)基因,克隆到pentr1a载体(invitrogen),生成pentr-tert-ires-egfp载体。单纯疱疹病毒胸苷激酶(hsv-tk)基因克隆到pentr1a载体,生成pentr-tk载体。转入载体(pentr-tert-ires-egfp或pentr-tk)和目的载体(plentineoorplentipuro)通过lr反应生成慢病毒表达载体plenti-tert-ires-egfp-neo或plenti-tk-puro。这些表达载体与plp/vsvg(编码vsv-g包膜蛋白)和包装构造plp1和plp2(invitrogen)基因都被转染到293t细胞用于生成目的慢病毒。浓缩的目的慢病毒用来感染人皮肤成纤维细胞。
tert+egfp+tk转染的人皮肤成纤维细胞通过两个步骤创建(图1)。首先,将正常人皮肤成纤维细胞(kf-4009)(kurabo,osaka,japan)感染plenti-tert-ires-egfp-neo慢病毒,通过800μg/mlg418(invitrogen)药物筛选,生成tert+egfp转染的人皮肤成纤维细胞。接着将tert+egfp转染的人皮肤成纤维细胞感染plenti-tk-puro慢病毒,通过1μg/ml嘌呤霉素(sigma)药物筛选,生成tert+egfp+tk转染的人皮肤成纤维细胞(tert+tk-d)。创建的tert+tk-d细胞置于含1%–青霉素链霉素的fibrolifes2细胞培养液中常规培养。
步骤02、更昔洛韦的细胞毒性检测;
将tert+tk-d细胞按5,000个/孔接种于96孔培养板中,培养24小时后,分为四组,分别加入含0μg/ml,5μg/ml,25μg/ml,125μg/ml更昔洛韦的培养液,5%co2浓度37℃培养箱中培养1至6天;每隔24小时,用cck-8法检测一次细胞活性;与试验平行不加细胞只加培养液孔设为空白对照,最后比色以空白调零;未用药物处理的细胞孔为阴性对照;更昔洛韦的细胞毒作用用细胞存活的百分比表示;
步骤03、饲细胞层的制备;
tert+tk-d细胞和3t3细胞分别用加入8μg/ml丝裂霉素c(mitomycinc,mmc)((kyowahakko,tokyo,japan)的培养基在37℃.培养2小时。吸去丝裂霉素c培养基,pbs洗3次,胰蛋白酶消化后,按0.5×104个/cm2tert+tk-d细胞或者2×104个/cm23t3细胞密度将饲细胞接种入6孔细胞培养板和铺有i型胶原凝胶的transwell小室(collagengelculturingkit,nittagelatin,osaka,japan)作为饲细胞层。
步骤04、角膜缘干细胞的分离与培养;
本研究采用的角膜均来自northwestlions眼库(seattle,wa)。角膜移植后剩余的角膜片,撕去内皮层后,用2.4u/mldispase溶液(bdbiosciences,bedford,ma)37℃水浴消化1小时,再用0.02%的edta溶液(nacalaitesque,kyoto,japan)在室温下孵育2分钟。用无菌手术镊沿着角膜缘将上皮细胞刮下,收集的细胞用0.25%胰酶-乙二胺四乙酸(edta)(nacalaitesque,kyoto,japan)在37℃孵育15分钟。然后加入改良的角化细胞培养基(keratinocyteculturemedium,kcm)制成上皮细胞悬液,用于克隆形成率计算和角膜上皮再生细胞片培养的研究。改良的角化细胞培养基中添加有:dmem培养基(dulbecco’smodifiedeaglemedium)和ham’sf12培养基(dmem/f12,3:1),5%胎牛血清(fbs)(invitrogen),1nm霍乱毒素(calbiochem,lajolla,ca),2nm三碘甲状腺原氨酸(takeda,osaka,japan),0.4μg/ml氢化可的松(kowa,tokyo,japan),1%胰岛素-转铁蛋白补硒(invitrogen),100u/ml青霉素,100μg/ml链霉素(invitrogen)。
步骤05、克隆形成率实验;
将原代角膜缘干细胞按照1000个/孔的密度接种于覆盖有tert+tk-d
或者3t3饲细胞层的6孔板,共培养10-13天。终止培养后,用10%中性福尔马林固定,1%罗丹明b(wako,osaka,japan)染色。克隆形成率(cfe%)=克隆数(克隆直径>2毫米)/接种活细胞数×100%。
步骤06、角膜上皮再生细胞片的制备;
将原代角膜缘上皮细胞按1-2×105个/孔分别接种在含有饲细胞层的胶原凝胶涂层的transwell小室。细胞在kcm培养基中培养12天后,置于含25μg/mlgcv的kcm培养基中降低液平面(air-lifting)培养6-8天,而非gcv处理对照组用不含gcv的kcm培养基降低液平面培养。每2天换液一次。
步骤07、逆转录pcr及定量pcr;
按rneasyminikit(qiagen,valencia,ca)试剂盒使用说明书提取各组织和细胞的总rna。采用1ststrandcdnasynthesissystem(origene,rockville,md)进行逆转录翻译,合成pcr所需的cdna。pcr热循环条件为:94℃预变性5min;94℃变性30s,60℃延伸30s,72℃延伸30s,共35个循环;最后72℃延伸10min。用2%琼脂糖凝胶电泳鉴定pcr产物,紫外投射成像系统观察,凝胶图像分析软件分析目的基因的相对含量。pcr特异引物序列信息见表1。各种基因的表达均使用3-磷酸甘油醛脱氢酶(gapdh)作为内参进行标准化。定量pcr使用
步骤08、pcr检测饲细胞残留实验;
按qiaampdnaminikit(qiagen,valencia,ca)试剂盒使用说明,将gcv添加组和非添加组的与tert+tk-d饲细胞共培养的角膜上皮细胞片组织dna提取。长末端重复序列(ltr)是慢病毒载体的特异序列,通过慢病毒转染人皮肤成纤维细胞时整合到tert+tk-d细胞基因中。按照之前所述pcr条件,使用ltr特异性引物:ltr1:5’-aagggctaattcactcccaa-3’,ltr2:5’-tgcgtcgagagagctctggttt-3’;以gapdh作为阳性对照对提取的细胞片dna进行检测。
步骤09、免疫组织化学染色;
收获的上皮细胞片用tissue-tekoct(sakurafinechemicalco.,tokyo,japan)包埋,用于h&e染色和免疫荧光染色。h&e染色按照常规方法进行。免疫荧光染色按照以下方法进行:切片用4%多聚甲醛在4℃下固定30min,4%脱脂牛奶pbs溶液(含0.3%tritonx-100)室温1h封闭非特异结合,之后加入一抗:anti-k3(ae5)(1:100,progenbiotechnik,heidelberg,germany),anti-keratin12(1:100,santacruzbiotechnology,santacruz,ca),andanti-p63(4a4)(1:100,santacruz),4℃孵育过夜。之后用pbs洗3遍,每遍5min,加入相应的二抗常温孵育1h。之后用pbs洗3遍,每遍5min,加dapi染细胞核,zeiss荧光显微镜(axiovert200m,carlzeissjenagmbh,jenagermany)观察。切片加入相同浓度非特异性抗体的作为阴性对照。
步骤10、所得数据采用统计分析软件处理。
所得数据均采用spss16.0统计分析软件(spssinc.,chicago,il,usa)处理。采用独立样本t检验对数据进行分析,p<0.05为差异有显著性意义。
人皮肤成纤维细胞基因表达特征
人皮肤成纤维细胞基因表达与角膜基质成纤维细胞相似(图2),两者均表达肝细胞生长因子(hepatocytegrowthfactor,hgf),角质形成细胞生长因子(keratinocytegrowthfactor,kgf),表皮调节素(epiregulin,epr),脑源性神经营养因子(brain-derivedneurotrophicfactor,bdnf),成纤维细胞生长因子2(fibroblastgrowthfactor2,bfgf),和神经性钙粘附蛋白(n-cadherin,n-cad)。
tert+tk-d饲细胞生物学特性
将增强型绿色荧光蛋白(egfp)基因,端粒酶逆转录酶(htert)基因,和单纯疱疹病毒胸苷激酶(hsv-tk)基因导入人皮肤成纤维细胞,创建出tert+tk-d人源饲细胞系。将tert+tk-d饲细胞在体外连续传代6个月(>50代),tert+tk-d仍然保持原代人皮肤成纤维细胞形态(图3a),并且在紫外灯光照射下显示绿色荧光(图3b),并且保持更昔洛韦药物致死性(图3c)。rt-pcr检测显示tk基因和ltr序列在tert+tk-d细胞中表达,而在正常人成纤维细胞中不表达(图3d)。经过长时间传代后的tert+tk-d细胞仍保持旺盛的分裂能力(图3e)。更昔洛韦(gcv)细胞毒性实验显示,gcv对tert+tk-d细胞的毒性作用呈剂量依赖性,随着gcv剂量的加大,细胞毒作用增强。25μg/mlgcv组,几乎所有的细胞在6日内都凋亡(图3f)。
克隆形成率和特征
实验分为3组,2×104个/cm23t3细胞组(经典浓度),0.5×104/cm23t3细胞组,0.5×104个/cm2tert+tk-d细胞组。在共培养的第10-13日,所有组均形成了典型的角膜缘干细胞克隆(图4a,b),tert+tk-d组(cfe,11.77±0.21%)与同浓度3t3细胞组(cfe,5.7±0.89%)相比形成更多典型克隆(p<0.001),与经典浓度3t3细胞组相比,克隆形成率无显差异(p=0.332)。tert+tk-d细胞组(d>2mm;cfe,3.37±0.35%)比同密度3t3细胞组(d>2mm;cfe,1.3±0.26%)(p=0.01),和经典密度3t3细胞组(d>2mm,cfe,2.07±0.06%)(p=0.03)有更多面积大细胞数多的克隆形成(图4c)。共培养的第9日,将角膜缘上皮细胞克隆固定并用角膜上皮分化标记物k3和假定角膜缘干细胞标记物δnp63抗体进行免疫荧光染色。同时,将克隆细胞收集行逆转录pcr,用于检测k3和δnp63real-timepcr定量分析。
tert+tk-d和3t3细胞组均表达k3和δnp63(图5a,b),然而tert+tk-d组k3阳性表达低于3t3组。real-timepcr的结果证实了免疫荧光染色的结果,3t3组表达k3高于tert+tk-d组(p=0.01),而两组表达δnp63无显著性差异(p=0.982)(图5c)。
pcr检测饲细胞残留实验
图6为获得添加gcv组和非添加gcv组制备角膜上皮细胞片的流程图。角膜缘干细胞与tert+tk-d饲细胞层在kcm培养液中培养12日后,降低液平面培养6-8天促进角膜上皮复层化。在添加gcv组,25μg/mlgcv被加入kcm培养液作用于上皮细胞片培养的最后6-8日,以消灭tert+tk-d饲细胞。按之前所诉方法将两组培养获得的细胞片的组织和细胞dna提取,用pcr检测细胞片中慢病毒特异ltr序列的表达。两组细胞片检测结果均表达内参gapdh基因,但是ltr序列只表达于非添加gcv组。在gcv添加组,ltr序列不表达(图7)。
培养的角膜缘上皮再生细胞片的特性
角膜缘干细胞与tert+tk-d或3t3细胞共培养形成角膜上皮再生细胞片,这些细胞在kcm培养液中培养12日后,在添加25μg/mlgcv的kcm培养液中降低液平面培养6-8日促进上皮复层化。经过2-3周共培养,两组都形成了4-5层复层上皮细胞片(图8a)。25μg/mlgcv对于角膜缘上皮细胞和3t3饲细胞没有毒副作用,而tert+tk-d饲细胞在添加25μg/mlgcv的kcm培养液中6日后全部凋亡。细胞片切片免疫荧光染色显示,两组细胞片均表达角膜上皮细胞分化标记k310、假定角膜缘干细胞标记物δnp6311以及角膜上皮细胞特异性标记物k1212(图8d)。与3t3组相比,tert+tk-d组形成的细胞片较低表达k3,而在基底和翼细胞层较高表达δnp63。k12表达没有显著差异。
我们的研究结果证实,转基因,永生化,荧光标记的,可去除型人表皮成纤维细胞具有维持角膜缘干细胞生长、分化的能力,同时还可以防止饲细胞污染形成的再生细胞片。
为了避免使用动物来源的饲细胞,人源性饲细胞如骨髓间充质干细胞,角膜基质成纤维细胞,和皮肤成纤维细胞被广泛研究用于替代3t3成纤维细胞应用于临床。人表皮成纤维细胞在口腔黏膜上皮细胞表面重建取得良好效果;sharma等比较了人皮肤成纤维细胞,骨髓间充质干细胞和3t3细胞在体外分别与人角膜缘干细胞和口腔黏膜细胞共培养,发现人皮肤成纤维细胞优于骨髓间充质干细胞,与3t3细胞可以媲美。我们的实验也证实,人皮肤成纤维细胞与角膜基质成纤维细胞许多细胞因子表达相似,比如:hgf,
kgf,epr,bdnf,bfgf和n-cadherin。我们的预实验也显示,角膜缘干细胞与人皮肤成纤维细胞共培养的克隆形成率cfe高于与角膜基质成纤维细胞共培养(数据未显示)。因此,人皮肤成纤维细胞有着替代3t3细胞用于临床的广泛前景。
我们将htert基因转导入人皮肤成纤维细胞以防止细胞多次分裂后衰老。目前研究表明,永生化人皮肤成纤维细胞在体外连续传代超过6个月,大于50代,仍保持旺盛的分裂能力,荧光可视,并且对gcv药物敏感。赋予细胞永生化后,可以大大简化细胞的保存与使用,降低了原代培养成本,减少了重复使用慢病毒的风险。tk基因也导入htert和egfp转染的真皮成纤维细胞,以防止未知的感染和异种饲细胞污染。我们通过pcr检测ltr序列的实验发现,gcv处理的与tert+tk-d饲细胞共培养的细胞片没有受到饲细胞污染,而没有经过gcv处理的同样条件培养的细胞片却检测到残留的tert+tk-d饲细胞ltr序列基因。可去除型饲细胞可以灵活、方便地应用于各种需要饲细胞接触培养或者混合培养的情况。此外,饲养细胞可去除的特性也降低了转染外源基因产生的未知风险,增加使用转基因细胞的安全性。
sharma等比较了人皮肤成纤维细胞与3t3细胞对角膜缘干细胞增殖的作用,发现克隆形成率cfe和角膜缘干细胞标记物的表达两组细胞作用相似。实验证实tert,egfp,tk基因转导的人皮肤成纤维细胞保持了纤维细胞形态、旺盛的分裂增殖力,与正常人皮肤成纤维细胞一样具有支持角膜缘干细胞生长的特性。在tert+tk-d组和3t3组均形成了4-5层复层上皮角膜上皮再生细胞片。角膜缘干细胞的克隆形成率cfe在tert+tk-d组和经典浓度3t3组没有显著差异。值得注意的是,tert+tk-d组形成了更多面积大(直接>2mm)的克隆,并且比同浓度3t3细胞组的克隆形成率cfe高。此外,免疫组织化学染色和real-timepcr结果显示tert+tk-d组与3t3组相比低表达角膜上皮分化标记k3,并且更好的维持了角膜上皮层细胞的未分化状态。
用人皮肤成纤维细胞成功陪养出无动物源性成分人皮肤角质形成细胞25。rodriguez-piza等在无动物源性成分培养体系下成功分离出原代培养的人皮肤成纤维细胞,并显示这些细胞既能诱导出多能干细胞,又能作为饲细胞支持多能干细胞的生长。在目前的研究中,我们主要关注创建tert+tk-d细胞,研究创建的细胞的生物特性和饲细胞作用。结果显示创建的人皮肤成纤维饲细胞保持了原细胞的生物特性,具有支持角膜缘干细胞生长的能力,同时变得使用更方便,经济和安全。进一步的研究将在无动物源性成分培养体系下,用人源性成分取代目前常用的动物源性成分,比如用人血清替代胎牛血清等。同时,将创建的人皮肤成纤维饲细胞广泛应用于其他再生医疗研究,比如与口腔上皮细胞或者角质形成细胞共培养等。
综上所述,我们通过转基因手段创建了永生化可去除型人皮肤成纤维饲细胞,并且证实了该细胞安全有效。这些研究成果表明,转基因人皮肤成纤维饲细胞在再生医疗将有着广阔应用前景。
以上所述实施例仅表达了本发明的两种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。
- 还没有人留言评论。精彩留言会获得点赞!