一种纳米抗体人源化的方法与流程
本发明涉及分子生物学中抗体人源化设计研究领域,包括分子生物学,生物化学,抗体蛋白结构预测和模拟,具体涉及一种利用带有点回复突变位点的引物的相互重叠区域搭桥的pcr进行纳米抗体人源化回复突变文库建立的方法。
背景技术:
最早用于单克隆抗体人源化改造的方法是构建嵌合抗体[1]。该方法是将鼠源抗体的可变区和人抗体恒定区通过基因工程技术连接起来,即将鼠源抗体的恒定区基因替换为人抗体恒定区基因,与抗原结合的可变区部分仍然是鼠源抗体。此方法构建出的工程化嵌合抗体最大限度的保留了识别靶抗原能力的鼠源抗体可变区,同时又拥有了人抗体所有的恒定区的免疫学杀伤效应,而且由于这种嵌合抗体的免疫原性相比原始的鼠源抗体降低了2/3,所以可以应用于人体治疗[2]。但由于其分子中还保留1/3的鼠源部分,用于长期临床治疗还有可能发生人抗鼠抗体反应。因此,为了进一步降低嵌合抗体的免疫原性,需要对嵌合抗体的鼠源可变区进行进一步的人源化改造,获得全人源化抗体。
目前应用较多的全人源化方法是将鼠源抗体可变区内参与抗原结合的部分与选择用于做模板的人抗体可变区的框架区重新拼接,使抗体可变区中除高度可变的互补决定区(cdr)来源于鼠抗体外,其余部分都换成人源的。由于抗体可变区中参与抗原结合的一般是其6个互补决定区(cdr),故此过程也被称为“特异性和亲和力”。为了克服由于“cdr移植”可能导致的亲和力下降,需通过一系列对框架区残基的突变,逐步恢复或提高抗体的抗原结合能力,从而得到人源化程度更高的重构抗体[3-5]。已报道的构建重构抗体的方法依照其人源化改造使用的模板的选择和回复抗体结合能力的方法,目前主要的方法是通过序列对比,以序列相似性为标准分别选择相似性最高的抗体轻链和重链可变区的人源抗体为模板序列,在经过cdr移植后的轻、重链序列基础上,针对可能影响结合能力的框架残基分别构建一系列突变体,鉴别合适的突变组合。由于这些突变体需各自独立制备及测试其抗原结合能力,然后将较好的突变组合起来,即需要对各个可能的残基的突变、筛选重复循环实验,所以步骤繁复,效率低,费时费力。
相关参考文献:
[1]vaughantj,osbournjk,tempestpr.(1998)humanantibodiesbydesign.nat.biotechnol6:535-539
[2]davista.(1999)finalreportonthesaietyandelficacyofretreatmentwithrituximablorpatientswithnon-hodgkin’slymphoma.blood94:88a
[3]jonespt,dearph,footej.(1986)replacingthecomplementarity-determiningregionsinahumanantibodywiththosefromamouse
[4]riechmannl,clarkm,waldmannh.(1988)reshapinghumanantibodiesfortherapy
[5]chothiac,leskam,tramontano.(1989)conformationsofimmunoglobulinhypervariableregions
技术实现要素:
本发明人提供一种纳米抗体人源化的方法,包括步骤:
a.将通用性人源化纳米抗体框架的互补决定区cdr替换为抗体株纳米抗体的互补决定区cdr,对所述对抗体株纳米抗体的框架区fr与所述通用性人源化纳米抗体框架不同的氨基酸,进行回复突变;
b.通过重叠pcr并采用带有回复突变位点的引物对所述回复突变点进行随机组合以构建点回复突变文库;
c.通过第二轮pcr在所述点回复突变文库片段两端引入表达载体开口端重叠片段;
d.将所述点回复突变文库连接表达载体,转化至表达菌株并诱导表达以获得表达产物;
e.筛选高亲和力分子。
作为一个具体的实例,所述通用性人源化纳米抗体框架为h-nbbcii10fgla。
作为一个具体的实例,步骤b中所述重叠pcr的循环参数为:95℃预变性10秒(s),95℃变性10秒(s),50℃-68℃引物退火10秒(s),68℃引物延伸,循环28次后,最后68℃延伸2分钟(min)。
作为一个具体的实例,步骤c中所述第二轮pcr的反应体系与循环参数为:95℃预变性10秒(s),95℃变性10秒(s),50℃-68℃引物退火10秒(s),68℃引物延伸,循环28次后,最后68℃延伸2分钟(min)。
作为一个具体的实例,所述表达菌株为e.colibl21(de3)。
作为一个具体的实例,所述步骤d中,所述表达载体电转化至所述表达菌株。
作为一个具体的实例,所述步骤d中,诱导表达为在zym-5052培养基中低温诱导表达48小时,所述zym-5052培养基中包括抗生素carb。
作为一个具体的实例,所述步骤e中,通过取所述表达产物的上清液通过elisa检测筛选与抗原蛋白特异性结合活性与原纳米抗体相当的候选分子。
本发明与现有技术相比,具有以下有益效果:
1.本发明利用引物重叠pcr方法直接构建回复点突变文库组合,并进一步对突变文库进行表达筛选,进而筛选出免疫原性低且又能够最大限度保留其特异性和亲和力的人源化抗体,从而达到合理的人源化的效果。
2.本发明构建的点回复突变文库包含了点突变位点的组合,减少了现有技术中需筛选突变体并将较好的突变组合起来,再进行抗原结合能立测试的时间和成本,从而减少了点突变抗体各自独立制备及测试其抗原结合能力的时间和基因合成的成本,操作相对简单,简化人源化流程,提高工作效率并减少了花费。
附图说明
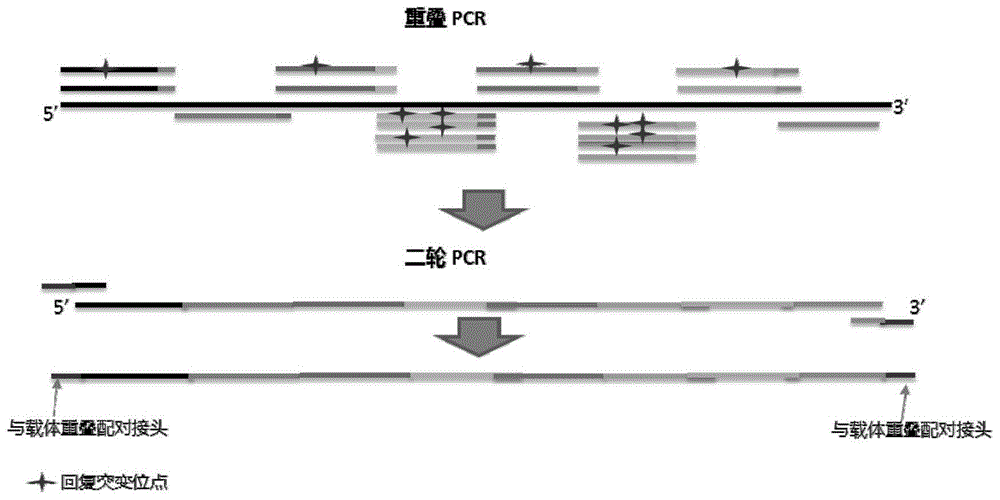
图1建立点回复突变文库并构建表达载体的重叠pcr流程图
图2a点回复突变文库pcr反应体系及条件-重叠pcr
图2b点回复突变文库pcr反应体系及条件-二轮pcr
图3点回复突变文库电泳图
附图中符号标记说明:
3a重叠pcr产物的琼脂糖凝胶电泳胶图
3bdna分子量标准
3c二轮pcr产物的琼脂糖凝胶电泳胶图
具体实施方式
下面将对本发明的技术方案进行清楚、完整的描述,显然,所描述的实施例是本发明的一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所获得的所有其他实施例,都属于本发明保护的范围。
为进一步阐述本发明,以下为一个纳米抗体人源化项目的实例。应理解,这一项目后期实例仅用于阐述本发明而不限制本发明的范围。除非另有描述,否则本发明中对这一项目后期实例的实施将一律采用常规的分子生物学和生物化学实验方法,且这些方法都是本领域的技术人员,从业人员或学者所知的。这些方法在下列文献中有完整的描述:michaelr.green,josephsambrook,《分子克隆实验指南》4theditionbook1-3(2017);相关的商品化试剂应当按照试剂生产商所提供的说明书进行操作;相关的仪器设备应当按照其供应商或生产商提供的说明书进行操作。
本发明中,所述纳米抗体人源化的具体步骤如下:
获取cécilevincke等人根据序列同源性设计完成的通用性人源化纳米抗体框架h-nbbcii10fgla(pdb编号为:3eak)。所述框架由基于纳米抗体nbbcii10抗体(pdb编号为:3dwt),参考人源抗体dp-47进行蛋白表面氨基酸人源化,并改造vhh序列框架2(framework-2)的部分氨基酸fgla完成。
使用所述通用性人源化纳米抗体框架h-nbbcii10fgla作为本发明的框架,将其cdr区替换为抗体株纳米抗体的cdr区,其具体方法采用现有技术中的常用技术手段,故在此不具体阐述。再对经过cdr移植后所述抗体株纳米抗体的框架区fr中与h-nbbcii10fgla不同的氨基酸,进行回复突变,采用引物重叠pcr方法对回复突变点进行随机组合构建突变文库,具体流程如图1所示,多个带有回复突变位点的引物具有相互重叠的片段,通过所述重叠片段塔桥,通过重叠pcr将所述多个引物进行随机组合以构建点回复突变文库;随后设置第二轮pcr(下文称为二轮pcr)在所述点回复突变文库片段两端引入表达载体开口端重叠片段。
上述重叠pcr与二轮pcr的pcr反应体系设置如表1-1、1-2所示,本实施例中的所述重叠pcr与二轮pcr选用2xpfuultraiihotstart(agilent,cat#:600850)与引物pcr水等配成25μl体系,反应条件设置如图2a、图2b所示:95℃预变性10秒(s),95℃变性10秒(s),50℃-68℃引物退火10秒(s),68℃引物延伸,循环28次后,最后68℃延伸2分钟(min)。
将两次pcr所得产物分别进行琼脂糖凝胶电泳,结果见图3。如图3(右)所示,选取二轮pcr产物400bp左右大小的片段进行割胶回收,回收物与表达载体通过infusion重组酶(takara,638910)进行重组连接后电转化至e.colibl21(de3)获得点突变文库表达的单克隆菌株。挑取相当于2-3倍文库库容量的单克隆菌株于96孔板的zym-5052培养基中进行低温诱导表达48小时。其中,所述zym-5052培养基的配制方法为:(1)配置zy溶液:称取10g蛋白胨和5g酵母提取物,加水至终体积940ml,溶解后倒入1l玻璃瓶,高压灭菌;(2)配置50×5052溶液:称取5g葡萄糖和20g乳糖,加入50ml甘油,加水至终体积200ml,完全溶解后抽滤除菌;(3)配置25×m溶液:称取44.75g十二水合磷酸氢二钠,17g磷酸二氢钾,13.25g氯化铵,3.55g硫酸钠,加水至200ml,完全溶解后抽滤除菌;(4)配置500×硫酸镁溶液:称取1.2g硫酸镁,溶解于10ml水中,用0.22μm滤膜过滤除菌;(5)在超净工作台中将每瓶zy溶液中加入20ml的50×5052溶液,40ml的25×m溶液和2ml的500×硫酸镁溶液,加入终浓度0.1mg/ml的抗生素carb,混匀,放置于室温待用。
取表达产物的上清液,采用间接elisa方法,检测筛选出与抗原蛋白特异性的结合活性与原纳米抗体相当的候选分子。对elisa阳性的菌株进行测序验证后,共获得8株回复点突变少于或等于2个的不同vhh纳米抗体人源化抗体变体。对所述8株抗体变体重新进行表达纯化,其中vhh-z2蛋白表达量较对照抗体vhh表达量降低了80%,所以vhh-z2未作后续纯化及进一步的亲合力验证实验。剩余7种纯化的变体如表2所示,表2列出所述变体的编号以及其中的氨基酸变化,其中氨基酸残基编号比照kabat编号。
表2
结果可知,在7种纯化的纳米抗体人源化变体中,vhh人源化设计的7个回复突变位点14p/a,43k/r,49s/a,75s/a,87r/k,88a/p和119l/q中,至少有1个位点进行了回复突变。
后续对这7种人源化变体进行进一步的验证,其中纯化后vhh抗体的表达量,蛋白纯度,蛋白热稳定性以及对不同种属的抗原在ph7.4和ph5.5条件下的亲合力测试结果见表3所示。
表3
结果可知,这7种vhh人源化变体与不同种属抗原的亲合力与对照抗体vhh基本一致。其中vhh-z1,vhh-z6,vhh-z7和vhh-z8的dsf-tm值均有降低。进一步查看vhh-z1,vhh-z6,vhh-z7和vhh-z8的蛋白序列,发现这4种人源化变体的49位均为氨基酸s,而vhh-z3,vhh-z4和vhh-z5的49位均进行了回复突变,将氨基酸s替换成了与vhh对照抗体的一致的氨基酸a。本实验筛选出的vhh-z3,vhh-z4和vhh-z5在抗体的表达量,蛋白纯度,热稳定性以及与抗原的亲合力方面与vhh对照抗体一致,可作为人源化抗体的候选分子。
综上所述,上述各实施例仅为本发明的较佳实施例而已,并不用以限定本发明的保护范围,凡在本发明的精神和原则之内,所做的任何修改、等同替换、改进等,皆应包含在本发明的保护范围内。
- 还没有人留言评论。精彩留言会获得点赞!