一种抗新型冠状病毒的单克隆抗体或其衍生体的制作方法
本发明属于细胞免疫学、分子生物学领域,涉及一种抗新型冠状病毒的单克隆抗体或其衍生体。
背景技术:
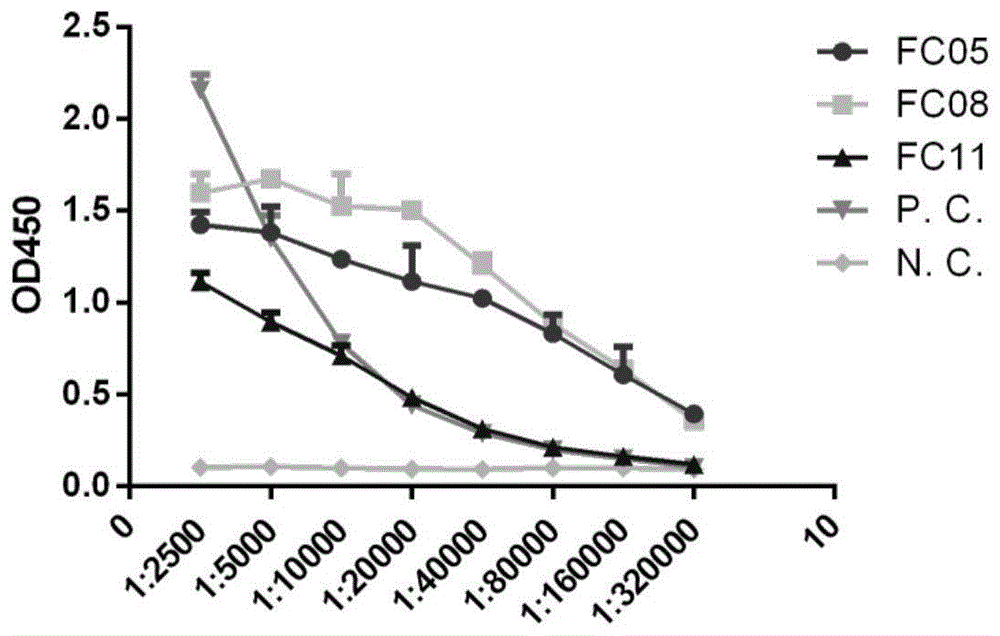
:国际病毒分类委员会将新型冠状病毒命名为sars-cov-2,世界卫生组织将感染此病毒引起的肺炎称为covid-19。此病毒传染性强,传播途径广。该病毒能迅速适应人体环境,感染后在潜伏期即具有传播能力,同时还有一些无症状感染者报道,甚至在多种动物体内也检测到病毒核酸。这些因素使得对该病毒的防控变的非常复杂,而且目前没有有效治疗药物及疫苗上市。sars-cov-2属于冠状病毒属,为单股正链rna病毒,大小约30kb,与sars-cov相似性为79%,与蝙蝠体内分离的冠状病毒(coronavirus,cov)相似性最高约88%。sars-cov-2具有典型的冠状病毒特征,病毒包膜上有典型的棘突,形似日冕。spike蛋白(刺突蛋白)是冠状病毒最重要的表面膜蛋白,决定了病毒的宿主范围和特异性,是宿主中和抗体的重要位点以及疫苗设计的关键靶点。由于特异性治疗药物及有效疫苗尚未研发成功,目前已有恢复期病人血浆用于治疗重症患者的尝试,且具有明显的效果。由于血浆及血浆制品成分复杂,且可能具有潜在的危险因素。病毒的中和性抗体,特别是全人源单克隆的在病毒诊断及治疗方面显得尤为重要。单克隆抗体能够识别病毒的单一抗原表位,有些具有中和作用的单克隆抗体能够通过结合在病毒特异性位点,例如受体结合部位,蛋白酶切位点,膜融合部位的附件,从而感染病毒生命周期中的粘附宿主细胞,利用膜融合及表面蛋白水解等机制而起到中和作用。其中从恢复期病人体内获得的全人源单克隆抗体更具有成药潜能。首先因为恢复期患者体内的免疫系统经过充分的免疫应答,b细胞经过充分的体细胞高频突变,使抗体亲和力得到最大程度的成熟。其次因为人体免疫系统全人源抗体不产生免疫应答,人源抗体成药更具安全性。因此,高亲和力和高中和活性的人源抗体对新型冠状病毒疫情控制和重症患者治疗方面都具有重大的应用价值。技术实现要素:本发明要解决的技术问题之一是提供一种抗新型冠状病毒的单克隆抗体或其衍生体如抗体fab片段、单链抗体等。本发明要解决的技术问题之二是提供编码上述抗体的dna分子或基因。本发明要解决的技术问题之三是提供制备上述抗体的方法。为解决上述技术问题,本发明采用如下技术方案:在本发明第一方面,提供了一种抗新型冠状病毒的单克隆抗体或其衍生体,其包含第一可变区和第二可变区,其中所述第一可变区是抗体轻链可变区,其抗原互补决定区cdr1,cdr2和cdr3分别包含seqidno:5,seqidno:6及seqidno:7所示的氨基酸序列;其中所述第二可变区是抗体重链可变区,其抗原互补决定区cdr1,cdr2和cdr3分别为seqidno:1,seqidno:2及seqidno:3所示的氨基酸序列;所述单克隆抗体的衍生体包括抗体fab片段、单链抗体、双特异抗体(bi-specific)等。作为本发明的优选的技术方案,所述第一可变区是抗体轻链可变区,为seqidno:8所示的氨基酸序列;其所述第二可变区是抗体重链可变区,为seqidno:4所示的氨基酸序列。作为本发明的优选的技术方案,其包含所述抗体轻链可变区和人抗体轻链恒定区,以及所述抗体重链可变区和人抗体重链恒定区的铰链区,ch1区,ch2区和ch3区。作为本发明的优选的技术方案,所述人抗体轻链恒定区来自人抗体kappa链或抗体lamda链,所述人抗体重链恒定区来自人igg1,igg2,igg3或igg4亚型。在本发明第二方面,提供了一种编码前面所述的单克隆抗体抗体或其衍生体的dna分子或基因核苷酸序列。作为本发明的优选的技术方案,抗体轻链可变区为seqidno:10所示的核苷酸序列,抗体重链可变区为seqidno:9的核苷酸序列。此外,本发明包括与本文提供的任何核苷酸序列特异性杂交的序列。术语“特异性杂交”指核苷酸序列与本文提供的序列或针对其的序列互补体的至少12、15、20、25、30、35、40、45、50或100个连接核苷酸杂交的能力,从而使得它具有与对照核酸(例如,非特异性dna或除本文提供的具体抗体序列外的dna)小于15%、优选小于10%、和更优选小于5%的背景杂交。各种杂交条件可用于检测特异性杂交,并且严格性主要由杂交测定法的洗涤步骤决定。一般而言,高温和低盐浓度产生高严格性,而低温和高盐浓度产生低严格性。通过在例如约2.0×ssc中在50℃下洗涤达到低严格性杂交,并且用约0.2×ssc在50℃下达到高严格性。编码本发明的抗体或其衍生体的核苷酸可含前导或信号序列。前导和信号序列可改变,并且可用备选前导序列取代,并且应当理解,在某些实施方案中,本发明的抗体含无前导序列的序列。可使用任何合适的备选前导或信号序列。在本发明第三方面,提供了一种表达载体,它含有前面所述的dna分子/基因核苷酸序列以及与该序列操作性相连的表达调控序列。在本发明第四方面,提供了一种重组宿主细胞,它由前面所述的表达载体转化而成。所述重组宿主细胞或其子代细胞表达前面所述的单克隆抗体或其衍生体。在本发明第五方面,提供了一种制备前面所述的单克隆抗体或其衍生体的方法,该方法包括如下步骤:a)提供一表达载体,该表达载体含有前面所述的dna分子序列以及与该序列操作性相连的表达调控序列;b)用步骤a)所述的表达载体转化宿主细胞;c)在适合条件下培养步骤b)所得的宿主细胞:和d)从宿主细胞培养液中分离纯化获得所述单克隆抗体或其衍生体。在本发明第六方面,提供了一种组合物,其含有前面所述的单克隆抗体或其衍生体。根据一个特定的实施方案,所述组合物是一种包含本发明的抗体或抗原结合部分以及药学上可接受的载体的药物组合物。药学上可接受的载体包括任何溶剂、分散介质、包衣、抗细菌和抗真菌剂、等渗和吸收延迟剂等等,只要它们是生理学相容的。药学上可接受的载体包括例如水、盐水、磷酸盐缓冲盐水、葡萄糖、甘油、乙醇等等,以及它们的组合。在多数情况下,优选使用等渗剂例如糖类、诸如甘露糖醇或山梨糖醇的多元醇类或氯化钠。药学上适合的载体可额外包含相对少量的增加抗体半衰期或有效性的辅助物质如润湿剂或乳化剂、防腐剂或缓冲剂。例如,药物组合物可以是适合于肠胃外给药的。在此,抗体被优选制备为具有0.1-250mg/ml的抗体含量的可注射的溶液。可以液体或冻干形式制备可注射的溶液,剂型为氧化铅玻璃瓶或管形瓶、安瓿或载药注射器。缓冲剂可含有l-组氨酸(1-50mm,优选5-10mm)并具有5.0-7.0,优选6.0的ph。更多适合的缓冲剂包括但不限于琥珀酸钠、柠檬酸钠、磷酸钠或磷酸钾缓冲剂。可使用氯化钠以便将溶液张度调节到0-300mm的浓度(对于液体剂型,优选150mm)。对于冻干剂型,还可包括冷冻保护剂如蔗糖(如0-10%,优选0.5-1.0%)。其他合适的冷冻保护剂为海藻糖和乳糖。对于冻干剂型,还可包括填充剂如甘露糖醇(如1-10%,优选2-4%)。稳定剂如l-甲硫氨酸(如51-50mm,优选5-10mm)可用于液体和冻干剂型中。个更多适合的填充剂为甘氨酸和精氨酸。还可使用表面活性剂如聚山梨醇酯80(如0-0.05%,优选0.005-0.01%)。更多的表面活性剂为聚山梨醇酯20和brij表面活性剂。本发明的组合物可具有多种剂型。这些剂型包括液体、半固体和固体剂型,如液体溶液(如可注射和可输注的溶液)、分散液或混悬剂、片剂、丸剂、粉剂、脂质体和栓剂。优选的剂型取决于期望的给药类型以及治疗应用。典型地,组合物优选以可注射的或能输注的溶液形式给予,例如类似于用于人被动免疫接种的其他抗体的组合物。优选的给药途径为肠胃外(如静脉内、皮下、腹膜内或肌内)给药。根据一个优选的实施方案,通过静脉输注或注射给予抗体。根据另一个优选的实施方案,通过肌内或皮下注射给予抗体。在制备和贮藏条件下,治疗组合物通常应当是无菌且稳定的。组合物可配制为溶液、微乳剂、分散剂、脂质体或其他适合于高浓度活性物质的有序结构。可通过将需要量活性物质(即抗体)引入合适的溶剂(根据需要适当时使用一种上述成分或其组合)中,并接着无菌过滤所述溶液,从制备无菌可注射溶液。通常通过将活性物质引入包含基本分散介质的无菌载体以及适当时其他必需成分中制备分散剂。就用于制备无菌可注射溶液的无菌冻干粉来说,真空干燥和喷雾干燥是优选的制备方法,其由之前无菌过滤的溶液产生了活性成分以及适当时更多所需成分的粉末。可例如通过使用诸如卵磷脂的包衣,通过在分散剂情况下维持所需的颗粒尺寸或通过利用表面活性剂,从而可以保持溶液合适的流动性。通过将延迟吸收的制剂如单硬脂酸盐和明胶额外引入组合物中,可以实现可注射组合物的延长吸收。尽管对于诸多治疗应用优选的给药类型为皮下注射、静脉注射或输注,本发明的抗体可通过多种本领域技术人员已知的方法给药。本领域技术人员应当理解给药途径和/或类型取决于所期望的结果。根据特定的实施方案,可用保护活性物质免于快速释放的载体制备该活性物质,例如,具有持续或控制释放的配方,其包括植入物、透皮膏剂以及微囊包埋释放系统。可使用生物学上可降解的生物相容的聚合物如乙二醇二乙酸酯、聚酐、聚乙醇酸、胶原、多正酯类和聚乳酸。制备上述剂型的方法是本领域技术人员众所周知的;参见例如sustainedandcontrolledreleasedrugdeliverysystems,j.r.robinson,编,marceldekker,inc.,newyork,1978。根据特定的实施方案,本发明的抗体可经口给予,例如处于惰性稀释剂或可代谢食用的载体中。抗体(以及更多的成分,如果需要的话)还可包封于硬或软胶囊中、压制成片或直接添加到食品中。为了口服治疗,可将抗体与赋形剂混合并以口服片剂、口含片剂、胶囊剂、酏剂、混悬剂、糖浆剂等形式使用。如果意在通过不同于肠胃外的途径给予本发明的抗体,可能需要从阻止该抗体失活的物质中选择包衣。在本发明第七方面,提供了含有前面所述的单克隆抗体或其衍生体的试剂盒。所述试剂盒还包括诊断剂。所述诊断剂包括可检测物质,可检测物质的例子包括各种酶、辅基、荧光材料、发光材料、生物发光材料、放射性核素、正电子发射金属(用于在正电子发射断层摄影术中使用)、和非放射性顺磁金属离子。关于可与抗体缀合用于用作诊断剂的金属离子,一般参见us4,741,900。合适的酶包括辣根过氧化物酶、碱性磷酸酶、β-半乳糖苷酶、或乙酰胆碱酯酶;合适的辅基包括链霉亲和素、抗生物素蛋白和生物素;合适的荧光材料包括伞形酮、荧光素、异硫氰酸荧光素、罗丹明、二氯三嗪基胺荧光素、丹酰氯和藻红蛋白;合适的发光材料包括鲁米诺;合适的生物发光材料包括萤光素酶、萤光素和水母素;放射性同位素,例如125i、131i、111in和90y、lu177、铋213、锎252、铱192和钨188/铼188、211砹、99tc。本发明的试剂盒还包括标签和施用说明书。在本发明第八方面,提供了前面所述的的单克隆抗体或其衍生体在制备新型冠状病毒检测产品或诊断产品中的应用。在本发明第九方面,提供了前面所述的单克隆抗体或其衍生体在制备预防或治疗新型冠状病毒感染的药物中的应用。在本发明第十方面,提供了前面所述的单克隆抗体或其衍生体在制备预防或治疗新型冠状病毒感染导致的疾病的药物中的应用。在本发明第十一方面,提供了前面所述的组合物在制备检测新型冠状病毒的检测产品或诊断产品中的应用。在本发明第十二方面,提供了前面所述的组合物在制备预防或治疗新型冠状病毒感染的药物中的应用。在本发明第十三方面,提供了前面所述的组合物在制备预防或治疗新型冠状病毒感染导致的疾病的药物中的应用。本文所采用的术语“单克隆抗体(单抗)”指从一纯系细胞得到的免疫球蛋白,具有相同的结构和化学特性,对单一抗原决定簇有特异性。单克隆抗体与常规多克隆抗体制剂(通常是具有针对不同决定簇的不同抗体)不同,各单克隆抗体是针对抗原上的单个决定簇。除了它们的特异性外,单克隆抗体的好处还在于它们是通过杂交瘤或重组工程细胞培养获得,不会混杂有其它免疫球蛋白。修饰语“单克隆”表示了抗体的特性,是从均一的抗体群中获得的,这不应被解释成需要用任何特殊方法来生产抗体。本文所用的术语“抗体”和“免疫球蛋白”是有相同结构特征的约150000道尔顿的异四聚糖蛋白,其由两个相同的轻链(l)和两个相同的重链(h)组成。每条轻链通过一个共价二硫键与重链相连,而不同免疫球蛋白同种型的重链间的二硫键数目不同。每条重链和轻链也有规则间隔的链内二硫键。每条重链的一端有可变区(vh)。其后是多个恒定区。每条轻链的一端有可变区(vl),另一端有恒定区;轻链的恒定区与重链的第一个恒定区相对,轻链的可变区与重链的可变区相对。特殊的氨基酸残基在轻链和重链的可变区之间形成界面。本文所用的术语“可变”表示抗体中可变区的某些部分在序列上有所不同,它形成了各种特定抗体对其特定抗原的结合和特异性。然而,可变性并不均匀地分布在整个抗体可变区中。它集中于轻链和重链可变区中成为互补决定区(cdr)或超变区中的三个片段中。可变区中较保守的部分称为构架区(frameworkregions,fr)。抗体重链和轻链的可变区中各自包含四个fr区,它们大致上呈β-折叠构型,由形成连接环的三个cdr相连,在某些情况下可形成部分β折叠结构。每条链中的cdr通过fr区紧密地靠在一起并与另一链的cdr一起形成了抗体的抗原结合部位(参见kabat等,nihpubl.no.91-3242,卷1,647-669页(1991))。抗体恒定区不直接参与抗体与抗原的结合,但是它们表现出不同的效应功能,例如参与抗体的依赖于抗体的细胞毒性(antibody-dependentcellularcytotoxicity,adcc)或补体介导毒性(complemnt-dependentcytotoxicity,cdc)。本文所用的术语“表达调控序列”通常指参与控制基因表达的序列。表达调控序列包括与目标基因操作性相连的启动子和终止信号。编码本发明抗体的基因(dna)序列可用本领域技术人员熟知的常规手段,如根据本发明公开的蛋白质序列人工合成或用pcr法扩增得到。其后可用本领域熟知的各种方法将合成或pcr扩增得到的dna片段插入到合适的表达载体中。本发明中所用的表达载体可以是本领域技术人员已知的市售表达载体,如invitrogen公司的pcdna3.1表达载体。用于接纳表达载体转化的合适宿主细胞一般包括原核细胞和真核细胞。常用的原核宿主细胞的例子包括大肠杆菌、枯草杆菌等。常用的真核宿主细胞包括酵母细胞、昆虫细胞、哺乳动物细胞等。表达载体转化的宿主细胞在合适的条件下(如以无血清培养基在细胞培养瓶或生物反应器中贴壁或悬浮培养)培养后,收获培养上清液,然后用包括protein-a亲和层析、离子交换层析、过滤除菌等本领域技术人员熟知的常规分离步骤或手段纯化得到本发明的抗体。纯化得到的本发明抗体可以溶于适当的溶剂如无菌生理盐水液体中,溶度可以制备成0.01至100mg/ml之间,理想的最终溶度可以制备成1至20mg/ml之间。附图说明图1显示利用间接elisa检测本发明的抗体与重组s-ecd特异性结合的结果图;图2显示利用间接elisa检测本发明的抗体与重组s-rbd特异性结合的结果图;图3显示利用免疫沉淀检测本发明的抗体与s-rbd与s-ecd结合的蛋白电泳图;图4显示利用spr实验检测本发明的抗体与s-rbd与s-ecd亲和力的结果图,其中,a:fc05;b:fc08;c:fc11;图5显示利用体外中和实验检测本发明的抗体的中和活性的结果图。具体实施方式下面通过实施例进一步说明本发明。应该理解的是,本发明的实施例是用于说明本发明而不是对本发明的限制。根据本发明的实质对本发明进行的简单改进都属于本发明要求保护的范围。实施例1抗体筛选一、噬菌体文库构建1、采集covid-19患者恢复期外周血,从外周血中分离单个核细胞(pbmc)本项目于2020年2月14日,经过知情同意,采集5位covid-19确诊患者出院前外周血各20ml。5位患者为同一传播链5人均非重症,经过治疗后分别与2月15日-22日出院居家隔离。使用ge的ficoll-paqueplus,经密度梯度离心法,分离20ml肝素抗凝血中的单个核细胞(pbmc)。2、pbmc中rna的提取和cdna的合成使用qiagen的rneasyminikit提取pbmc细胞rna,然后使用罗氏公司的第一链合成试剂盒(transcriptorfirststrandcdnasynthesiskit,roche,catno.:04896866001)将rna反转录成cdna。3、pcr扩增vk,vl和vh(extaq,takara,catno.:drr001a)(1)扩增vk&vl体系如表1所示。表1扩增vk&vl体系溶液或组分体积(μl)cdna1exbuffer(10x)5dntps(10mmeach)4p1(10μm)2p2(10μm)2extaq1u/μl0.3dh2o35.7(2)扩增重链fd段体系如表2所示。表2扩增重链fd段体系溶液或组分体积(μl)cdna2exbuffer(10x)10dntps(10mmeach)8p1(10μm)2p2(10μm)2extaq1u/μl0.6dh2o75.4(3)反应程序如表3所示。表3反应程序pcr产物过2%琼脂糖凝胶电泳,回收750bp左右的片段。4、轻链克隆(将vk和vl克隆入pcomb3h载体)vk和vl经xbaⅰ和sacⅰ酶切后与同样经xbaⅰ和sacⅰ酶切的pcomb3h载体连接后,回收连接产物,然后电转xl1-blue感受态细胞。电击菌液涂15cm大平皿,次日刮菌,提质粒即为轻链库。此时重组质粒为pcomb3h-vk和pcomb3h-vl。5、重链克隆(将vh基因克隆入pcomb3h-vk和pcomb3h-vl轻链库中)将轻链库pcomb3-l和fd片段分别经xhoi和spei双酶切,与同样经xhoi和spei双酶切的pcomb3h-vk和pcomb3h-vl连接,然后电转即得到抗体文库。6、抗体库的包装(1)从-80℃冰箱取出抗体库,冰上融化后取1ml加入10mla+(20μg/ml)2yt培养基中,37℃200rpm摇1小时;(2)加100mla+(100μg/ml),t+(20μg/ml)2yt培养基,200rpm摇1小时;(3)加1012pfu的vcsm13辅助噬菌体,37℃静置20min,200rpm摇2小时;(4)加终浓度70μg/ml卡那30℃200rpm摇过夜;(5)次日6000rpm离心20min,倒出上清,加入4%peg8000(4g)和3%nacl(3g),混匀,置于冰上30min以上;(6)分装于50ml离心管中9000rpm离心25min,弃去上清,控干,沉淀用1mlpbs重悬即为包装文库。二、噬菌体文库筛选1、将重组sars-cov-2刺突蛋白胞外区(extracellulardomainofspikeprotein,s-ecd,购自南京巴傲得生物科技有限公司,货号ncp0030p)包被于免疫管中,按50μg/管包被3管,于4℃放置过夜,次日用2%脱脂牛奶封闭免疫管1h。2、向免疫管中加1.75ml含2%脱脂牛奶的pbs和250μl噬菌体文库,37℃摇1h,再37℃静置1h。3、倒去噬菌体文库,用pbst洗20次,每次摇5min。4、用1mlph=2.2的gly-hcl洗脱免疫管,室温静置5min,再37℃摇5min,然后吸至1.5mlep管中,加入57μl2mtris中和至ph=7。5、将洗脱液转移至一个新的50ml离心管中,立即加入10mlod=1的新鲜xl1-blue,混匀后37℃孵育30min,加入10ml2yt(amp100μg/ml,tet20μg/ml)。6、取10μl菌液用来测洗脱库容量,剩下20ml培养基倒入500ml三角瓶,230rpm摇1h。7、加入130ml2yt(amp100ug/ml,tet20μg/ml),230rpm摇1h。8、加入moi=20的辅助噬菌体,37℃静置孵育30min。9、3000g10min离心,重悬沉淀至150ml2yt(amp100μg/ml,tet20μg/ml)中,37℃,230rpm摇2h。10、加入110μl70mg/ml卡那霉素,30℃230rpm过夜。次日再加1/5体积的peg-nacl(40ml),混匀后冰浴至少1h,然后10000g4℃离心20min,沉淀重悬于2-3mlpbs中,瞬时离心去除杂菌,过0.45μm滤器后用于下一轮筛选。11、重复上述筛选步骤3次,以达到对噬菌体文库富集筛选的目的。12、第三轮富集完以后,挑选2*96个克隆。经iptg诱导后,次日进行elisa检测。三、elisa检测2*96个克隆的结合特异性1、分别包被2块抗人fab抗体(1:3000)、2块s-ecd蛋白(2μg/ml),于4℃包被过夜。2、次日用3%脱脂牛奶封闭1h,然后加入50μl诱导上清和50μl脱脂牛奶,37℃孵育1h,pbst洗涤。3、4块板均加入hrp标记的抗人fab抗体(1:3000),37℃孵育1h,pbst洗涤后,tmb显色。经筛选获得159株能与s-ecd蛋白结合的噬菌体抗体片段,抗体片段为人源的fab段,包括轻链全长及重链的fd段。将159个单菌落扩增后送测序,获得轻重链齐全的合格序列。实施例2间接elisa检测抗体与s-rbd及s-ecd的结合特异性从筛选获得的159株抗体中选定3株人源抗体,构建成igg形式人源全分子抗体(三株抗体分别命名为fc05、fc08、fc11),并在293f细胞中表达,用proteina纯化后备用。fc08抗体序列如下所示:重链可变区的cdr1序列如seqidno:1所示、重链可变区cdr2的序列如seqidno:2所示、重链可变区的cdr3序列如seqidno:3所示;轻链可变区的cdr1序列如seqidno:5所示、轻链可变区的cdr2序列如seqidno:6所示、轻链可变区的cdr3序列如seqidno:7所示。重链可变区的氨基酸序列如seqidno:4所示,核苷酸序列如seqidno:9所示;轻链可变区的氨基酸序列如seqidno:8所示,核苷酸序列如seqidno:10所示。将重组sars-cov-2刺突蛋白受体结合区(receporbindingdomainofspikeprotein,s-rbd,购自南京巴傲得生物科技有限公司,货号ncp0029p)及重组s-ecd用pbs按1μg/ml浓度包被elisa板,将所有抗体浓度稀释到1mg/ml,然后从1:2500开始倍比稀释8个稀释度,使用病人血清作为阳性对照,用健康成人血清作为阴性对照,从1:100开始稀释8个梯度。标本稀释以后,于37℃孵育30min,然后pbst洗3次,加入hrp标记的抗人fc(1:5000),37℃孵育30min后pbst洗3次,用tmb显色,终止后读取od450吸光度值。在同等条件下重复3批,每孔吸光度值取平均数后用graphpad软件分析。与重组s-ecd的间接elisa结果如图1所示,fc05、fc08和fc11均能与重组s-ecd特异性结合。以1mg/ml为起始浓度,将cutoff值定义为抗体滴度可分别达到1:320000,1:320000和1:40000,说明该3株抗体均能与s-ecd特异性结合。与重组s-rbd的间接elisa结果如图2所示,只有fc08和fc11与s-rbd结合活性比较高,其中fc08抗体与s-rbd明显强于fc11,fc05与s-rbd蛋白不结合。此结果说明,fc05,fc08和fc11均能识别s-ecd,其中fc08和fc11识别的s-ecd中的rbd区,而fc05则结合在rbd以外的区域。实施例3抗体与s-rbd及s-ecd的免疫沉淀实验前期用westernblot检测3株抗体与s-rbd及s-ecd的结合特异性,发现该3株抗体均不与经sds-page后的s-rbd及s-ecd反应,预示三株抗体均为构象表位。因此,采用免疫沉淀(immunoprecipitation,ip)方法检测抗体与目的蛋白的结合特异性,方法如下:将fc05,fc08和fc11三株抗体与20μlproteinabeads室温结合2min,然后用20mm磷酸钠洗去未结合的抗体。再将20μg的靶抗原(s-rbd和s-ecd)加入抗体与proteina凝胶混合物中,室温结合2min。用20mm磷酸钠洗去未结合抗原,用30μlgly-hcl缓冲液(ph3.0)洗脱抗原抗体复合物,加1ul1mtris(ph9.0)中和体系至中性,洗脱物加入sds-pageloadingbuffer煮沸10min后进行sds-page分析。ip结果如图3所示,fc05能结合ecd,在line1中可见约140kda大小的ecd蛋白条带,以及抗体的重链(58kda)及轻链(28kda),而在line2中只有抗体的两条带,没有rbd蛋白条带。fc08和fc11根据前期elisa结果,认为即能和rbd结合又能和ecd结合,line3,5显示此两株抗体均能结合ecd,line4,6为结合rbd泳道,由于rbd分子量大小与抗体轻链大小相似均在28kda左右,在lin4,6道可见抗体轻链与rbd重叠后的弥散条带。注:图中m:蛋白marker;1,3,5为3株抗体与ecd蛋白结合的泳道;2,4,6为3株抗体与rbd蛋白结合的泳道。实施例4spr测定抗体与s-ecd的亲和力亲和力测定由biacore8k工作站完成,首先使用nhs/edc方法将标有链霉素的重组s-ecd蛋白固定于cm5芯片上并使响应值(responseunits,rus)达到600左右。系列稀释的抗体由125nm~7.8nm依次进样;带有histag的ace2蛋白进样浓度依次为500nm~31.25nm。在竞争实验中,首先将第一个样品以20μl/min流经芯片120s,然后将第二个样品以同样的速度和时间注入芯片中,收集响应信号,并用biaevaluation(版本4.1)软件全局拟合曲线来获得结合亲和力。spr结果如图4所示,spr结果表明,fc05和fc08和fc11抗体均能高效结合s-ecd蛋白,其亲和力分别为0.1nm,0.8nm和0.5nm。fc08和fc11能够高亲和力结合病毒的rbd区,可以通过影响病毒与受体的结合而发挥中和作用。fc05不与rbd结合,但是与ecd的亲和力可以达到0.1nm。实施例5抗体中和活性鉴定1、病毒来源病毒来源于sars-cov-2分离株,gisaid号:epi_isl_411953,毒株名:betacov/js03/human/20202、稀释抗体5份血清从1:10开始稀释(100μl血清+900μlpbs);3株抗体从1:80开始稀释(15μl抗体+1185μlpbs)3、准备细胞将veroe6细胞以1*104/孔传至96孔板中,37℃5%co2放置过夜,次日细胞长至单层后即可使用。4、准备病毒和抗体混合物1)取一96孔板,在a1-h1孔加100μl抗体(或血清),其他孔均加50μlpbs,然后用排枪从左至右倍比稀释,每个抗体做4个复孔。2)将病毒稀释至100tcid/50μl的浓度,向所有孔中加入50μl病毒液(即加入100tcid50的病毒),37℃孵育1小时。3)将96孔板中veroe6细胞换液,每孔加入病毒抗体复合物100μl,放37℃5%co2培养箱中,持续观察细胞病变直至5天(120h)后。4)每次需做100tcid50,10tcid50,1tcid50,0.1tcid50病毒对照孔,同时需做一个阳性血清对照,一次正常细胞对照。5、结果表4显示本发明的抗体或患者血清的中和滴度信息。表4抗体中和滴度信息统计结果见表5和图5。表5抗体的ic50值抗体ic50(ng/ml)fc08325fc11818fc05142fc05+fc084fc05+fc1119fc08+fc11102fc05+fc08+fc119三株单克隆抗体的ic50值在142-818ng/ml之间,其中fc05中和活性最高,可达142ng/ml。将三种抗体互相组合形成鸡尾酒制剂后,表现出了更强的协同效应。其中两株rbd区的抗体(fc08和fc11)混合后ic50为102ng/ml,比单独的单抗平均值高5.6倍,具有一定的协同效应。如将s-ecd区的fc05和s-rbd区的两株抗体混合后,中和效果出现了协同效应。fc05,fc11组合的ic50值为19ng/ml,fc05与fc08组合的ic50值为4ng/ml,三株抗体混合后的ic50值为9ng/ml。从结果中可以发现,非rbd区的抗体fc05的中和活性高于2株rbd区抗体,rbd区中和抗体与另外一株非rbd区抗体组合成鸡尾酒以后,混合物的中和效果可以提高约100倍。此揭示sars-cov-2病毒的中和位点除了rbd区以外,还有其他更加重要的中和位点。虽然以上仅描述了本发明的具体实施方式范例,但是本领域的技术人员应当理解,这些仅是举例说明,本发明的保护范围是由所附权利要求书限定的。本领域的技术人员在不背离本发明的原理和实质的前提下,可以对这些实施方式做出多种变更或修改,但这些变更或修改均落入本发明的保护范围。序列表<110>江苏省疾病预防控制中心(江苏省公共卫生研究院)<120>一种抗新型冠状病毒的单克隆抗体或其衍生体<150>2020103891874<151>2020-05-09<160>10<170>siposequencelisting1.0<210>1<211>8<212>prt<213>人工序列(artificialsequence)<400>1glyglythrphesersertyrala15<210>2<211>8<212>prt<213>人工序列(artificialsequence)<400>2ileileproileleuglyileala15<210>3<211>17<212>prt<213>人工序列(artificialsequence)<400>3valarggluargglytyrserglytyrglyalaalatyrtyrpheasp151015tyr<210>4<211>125<212>prt<213>人工序列(artificialsequence)<400>4gluvalglnleuleuglnglnserglyalagluvallyslysprogly151015serservallysvalsercyslysalaserglyglythrpheserser202530tyralailesertrpvalargglnalaproglyglnglyleuglutrp354045metglyglyileileproileleuglyilealaasntyralaglnlys505560pheglnglyargvalthrilethralaasplysserthrserthrala65707580tyrmetgluleuserserleuargsergluaspthralavaltyrtyr859095cysvalarggluargglytyrserglytyrglyalaalatyrtyrphe100105110asptyrtrpglyglnglythrleuvalthrvalserser115120125<210>5<211>9<212>prt<213>人工序列(artificialsequence)<400>5serserasnileglyalaglytyrasp15<210>6<211>3<212>prt<213>人工序列(artificialsequence)<400>6glyasnser1<210>7<211>11<212>prt<213>人工序列(artificialsequence)<400>7glnsertyraspserserleuserglyserval1510<210>8<211>111<212>prt<213>人工序列(artificialsequence)<400>8glnservalleuthrglnproproservalserglyalaproglygln151015argvalthrilesercysthrglyserserserasnileglyalagly202530tyraspvalhistrptyrglnglnleuproglythralaprolysleu354045leuiletyrglyasnserasnargproserglyvalproaspargphe505560serglyserlysserglythrseralaserleualailethrglyleu65707580glnalagluaspglualaasptyrtyrcysglnsertyraspserser859095leuserglyservalpheglyglyglythrlysleuthrvalleu100105110<210>9<211>375<212>dna<213>人工序列(artificialsequence)<400>9gaggtgcagctgttgcagcagtcaggggctgaggtgaagaagcctgggtcctcagtgaag60gtctcctgcaaggcttctggaggcaccttcagcagctatgctatcagctgggtgcgacag120gcccctggacaagggcttgagtggatgggagggatcatccctatccttggtatagcaaac180tacgcacagaagttccagggcagagtcacgattaccgcggacaaatccacgagcacagcc240tacatggagctgagcagcctgagatctgaggacacggccgtgtattactgtgtgagagaa300cgtggatatagtggctacggggcggcttactactttgactactggggccagggaaccctg360gtcaccgtctcctca375<210>10<211>333<212>dna<213>人工序列(artificialsequence)<400>10cagtctgtgctgacgcagccgccctcagtgtctggggccccagggcagagggtcaccatc60tcctgcactgggagcagctccaacatcggggcaggttatgatgtacactggtaccagcag120cttccaggaacagcccccaaactcctcatctatggtaacagcaatcggccctcaggggtc180cctgaccgattctctggctccaagtctggcacctcagcctccctggccatcactgggctc240caggctgaggatgaggctgattattactgccagtcctatgacagcagcctgagtggttcg300gtattcggcggagggaccaagctgaccgtccta333当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1