一种通过人工干扰提高菊花黑斑病抗性的方法与流程
本发明属于植物基因工程育种领域,涉及一种通过人工干扰提高菊花黑斑病抗性的方法。
背景技术:
菊花(chrysanthemummorifolium)是我国十大传统名花和世界四大切花之一,具有很高的观赏与经济价值。菊花生产过程中经常会有很多病害发生,其中由链格孢属真菌引起的黑斑病是最严重病害之一。链格孢属真菌侵染菊花后,产生圆形黑色斑点,随后逐渐扩大成圆形、近圆形或不规则形的病斑,潮湿条件下具有暗色霉层。近年来,菊花黑斑病的发生面积不断扩大,严重影响了菊花产量和观赏品质,给花卉生产造成了巨大损失。目前,黑斑病主要靠喷施杀菌剂防治,但常造成农药残留和环境污染等问题,不利于绿色可持续性发展。培育抗病品种是防治菊花黑斑病最经济、安全和有效的途径。
近年来,随着分子生物学的迅速发展,通过遗传转化的技术在植物体内过量表达或沉默特定的内源基因以提高植物抗逆性已成为现代育种的重要手段。基因沉默利用植物内源rna沉默的原理,提供小的双链rna靶序列沉默靶基因。人工小rna干扰技术(artificialmicrornatechnology,amirna)是一种在rnai基础上发展出的基因沉默技术,具有特异性高、稳定性强和沉默效应可预见等优点。amirnas是一类由内源mirna前体生成的长21mer的人工小rna分子,它能特异性地对单个或多个靶基因进行高效、稳定的沉默。因而amirna是分析基因功能的有效工具之一,有望通过沉默内源基因提高植物的抗病性。在菊花中,通过沉默内源基因提高菊花黑斑病抗性还鲜有报道。目前,kic基因在抗病育种中未见研究报道,具有明显创新性。因此通过农杆菌介导法沉默菊花的内源基因cmkic提高其抗病性是一种新的探索,为采用基因工程技术选育菊花抗病品种提供新颖而实用的方法。
技术实现要素:
本发明的目的在于解决现实生产中切花菊对黑斑病抗性较低的问题,提供一种通过人工干扰提高菊花黑斑病抗性的方法。本发明涉及的农杆菌介导遗传转化、转基因植物的分子检测及转基因植株后代对黑斑病的抗性分析为利用基因工程技术开展抗病性菊花分子育种提供方法和实例。
本发明的目的可以通过以下技术方案实现:
利用根癌农杆菌介导法,对cmkic基因进行人工干扰,并经过潮霉素筛选抗性植株;经过潮霉素抗性筛选得到阳性转化植株,对转化植株进行pcr、荧光定量rt-pcr验证,对转基因植株后代进行抗病性分析,最终获得抗病性提高的转基因菊花植株。cmkic基因的microrna序列由专门进行amirna研究的专业网站自动生成(http://wmd3.weigelworld.org/),cmkic基因的序列为seqidno.1,cmkic基因的amirna即amicmkic序列为seqidno.3。
本发明的第一个目的是提供seqidno.1所示的cmkic基因在提高菊花黑斑病抗性中的基因工程应用。
进一步的,所述应用为特异性沉默cmkic基因提高菊花黑斑病抗性。
本发明的第二个目的是提供seqidno.3所示amicmkic在提高菊花黑斑病抗性中的基因工程应用。
本发明的第三个目的是提供一种通过人工干扰提高菊花黑斑病抗性的方法,所述方法包括以下步骤:
(1)构建cmkic基因植物表达载体:将seqidno.2所示片段d连接到pmd19-t载体,转化dh5α感受态细胞,提取阳性质粒,将提取的阳性质粒和pentrtm1a质粒分别用sali和noti双酶切,然后连接,转化,提取的阳性质粒经nsii单酶切线性化后与植物表达载体pmdc32质粒进行lr重组反应,转化,提取阳性质粒,获得cmkic基因植物表达载体pmdc32-amicmkic;所述seqidno.2所示的片段d包含seqidno.3所示amicmkic。
优选的,所述片段d为直接合成或以包含拟南芥mir319a前体的prs300为模板质粒,采用cmkic特异人工干扰引物,重叠pcr反应扩增得到;
(2)采用农杆菌介导法将步骤(1)构建的cmkic基因植物表达载体pmdc32-amicmkic转入菊花中,筛选得到潮霉素抗性植株;将筛选得到的潮霉素抗性植株进行pcr鉴定、荧光定量rt-pcr分子检测,获得提高黑斑病抗性的特异性沉默cmkic基因的菊花植株;
优选的,所述菊花的品种为‘神马’,
优选的,所用的农杆菌菌株为eha105。
进一步的,步骤(1)中所述重叠pcr反应扩增目的片段d具体操作如下:
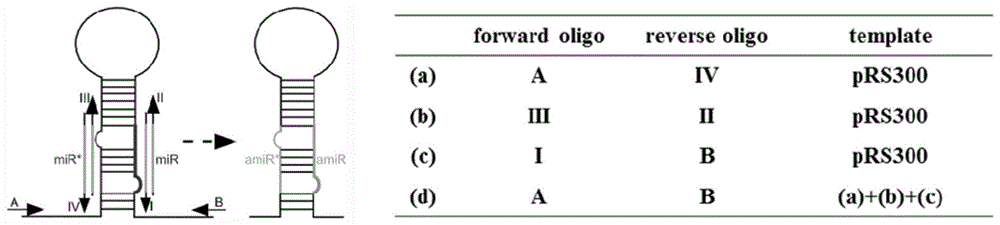
以包含拟南芥mir319a前体的prs300为模板质粒,采用cmkic特异人工干扰引物a-f、iv-r扩增得到片段a;采用引物iii-f、ii-r扩增到片段b;采用引物i-f、b-r扩增得到片段c;
回收片段a、b、c,采用引物a-f、b-r扩增,得到目的片段d;
所述cmkic特异人工干扰引物序列如下:
i-f:5′-gataacgtgtttacgtctagccttctctcttttgtattcc-3′(seqidno.4),
ii-r:5′-gaaggctagacgtaaacacgttatcaaagagaatcaatga-3′(seqidno.5),
iii-f:5′-gaagactagacgtaatcacgttttcacaggtcgtgatatg-3′(seqidno.6),
iv-r:5′-gaaaacgtgattacgtctagtcttctacatatatattcct-3′(seqidno.7),
a-f:5′-ctgcaaggcgattaagttgggtaac-3′(seqidno.8),
b-r:5′-gcggataacaatttcacacaggaaacag-3′(seqidno.9)。
进一步的,步骤(2)中所述的采用农杆菌介导法将cmkic基因植物表达载体pmdc32-amicmkic转入菊花的过程为:制备感受态的农杆菌,将步骤(1)中构建的pmdc32-amicmkic植物表达载体转入感受态的农杆菌中,挑选阳性克隆,摇菌至od值为0.5~0.6,离心后,弃上清,用ms(ph5.8)培养液将沉淀等体积悬浮,用于侵染;取组培瓶中菊花苗顶端叶盘作为转化受体,在预培养基中培养2~3d,然后浸入上述备好的农杆菌菌液中侵染8~10min,用滤纸吸干叶盘表面的菌液后再将其接种到共培养基上,暗培养3d,转入脱羧培养基上培养7d,然后转入筛选培养基上继代培养3~4代,等分化出的抗性芽长至2~3cm时转入含潮霉素的生根培养基上培养,筛选得到潮霉素抗性植株;优选的,所述组培瓶中菊花的品种为‘神马’。
进一步的,步骤(2)所用菊花组织培养基均以ms固体培养基为基础,ph5.8,100kpa、116℃灭菌30min,各培养基具体配比如下:
预培养基、共培养培养基:ms固体培养基+6-苄氨基嘌呤(6-ba)1mg/l+萘乙酸(naa)0.5mg/l;
脱羧培养基:ms固体培养基+6-苄氨基嘌呤(6-ba)1mg/l+萘乙酸(naa)0.5mg/l+羧卞青霉素(carb)500mg/l;
筛选培养基逐渐降低筛选压(继代培养3~4代中,按照筛选培养基1-2-3-4的顺序,每隔两周更换一种培养基即继代一次,直至分化出的抗性芽长到2-3cm。),所述筛选培养基1、2、3、4配比分别如下:
筛选培养基1:ms固体培养基+6-苄氨基嘌呤(6-ba)1mg/l+萘乙酸(naa)0.5mg/l+350mg/lcarb+12mg/lhyg,
筛选培养基2:ms固体培养基+6-苄氨基嘌呤(6-ba)1mg/l+萘乙酸(naa)0.5mg/l+300mg/lcarb+10mg/lhyg,
筛选培养基3:ms固体培养基+6-苄氨基嘌呤(6-ba)1mg/l+萘乙酸(naa)0.3mg/l+250mg/lcarb+8mg/lhyg,
筛选培养基4:ms固体培养基+6-苄氨基嘌呤(6-ba)1mg/l+萘乙酸(naa)0.1mg/l+200mg/lcarb+8mg/lhyg;
生根培养基:ms固体培养基+潮霉素(hyg)8mg/l。
进一步的,步骤(2)所述pcr鉴定、荧光定量rt-pcr分子检测步骤如下:
(1)pcr检测
取生根筛选得到的潮霉素抗性植株嫩叶及未转化株嫩叶,提取基因组dna,以载体35s-amicmkic和片段b作为检测目标,所述载体35s-amicmkic目的片段长475bp,所述片段b目的片段长176bp,引物序列如下:
35s-f:5′-gacgcacaatcccactatcc-3′(seqidno.10),
iii-f:5′-gaagactagacgtaatcacgttttcacaggtcgtgatatg-3′(seqidno.6);
ii-r:5′-gaaggctagacgtaaacacgttatcaaagagaatcaatga-3′(seqidno.5);
分别以潮霉素抗性植株和野生型植株dna为模板,以35s-f/ii-r和iii-f/ii-r为引物,进行pcr检测,扩增产物进行琼脂糖凝胶电泳检测分析;
(2)荧光定量rt-pcr检测
分别提取抗潮霉素植株叶片及野生型植株叶片rna,反转录成cdna,建立荧光定量rt-pcr扩增体系,根据数据分析得到各个样品的ct值,以野生型植株的表达量为基准值,计算野生型和各转基因植株的基因相对表达情况;荧光定量特异引物扩增出的片段长为80bp,引物序列为:
上游引物cmkic-rt-f:5′-gctagcggaccaggaaagtg-3′(seqidno.11),
下游引物cmkic-rt-r:5′-tcattccttccatacccaaaattc-3′(seqidno.12),
以ef1α扩增的基因片段为内标,片段长度为151bp,引物序列:
上游引物ef1α-f:5′-ttttggtatctggtcctggag-3′(seqidno.13),
下游引物ef1α-r:5′-ccattcaagcgacagactca-3′(seqidno.14)。
进一步的,对通过pcr、荧光定量rt-pcr分子检测所获得转基因植株后代进行抗性分析验证,通过表型观察进一步确认转化植物的抗病性提高:
选取6~8叶龄的野生型菊花(wt)和转基因菊花的扦插苗作为接种处理的材料。病原菌链格孢菌的接种方法为菌丝富集接种法:在pda(potatodextroseagar)培养基上培养链格孢菌4~5d,然后从培养基边缘取10个直径约4mm的菌饼,在组织磨样机中充分研磨后转移到pdb(potatodextrosebroth)液体培养基中,25℃,200rpm培养2d。每1mlpdb菌丝富集成一个菌球,用毛笔接种在第三片完全展开的叶片背面,每片叶两个接种点。接种后的幼苗放置在人工培养箱中,在25℃、高湿状态下黑暗培养2d。每个株系设置10株重复,接种后2d取下接种的叶片拍照并统计发病情况。使用imagej软件测量叶片正面的产孢面积,试验数据利用spss19.0软件进行差异分析和duncan多重比较。
本发明的第四个目的是提供cmkic基因植物表达载体在提高菊花黑斑病抗性中的基因工程应用,所述cmkic基因植物表达载体采用以下方法制备:将seqidno.2所示片段d连接到pmd19-t载体,转化dh5α感受态细胞,提取阳性质粒,将提取的阳性质粒和pentrtm1a质粒分别用sali和noti双酶切,然后连接,转化,提取的阳性质粒经nsii单酶切线性化后与植物表达载体pmdc32质粒进行lr重组反应,转化,提取阳性质粒,获得cmkic基因植物表达载体pmdc32-amicmkic;所述seqidno.2所示的片段d包含seqidno.3所示amicmkic,优选的,所述片段d为直接合成或以包含拟南芥mir319a前体的prs300为模板质粒,采用cmkic特异人工干扰引物,重叠pcr反应扩增得到。
所述重叠pcr反应扩增目的片段d具体操作如下:
以包含拟南芥mir319a前体的prs300为模板质粒,采用cmkic特异人工干扰引物a-f、iv-r扩增得到片段a;采用引物iii-f、ii-r扩增到片段b;采用引物i-f、b-r扩增得到片段c;
回收片段a、b、c,采用引物a-f、b-r扩增,得到目的片段d;
所述cmkic特异人工干扰引物序列如下:
i-f:5′-gataacgtgtttacgtctagccttctctcttttgtattcc-3′(seqidno.4),
ii-r:5′-gaaggctagacgtaaacacgttatcaaagagaatcaatga-3′(seqidno.5),
iii-f:5′-gaagactagacgtaatcacgttttcacaggtcgtgatatg-3′(seqidno.6),
iv-r:5′-gaaaacgtgattacgtctagtcttctacatatatattcct-3′(seqidno.7),
a-f:5′-ctgcaaggcgattaagttgggtaac-3′(seqidno.8),
b-r:5′-gcggataacaatttcacacaggaaacag-3′(seqidno.9)。
本发明的第五个目的是提供包含有cmkic基因植物表达载体的农杆菌在提高菊花黑斑病抗性中的基因工程应用。
详细操作过程为:
从yeb(50μg/ml利福平)平板上挑取eha105单菌落,接种于含50μg/ml利福平的yeb液体培养基中,200rpm,28℃培养至od值0.5~0.6,然后冰浴菌液30min,离心收集菌体,悬浮于预冷的100mmcacl2(20%甘油)溶液中,200μl/管分装,待用。
取1μgpmdc32-amicmkic载体质粒,加入200μl感受态细胞中,冰浴30min,液氮冷冻5min,37℃水浴5min,加入800μlyeb液体培养基,28℃200rpm预培养4h,菌液涂板于yeb(50μg/ml利福平+50μg/ml卡那霉素)固体培养基上,28℃暗培养2d,挑取单克隆检测,选取阳性克隆摇菌,用于转化菊花。
以切花菊‘神马’叶片为外植体,取组培瓶中菊花苗顶端叶盘(0.5cmⅹ0.5cm)作为转化受体,在预培养培养基中培养2~3d,然后浸入备好的农杆菌菌液中侵染8~10min,用滤纸吸干菌液后再接种到共培养基上黑暗培养3d,转入脱羧培养基上培养7d,然后转入筛选培养基上继代培养3~4代,等分化出的抗性芽长至2~3cm时转入生根培养基上培养,初步获得抗性植株。
上述通过人工干扰提高菊花黑斑病抗性的方法,将pmdc32-amicmkic转基因获得的抗性植株进行pcr鉴定、荧光定量rt-pcr分子检测,筛选阳性植株,获得转基因菊花株系:
(1)pcr检测
取生根筛选得到的潮霉素抗性植株嫩叶及野生型嫩叶,提取基因组dna,将载体35s-amicmkic和片段b作为检测目标,目的片段分别长475bp和176bp,引物序列如下:
35s-f:5′-gacgcacaatcccactatcc-3′(seqidno.10)
iii-f:5′-gaagactagacgtaatcacgttttcacaggtcgtgatatg-3′(seqidno.6)
ii-r:5′-gaaggctagacgtaaacacgttatcaaagagaatcaatga-3′(seqidno.5)
分别以潮霉素抗性植株和野生型植株dna为模板,以35s-f/ii-r和iii-f/ii-r为引物,进行pcr检测,扩增产物进行琼脂糖凝胶电泳检测分析。
(2)荧光定量rt-pcr检测
分别提取抗潮霉素植株叶片及野生型植株叶片rna,反转录成cdna,建立荧光定量rt-pcr扩增体系,每个样品重复3次,根据数据分析得到各个样品的ct值,以野生型植株的表达量为基准值,计算野生型和转基因植株的基因相对表达情况;荧光定量特异引物扩增出的片段长为80bp,引物序列为:
上游引物cmkic-rt-f:5′-gctagcggaccaggaaagtg-3′(seqidno.11)
下游引物cmkic-rt-r:5′-tcattccttccatacccaaaattc-3′(seqidno.12)
以ef1α扩增的基因片段为内标,片段长度为151bp,引物序列:
上游引物ef1α-f:5′-ttttggtatctggtcctggag-3′(seqidno.13)
下游引物ef1α-r:5′-ccattcaagcgacagactca-3′(seqidno.14)
上述的通过人工干扰提高菊花黑斑病抗性的方法,其在于对通过pcr、荧光定量rt-pcr分子检测所获得转基因植株后代进行抗病性分析:
选取6~8叶龄的野生型菊花(wt)和转基因菊花的扦插苗作为接种处理的材料。病原菌链格孢菌的接种方法为菌丝富集接种法:在pda(potatodextroseagar)培养基上培养链格孢菌4~5d,然后从培养基边缘取10个直径约4mm的菌饼,在组织磨样机中充分研磨后转移到pdb(potatodextrosebroth)液体培养基中,25℃,200rpm培养2d。每1mlpdb菌丝富集成一个菌球,用毛笔接种在第三片完全展开的叶片背面,每片叶两个接种点。接种后的幼苗放置在人工培养箱中,在25℃、高湿状态下黑暗培养48h。每个株系设置10株重复,接种后48h取下接种的叶片拍照并统计发病情况。使用imagej软件测量叶片正面的产孢面积,试验数据利用spss19.0软件进行差异分析和duncan多重比较。
本发明所提供的通过人工干扰提高菊花黑斑病抗性的方法具有如下优点:
本发明提供的方法创制了转基因菊花材料,采用遗传转化技术对目的基因cmkic进行特异性沉默,通过黑斑病接种试验分析获得具有抗病性的转化菊花株系。结果发现,与野生型植株相比,cmkic基因沉默的植株抗黑斑病的能力得到明确提高,产孢面积减少了50%以上,利用本方法使cmkic基因在转录水平上沉默表达可以显著提高菊花的抗病性。
附图说明
图1amirna组装模式图
图2pmdc32-amicmkic植物载体构建路线图
图3为植物表达载体pmdc32-amicmkic构建过程的琼脂糖凝胶电泳图
m1:marker2000;m2:marker5000;m3:marker15000;
1-3:prs300模板质粒扩增的a,b,c片段;
4:a+b+c片段为模板扩增的d片段;
5:pmd19-amicmkic质粒;
6:pmd19-amicmkic质粒sali和noti双酶切;
7:pentrtm1a质粒;
8:pentrtm1a-amicmkic质粒sali和noti双酶切;
9:pentrtm1a-amicmkic质粒;
10:pentrtm1a-amicmkic质粒nsii单酶切;
11:pmdc32-amicmkic表达载体质粒电泳图。
图4pmdc32-amicmkic转基因菊花的转化和再生过程
a:转化叶盘分化出愈伤;b:转化叶盘分化出芽点;c:抗性苗生根筛选;
d:抗性苗生根;e:抗性苗生根长成完整植株。
图5pmdc32-amicmkic转基因菊花特异引物检测电泳图
a:35s-f/ii-r引物检测电泳图;b:iii-f/ii-r引物检测电泳图;
m:dl2000marker;5-112:pmdc32-amicmkic转基因菊花株系;
wt:野生型植株;+:阳性对照;-:阴性对照。
图6野生型及转基因菊花植株中cmkic基因的相对表达量
wt:野生型植株;89-112:转pmdc32-amicmkic的株系。
图7野生型及转基因菊花植株的黑斑病菌接种试验(2d)
wt:野生型植株;94,95:转pmdc32-amicmkic的株系。
表1野生型及转基因菊花植株接种黑斑病菌后产孢面积(2d)
具体实施方式
下面对发明的具体实施例进行详细的说明:本实施例在以本发明技术方案为前提下进行实施,给出了详细的实施方式和具体的操作过程,其具体实施方式如下:
实施例1.植物表达载体pmdc32-amicmkic的构建
登录进行amirna研究的专业网站(http://wmd3.weigelworld.org/),设计cmkic特异人工干扰引物,模板质粒为包含拟南芥mir319a前体的prs300(该质粒可以从生物公司等公开渠道获得,本发明所用包含拟南芥mir319a前体的prs300购于addgene官网,重叠pcr反应扩增目的片段d(seqidno.2),组装模式如图1。d片段连接到pmd19-t载体,转化dh5α感受态细胞,提取阳性质粒,将提取的阳性质粒和pentrtm1a质粒分别用sali和noti双酶切,然后连接,转化,提取的阳性质粒经nsii单酶切线性化后与植物表达载体pmdc32质粒进行lr重组反应(invitrogen,usa),转化,提取阳性质粒。
以包含拟南芥mir319a前体的prs300为模板,用高保真酶(primestartmhfdnapolymerase,takara)进行pcr(a)、(b)、(c)反应,50μl反应体系:5×hfpcrbuffer10.0μl,正反引物各2.0μl,dntpmix4.0μl(2.5mmol·l-1),primestartmhfdnapolymerase0.5μl,prs300模板2μl,ddh2o补足到50.0μl;反应程序:95℃预变性2min,然后95℃解链30sec,55℃退火30sec,72℃延伸40sec,反应24个循环,72℃延伸7min;
pcr产物用凝胶回收试剂盒(axygen,usa)回收,回收产物用于进行pcr(d)反应。反应体系(50μl):5×hfpcrbuffer10.0μl,a、b引物各2.0μl,dntpmix4.0μl(2.5mmol·l-1),primestartmhfdnapolymerase0.5μl,pcr(a)、(b)、(c)回收产物各0.5μl,ddh2o补足到50.0μl;反应程序:95℃预变性2min,然后95℃解链30sec,55℃退火30sec,72℃延伸1min30sec,反应35个循环,72℃延伸7min;pcr产物用凝胶回收试剂盒回收,回收产物连接到pmd19-t载体,转化dh5α感受态细胞,提取阳性质粒pmd19-amicmkic。
用sali和noti分别双酶切gateway入门载体pentrtm1a(invitrogen,usa)和pmd19-amicmkic质粒,双酶切体系(50μl):10×fastdigestbuffer5μl,质粒pentrtm1a或pmd19-amicmkic2.5μg,sali2.5μl,noti2.5μl,ddh2o补足到50.0μl;37℃反应3h,65℃酶失活15min;双酶切产物进行琼脂糖凝胶电泳分析,用凝胶回收试剂盒(axygen)回收质粒pentrtm1a大片段和pmd19-amicmkic片段。用t4dna连接酶(takara)连接两个回收的产物,连接反应体系(10μl):10×t4ligasebuffer1μl,pentrtm1a大片段2μl,pmd19-amicmkic片段6μl,t4dna连接酶1μl;16℃过夜连接,连接产物转化dh5α感受态细胞。37℃培养12~16h,挑取阳性单克隆扩大培养,提取质粒pentrtm1a-amicmkic。
nsii单酶切质粒pentrtm1a-amicmkic,酶切体系(50μl):10×fastdigestbuffer5μl,质粒pentrtm1a-amicmkic2.5μg,nsii2.5μl,ddh2o补足到50.0μl;37℃反应3h,65℃酶失活15min,用凝胶回收试剂盒(axygen)回收质粒pentrtm1a-amicmkic大片段。将回收的片段与pmdc32载体质粒进行lr重组反应,反应体系(5μl):pentrtm1a-amicmkic大片段3μl,pmdc32质粒1μl,lrclonasetmⅱenzymemix1μl;25℃反应1h,加入1μlproteinasek,37℃反应10min;重组产物转化dh5α感受态细胞,37℃培养12~16h,挑取阳性单克隆扩大培养,提取质粒pmdc32-amicmkic,电泳和测序验证。
植物表达载体pmdc32-amicmkic的构建成功(如图2、图3)。
实施例2.农杆菌eha105介导叶盘法转化菊花
从yeb(50μg/ml利福平)平板上挑取eha105单菌落,接种于含50μg/ml利福平的yeb液体培养基中,200rpm,28℃培养至od值0.5~0.6,而后冰浴菌液30min,离心收集菌体,悬浮于预冷的100mmcacl2(20%甘油)溶液中,200μl/管分装,待用。取1μgpmdc32-amicmkic载体质粒,加入200μl感受态细胞,冰浴30min,液氮冷冻5min,37℃5min,加入800μlyeb液体培养基,28℃200rpm预培养4h,菌液涂板于yeb(50μg/ml利福平+50μg/ml卡那霉素)固体培养基上,28℃暗培养2d,挑取单克隆检测,选取阳性克隆摇菌,用于转化菊花。
采用的农杆菌指包含pmdc32-amicmkic植物表达载体的eha105,用yeb液体培养基培养农杆菌eha105;以切花菊‘神马’叶片为外植体,采用根癌农杆菌介导法将pmdc32-amicmkic导入菊花。取组培瓶中菊花苗顶端叶盘(0.5cmⅹ0.5cm)作为转化受体,在预培养培养基中培养2~3d,然后浸入备好的农杆菌菌液中感染8~10min,用滤纸吸干菌液后再接种到共培养基上黑暗培养3d,转入脱羧培养基上培养7d,然后转入筛选培养基上继代培养3~4代,等分化出的抗性芽长至2~3cm时转入生根培养基上培养,获得抗性植株(图4)。
菊花组织培养基以ms固体培养基为基础,ph5.8,100kpa、116℃灭菌30min;
预培养、共培养培养基:ms固体培养基+6-苄氨基嘌呤(6-ba)1mg/l+萘乙酸(naa)0.5mg/l;
脱羧培养基:ms固体培养基+6-苄氨基嘌呤(6-ba)1mg/l+萘乙酸(naa)0.5mg/l+羧卞青霉素(carb)500mg/l;
筛选培养基逐渐降低筛选压(继代培养3~4代中,按照筛选培养基1-2-3-4的顺序,每隔两周更换一种培养基即继代一次,直至分化出的抗性芽长到2-3cm。):
筛选培养基1:ms固体培养基+6-苄氨基嘌呤(6-ba)1mg/l+萘乙酸(naa)0.5mg/l+350mg/lcarb+12mg/lhyg,
筛选培养基2:ms固体培养基+6-苄氨基嘌呤(6-ba)1mg/l+萘乙酸(naa)0.5mg/l+300mg/lcarb+10mg/lhyg,
筛选培养基3:ms固体培养基+6-苄氨基嘌呤(6-ba)1mg/l+萘乙酸(naa)0.3mg/l+250mg/lcarb+8mg/lhyg,
筛选培养基4:ms固体培养基+6-苄氨基嘌呤(6-ba)1mg/l+萘乙酸(naa)0.1mg/l+200mg/lcarb+8mg/lhyg;
生根培养基:ms固体培养基+潮霉素(hyg)8mg/l。
实施例3.将转pmdc32-amicmkic基因抗性植株进行分子检测(pcr、荧光定量rt-pcr)呈阳性,获得转基因菊花株系
1)pcr检测
将载体35s-amicmkic和片段b作为检测目标,目的片段分别长475bp和176bp,引物序列如下:
35s-f:5′-gacgcacaatcccactatcc-3′(seqidno.10)
iii-f:5′-gaagactagacgtaatcacgttttcacaggtcgtgatatg-3′(seqidno.6)
ii-r:
5′-gaaggctagacgtaaacacgttatcaaagagaatcaatga-3′(seqidno.5)
分别以潮霉素抗性植株和野生型植株dna为模板,以35s-f/ii-r和iii-f/ii-r为引物,进行pcr检测。
扩增体系为:1μldna模板,2.5μl10×pcrbuffer,2μldntp,taq酶0.3μl,正反引物各1μl,去离子水补足体积至25μl。
扩增条件为:94℃预变性4min,94℃变性30s,55℃退火30s,72℃延伸1min,35个循环;72℃延伸10min。
扩增产物进行琼脂糖凝胶电泳检测分析(如图5)。图中可以看到,人工干扰植株均可扩增出与pmdc32-amicmkic质粒的阳性对照相同的特异条带,野生型植株没有扩增出条带。
2)荧光定量rt-pcr检测
分别提取抗潮霉素植株叶片及野生型植株叶片rna,反转录成cdna,用荧光定量rt-pcr对cmkic基因的表达量进行检测。按照荧光定量试剂盒(
上游引物cmkic-rt-f:5′-gctagcggaccaggaaagtg-3′(seqidno.11)
下游引物cmkic-rt-r:5′-tcattccttccatacccaaaattc-3′(seqidno.12)
以ef1α扩增的基因片段为内标,片段长度为151bp,引物序列:
上游引物ef1α-f:5′-ttttggtatctggtcctggag-3′(seqidno.13)
下游引物ef1α-r:5′-ccattcaagcgacagactca-3′(seqidno.14)
根据荧光定量rt-pcr检测结果(图6),与野生型相比,转pmdc32-amicmkic的株系基因表达量有所降低,株系94和95表达量明显较低。证实pmdc32-amicmkic已经导入菊花基因组dna并表达。
实施例4.转基因植株后代的抗病性分析
选取6~8叶龄的野生型菊花(wt)和转基因菊花(94,95)的扦插苗作为接种处理的材料。
病原菌链格孢菌的接种方法为菌丝富集接种法:在pda(potatodextroseagar)培养基上培养链格孢菌4~5d,然后从培养基边缘取10个直径约4mm的菌饼,在组织磨样机中充分研磨后转移到pdb(potatodextrosebroth)液体培养基中,25℃,200rpm培养2d。每1mlpdb菌丝富集成一个菌球,用毛笔接种在第三片完全展开的叶片背面,每片叶两个接种点。接种后的幼苗放置在人工培养箱中,在25℃、高湿状态下黑暗培养2d。每个株系设置10株重复,接种后2d取下接种的叶片拍照并统计发病情况。使用imagej软件测量叶片正面的产孢面积,试验数据利用spss19.0软件进行差异分析和duncan多重比较。
人工接种黑斑病菌试验表明,转基因菊花植株的产孢面积减少了50%以上,转基因菊花植株对黑斑病菌抗性提高。如图7和表1所示,接种2d后,转基因植株的产孢面积显著小于野生型植株。由此可见,转基因株系具有明确的抗病性。
表1野生型及转基因菊花植株接种黑斑病菌后产孢面积(2d)
序列表
<110>南京农业大学
<120>一种通过人工干扰提高菊花黑斑病抗性的方法
<160>14
<170>siposequencelisting1.0
<210>1
<211>375
<212>dna
<213>菊花‘神马’(chrysanthemummorifolium'jinba')
<400>1
atggaggaagaaaaacaataccaagacttacttcctgtgatggcggaaaagctagacgta60
aacacgtttatcgatgagctatgtggcggttttcgcctgctagcggaccaggaaagtggc120
ctgatcacacccgaaagcttgaggaaaaattcaggaattttgggtatggaaggaatgagt180
aaagaggaatcagagaatatggttagagaaggagacttggatggtgatggatgtcttaat240
gagaccgagttttgtatactaatggttagacttagtcctgaaatgatgcaagatgctgat300
ttgtggttagagaaggctattcagcaagagctcgacaaatcgtcttcttcatcttcttcg360
acgttggataatata375
<210>2
<211>701
<212>dna
<213>人工序列(artificialsequence)
<400>2
ctgcaaggcgattaagttgggtaacgccagggttttcccagtcacgacgttgtaaaacga60
cggccagtgaattgtaatacgactcactatagggcgaattgggtaccgggccccccctcg120
aggtcgacggtatcgataagcttgatatcgaattcctgcagccccaaacacacgctcgga180
cgcatattacacatgttcatacacttaatactcgctgttttgaattgatgttttaggaat240
atatatgtagaagactagacgtaatcacgttttcacaggtcgtgatatgattcaattagc300
ttccgactcattcatccaaataccgagtcgccaaaattcaaactagactcgttaaatgaa360
tgaatgatgcggtagacaaattggatcattgattctctttgataacgtgtttacgtctag420
ccttctctcttttgtattccaattttcttgattaatctttcctgcacaaaaacatgcttg480
atccactaagtgacatatatgctgccttcgtatatatagttctggtaaaattaacatttt540
gggtttatctttatttaaggcatcgccatggggggatccactagttctagagcggccgcc600
accgcggtggagctccagcttttgttccctttagtgagggttaatttcgagcttggcgta660
atcatggtcatagctgtttcctgtgtgaaattgttatccgc701
<210>3
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>3
taacgtgtttacgtctagcct21
<210>4
<211>40
<212>dna
<213>人工序列(artificialsequence)
<400>4
gataacgtgtttacgtctagccttctctcttttgtattcc40
<210>5
<211>40
<212>dna
<213>人工序列(artificialsequence)
<400>5
gaaggctagacgtaaacacgttatcaaagagaatcaatga40
<210>6
<211>40
<212>dna
<213>人工序列(artificialsequence)
<400>6
gaagactagacgtaatcacgttttcacaggtcgtgatatg40
<210>7
<211>40
<212>dna
<213>人工序列(artificialsequence)
<400>7
gaaaacgtgattacgtctagtcttctacatatatattcct40
<210>8
<211>25
<212>dna
<213>人工序列(artificialsequence)
<400>8
ctgcaaggcgattaagttgggtaac25
<210>9
<211>28
<212>dna
<213>人工序列(artificialsequence)
<400>9
gcggataacaatttcacacaggaaacag28
<210>10
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>10
gacgcacaatcccactatcc20
<210>11
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>11
gctagcggaccaggaaagtg20
<210>12
<211>24
<212>dna
<213>人工序列(artificialsequence)
<400>12
tcattccttccatacccaaaattc24
<210>13
<211>21
<212>dna
<213>人工序列(artificialsequence)
<400>13
ttttggtatctggtcctggag21
<210>14
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>14
ccattcaagcgacagactca20
- 还没有人留言评论。精彩留言会获得点赞!