一株自凝絮嗜盐菌及其应用的制作方法
本发明属于工业生物技术领域,涉及一株具有自凝絮特性的嗜盐菌及其工业生物技术应用。
背景技术:
工业生物技术广泛应用于生物基化学品、生物基材料、生物燃料、生物环保和酶制剂生产。近年来随着绿色发展理念的不断深入,工业生物技术已经成为我国新一轮科技革命和产业变革的焦点,在我国科技创新战略中的地位和重要性稳步提升。
微生物是工业生物技术的核心,是支撑生物制造产业发展的三大支柱之一,也是决定生产成本的关键因素。微生物的特性决定其培养条件、发酵工艺和后期分离程序。在大规模生物发酵制造中,微生物的无菌纯培养以及菌体的离心分离往往是影响生产工艺和生产成本的重要因素。
现有工业生物技术存在许多缺点:易发生微生物污染,对生物反应器、操作人员、发酵条件和发酵程序要求十分严格,微生物生长缓慢,原材料价格昂贵,底物到产物的转化率低,生产过程难以连续,产品分离纯化困难,大量消耗淡水和能源等。这些缺点导致工业生物技术生产成本较高,无法与以低廉的石油为基础的传统化学工业竞争。因此,迫切需要开发能够克服这些缺点的新型工业生物技术。尽管已在尝试开发能够耐受中高盐浓度的嗜盐菌来合成人类需要的化合物,但适用于发酵生产的菌株非常有限,性能优良的菌株则更少。
技术实现要素:
本发明旨在解决现有工业大规模生物发酵中下游工艺中产生的能耗高、产率低以及生产过程中的废水排放污染环境等诸多问题。基于该问题,本发明的发明人致力于筛选在适宜环境下具有自凝絮和自沉降特性的微生物,其在适宜的盐浓度下能够发生自凝絮和自沉降,便可以实现下层自沉降的细菌菌体与上清的分离,分离之后的细菌菌体经洗涤之后用于进一步处理,洗涤产生的含盐废水可加入分离的上清中,用于下一轮微生物的发酵培养。由于在发酵培养过程中可以省略常规微生物发酵工艺中需要的离心以便分离菌体和上清的工序,可以高效并且低成本地实现微生物培养、产物合成、废水再利用,从而实现工业大规模生物发酵培养微生物的目标。
(一)
在一个方面,本发明涉及一种具有自凝絮特性的盐单胞菌halomonasaydingkolgenesism1,其在中国微生物菌种保藏管理委员会普通微生物中心的保藏编号为cgmccno.19880。
(二)
在另一方面,本发明涉及pha的生产方法,其中该方法以盐单胞菌(halomonasaydingkolgenesism1)作为生产菌进行培养和发酵来生产pha。
在上述pha的生产方法中,pha可以是短链pha或者中长链pha。具体地,pha可以是聚-3-羟基丁酸酯(p3hb,其是较常见的聚羟基脂肪酸酯,也往往简写为phb)、聚-4-羟基丁酸酯(p4hb)、聚-3-羟基丙酸酯(p3hp)或聚-3-羟基戊酸酯(p3hv)、聚(3-羟基丁酸酯-co-4-羟基丁酸酯)(p3hb4hb)、聚(3-羟基丁酸酯-co-3-羟基戊酸酯)(p3hb3hv)或聚(3-羟基丁酸酯-co-4-羟基丁酸酯-co-3-羟基戊酸酯)(p3hb4hb3hv)等等、或其组合。
在上述的pha生产方法中用于培养halomonasaydingkolgenesism1的培养基可以根据该菌的特性结合本领域知晓的微生物培养技术来选择,通常其可包括营养源(如碳源和/或氮源)、能量源、必需矿物质、(任选的)缓冲剂和(任选的)ph指示剂。例如,可以采用本领域常规使用的矿物质培养基、lb培养基、mm培养基、mm-g培养基或牛肉膏蛋白胨等等,也可以是在这些培养基的基础上根据期望目的进行改良的培养基。培养基可以包含碳源和氮源,并且/或者也可以在发酵工序中将碳源和/或氮源补充添加到培养发酵体系中。碳源可以是例如糖类、油脂、有机酸及有机酸酯等等,但不限于此。氮源可以是有机氮源、无机氮源或其混合,例如牛肉膏、酵母膏、玉米浆粉、饼粕粉、尿素、蛋白胨、明胶、硫酸铵、氯化铵、硝酸钾等等,但不限于此。
用于生产pha的底物可以根据该菌的特性和代谢通路来适当的选择,例如,底物可以是各种碳源物质(在本文中“底物”可与碳源互换使用),如葡萄糖、蔗糖、果糖、糖蜜、脂肪酸(包括乙酸)、甘油、葡萄糖酸钠、纤维素水解液和淀粉等等,但不限于此。例如,在合成p3hb4hb的情况下,底物可以额外包含γ-丁内酯或者能转化成γ-丁内酯的物质。用于合成pha的底物可以预先添加在用于培养生产菌的培养基中,也可以在生产菌培养一段时间之后添加/补充到发酵体系中。
在上述的pha生产方法中,生产菌的初始发酵培养温度可以在4℃-45℃的范围内,优选地在25℃-40℃的范围内,更优选地,在35-40℃的范围内。例如,初始温度可以是25℃、26℃、27℃、28℃、29℃、30℃、31℃、32℃、33℃、34℃、35℃、36℃、37℃、38℃、39℃或40℃。
在上述的pha生产方法中,发酵体系的初始ph值可以在5.0-11.0、优选8.0-10.0的范围内,例如5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5、10.0、10.5、或11.0。
在上述的pha生产方法中,发酵体系的初始溶氧可以在5%-100%的范围内,例如5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或99%、100%。
上述的pha生产方法可以以分批发酵的方式进行,也可以以连续发酵或者补料分批发酵的方式进行。发酵可以根据情况任选地执行期望的时长,例如12小时至120小时,比如24小时、48小时、60小时、72小时等等,但不限于此,本领域技术人员可以视具体情况适当地选择发酵时间。这些发酵方式为本领域技术人员所熟知,本领域技术人员可以根据期望的目的和实验条件适当地选择任一种发酵方式来执行本发明的方法。
具体地,生产pha的方法可以包括以下步骤:
(1)将嗜盐菌halomonasaydingkolgenesism1cgmccno.19880菌株的种子液接种到含初始发酵培养基的容器中进行培养,其中用于合成pha的底物包含在初始发酵培养基中,或者在后续的步骤中添加到发酵培养基中;
任选地进行或者不进行以下步骤(2)或(3),
(2)向上述容器中进行补入补料培养基,继续培养发酵;
(3)在培养发酵一段时间之后停止发酵,让菌体静置沉降,并将沉降的菌体转移出发酵罐,补充适量的培养基继续发酵;该步骤可以进行一次或重复进行多次;
(4)收集培养物,进行后续纯化操作。
上述生产pha的方法中步骤(1)中的培养时间可以是8-16小时(在仅进行分批发酵的情况下,步骤(1)的培养时间可以持续更长时间,例如8-72小时、12-60小时、24-48小时等)。步骤(2)中培养发酵的持续时间可以是12-72小时,如24小时、48小时、60小时等等。步骤(3)中每次培养发酵的持续时间可以是12-72小时,如24小时、48小时、60小时等等,菌体静置时间可以是0.5分钟以上、1分钟以上、2分钟以上、5分钟以上、10分钟以上、1小时以上,但不限于此,例如,可以将菌体静置1-5分钟。
在步骤(4)中,可通过离心或者静置分离出沉淀和上清,将沉淀物或者上清用于进行后续的产物纯化。
在上述的pha生产方法中,初始发酵培养基和补料培养基在添加到发酵体系之前,可以进行灭菌处理,也可以不进行处理直接添加到发酵体系中。并且,发酵体系可以维持在开放式的免无菌条件(即,可以直接暴露于环境中,不需要采用避免杂菌污染的封闭发酵条件)下,也可以维持为避免杂菌污染的封闭条件下。
在上述的pha生产方法中,初始发酵培养基和补料培养基可以由本领域技术人员根据盐单胞菌的特性而适当的选择。
具体地,作为示例,每1l初始发酵培养基可以包含:5g-200g氯化钠、5g-100g葡萄糖、0g-30g尿素、2g-100g玉米浆粉、0.01g-5g硫酸镁、0g-10g磷酸二氢钾、10-100ml微量元素ⅰ和0.1-10ml微量元素ⅱ,其中:
每升微量元素ⅰ包含如下成分:1g-10g柠檬酸铁铵、1g-5g二水合氯化钙,用0.5mol/l盐酸水溶液补足至1升;
每升微量元素ⅱ包含如下成分:50mg-200mg七水合硫酸锌、5mg-50mg四水合氯化锰、50mg-500mg硼酸、30mg-400mg六水合氯化钴、3mg-30mg五水合硫酸铜、5mg-50mg六水合氯化镍、10mg-50mg二水合钼酸钠,将这些物质混合后用0.5mol/l盐酸水溶液补足至1升。
进一步地,仅作为示例,在上述的pha生产方法中,相对于1升初始发酵培养基中,氯化钠的量可以为,例如10g、15g、20g、30g、40g、50g或60g,葡萄糖的量可以是,例如,5g、30g、60g或100g,尿素的量可以是,例如,0、3g、6g、9g、12g或20g,玉米浆粉的量可以是2g、5g、10g、30g、50g、70g或100g,硫酸镁的量可以是,例如,0.1g、0.5g、1g、3g或5g,磷酸二氢钾的量可以是,例如,0.5g、2g、5g、10g或20g,微量元素ⅰ的体积可以是,例如,1ml、5ml、10ml或30ml,微量元素ⅱ的体积可以是,例如,0.1ml、1ml、3ml、5ml或10ml。
在上述生产pha的方法中,相对于1升所述微量元素ⅰ,柠檬酸铁铵的量可以是2g、5g或10g、二水合氯化钙的量可以是1g、2g或5g。
在上述生产pha的方法中,相对于1升微量元素ⅱ,七水合硫酸锌的量可以是50mg、100mg或200mg,四水合氯化锰的量可以是10mg、30mg或50mg,硼酸的量可以是100mg、300mg或500mg,六水合氯化钴的量可以是50mg、200mg或400mg,五水合硫酸铜的量可以是3mg、10mg或30mg,六水合氯化镍的量可以是5mg、20mg或50mg,二水合钼酸钠的量可以是10mg、30mg或50mg。
在上述方法采用补料分批发酵的方式进行的情况下,分段补料到发酵体系中的补料培养基可以包含以下中的一种或多种:
补料培养基i:每升补料培养基可包含葡萄糖0g-500g、0-50g玉米浆粉和尿素0g-50g;
补料培养基ii:每升补料培养基可包含葡萄糖0g-500g和氯化铵0.1g-10g;和
补料培养基iii:每升补料培养基可包含葡萄糖0g-500g。
进一步地,相对于每1l补料培养基i,其中的葡萄糖的量可以是0g、100g、200g、300g、400g或500g,尿素的量可以是0g、5g、10g、20g、30g、40g或50g。相对于每1l补料培养基ii,其中的葡萄糖的量可以是0g、100g、200g、300g、400g或500g,氯化铵的量可以是0.1、0.5g、1g、2g、3g、4g、5g或10g。相对于每1l补料培养基iii,其中葡萄糖的量可以是0g、50g、100g、200g、300g、400g或500g。
补料培养基可以根据发酵情况适当地补加,例如可以每隔4小时补加一次。
分批补料发酵和连续发酵方法中采用的初始培养基和补料培养基如前文所限定,并且可以适当地进行调整,这些情形都涵盖在本发明的范围内。
(三)
在另一方面,本发明涉及生产四氢嘧啶的方法,其中该方法以盐单胞菌(halomonasaydingkolgenesism1)作为生产菌进行培养和发酵来生产四氢嘧啶。
例如,生产四氢嘧啶的方法可以包括以下步骤:
(1)将嗜盐菌halomonasaydingkolgenesism1cgmccno.19880菌株的种子液接种到含初始发酵培养基的容器中进行培养,其中用于合成四氢嘧啶的底物包含在初始发酵培养基中,或者在后续的步骤中添加到发酵培养基中;
任选地进行或者不进行以下步骤(2)或(3),
(2)向上述容器中进行补入补料培养基,继续培养发酵;
(3)在培养发酵一段时间之后停止发酵,让菌体静置沉降,并将沉降的菌体转移出发酵罐,补充适量的培养基继续发酵;该步骤可以进行一次或重复进行多次;
(4)收集培养物,进行后续纯化操作。
在生产四氢嘧啶的方法中,发酵条件(如发酵温度、ph、溶氧等等)和发酵方式(分批发酵、补料分批发酵或连续发酵)、发酵工序(发酵时长、补料工序等)等可以如在前文第(二)部分中所限定。
用于生产四氢嘧啶的底物可以根据该菌的特性和代谢通路来适当的选择,例如,底物可以是葡萄糖、蔗糖、果糖、糖蜜、脂肪酸(包括乙酸)、甘油、葡萄糖酸钠、纤维素水解液和淀粉等等,但不限于此。用于合成四氢嘧啶的底物可以预先添加在用于培养生产菌的培养基中,也可以在生产菌培养一段时间之后添加/补充到发酵体系中。
在上述的四氢嘧啶生产方法中采用的培养基可以根据该菌的特性结合本领域知晓的微生物培养技术来选择,通常其可包括营养源、能量源、必需矿物质、缓冲剂和(任选的)ph指示剂。
进一步地,发酵中采用的培养基可以包括初始发酵培养基和补料培养基,这些培养基可以在加入到发酵体系之前可以进行灭菌,也可以不进行灭菌直接添加到发酵体系中。并且,发酵体系可以维持在开放式的免灭菌条件下,也可以维持为封闭条件。
初始发酵培养基的成分和补料培养基的成分可以如前文第(二)部分中关于初始发酵培养基和补料培养基所描述的。
进一步地,补料培养基可以在其基础上进行适当调整,以有利于四氢嘧啶的合成。作为示例,补料培养基可以包含以下中的一种或多种:
补料培养基i:每升补料培养基可包含葡萄糖0g-500g、玉米浆粉0g-50g、尿素1g-50g。
补料培养基ii:每升补料培养基可包含葡萄糖0g-500g、玉米浆粉0g-30g、尿素1g-40g。
更具体地,每升补料培养基i中包含的葡萄糖的量可以是0g、100g、200g、300g、400g或500g,玉米浆粉的量可以是0g、1g、10g、20g、30g、40g或50g,尿素的量可以是5g、10g、20g或50g。
更具体地,每升补料培养基ii中包含的葡萄糖的量可以是0g、100g、200g、300g、400g或500g,玉米浆粉的量可以是0g、1g、10g、20g或30g,尿素的量可以是5g、10g、20g或40g。
(四)
在另一方面,本发明涉及联合生产pha和四氢嘧啶的方法,其中该方法以盐单胞菌(halomonasaydingkolgenesism1)作为生产菌进行培养和发酵来联合生产pha和四氢嘧啶。
在生产四氢嘧啶的方法中,发酵条件(如发酵温度、ph、溶氧等等)和发酵方式(分批发酵、补料分批发酵或连续发酵)、发酵工序(发酵时长、补料工序等)等可以如在前文第(二)和第(三)部分中所限定。
用于生产四氢嘧啶的底物可以根据该菌的特性和代谢通路来适当的选择,例如,底物可以是葡萄糖、蔗糖、果糖、糖蜜、脂肪酸(包括乙酸)、甘油、葡萄糖酸钠、纤维素水解液和淀粉,但不限于此。在合成p3hb4hb的情况下,底物可以额外包含γ-丁内酯或者能转化成γ-丁内酯的物质。用于合成pha和四氢嘧啶的底物可以预先添加在用于培养生产菌的培养基中,也可以在生产菌培养一段时间之后补充到培养基中。
在上述的四氢嘧啶生产方法中采用的培养基可以根据该菌的特性结合本领域知晓的微生物培养技术来选择,通常其可包括营养源、能量源、必需矿物质、缓冲剂和(任选的)ph指示剂。
进一步地,发酵中采用的培养基可以包含初始发酵培养基和补料培养基,这些培养基可以在加入到发酵体系之前可以进行灭菌,也可以不进行灭菌直接添加到发酵体系中。并且,发酵体系可以维持在开放式的免灭菌条件下,也可以维持为封闭条件。
初始发酵培养基的成分和补料培养基的成分可以如前文第(二)和第(三)部分中关于初始发酵培养基和补料培养基所描述的。进一步地,补料培养基可以在其基础上进行进一步调整,以有利于四氢嘧啶和pha的联产。作为示例,补料培养基可以包含以下中的一种或多种:
补料培养基i:每升补料培养基可包含葡萄糖0g-500g、玉米浆粉0g-50g、尿素1g-50g。
补料培养基ii:每升补料培养基可包含葡萄糖0g-500g、玉米浆粉0g-30g、尿素1g-40g。
更具体地,每升补料培养基i中包含的葡萄糖的量可以是0g、100g、200g、300g、400g或500g,玉米浆粉的量可以是0g、1g、10g、20g、30g、40g或50g,尿素的量可以是5g、10g、20g或50g。
更具体地,每升补料培养基ii中包含的葡萄糖的量可以是0g、100g、200g、300g、400g或500g,玉米浆粉的量可以是0g、1g、10g、20g或30g,尿素的量可以是5g、10g、20g或40g。
(五)
在另一方面,鉴于上述盐单胞菌的优良特性(自絮凝特性、耐高盐、在发酵中可以省略高温高压灭菌步骤并可以在开放环境下进行发酵等等),本发明的盐单胞菌可以用作合成生物学中的底盘细胞,通过向该工作平台中引入各种功能化的生物组件或其组合和/或对该底盘细胞自身的基因组进行改造,从而使细胞具备期望的特性(比如提供更高的产物产量、合成不同产物的能力等等)。
因此,本发明还涉及盐单胞菌halomonasaydingkolgenesism1用作底盘细胞的用途。例如,可以通过将orfz基因(但不限于该基因)引入到该菌的基因组中,以构建能够合成聚(3-羟基丁酸酯-co-4-羟基丁酸酯)(p3hb4hb)的菌株。
进一步地,本发明还涉及通过以盐单胞菌halomonasaydingkolgenesism1作为底盘细胞进行改造而得到的重组菌。优选地,该重组菌具有自絮凝特性。例如,可以通过将orfz基因引入到该菌的基因组中,以构建能够合成聚(3-羟基丁酸酯-co-4-羟基丁酸酯)(p3hb4hb)的菌株。具体地,该重组菌可以是halomonasaydingkolgenesism1-orfz。优选该重组菌具有自絮凝特性。
此外,本发明还涉及获得重组菌特别是具有自絮凝特性的重组菌的方法,其中该方法以盐单胞菌halomonasaydingkolgenesism1作为底盘细胞进行改造而得到。
本发明不限于以上方面。本领域技术人员可以根据本申请的公开内容,结合本领域知晓的知识,将其用于合成其他的应用中。由于该单胞菌是嗜盐菌,因此在其发酵中可以利用海水替代淡水(或配置含盐培养基比如氯化钠培养基),发酵工序中的过程水也可以循环利用。由于其能够耐受苛刻的生长环境,相较于其他常规生产菌具有更好的生存能力,因此用于发酵工序的培养基不需要在高温高压下灭菌,并且在发酵过程中发酵体系也无需保持在无杂菌的环境下,因此无需使用常规采用的成本高昂的不锈钢发酵系统,而可以使用价格低廉的塑料、陶瓷甚至水泥罐体或管道进行发酵。此外,由于该菌具有自絮凝特性,因此可以容易地通过静置而实现菌体与上清的分离,省略离心,由此大大提高生产效率,进一步降低生产成本。
附图说明
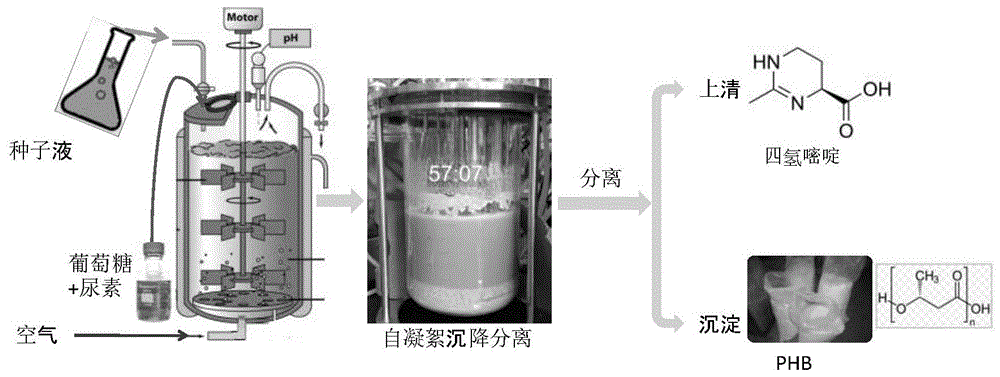
图1示例性地说明发酵联产phb和四氢嘧啶的工序。
具体实施方式
定义
本文所提及的pha是指聚羟基脂肪酸酯,其根据单体组成可以分为均聚物和共聚物。根据单体的碳原子数,本发明的pha可以是短链pha(即,单体为c3-c5的羟基脂肪酸)或者中长链pha(即,单体为c6-c16的羟基脂肪酸),但不限于此。在本发明的一些实施方式中,pha可以是均聚物,包括但不限于聚羟基丙酸酯、聚羟基丁酸酯、聚羟基戊酸酯等等,例如,聚-3-羟基丁酸酯(p3hb)、聚-4-羟基丁酸酯(p4hb)、聚-3-羟基丙酸酯(p3hp)或聚-3-羟基戊酸酯(p3hv)等。在本发明的一些实施方式中,pha可以是共聚物如二聚物、三聚物等,但不限于此,例如,共聚物可以是羟基丙酸酯与羟基丁酸酯的共聚物;羟基丙酸酯与羟基戊酸酯的共聚物;羟基丁酸酯与羟基戊酸酯的共聚物;羟基丙酸酯、羟基丁酸酯、羟基戊酸酯三者的共聚物等等。更具体地,在本发明的一些实施方式中,pha可以是聚(3-羟基丁酸酯-co-4-羟基丁酸酯)(p3hb4hb)、聚(3-羟基丁酸酯-co-3-羟基戊酸酯)(p3hb3hv)或聚(3-羟基丁酸酯-co-4-羟基丁酸酯-co-3-羟基戊酸酯)(p3hb4hb3hv)、或其组合等等。在本发明的一些实施方式中,pha可以是p3hb(即,聚β-羟基丁酸酯或聚3-羟基丁酸酯)。在本发明的另一些实施方式中,pha可以是p3hb3hv(即,3-羟基丁酸3-羟基戊酸共聚物)。另外,本文所提及的pha可以表示一种pha或多种pha的组合。
以下结合具体实施例对本发明进行进一步阐述说明,但这些实施例并不对本发明做任何形式的限定,仅以具体实施例的方式来帮助描述和理解本发明。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1:菌株的分离与鉴定
一、分离
从新疆盐湖艾丁湖中取得土样和水样,从中筛选分离菌株。对生长良好的菌落进行傅立叶红外(fi-ir)检测其是否积累pha。得到10株可产pha的嗜盐菌,其中一株命名为m1。
分离纯化菌种的40-lb培养基:氯化钠40g/l,蛋白胨10g/l,酵母粉1g/l,ph值约为8.5;
判断是否可积累pha的培养基为添加2%琼脂的固体葡萄糖矿物(mm-g)培养基。
mm-g培养基:
1升mm-g培养基按照如下方法制备:将20g葡萄糖、40g氯化钠、0.5g酵母粉、2g硫酸铵、0.2g硫酸镁、1.5g磷酸二氢钾、9.65g十二水合磷酸氢二钠、10ml微量元素ⅰ和1ml微量元素ⅱ混合,用去离子水补足体积至1升。
1升微量元素ⅰ按照如下方法制备:将柠檬酸铁铵5g、二水合氯化钙2g和0.5mol/l盐酸水溶液混合,用0.5mol/l盐酸水溶液补足至1升;
1升微量元素ⅱ按照如下方法制备:将七水合硫酸锌100mg、四水合氯化锰30mg、硼酸300mg、六水合氯化钴200mg、五水合硫酸铜10mg、六水合氯化镍20mg、二水合钼酸钠30mg和0.5mol/l盐酸水溶液混合,用0.5mol/l盐酸水溶液补足至1升。
二.鉴定
1、形态鉴定
活化菌种m1,过夜培养,稀释至10-3,取100μl涂布于lb平板(组分同分离用的40-lb培养基),37℃培养箱培养24-48小时,观察菌落形态:菌落呈圆形,直径约0.5-1.0mm,边缘光滑,白色半透明。在显微镜下(100倍放大),菌体呈棒状。
2、生理生化鉴定
对菌株进行革兰氏染色鉴定,结果为革兰氏阴性菌。
3、分子鉴定
检测该菌株的16srdna序列,扩增16srdna序列的引物为通用引物:16f5’-ttgctacccgctgacgagc-3’(seqidno:1),16r5’-ccgccttcgccactggtatt-3’(seqidno:2)。测得的16srdna序列如seqidno:3所示。
综合以上鉴定结果,将该菌株鉴定为嗜盐菌(halomonassp.)。该菌株已于2020年5月26日保藏于中国微生物菌种保藏管理委员会普通微生物中心(简称cgmcc,地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,邮编100101),保藏号为cgmccno.19880。菌株名称为halomonasaydingkolgenesism1。
三、性能检测
对菌株halomonasaydingkolgenesism1性能进行检测,培养基为40-lb(组分同分离用的lb培养基),37℃条件下200转/分摇床培养48小时,测定其od600和细胞干重。
改变培养基中氯化钠浓度,进行氯化钠浓度梯度实验。
改变培养温度,进行温度梯度实验。
实验设3次重复。结果表明,菌株halomonasaydingkolgenesism1是一种适应范围很广的中度嗜盐菌,能在5-200g/l氯化钠条件下生长,最适氯化钠浓度为30-40g/l;最低生长温度为4℃,最高生长温度为45℃,最适生长温度为35-40℃;最低生长ph为5.0,最高生长ph为11.0,最适ph为8.0-10.0。
实施例2:利用halomonasaydingkolgenesism1不灭菌连续发酵生产phb(即p3hb)
(1)种子液的培养
一级和二级种子液培养基均为40-lb培养基,每升40-lb培养基组成为:40g氯化钠、10g蛋白胨、5g酵母粉,用蒸馏水补足至1升,121℃灭菌20分钟。
取20μl在-80℃甘油管保存的嗜盐菌halomonasaydingkolgenesism1cgmccno.19880接入到20ml培养基,在37℃、200转/分条件下过夜培养,得到一级种子培养液。一级种子培养液按5%接种量接入装有100ml培养基的500ml三角瓶中,共接3瓶(共计约300ml),37℃、200转/分培养约12小时,得到二级种子培养液。
(2)发酵过程与控制
将300mlod600约为2.5的过夜培养种子液接种到3l初始发酵培养基(氯化钠120g、葡萄糖60g、尿素6g、玉米浆粉48g、硫酸镁0.6g、磷酸二氢钾10.5g、微量元素ⅰ30ml和微量元素ⅱ3ml)中,然后进行培养。
微量元素ⅰ和微量元素ii包含如下成分:
1升微量元素ⅰ按照如下方法制备:将柠檬酸铁铵5g、二水合氯化钙2g和0.5mol/l盐酸水溶液混合,用0.5mol/l盐酸水溶液补足至1升;
1升微量元素ⅱ按照如下方法制备:将七水合硫酸锌100mg、四水合氯化锰30mg、硼酸300mg、六水合氯化钴200mg、五水合硫酸铜10mg、六水合氯化镍20mg、二水合钼酸钠30mg和0.5mol/l盐酸水溶液混合,用0.5mol/l盐酸水溶液补足至1升。
在整个发酵过程中,以1–1.15vvm的流速注入过滤空气来提供溶解氧(do%),溶解氧保持在空气饱和度的30%左右,ph值通过添加5m氢氧化钠自动调节,保持在8.5左右。当第一次检测到残留葡萄糖浓度低于6g/l时,添加补料培养基i(250g/l葡萄糖、5g/l玉米浆粉和12g/l尿素),然后在第14h时添加补料培养基ii(feed-ii)(240g/l葡萄糖和2.22g/l氯化铵),在第22h时添加补料培养基iii(feed-iii)(320g/l葡萄糖)。在整个发酵过程中将葡萄糖含量维持在5-15g/l。
(3)连续培养
在停止向发酵体系供气并停止搅拌后将其静置1分钟,待菌体完成自沉降后移出发酵罐,体积约为500ml,进行后续分离提取过程。向发酵罐中加入500ml初始发酵培养基,然后开始第二次连续培养。以1–1.15vvm的流速注入过滤空气来提供溶解氧(do%),溶解氧保持在空气饱和度的30%左右,ph值通过添加5m氢氧化钠自动调节,保持在8.5左右。当第一次检测到残留葡萄糖浓度低于6g/l时,添加补料培养基i(250g/l葡萄糖、5g/l玉米浆粉和12g/l尿素),然后在第14h时添加补料培养基ii(feed-ii)(240g/l葡萄糖和2.22g/l氯化铵),在第22h时添加补料培养基iii(feed-iii)(320g/l葡萄糖)。在整个发酵过程中将葡萄糖含量维持在5-15g/l。在37℃开放(非无菌)和连续条件下,本研究共收集菌体6次。发酵结束后,利用菌株的自絮凝特性经静置实现菌体与上清的分离,从而用于进一步的产物收集纯化。
(4)产物含量测定
phb含量(%)定义为phb产量与细胞干重(cdw)的比值。为测定phb含量,将30ml培养物置于预先称重的50ml试管中,10000×g室温下离心15min。测量细胞干重前先将菌体冷冻干燥24小时,然后在40mg冻干细胞中加入2ml包含3%(v/v)浓硫酸(98%,w/w)和1g/l苯甲酸的酯化液及2ml氯仿,100℃下酯化约4h。对应的标准品同样处理作为参照。甲醇分解后,样品在gc-2014气相色谱仪(日本岛津)上测定phb含量。
由于连续发酵第二次菌体收集只需约24h,而分批发酵时达到相近的菌体重量需要约48h,因此在相同的时间内,连续发酵可收获更多的培养物。
表1.halomonasaydingkolgenesism1在7.5升发酵罐中连续发酵生产phb产量
从表1的数据我们可以确定,本发明的halomonasaydingkolgenesism1在开放的非无菌发酵条件下能够高效地生产phb。而且,采用连续发酵的方式,可以在较短的时间内达到较高的phb产量。
(5)杂菌的检测
从发酵开始时计起,每隔1天取发酵液稀释至10-4,取100μl涂布于lb平板(配制同分离培养基),37℃培养箱培养24小时,观察菌落形态,每个平板挑选10个菌落进行pcr验证,确定不灭菌条件下发酵是否会染杂菌。
选取的两段序列为halomonasaydingkolgenesism1的高度保守序列。其中,两对引物分别为:16f5’-ttgctacccgctgacgagc-3’,16r5’-ccgccttcgccactggtatt-3’,片段长度为644bp;f25’-tttgtggcgaagttaacgcgataagt-3’(seqidno:4),r25’-ttcccctacggctaccttgttacga-3’(seqidno:5),pcr片段长度为671bp。
菌落形态和pcr验证结果都显示,发酵过程中并没有染菌,表明在非无菌的开放条件下进行连续发酵是可行的,这极大地降低了生产过程的能耗,降低了成本,简化了发酵过程。
实施例3:利用halomonasaydingkolgenesism1作为底盘细胞构建能够生产p3hb4hb的重组菌,并用该重组菌通过不灭菌连续发酵生产p3hb4hb
(1)重组菌halomonasaydingkolgenesism1-orfz的构建
orfz是4-羟基丁酰辅酶a转移酶的编码基因,来自克氏梭状芽胞杆菌的染色体。4-羟基丁酰辅酶a转移酶的作用是将4-羟基丁酸催化成4-羟基丁酰辅酶a。4-羟基丁酸可以由碳源底物经γ-丁内酯水解开环得到,而4-羟基丁酰辅酶a在pha聚合酶的催化作用下可聚合成4-羟基丁酸的聚合物,包括p4hb均聚物、p(3hb-co-4hb)共聚物等。因此,预期能够正常表达外源orfz基因的halomonasaydingkolgenesism1重组菌株具备合成p(3hb-co-4hb)的能力,下面进行相应的菌株合成和验证。
具体地,将orfz基因插入halomonasaydingkolgenesism1基因组g1位点的方法按照以下步骤进行:
①以pq41质粒(qin等人(2018)crispr/cas9editinggenomeofextremophilehalomonasspp.metabolicengineering)为模板,将guiderna序列设计在引物中,通过引物对f1和r1对pq41进行环状pcr扩增得到线性片段,再进行平末端连接,得到含有guiderna的质粒。
②以克氏梭状芽胞杆菌的染色体为模板,通过引物对f2’和r2’扩增,经纯化后获取orfz片段。
③利用porin启动子库(shen等人.(2018)promoterengineeringforenhancedp(3hb-co-4hb)productionbyhalomonasbluephagenesis.acssyntheticbiology),以启动子porin140为模板,通过引物对f3和r3扩增获取porin140启动子片段。
④在grna附近选取两段500个碱基作为同源臂。以halomonasaydingkolgenesism1基因组为模板,分别使用pcr的方法通过引物f4和r4扩增上游同源臂,通过f5和r5引物扩增下游同源臂。
⑤以①中得到的质粒为模板,通过引物f6、r6扩增获取质粒骨架片段。将上述片段通过gibson的方法组装到一起,构建质粒。
⑥使用接合转化的方法将含有cas9的氯霉素抗性的质粒pq08(qin等人.(2018)crispr/cas9editinggenomeofextremophilehalomonasspp.metabolicengineering)通过接合方式转到halomonasaydingkolgenesism1中,再将⑤中获得的质粒转入该菌中,在氯霉素,壮观霉素双抗的平板中培养一天,直至长出单菌落。
⑦验证。在插入位点上下游处设计一对引物,进行菌落pcr的验证,并通过测序进行进一步验证。
⑧挑选出测序正确的菌株,在无抗的种子培养液中培养,直到嗜盐菌完全丢掉质粒,得到的菌株命名为halomonasaydingkolgenesism1-orfz。
其中采用的引物序列为:
f1:gttttagagctagaaatagcaagttaaaataaggctagtcc(seqidno:6)
r1:ccaccgcgctggaggctaccactagtattata(seqidno:7)
f2’:gaggagaaatactagatggagtgggaagag(seqidno:8)
r2’:taaccgcctattcccctaaaatctcttttt(seqidno:9)
f3:ttagtgtgtggttttatgcctccacaccgc(seqidno:10)
r3:ctcttcccactccatctagtatttctcctc(seqidno:11)
f4:tttgaacccgggatgtgggcccatcgtcgt(seqidno:12)
r4:gcggtgtggaggcataaaaccacacactaa(seqidno:13)
f5:aaaaagagattttaggggaataggcggtta(seqidno:14)
r5:ccagtcacgacggcttggagcgcgttcgaa(seqidno:15)
f6:ttcgaacgcgctccaagccgtcgtgactgg(seqidno:16)
r6:acgacgatgggcccacatcccgggttcaaa(seqidno:17)。
4-羟基丁酸-辅酶a转移酶的基因序列如下所示:
>atggagtgggaagagatatataaagagaaactggtaactgcagaaaaagctgtttcaaaaatagaaaaccatagcagggtagtttttgcacatgcagtaggagaacccgtagatttagtaaatgcactagttaaaaataaggataattatataggactagaaatagttcacatggtagctatgggcaaaggtgaatatacaaaagagggtatgcaaagacattttagacataatgctttatttgtaggcggatgtactagagatgcagtaaattcaggaagagcagattatacaccttgttttttctatgaagtgccaagtttgtttaaagaaaaacgtttgcctgtagatgtagcacttattcaggtaagtgagccagataaatatggctactgcagttttggagtttccaatgactataccaagccagcagcagaaagtgctaagcttgtaattgcagaagtgaataaaaacatgccaagaactcttggagattcttttatacatgtatcagatattgattatatagtggaagcttcacacccattgttagaattgcagcctcctaaattgggagatgtagaaaaagccataggagaaaactgtgcatctttaattgaagatggagctactcttcagcttggaataggtgctataccagatgcggtacttttattcttaaagaacaaaaagaatttaggaatacattctgagatgatatcagatggtgtgatggaactggtgaaggcaggggttatcaataacaagaaaaagaccctccatccaggcaaaatagttgtaacatttttaatgggaacaaaaaaattatatgattttgtaaacaataatccaatggtagaaacttattctgtagattatgtaaataatccactggtaattatgaaaaatgacaatatggtttcaataaattcttgtgttcaagtagacttaatgggacaagtatgttctgaaagtataggattgaaacagataagtggagtgggaggccaggtagattttattagaggagctaatctatcaaagggtggaaaggctattatagctataccttccacagctggaaaaggaaaagtttcaagaataactccacttctagatactggtgctgcagttacaacttctagaaatgaagtagattatgtagttactgaatatggtgttgctcatcttaagggcaaaactttaagaaatagggcaagagctctaataaatatcgctcatccaaaattcagagaatcattaatgaatgaatttaaaaagagattttag(seqidno:18)。(2)种子液的培养
一级和二级种子液培养基均为40-lb培养基,每升40-lb培养基组成为:40g氯化钠、10g蛋白胨、5g酵母粉,用蒸馏水补足至1升,121℃灭菌20分钟。
取20μl在-80℃甘油管保存的嗜盐菌halomonasaydingkolgenesism1-orfz接入到20ml培养基一级种子液,在37℃、200转/分条件下过夜培养,得到一级种子培养液。一级种子培养液按5%接种量接入装有100ml培养基的500ml三角瓶中,共接3瓶(共计约300ml)共接3瓶300ml,37℃、200转/分培养约12小时,得到二级种子培养液。
(3)发酵过程与控制
将300mlod600约为2.5的过夜培养种子液接种到3l初始发酵培养基(氯化钠120g、葡萄糖60g、尿素6g、玉米浆粉48g、硫酸镁0.6g、磷酸二氢钾10.5g、微量元素ⅰ30ml和微量元素ⅱ3ml)中,然后进行培养。
微量元素ⅰ和微量元素ⅱ的成分同实施例1。
在整个发酵过程中,以1–1.15vvm的流速注入过滤空气来提供溶解氧(do%),溶解氧保持在空气饱和度的30%左右,ph值通过添加5m氢氧化钠自动调节,保持在8.5左右。当第一次检测到残留葡萄糖浓度低于6g/l时,添加补料培养基i(250g/l葡萄糖、5g/l玉米淀粉和12g/l尿素),然后在第14h时添加补料培养基ii(feed-ii)(240g/l葡萄糖和2.22g/l氯化铵),在第22h时添加补料培养基iii(feed-iii)(320g/l葡萄糖)。在整个发酵过程中将葡萄糖含量维持在5-15g/l。发酵过程在开放(非无菌)条件下进行。发酵结束后,利用菌株的自絮凝特性经静置实现菌体与上清的分离,进而用于进一步的产物收集纯化。
(4)连续培养
在停止供气并停止搅拌后将发酵体系静置1分钟,待菌体完成自沉降后移出发酵罐,体积约为500ml,进行后续分离提取过程。向发酵罐中加入500ml初始发酵培养基,然后开始第二次连续培养。以1–1.15vvm的流速注入过滤空气来提供溶解氧(do%),溶解氧保持在空气饱和度的30%左右,ph值通过添加5m氢氧化钠自动调节,保持在8.5左右。当第一次检测到残留葡萄糖浓度低于6g/l时,添加补料培养基i(250g/l葡萄糖、5g/l玉米浆粉和12g/l尿素),然后在第14h时添加补料培养基ii(feed-ii)(240g/l葡萄糖和2.22g/l氯化铵),在第22h时添加补料培养基iii(feed-iii)(320g/l葡萄糖)。在整个发酵过程中将葡萄糖含量维持在5-15g/l。
发酵培养时,γ-丁内酯的起始添加均在od600为100时,其中γ-丁内酯的总添加量为15g/l(以起始发酵体积计算),每两小时添加一次,一共添加10次。
在37℃开放(非灭菌)和连续条件下,本研究共收集菌体6次。
(5)产物含量测定
为测定p3hb4hb含量,将30ml培养物置于预先称重的50ml试管中,10000×g室温下离心15min。测量细胞干重前先将菌体冷冻干燥24小时,然后在40mg冻干细胞中加入2ml包含3%(v/v)浓硫酸(98%,w/w)和1g/l苯甲酸的酯化液及2ml氯仿,100℃下酯化约4h。对应的标准品同样处理做为参照。甲醇分解后,样品在gc-2014气相色谱仪(日本岛津)上测定p3hb4hb含量。
由于连续发酵第二次菌体收集只需约24h,相较于分批发酵,连续发酵能够在短时间内收获更多的培养物。
表2.halomonasaydingkolgenesism1-orfz在7.5升发酵罐中连续发酵生产p3hb4hb的产量
从表2的数据我们可以确定,本发明构建的halomonasaydingkolgenesism1-orfz在非灭菌的发酵条件下能够高效地生产p3hb4hb。而且,采用连续发酵的方式,可以在较短的时间内达到较高的p3hb4hb产量。
(6)杂菌的检测
从发酵开始时计起,每隔1天取发酵液稀释至10-4,取100μl涂布于lb平板(配制同分离培养基),37℃培养箱培养24小时,观察菌落形态,每个平板挑选10个菌落进行pcr验证,确定不灭菌条件下发酵是否染杂菌。
选取的两段序列为halomonasaydingkolgenesism1的高度保守序列。其中,两对引物分别为:16f5’-ttgctacccgctgacgagc-3’,16r5’-ccgccttcgccactggtatt-3’,片段长度为644bp;f25’-tttgtggcgaagttaacgcgataagt-3’,r25’-ttcccctacggctaccttgttacga-3’,pcr片段长度为671bp。
菌落形态和pcr验证结果显示,发酵过程中并没有染菌,表明在非无菌的开放条件下进行连续发酵是可行的,这极大地降低了生产过程的能耗,降低了成本,简化了发酵过程。
实施例4:利用halomonasaydingkolgenesism1不灭菌连续发酵生产四氢嘧啶
(1)种子液的培养
一级和二级种子液培养基均为40-lb培养基,每升40-lb培养基组成为:40g氯化钠、10g蛋白胨、5g酵母粉,用蒸馏水补足至1升,121℃灭菌20分钟。
取20μl在-80℃甘油管保存的嗜盐菌halomonasaydingkolgenesism1cgmccno.19880接入20ml培养基,在37℃、200转/分条件下过夜培养,得到一级种子培养液。一级种子培养液按5%接种量接入装有100ml培养基的500ml三角瓶中,共接3瓶(共计约300ml),37℃、200转/分培养约12小时,得到二级种子培养液。
将300mlod600约为2.5的过夜培养种子液接种到3l初始发酵培养基(氯化钠120g、葡萄糖60g、尿素6g、玉米浆粉48g、硫酸镁0.6g、磷酸二氢钾10.5g、微量元素ⅰ30ml和微量元素ⅱ3ml)中,然后进行培养。微量元素ⅰ和微量元素ii的成分同实施例1。
(2)发酵过程与控制
在整个发酵过程中,以1–1.15vvm的流速注入过滤空气来提供溶解氧(do%),溶解氧保持在空气饱和度的30%左右,ph值通过添加5m氢氧化钠自动调节,保持在8.5左右。当第一次检测到残留葡萄糖浓度低于6g/l时,添加补料培养基i(200g/l葡萄糖、8g/l玉米浆粉和32g/l尿素),然后在第14h时添加补料培养基ii(200g/l葡萄糖,4g/l玉米浆粉和28g/l尿素)。在整个发酵过程中将葡萄糖含量维持在5-15g/l。发酵过程在开放(非无菌)条件下进行。
(3)连续培养
halomonasaydingkolgenesism1菌株在停止供气并停止搅拌后静置1分钟,待菌体完成自沉降后移出发酵罐,体积约为500ml。向发酵罐中补充加入500ml初始发酵培养基,然后开始第二次连续培养。以1–1.15vvm的流速注入过滤空气来提供溶解氧(do%),溶解氧保持在空气饱和度的30%左右,ph值通过添加5m氢氧化钠自动调节,保持在8.5左右。当第一次检测到残留葡萄糖浓度低于6g/l时,添加补料培养基i(200g/l葡萄糖、8g/l玉米浆粉和32g/l尿素),然后在第14h时添加补料培养基ii(200g/l葡萄糖,4g玉米浆粉和28g/l尿素)。在整个发酵过程中将葡萄糖含量维持在5-15g/l。发酵结束后,利用菌株的自絮凝特性经静置实现菌体与上清的分离,进而用于进一步的产物收集纯化。
(4)四氢嘧啶含量测定
为测定四氢嘧啶含量,培养后菌体以6000rpm离心10min,用50mmkpi缓冲液(1l50mm的kpi溶液含有kh2po46.805g,使用koh调节ph至7)等速洗涤两次至培养基中,悬浮于80%(v/v)乙醇中,静置12小时以提取细胞内四氢嘧啶。将含有四氢嘧啶的细胞提取物过滤并在50℃下蒸发18h。将沉淀物重新悬浮在水/氯仿(1:1v/v)混合物中并剧烈混合;将氯仿层倾析,收集上层透明层并再次离心。用高效液相色谱法采用c18柱和乙腈与水(8:2)组成的流动相(流速为1ml/min)测定四氢嘧啶。
培养后收集菌液,使用高压均质机(800bar)进行高压破碎,12000rpm离心10min后取上清液进行测定。将上清液用蒸馏水稀释一定倍数(通常为10倍),用0.22μm滤膜过滤,用高效液相色谱法采用c18柱和乙腈与水(7:3)组成的流动相(流速为1ml/min)测定四氢嘧啶。
由于连续发酵生产四氢嘧啶第二次菌体收集只需约14h,而分批发酵达到相近菌体重量需要发酵28h,因此在相同的时间内,连续发酵可收获更多的培养物。
表3.halomonasaydingkolgenesism1在7.5升发酵罐中连续发酵生产四氢嘧啶
从表3的数据我们可以得出以下结论:嗜盐菌halomonasaydingkolgenesism1进行连续培养发酵时,可以短时间内达到较高的产量。
(5)杂菌的检测
从发酵开始时计起,每隔1天取发酵液稀释至10-4,取100μl涂布于lb平板(配制同分离培养基),37℃培养箱培养24小时,观察菌落形态,每个平板挑选10个菌落进行pcr验证,确定不灭菌条件下发酵是否染杂菌。
选取的两段序列为halomonasaydingkolgenesism1的高度保守序列。其中,两对引物分别为:16f5’-ttgctacccgctgacgagc-3’,16r5’-ccgccttcgccactggtatt-3’,片段长度为644bp;f25’-tttgtggcgaagttaacgcgataagt-3’,r25’-ttcccctacggctaccttgttacga-3’,pcr片段长度为671bp。
菌落形态和pcr验证结果显示,发酵过程中并没有染菌,表明不灭菌连续发酵是可行的,这极大地降低了生产过程的能耗,降低了成本,简化了发酵过程。
实施例5.利用halomonasaydingkolgenesism1不灭菌发酵联产pha和四氢嘧啶
(1)种子液的培养
一级和二级种子液培养基均为40-lb培养基,每升40-lb培养基组成为:40g氯化钠、10g蛋白胨、5g酵母粉,用蒸馏水补足至1升,121℃灭菌20分钟。
取20μl在-80℃甘油管保存的嗜盐菌halomonasaydingkolgenesism1(cgmccno.19880)接入到20ml培养基,在37℃、200转/分条件下过夜培养,得到一级种子培养液。一级种子培养液按5%接种量接入装有100ml培养基的500ml三角瓶中,共接3瓶(共计约300ml),37℃、200转/分培养约12小时,得到二级种子培养液。
(2)发酵过程与控制
将300mlod600约为2.5的过夜培养种子液接种到3l初始发酵培养基(氯化钠90g、30氯化钾、葡萄糖60g、尿素6g、玉米浆粉48g、硫酸镁0.6g、磷酸二氢钾10.5g、微量元素ⅰ30ml和微量元素ⅱ3ml)中,然后进行培养。
在整个发酵过程中,以1–1.15vvm的流速注入过滤空气来提供溶解氧(do%),溶解氧保持在空气饱和度的30%左右,ph值通过添加5m氢氧化钠自动调节,保持在8.5左右。当第一次检测到残留葡萄糖浓度低于6g/l时,添加补料培养基i(200g/l葡萄糖、8g/l玉米浆粉和24g/l尿素),然后在第14h时添加补料培养基ii(200g/l葡萄糖,4g玉米浆粉和8g/l尿素)。在整个发酵过程中将葡萄糖含量维持在5-15g/l。
(3)连续培养
halomonasaydingkolgenesism1菌株在停止供气并停止搅拌后静置1分钟,待菌体完成自沉降后移出发酵罐,体积约为500ml。向发酵罐中补充加入500ml初始发酵培养基,然后开始第二次连续培养。以1–1.15vvm的流速注入过滤空气来提供溶解氧(do%),溶解氧保持在空气饱和度的30%左右,ph值通过添加5m氢氧化钠自动调节,保持在8.5左右。当第一次检测到残留葡萄糖浓度低于6g/l时,添加补料培养基i(200g/l葡萄糖、8g/l玉米浆粉和24g/l尿素),然后在第14h时添加补料培养基ii(200g/l葡萄糖,4g玉米浆粉和8g/l尿素)。发酵过程在开放(非无菌)条件下进行。发酵结束后,利用菌株的自絮凝特性经静置实现菌体与上清的分离,进而用于进一步的产物收集纯化。生产工序可见图1。
(4)phb和四氢嘧啶含量测定
为测定四氢嘧啶含量,培养后菌体以6000rpm离心10min,用50mmkpi缓冲液等速洗涤两次至培养基中,悬浮于80%(v/v)乙醇中,静置12小时以提取细胞内四氢嘧啶。将含有四氢嘧啶的细胞提取物过滤并在50℃下蒸发18h。将沉淀物重新悬浮在水/氯仿(1:1v/v)混合物中并剧烈混合;将氯仿层倾析,收集上层透明层并再次离心。用高效液相色谱法采用c18柱和乙腈与水(8:2)组成的流动相(流速为1ml/min)测定四氢嘧啶。
为测定phb含量,将30ml培养物置于预先称重的50ml试管中,10000×g室温下离心15min。测量细胞干重前先将菌体冷冻干燥24小时,然后在40mg冻干细胞中加入2ml包含3%(v/v)浓硫酸(98%,w/w)和1g/l苯甲酸的酯化液及2ml氯仿,100℃下酯化约4h。对应的标准品同样处理做为参照。甲醇分解后,样品在gc-2014气相色谱仪(日本岛津)上测定phb含量。
表4.halomonasaydingkolgenesism1在7.5升发酵罐中连续发酵联产phb和四氢嘧啶
从表4.的数据我们可以得出以下结论:嗜盐菌halomonasaydingkolgenesism1进行连续培养发酵时,可同时生产pha和四氢嘧啶等小分子,效率大幅提高。
(5)杂菌的检测
从发酵开始时计起,每隔1天取发酵液稀释至10-4,取100μl涂布于lb平板(配制同分离培养基),37℃培养箱培养24小时,观察菌落形态,每个平板挑选10个菌落进行pcr验证,确定不灭菌条件下发酵是否染杂菌。
选取的两段序列为halomonasaydingkolgenesism1的高度保守序列。其中,两对引物分别为:16f5’-ttgctacccgctgacgagc-3’,16r5’-ccgccttcgccactggtatt-3’,片段长度为644bp;f25’-tttgtggcgaagttaacgcgataagt-3’,r25’-ttcccctacggctaccttgttacga-3’,pcr片段长度为671bp。
菌落形态和pcr验证结果显示,发酵过程中并没有染菌,表明不灭菌连续发酵是可行的,这极大地降低了生产过程的能耗,降低了成本,简化了发酵过程。
综合前述实验可以确定,本发明的菌株可以在开放条件下(代替常规采用的避免杂菌污染的封闭条件)高效地生产多种产物,如多种pha和小分子化合物四氢嘧啶。并且,由于该菌具有自絮凝特性,因此可以容易地通过静置而实现菌体与上清的分离,进一步降低生产成本,提高生产效率,因此可以适用于工业化生产。
序列表
<120>一株自凝絮嗜盐菌及其应用
<130>cgcnl200930w
<160>18
<170>siposequencelisting1.0
<210>1
<211>19
<212>dna
<213>人工序列(artificialsequence)
<400>1
ttgctacccgctgacgagc19
<210>2
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>2
ccgccttcgccactggtatt20
<210>3
<211>1540
<212>dna
<213>人工序列(artificialsequence)
<400>3
tttaaactgaagagtttgatcatggctcagattgaacgctggcggcaggcctaacacatg60
caagtcgagcggtaacaggggtagcttgctacccgctgacgagcggcggacgggtgagta120
atgcataggaatctgcccgatagtgggggataacctggggaaacccaggctaataccgca180
tacgtcctacgggagaaagggggctccggctcccgctattggatgagcctatgtcggatt240
agctagttggtgaggtaatggctcaccaaggcaacgatccgtagctggtctgagaggatg300
atcagccacatcgggactgagacacggcccgaactcctacgggaggcagcagtggggaat360
attggacaatgggcgaaagcctgatccagccatgccgcgtgtgtgaagaaggccctcggg420
ttgtaaagcactttcagcgaggaagaacgcctagtggttaatacccattaggaaagacat480
cactcgcagaagaagcaccggctaactccgtgccagcagccgcggtaatacggagggtgc540
aagcgttaatcggaattactgggcgtaaagcgcgcgtaggtggcttgataagccggttgt600
gaaagccccgggctcaacctgggaacggcatccggaactgtcaagctagagtgcaggaga660
ggaaggtagaattcccggtgtagcggtgaaatgcgtagagatcgggaggaataccagtgg720
cgaaggcggccttctggactgacactgacactgaggtgcgaaagcgtgggtagcaaacag780
gattagataccctggtagtccacgccgtaaacgatgtcgaccagccgttgggtgcctagc840
gcactttgtggcgaagttaacgcgataagtcgaccgcctggggagtacggccgcaaggtt900
aaaactcaaatgaattgacgggggcccgcacaagcggtggagcatgtggtttaattcgat960
gcaacgcgaagaaccttacctactcttgacatcctgcgaacttgtgagagatcacttggt1020
gccttcgggaacgcagagacaggtgctgcatggctgtcgtcagctcgtgttgtgaaatgt1080
tgggttaagtcccgtaacgagcgcaacccttgtccttatttgccagcgggtaatgccggg1140
aactctaaggagactgccggtgacaaaccggaggaaggtggggacgacgtcaagtcatca1200
tggcccttacgagtagggctacacacgtgctacaatggccggtacaaagggttgcgagct1260
cgcgagagtcagctaatcccgaaaagccggtctcagtccggatcggagtctgcaactcga1320
ctccgtgaagtcggaatcgctagtaatcgtgaatcagaatgtcacggtgaatacgttccc1380
gggccttgtacacaccgcccgtcacaccatgggagtggactgcaccagaagtggttagct1440
taaccttcgggaaagcgatcaccacggtgtggttcatgactggggtgaagtcgtaacaag1500
gtagccgtaggggaacctgcggctggatcacctccttaaa1540
<210>4
<211>26
<212>dna
<213>人工序列(artificialsequence)
<400>4
tttgtggcgaagttaacgcgataagt26
<210>5
<211>25
<212>dna
<213>人工序列(artificialsequence)
<400>5
ttcccctacggctaccttgttacga25
<210>6
<211>41
<212>dna
<213>人工序列(artificialsequence)
<400>6
gttttagagctagaaatagcaagttaaaataaggctagtcc41
<210>7
<211>32
<212>dna
<213>人工序列(artificialsequence)
<400>7
ccaccgcgctggaggctaccactagtattata32
<210>8
<211>30
<212>dna
<213>人工序列(artificialsequence)
<400>8
gaggagaaatactagatggagtgggaagag30
<210>9
<211>30
<212>dna
<213>人工序列(artificialsequence)
<400>9
taaccgcctattcccctaaaatctcttttt30
<210>10
<211>30
<212>dna
<213>人工序列(artificialsequence)
<400>10
ttagtgtgtggttttatgcctccacaccgc30
<210>11
<211>30
<212>dna
<213>人工序列(artificialsequence)
<400>11
ctcttcccactccatctagtatttctcctc30
<210>12
<211>30
<212>dna
<213>人工序列(artificialsequence)
<400>12
tttgaacccgggatgtgggcccatcgtcgt30
<210>13
<211>30
<212>dna
<213>人工序列(artificialsequence)
<400>13
gcggtgtggaggcataaaaccacacactaa30
<210>14
<211>30
<212>dna
<213>人工序列(artificialsequence)
<400>14
aaaaagagattttaggggaataggcggtta30
<210>15
<211>30
<212>dna
<213>人工序列(artificialsequence)
<400>15
ccagtcacgacggcttggagcgcgttcgaa30
<210>16
<211>30
<212>dna
<213>人工序列(artificialsequence)
<400>16
ttcgaacgcgctccaagccgtcgtgactgg30
<210>17
<211>30
<212>dna
<213>人工序列(artificialsequence)
<400>17
acgacgatgggcccacatcccgggttcaaa30
<210>18
<211>1290
<212>dna
<213>克氏梭状芽胞杆菌(clostridiumkluyveri)
<220>
<223>来自克氏梭状芽胞杆菌的4-羟基丁酰辅酶a转移酶编码基因
<400>18
atggagtgggaagagatatataaagagaaactggtaactgcagaaaaagctgtttcaaaa60
atagaaaaccatagcagggtagtttttgcacatgcagtaggagaacccgtagatttagta120
aatgcactagttaaaaataaggataattatataggactagaaatagttcacatggtagct180
atgggcaaaggtgaatatacaaaagagggtatgcaaagacattttagacataatgcttta240
tttgtaggcggatgtactagagatgcagtaaattcaggaagagcagattatacaccttgt300
tttttctatgaagtgccaagtttgtttaaagaaaaacgtttgcctgtagatgtagcactt360
attcaggtaagtgagccagataaatatggctactgcagttttggagtttccaatgactat420
accaagccagcagcagaaagtgctaagcttgtaattgcagaagtgaataaaaacatgcca480
agaactcttggagattcttttatacatgtatcagatattgattatatagtggaagcttca540
cacccattgttagaattgcagcctcctaaattgggagatgtagaaaaagccataggagaa600
aactgtgcatctttaattgaagatggagctactcttcagcttggaataggtgctatacca660
gatgcggtacttttattcttaaagaacaaaaagaatttaggaatacattctgagatgata720
tcagatggtgtgatggaactggtgaaggcaggggttatcaataacaagaaaaagaccctc780
catccaggcaaaatagttgtaacatttttaatgggaacaaaaaaattatatgattttgta840
aacaataatccaatggtagaaacttattctgtagattatgtaaataatccactggtaatt900
atgaaaaatgacaatatggtttcaataaattcttgtgttcaagtagacttaatgggacaa960
gtatgttctgaaagtataggattgaaacagataagtggagtgggaggccaggtagatttt1020
attagaggagctaatctatcaaagggtggaaaggctattatagctataccttccacagct1080
ggaaaaggaaaagtttcaagaataactccacttctagatactggtgctgcagttacaact1140
tctagaaatgaagtagattatgtagttactgaatatggtgttgctcatcttaagggcaaa1200
actttaagaaatagggcaagagctctaataaatatcgctcatccaaaattcagagaatca1260
ttaatgaatgaatttaaaaagagattttag1290
- 还没有人留言评论。精彩留言会获得点赞!